修回日期: 2017-06-02
接受日期: 2017-06-12
在线出版日期: 2017-08-08
观察布拉氏酵母菌散结合美沙拉嗪对活动期溃疡性结肠炎(ulcerative colitis, UC)的临床疗效及对钙卫蛋白(calprotectin, CP)、炎性因子的影响.
选取65例2016-01/2016-10于大庆市第四医院消化科符合诊断及纳入标准的UC患者, 随机分为对照组(32例)和治疗组(33例), 对照组给予美沙拉嗪肠溶片治疗, 治疗组在对照组的基础上加服布拉氏酵母菌散. 2组患者疗程均为6 wk, 分别观察2组患者治疗前、后临床症状, 粪便CP及血清炎性因子γ-干扰素(interferon-γ, IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-6(interleukin-6, IL-6)的影响.
治疗组总有效率明显优于对照组(93.75% vs 81.81%, P<0.05); 2组治疗后Mayo疾病活动指数均较本组治疗前显著降低(P<0.01), 治疗后组间比较, 治疗组明显优于对照组(P<0.01); 2组治疗后CP、IFN-γ、TNF-α、IL-6均较本组治疗前显著降低(P<0.01), 治疗后组间比较, 治疗组明显优于对照组(P<0.01); 治疗组随访复发率优于对照组(7.4% vs 24.2%, P<0.05).
布拉氏酵母菌散结合美沙拉嗪能够显著降低UC患者CP、IFN-γ、TNF-α、IL-6水平, 改善临床症状及肠道黏膜损伤, 且复发率低, 疗效显著.
核心提要: 文章从炎性因子的角度来探讨肠道菌群的调整对活动期溃疡性结肠炎(ulcerative colitis, UC)的疗效, 并结合粪便钙卫蛋白水平来探讨联合用药对UC的抗炎、免疫调节机制及预后效果.
引文著录: 周威. 布拉氏酵母菌散对活动期溃疡性结肠炎钙卫蛋白及炎性因子的影响. 世界华人消化杂志 2017; 25(22): 2065-2070
Revised: June 2, 2017
Accepted: June 12, 2017
Published online: August 8, 2017
To observe the curative effect of Saccharomyces boulardii powder combined with mesalazine in patients with active ulcerative colitis (UC) and the influence on fecal calprotectin (CP) and serum inflammatory factors.
Sixty-five active UC patients were randomly divided into a control group (32 cases) and a treatment group (33 cases). The control group was treated with mesalazin enteric-coated tablets alone, and the treatment group was given Saccharomyces boulardii powder plus mesalazin enteric-coated tablets. Both groups were treated for 6 wk. The clinical symptoms, fecal CP, and serum inflammatory factors interferon-γ (IFN-γ), tumor necrosis factor-α (TNF-α) and interleukin-6 (IL-6) were compared between the two groups.
The total effective rate of the treatment group was obviously better than that of the control group (93.75% vs 81.81%, P < 0.05). Mayo disease activity index was significantly lower after treatment than that before treatment in both groups (P < 0.01), and the improvement was more significant in the treatment group than in the control group (P < 0.01). Fecal CP and serum IFN-γ, TNF-α and IL-6 were significantly lower after treatment than those before treatment in both groups (P < 0.01), and the changes were more significant in the treatment group than in the control group (P < 0.01). The recurrence rate was significantly lower in the treatment group than in the control group (7.4% vs 24.2%, P < 0.05).
Saccharomyces boulardii powder combined with mesalazine can significantly reduce the levels of fecal CP and serum IFN-γ, TNF-α and IL-6, and improve the clinical symptoms and intestinal mucosal injury in patients with active UC, with obvious curative effect and a low recurrence rate.
- Citation: Zhou W. Saccharomyces boulardii powder combined with mesalazine for treatment of active ulcerative colitis: Curative effect and impact on fecal calprotectin and serum inflammatory factors. Shijie Huaren Xiaohua Zazhi 2017; 25(22): 2065-2070
- URL: https://www.wjgnet.com/1009-3079/full/v25/i22/2065.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i22.2065
溃疡性结肠炎(ulcerative colitis, UC)是一种原因不明的、反复发作的慢性非特异性肠道炎症性疾病, 常位于直肠和乙状结肠, 也可延伸至降结肠甚至全结肠, 病变常局限在结肠黏膜及黏膜下层[1,2]. 其主要以腹痛、腹泻、黏液血便及里急后重等为临床表现, 也可同时伴有肠道以外其他系统病变, 如肝胆管、关节及皮肤损伤等[3]. UC的发病机制尚不明确, 目前认为该病可能与环境因素、易感基因因素、肠道微生物、肠道屏障功能及免疫紊乱等多因素的相互作用有关, 最终导致结肠炎症的发生与迁延不愈[4]. 我们前期通过运用布拉氏酵母菌散联合美沙拉嗪治疗活动期UC, 取得了较好的临床疗效, 现将有关结果汇报如下.
选取65例2016-06/2016-10于大庆市第四医院消化科就诊的UC患者, 按照就诊顺序采用随机数字表分为对照组和治疗组, 其中对照组32例, 治疗组33例. 2组患者性别、年龄、病程、发病类型、病情等一般资料差异无统计学意义(P>0.05), 具有可比性(表1). 药物: 美沙拉嗪肠溶片(惠迪, 葵花药业集团佳木斯鹿灵制药有限公司, 国药准字: H19980148, 0.25 g/片); 布拉氏酵母菌散(亿活, 法国百科达药厂, 进口药品注册证号: S20100086, 0.25 g/袋).
| 分组 | n | 性别(男/女) | 年龄(岁) | 病程(年) | 类型(初/复) | 程度(轻/中) | 发病部位 | ||
| 直-乙状结肠 | 左半结肠 | 全结肠 | |||||||
| 对照组 | 32 | 15/17 | 39.54±8.94 | 5.36±2.17 | 18/14 | 18/14 | 13 | 11 | 8 |
| 治疗组 | 33 | 17/16 | 40.12±8.54 | 5.67±2.03 | 20/13 | 20/13 | 15 | 12 | 7 |
1.2.1 诊断、纳入及排除标准: 西医诊断标准参考《炎症性肠病诊断与治疗的共识意见(2012年•广州)》[5]中活动期UC相关诊断标准. 纳入标准: (1)符合活动期UC的西医诊断标准; (2)年龄25-70岁; (3)签署临床研究知情同意书. 排除标准: (1)伴有克罗恩病、肠结核、缺血性结肠炎或放射性结肠炎等; (2)伴有呼吸、循环、泌尿、内分泌、神经系统严重疾病; (3)缓解期、爆发性UC; (4)3 mo内应用糖皮质激素、水杨酸制剂、止泻药等UC治疗者; (5)既往有水杨酸制剂过敏史者; (6)妊娠期及哺乳期女性.
1.2.2 剔除及脱落标准: 剔除标准: (1)依从性差, 自行加药或停药者; (2)资料不全影响安全性或疗效者. 脱落标准: (1)患者因各种原因不愿意继续者; (2)发生严重的并发症, 不宜继续参加本试验者.
1.2.3 治疗: 对照组给予美沙拉嗪肠溶片, 口服4次/d, 4片/次. 治疗组在对照组的基础上加用布拉氏酵母菌散, 口服2次/d, 2袋/次. 2组患者疗程均为6 wk, 疗程结束后并随访4 wk. 疗程结束后对照组继续口服美沙拉嗪肠溶片, 口服1次/d, 4片/次维持治疗, 治疗组在对照组的基础上继续口服布拉氏酵母菌散, 口服2次/d, 2袋/次维持治疗.
1.2.4 临床疗效: 临床疗效评价参照《溃疡性结肠炎中西医结合诊疗指南(草案)》中疗效标准[6]: (1)完全缓解: 临床症状基本消失, 结肠镜显示结肠黏膜病变基本消失或Mayo总分值降低≥95%; (2)显效: 临床主要症状明显缓解, 结肠镜显示结肠黏膜病变明显减轻或Mayo总分值降低≥70%; (3)有效: 临床主要症状有所缓解, 结肠镜显示结肠黏膜病变有所减轻或Mayo总分值降低≥30%; (4)无效: 经治疗后临床症状无改善或加重, 或Mayo总分值降低<30%.
1.2.5 疾病活动指数: Mayo疾病活动指数[5]包括排便次数、便血程度、内镜发现及医师总体评价各项分数的总和, 按照无到重分别记以0-3分.
1.2.6 钙卫蛋白: 分别于治疗前、后取患者清晨大便, 采用酶联免疫法(enzyme-linked immunosorbent assay, ELISA)检测2组患者粪便钙卫蛋白(calprotectin, CP)含量, 具体操作方法严格按照试剂盒说明书进行.
1.2.7 炎性因子: 分别于治疗前、后采集患者清晨空腹静脉血, 采用ELISA检测2组患者γ-干扰素(interferon-γ, IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-6(interleukin-6, IL-6)的浓度, 具体操作方法严格按照试剂盒说明书进行.
统计学处理 采用SPSS18.0软件进行统计学分析, 计数资料以百分率(%)表示, 组间比采用χ2检验, 等级资料的检验采用Mann-Whitney检验; 计量资料以mean±SD表示, 2组间比采用独立样本t检验, 组内比采用配对样本t检验. P<0.05为差异具有统计学意义.
治疗组总有效率为93.75%, 对照组总有效率为81.81%, 2组临床疗效比较, 治疗组明显优于对照组(P<0.05, 表2).
| 分组 | n | 完全缓解 | 显效 | 有效 | 无效 | 总有效率(%) | Z值 | P值 |
| 治疗组 | 32 | 15 | 10 | 5 | 2 | 93.75 | -2.202 | 0.028 |
| 对照组 | 33 | 9 | 8 | 10 | 6 | 81.81 |
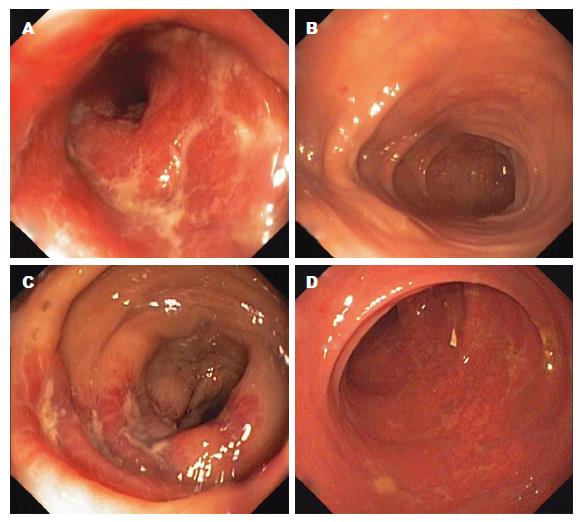
2组治疗后Mayo疾病活动指数、粪便CP的含量较本组治疗前均显著降低, 差异具有统计学意义(P<0.01), 治疗后组间比较, 治疗组明显优于对照组, 差异具有统计学意义(P<0.01, 表3, 图1).
2组患者治疗后血清IFN-γ、TNF-α、IL-6水平较本组治疗前均显著下降, 差异均具有统计学意义(P<0.01), 治疗后IFN-γ、TNF-α、IL-6组间比较, 治疗组明显优于对照组, 差异均具有统计学意义(P<0.01, 表4).
| 分组 | 病情 | n | IFN-γ | TNF-α | IL-6 | |||
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | |||
| 治疗组 | 轻度 | 20 | 27.16±7.17 | 13.56±5.38bd | 204.33±29.11 | 132.38±17.27bd | 35.43±9.15 | 24.10±3.61bd |
| 中度 | 13 | 38.56±8.77 | 15.07±5.06bd | 259.18±42.54 | 161.59±19.34bd | 67.43±11.85 | 29.67±7.74bd | |
| 对照组 | 轻度 | 18 | 28.21±9.03 | 17.67±6.23b | 217.93±31.76 | 152.94±19.38b | 38.07±9.34 | 29.73±8.18b |
| 中度 | 14 | 39.63±9.03 | 21.53±8.04b | 263.22±39.47 | 189.53±25.17b | 69.27±10.94 | 38.13±8.21b | |
2组治疗过程中均无病例剔除及脱落. 治疗组随访复发率为7.4%(3/32), 对照组随访复发率24.2%(8/33), 2组复发率组间比较, 差异具有统计学意义(P<0.05).
近年来, 随着生活水平的不断提高, UC在全球发病率呈现逐渐升高的趋势, 据流行病学调查显示, 其在欧美的发病率为8-14/10万, 流行率为120-200/10万, 我国南方的发病率为2.05/10万, 北方的发病率为1.64/10万[7,8]. 因其症状反复, 病程迁延, 严重影响到患者的生活质量, 因此世界卫生组织定义为现代难治疾病之一[9]. 目前临床治疗该病主要以氨基水杨酸类、肾上腺糖皮质激素类及免疫抑制剂类为主, 且多采用递增药物治疗策略, 然而因其药物依赖性强、疗效欠稳定及肝肾毒性大等问题, 新型微生态制剂逐渐成为治疗UC的主要药物[10].
近年来, 多项研究[11]发现肠道菌群在UC的发病过程中扮演着重要的角色, 肠道菌群的失调一方面可以导致侵袭性细菌过度生长, 产生大量的抗原增加肠道黏膜通透性和病理性免疫反应; 另一方面, 肠道黏膜的上皮细胞及抗原提呈细胞因病理性免疫反应失控, 从而产生大量的细胞因子, 导致Treg细胞功能下降及Th1、Th17细胞的分化和增殖, 最终导致肠道炎症的发生. 布拉氏酵母菌是近年来使用较为广泛的一种非致病性酵母菌, 其耐酸、耐碱、耐胆汁, 具有良好的稳定性. 其一方面能与肠道黏膜上皮细胞结合, 增加内源性防御屏障, 防治致病菌的黏附、定植、侵袭和繁殖, 减少细菌的移位; 另一方面, 还能够激活补体系统和网状内皮系统, 增加宿主的免疫功能, 抑制致病菌的过度生长, 调节肠道的免疫应答[12,13]. 动物实验研究[14,15]发现, 布拉氏酵母菌能够显著改善UC大鼠一般状态及肠道黏膜, 降低UC大鼠血清及肠道组织中IL-8、IFN-γ水平, 抑制结肠肠组织中TLR4、NF-κB p65蛋白的表达.
IFN-γ、TNF-α、IL-6属于Th1型细胞因子的重要组成部分, IFN-γ是一种二聚体糖蛋白, 是由Th1细胞分泌的促炎性细胞因子, 其能使Th1细胞扩增和细胞活性增强, 还能够抑制Th2细胞增生[16]. TNF-α是由活化的巨噬细胞和单核细胞产生, 是一种具有多种生物活性的促炎性细胞因子, 其通过表达成纤维增殖因子、黏附分子及凝血因子, 从而启动细胞毒性反应及急性炎症反应[17]. IL-6是一种具有免疫调节的细胞因子, 通过启动细胞表面信号复合体参与炎症反应. CP作为一种调节蛋白, 其主要来源于巨噬细胞和中性粒细胞, 具有调节细胞免疫和抑制细胞增殖的功能, 能够协同Th细胞共同抑制Treg细胞的表达, 从而促进UC发生及发展[18]. 本研究结果显示, 治疗组总有效率为93.75%, 明显优于对照组(P<0.05); 2组治疗后Mayo疾病活动指数较本组治疗前显著降低(P<0.01), 治疗后组间比较, 治疗组明显优于对照组(P<0.01), 说明布拉氏酵母菌散结合美沙拉嗪能够显著改善UC患者临床症状及肠道黏膜损伤. 另一方面, 2组治疗后粪便CP及血清IFN-γ、TNF-α、IL-6水平均较本组治疗前显著降低(P<0.01), 治疗后组间比较, 治疗组明显优于对照组(P<0.01), 说明布拉氏酵母菌散结合美沙拉嗪能够显著改善UC患者的炎性水平. 不仅如此, 治疗组随访复发率为7.4%, 优于对照组的24.2%(P<0.05).
总之, 布拉氏酵母菌散结合美沙拉嗪能够显著降低UC患者CP、IFN-γ、TNF-α、IL-6水平, 改善临床症状及肠道黏膜损伤, 且复发率低, 疗效显著, 值得临床进一步推广.
溃疡性结肠炎(ulcerative colitis, UC)在全球发病率呈现逐渐升高的趋势, 而传统的药物治疗存在药物依赖性强、疗效欠稳定及肝肾毒性大等问题, 新型微生态制剂逐渐成为治疗UC的主要药物.
近年来, 多项研究发现肠道菌群在UC的发病过程中扮演着重要的角色, 通过调节肠道菌群能够达到治疗UC的作用, 但是对于新型微生态制剂的作用机制并不十分明确.
关于联合应用肠道微生态制剂治疗活动期UC的报道很多, 大多侧重从临床症状及镜下肠道黏膜的改善, 本研究通过观察血清炎性因子及粪便钙卫蛋白(calprotectin, CP), 进一步探讨肠道微生态制剂对本病的作用机制.
针对联合用药活动期UC患者炎性因子及CP的作用, 特别是随访复发率的观察, 发现联合用药疗效更加显著.
本研究在实际的临床工作中具有较好的指导意义, 对于轻中度的活动期UC患者, 联合应用布拉氏酵母菌散能够显著改善临床症状及肠道黏膜损伤, 且复发率低, 值得临床进一步推广.
钙卫蛋白(CP): 是一种来源于中性粒细胞和巨噬细胞的含钙蛋白(分子量约36 kDa), 由Fagerhol等从中性粒细胞中分离出来. 因为其双链结构都可结合两个钙离子而且具有抵抗微生物的能力, 所以命名为钙卫蛋白.
迟雁, 副教授, 北京大学第一医院消化内科; 刘杰民, 主任医师, 贵州省人民医院消化内镜科
本文通过轻、中度UC患者的疗效评定, 观察布拉氏酵母菌散在UC治疗期的可能作用及对炎症指标的影响, 对临床探讨更有效安全的UC治疗方式及相关机制有较大临床意义.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 黑龙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 6. | 陈 治水, 危 北海, 张 万岱, 杨 春波, 劳 绍贤, 姚 希贤, 欧阳 钦, 郑 家驹, 王 新月. 溃疡性结肠炎中西医结合诊疗指南(草案)(中国中西医结合学会消化系统疾病专业委员会, 2010西昌). 中国中西医结合消化杂志. 2011;19:61-65. |
| 7. | Shimoda M, Horiuchi K, Sasaki A, Tsukamoto T, Okabayashi K, Hasegawa H, Kitagawa Y, Okada Y. Epithelial Cell-Derived a Disintegrin and Metalloproteinase-17 Confers Resistance to Colonic Inflammation Through EGFR Activation. EBioMedicine. 2016;5:114-124. [PubMed] [DOI] |
| 8. | Hanauer SB. Inflammatory bowel disease: epidemiology, pathogenesis, and therapeutic opportunities. Inflamm Bowel Dis. 2006;12 Suppl 1:S3-S9. [PubMed] [DOI] |
| 9. | Newcombe HB, Fair ME, Lalonde P. Discriminating powers of partial agreements of names for linking personal records. Part I: The logical basis. Methods Inf Med. 1989;28:86-91. [PubMed] [DOI] |
| 11. | Shim JO. Gut microbiota in inflammatory bowel disease. Pediatr Gastroenterol Hepatol Nutr. 2013;16:17-21. [PubMed] [DOI] |
| 14. | 张 晓明, 王 晓娟, 徐 洪雨, 杨 幼林. 布拉氏酵母菌散对TNBS-大鼠溃疡性结肠炎IL-8、IFN-γ的表达影响. 胃肠病学和肝病学杂志. 2013;22:993-996. |
| 17. | 王 少鑫, 浦 江, 刘 超群, 李 超, 闫 志辉, 崔 立红. 炎症因子TNF-α、IL-6和IL-4在溃疡性结肠炎中的表达及临床意义. 胃肠病学和肝病学杂志. 2015;24:104-106. |
| 18. | 王 坤, 宣 秀敏, 王 莲, 童 玲, 黄 琦, 朱 黎敏, 阮 海玲. Treg/Th17细胞、钙卫蛋白在溃疡性结肠炎模型大鼠血清及肠组织中的表达变化. 四川大学学报(医学版). 2014;45:946-949. |