修回日期: 2017-03-09
接受日期: 2017-03-13
在线出版日期: 2017-04-28
本课题旨在分子生物学技术和中医基础理论指导下, 从miRNAs与自噬相关联的角度, 讨论miR-30a与自噬基因Beclin1在结肠癌化疗耐药中的相关性, 并探讨肠胃清对miR-30a介导自噬的调控作用及逆转结肠癌耐药的分子机制.
建立人结肠癌耐奥沙利铂(L-OHP)细胞株HCT116/L-OHP裸鼠皮下移植瘤模型, 随机分为空白组、L-OHP组、肠胃清方组、肠胃清方低剂量+L-OHP组、肠胃清方高剂量+L-OHP组. 治疗结束后采用RT-PCR、免疫组织化学、Tunnel等研究肠胃清对瘤体组织中miR-30a、Beclin1、LC3的表达及细胞凋亡的影响.
奥沙利铂组可见Beclin1、LC3的上调, miR-30a的下调, 细胞凋亡的减少. 而肠胃清联用奥沙利铂组可见Beclin1、LC3的下调, miR-30a的上调, 细胞凋亡的增加(P<0.05或P<0.01).
奥沙利铂诱导保护性自噬导致细胞凋亡减少可能是其耐药的机制. 肠胃清可通过调控miR-30a/Beclin1通路而抑制自噬逆转结肠癌耐药.
核心提要: 研究发现肿瘤细胞可通过自噬途径逃避和修复化疗对细胞的损伤, miRNA可介导肿瘤细胞的自噬活性参与化疗耐药. 本研究发现肠胃清通过上调miR-30a的表达抑制其靶基因Beclin1而发挥抑制自噬的作用, 从而逆转化疗耐药.
引文著录: 张瑞娟, 许建华, 孙珏, 梁芳, 张勇, 余倩云, 范忠泽. 肠胃清方对人结肠癌HCT116/L-OHP裸鼠皮下移植瘤miR-30a/Beclin1通路的影响. 世界华人消化杂志 2017; 25(12): 1061-1070
Revised: March 9, 2017
Accepted: March 13, 2017
Published online: April 28, 2017
To evaluate the correlation of miR-30a and autophagy gene Beclin1 with chemoresistance and to explore the possible mechanism for Changweiqing to reverse drug resistance in colon cancer therapy.
A xenograft tumor model of oxaliplatin-resistant human colon cancer cell line HCT116/L-OHP was established in nude mice, and the mice were randomly divided into a control group, an L-OHP (oxaliplatin) group, a Changweiqing group, a low-dose Changweiqing + L-OHP group, and a high-dose Changweiqing + L-OHP group. The expression of miR-30a, Beclin1, and LC3 was evaluated by RT-PCR and immunohistochemistry, and cell apoptosis was evaluated by TUNEL assay.
The up-regulation of Beclin1 and LC3 expression, down-regulation of miR-30a expression, and decrease of apoptosis were observed in the L-OHP group. However, the down-regulation of Beclin1 and LC3 expression, up-regulation of miR-30a expression, and increase of apoptosis were observed in the Changweiqing plus L-OHP groups (P < 0.05 or P < 0.01).
L-OHP-induced protective autophagy to reduce apoptosis may be the mechanism of drug resistance. Changweiqing can reverse drug resistance, possibly by inhibiting autophagy and regulating the miR-30a/Beclin1 signal transduction pathway.
- Citation: Zhang RJ, Xu JH, Sun J, Liang F, Zhang Y, Yu QY, Fan ZZ. Effect of Changweiqing on miR-30a/Beclin1 pathway in subcutaneous xenografts of human colon cell line HCT116/L-OHP in nude mice. Shijie Huaren Xiaohua Zazhi 2017; 25(12): 1061-1070
- URL: https://www.wjgnet.com/1009-3079/full/v25/i12/1061.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i12.1061
结直肠癌(colorectal cancer, CRC)是一种高发的消化系恶性肿瘤之一. 近年来, 随着物质生活水平提高、膳食结构改变、人口老龄化趋势、内窥镜技术和影像学检查的发展, 结直肠癌发病率的上升非常显著, 严重威胁人类的健康. 据2017年美国癌症数据显示: 结直肠癌的发病率及死亡率在美国十大癌症中均位居第3位[1]. 2015年中国癌症总发病429.16万例, 总死亡281.42万例, 结直肠癌位居全国癌症发病及死亡的第5位[2]. 化疗仍是治疗结直肠癌的主要方法, 但却普遍存在耐药现象, 耐药限制了化疗的疗效甚至导致化疗失败, 因此如何逆转结直肠癌耐药, 提高化疗的敏感性是临床急需解决的课题.
(1)实验细胞与动物: 人结肠癌耐奥沙利铂细胞株HCT116/L-OHP为实验室本课题组前期自行诱导, 培养于含10%胎牛血清的RPMI 1640培养液(含青霉素、链霉素各100 U/mL)中, 37 ℃及50 mL/L CO2饱和湿度培养箱中常规培养, 培养体系中加入终浓度为5 μg/mL的L-OHP以维持耐药性, 实验在停用L-OHP培养2 wk后取处于对数生长期的细胞经MTT法检测, 对L-OHP的耐药倍数达8.15倍. Balb/c裸小鼠, ♂, 4-6周龄, 购自上海西普尔-必凯实验动物有限公司, 动物许可证号为SCXK(沪): 2008-0016. 常规饲养于上海中医药大学附属普陀医院SPF级动物实验室[动物实验室许可证号: SYXK(沪)2008-0055]; (2)实验试剂与仪器: 二氧化碳恒温培养箱(CELL240型), 德国贺利氏公司; 倒置显微镜, 日本Olympus公司; 眼科剪、眼科弯镊, 上海器材厂; 950 mL/L乙醇(分析纯), 上海振兴化工厂; 奥沙利铂, 江苏恒瑞医药股份有限公司; 甲醇(分析纯), 上海振兴化工厂; EDTA, Sigma公司; β-actin抗体, Santa Cruz公司; LC3A/B, Beclin1抗体, Proteintech公司; 辣根过氧化酶标记的羊抗兔, Proteintech Group; RT-PCR, Takara公司; 引物, 南通百奥迈科生物技术公司; 中药复方肠胃清由生黄芪30 g、党参15 g、生白术15 g、八月札24 g、薏苡仁30 g、野葡萄藤30 g、红藤30 g、猪苓24 g, 由上海中医药大学中药学院水提制备浸膏粉, 1 g浸膏粉含生药6.06 g.
1.2.1 皮下移植瘤的建立: 取对数生长期HCT116/L-OHP细胞, 将细胞用0.25%胰蛋白酶(Trypsin)消化后收集到离心管中, 然后用磷酸缓冲盐溶液(phosphate buffered saline, PBS)分别制成浓度为2×106/mL的细胞悬液. 取4-6周龄Balb/c♂裸鼠6只, 体质量20 g±2 g. 常规消毒裸鼠右前肢的腋部皮下, 用1 mL微量注射器及23号针头吸取HCT116/L-OHP单细胞悬液, 确定针头位于裸小鼠右前肢的腋部皮下后, 注入0.2 mL制备好的单细胞悬液, 术毕酒精棉球压迫穿刺点半分钟, 隔离鼠笼内SPF条件下, 恒温恒湿饲养. 经过12-20 d, 待皮下肿瘤生长至直径约100-200 mm3左右, 选择肿瘤生长旺盛且无破溃的荷瘤鼠, 作为供瘤鼠, 脱颈椎处死, 皮肤予1%碘伏、750 mL/L乙醇消毒, 小心用眼科剪剪开皮肤, 沿移植瘤包膜小心剥离皮下肿瘤组织, 将剥离的移植瘤块于无菌条件下, 生理盐水冲洗净表面的血污, 去除坏死组织和纤维组织, 将瘤体剪碎至1 mm3大小的组织块, 在超净工作台下用20号套管针接种于裸小鼠右侧前肢腋部皮下.
1.2.2 分组及给药方式: 待裸鼠皮下移植瘤生长至150-300 mm3时, 选择移植瘤瘤体生长良好、无出血坏死、瘤周无感染病灶的50只荷瘤鼠作为实验模型, 并随机分为5组, 每组各10只, 分别是: 空白组(Control): 腹腔注射蒸馏水(每周一、三、五各1次), 生理盐水灌胃(每周一、二、三、四、五各1次); 奥沙利铂组(L-OHP): 腹腔注射奥沙利铂5 mg/kg(每周一、三、五各1次), 生理盐水灌胃(每周一、二、三、四、五各1次); 肠胃清组(H-CWQ): 肠胃清高剂量13.42 g/kg灌胃(每周一、二、三、四、五各1次), 腹腔注射蒸馏水(每周一、三、五各1次); 肠胃清低剂量联合奥沙利铂组(L-CWQ+L-OHP): 肠胃清低剂量6.71 g/kg灌胃, (每周一、二、三、四、五各1次), 腹腔注射奥沙利铂5 mg/kg(每周一、三、五各1次); 肠胃清高剂量联合奥沙利铂组(H-CWQ+L-OHP): 肠胃清高剂量13.42 g/kg灌胃(每周一、二、三、四、五各1次), 腹腔注射奥沙利铂5 mg/kg(每周一、三、五各1次), 各组给药时间均为4 wk. 本实验体内奥沙利铂给药采用最大耐受剂量概念(maximum tolerated dose, MTD), 是指动物能够耐受的而不引起动物死亡的最高剂量, 根据前期研究发现裸鼠对奥沙利铂的MTD为10 mg/kg, 故采用其半剂量给药即5 mg/kg, 肠胃清给药根据人与小鼠等效剂量换算公式计算[3].
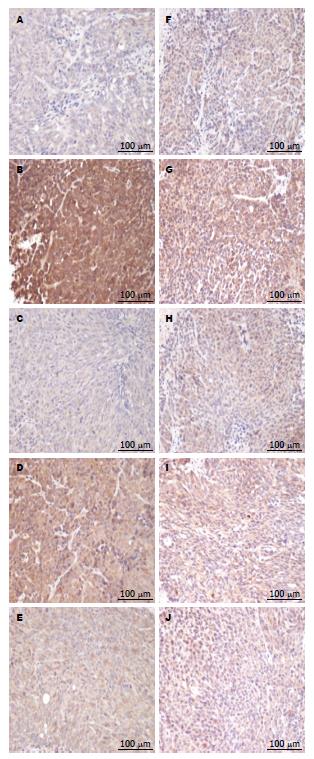
1.2.3 免疫组织化学检测蛋白表达: 将瘤体组织置于石蜡之中, 进行冷冻, 使石蜡变成固态; 置于石蜡切片机上切片, 将石蜡切片置于烘箱中58 ℃烤2-4 h, 石蜡切片常规二甲苯, 乙醇脱蜡至水, PBS洗3 min×3 min; 用柠檬酸钠抗原修复液, pH 6.0煮沸热修复(95 ℃ 15 min), 保温15 min, 室温自然冷却, PBS洗3 min×3 min; 3%的H2O2抑制内源性过氧化物酶室温下孵育10 min; PBS洗3 min×3 min, 10%正常胎牛血清室温孵育30 min, PBS洗3 min×3 min; 一抗4 ℃, 孵育过夜; PBS洗3 min×3 min; 二抗37 ℃孵育1.5 h, PBS洗3 min×3 min; DAB显色3-5 min; 苏木素复染30 s, 盐酸酒精分化1 s; 脱水吹干后, 树脂封片; 镜下观察, 细胞核呈紫蓝色, 阳性细胞显示为棕黄色或黄色. Beclin1阳性表达于细胞浆, LC3阳性表达于细胞浆、细胞间质和细胞核. 免疫组织化学阳性细胞用Image Proplus 6.0数码医学图像分析系统定量分析测定, 每张切片在200倍光镜下随机观察3个具有代表性的视野, 阳性率以积分光密度值(IOD/AREA)来表示.
1.2.4 实时荧光定量PCR检测Beclin1的表达: 取移植瘤组织移入匀浆机中, 运用TRIzol法抽提总RNA, 逆转录成cDNA, 按PrimeScript® RT reagent Kit(Perfect Real Time)反转录试剂盒说明书进行反应, 得到的cDNA进一步进行PCR实验. Beclin1引物序列: 上游引物: 5'CTGAGGGATGGAAGGGTCTA3', 下游引物: 5'CCTGGGCTGTGGTAAGTAATG3'. PCR反应体系: 实验结果运用使用2-ΔΔCt法测定了各组细胞中mRNA的相对表达水平. 计算公式: ΔCt = 检测基因Ct值的平均值-管家基因(β-actin)Ct值得平均值. ΔΔCt = 待测组ΔCt-对照组ΔCt. 因此待测基因的表达量由2-ΔΔCt来进行计算. 结果表示mRNA在实验组于空白组的表达倍数.
1.2.5 实时荧光定量PCR检测mRNAmiR-30a的表达: 取移植瘤组织移入匀浆机中, 运用TRIzol法抽提miRNA, 总miRNA逆转录为cDNA按One Step PrimeScript® miRNA cDNA Synthesis Kit(Perfect Real Time)反转录试剂盒说明书进行反应. 实验结果运用使用2-ΔΔCt法测定了各组细胞中miRNA的相对表达水平. miR-30a-5p引物序列: 上游引物: 5'TGTAAACATCCTCGACTGGAAG3'. 计算公式: ΔCt = 检测基因(miR-30a等)Ct值的平均值-管家基因(U6 snRNA)Ct值得平均值. ΔΔCt = 待测组ΔCt-对照组ΔCt. 因此待测基因的表达量由2-ΔΔCt来进行计算. 结果表示miRNA在实验组于空白组的表达倍数.
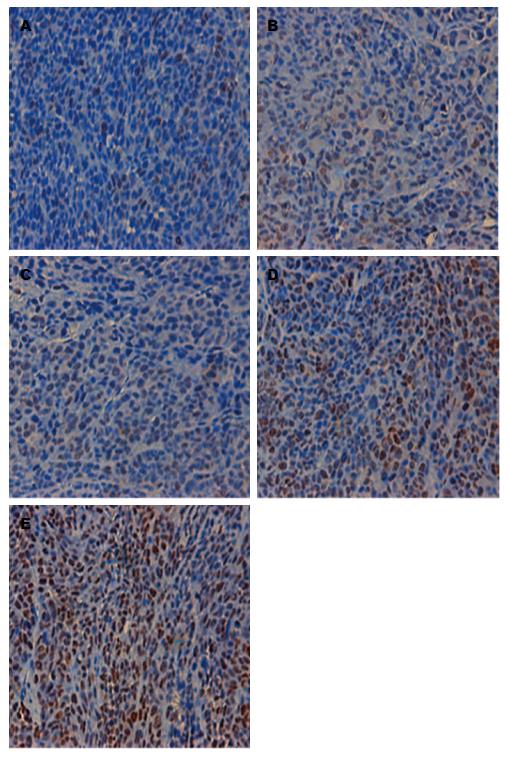
1.2.6 原位末断转移酶标记法(TUNEL法)检测细胞凋亡: 脱蜡和水合: 二甲苯Ⅰ(15 min), 二甲苯Ⅱ(15 min), 二甲苯Ⅲ(15 min), 无水酒精(5 min), 无水酒精(5 min), 95%酒精(5 min), 75%酒精(5 min), TBS漂洗(5 min×3 min), 小心干燥样品周围的玻片部分; 样品透性处理: 用PH = 8.0的Tris-Hcl稀释蛋白酶K至20 μg/mL, 组织用100 μL的蛋白酶K覆盖, 室温孵育20-30 min, TBS漂洗(5 min×3 min); 灭活内源过氧化物酶: 用甲醇按1:10稀释30%的H2O2到3%, 组织以100 μL 3%H2O2覆盖, 室温孵育5 min, TBS漂洗(5 min×3 min), 小心不要干燥样品周围的玻片部分, 平衡及标记反应(TdT酶用之前要离心, 使管壁的液体离到下面), 5×TdT平衡缓冲液用dh20溶液按1:5稀释, 以100 μL 1×TdT平衡缓冲室温孵育10-30 min, 同时准备标记反应混合物, 小心吸去样品上多余的平衡缓冲液, 立即加入TdT标记反应混合物, 每个样品60 μL(以完全覆盖组织为宜), 37 ℃孵育1.5 h; 标记反应的终止: 用TBS洗涤(5 min×3 min), 以终止缓冲液100 μL室温孵育5min, TBS再次洗涤(5 min×3 min), 让多余液体流干, 检测以100 μL封闭缓冲液室温孵育10 min, 以封闭缓冲液稀释50×偶联物按1:50稀释, 小心吸去样品上封闭缓冲液, 注意不要接触到样品, 并立即加100 μL偶联物, 37 ℃孵育30 min, TBS漂洗(5 min×3 min), 让多余液体流干, 滴加DAB溶液, 在显微镜下控制显色, 阳性明显且无背景, 用dh20溶液终止显色; 复染: 用苏木精复染1 min, 水洗5 min, 盐酸酒精分化1 s, 返蓝15 min; 脱水透明: 75%酒精(5 min), 90%酒精(5 min), 95%酒精(5 min), 无水酒精(5 min), 二甲苯Ⅰ(10 min), 二甲苯Ⅱ(10 min), 二甲苯Ⅲ(10 min)封片, 滴中性树脂, 加盖玻片. 镜下观察块状棕黄色为阳性表达, 阳性定位为细胞核. 阳性率分析同免疫组织化学法.
统计学处理 采用SPSS19.0统计软件进行统计分析, 数据用mean±SD表示. 两独立样本均数比较采用Independent-Samples t Test分析; 若数据具备正态性和方差齐性, 多样本均数比较采用one-way ANOVA分析, 组间两两比较采用SNK-q和LSD法检验; 若数据不具备正态性和方差齐性, 则进行Welch检验, 组间两两比较采用Dunnett's T3法检验, 以P<0.05为差异有统计学意义.
实验结果发现L-OHP组Beclin1、LC3蛋白表达高于Control组, 有显著性差异(P<0.01), 提示奥沙利铂可以上调Beclin1、LC3的表达, 诱导肿瘤发生自噬现象; H-CWQ+L-OHP组和L-CWQ+L-OHP组Beclin1、LC3蛋白表达低于L-OHP组, 有显著性差异(P<0.01), H-CWQ+L-OHP组低于L-CWQ+L-OHP组, 有显著性差异(P<0.05或P<0.01). 提示肠胃清可以下调Beclin1、LC3的表达, 抑制自噬现象, 并存在量效关系(表1, 图1).
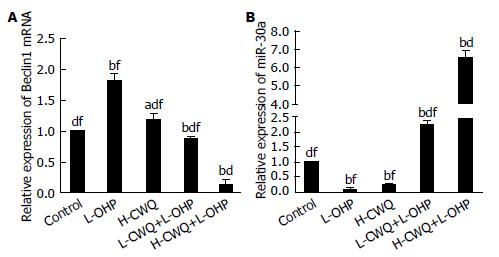
实验结果显示与Control组比较, L-OHP组Beclin1 mRNA表达倍数高于Control组, 有显著性差异(P<0.01), 提示奥沙利铂可以上调Beclin1 mRNA的表达, 诱导肿瘤发生自噬现象; H-CWQ+L-OHP组和L-CWQ+L-OHP组Beclin1 mRNA表达低于L-OHP组, 有显著性差异(P<0.01); H-CWQ+L-OHP组低于L-CWQ+L-OHP组, 有显著性差异(P<0.01). 提示肠胃清可以下调Beclin1 mRNA的表达, 抑制自噬现象, 并存在量效关系(表2, 图2).
实验结果显示与Control组比较, L-OHP组miR-30a表达倍数低于Control组, 有显著性差异(P<0.01), 提示奥沙利铂可以下调miR-30a的表达; H-CWQ+L-OHP组和L-CWQ+L-OHP组miR-30a表达高于L-OHP组, 有显著性差异(P<0.01); H-CWQ+L-OHP组高于L-CWQ+L-OHP组, 有显著性差异(P<0.01). 提示肠胃清可以上调miR-30a的表达, 通过抑制miR-30a的靶基因Beclin1发挥抑制自噬的作用, 并存在量效关系(表2, 图2).
细胞凋亡阳性率分析发现H-CWQ+L-OHP组、L-CWQ+L-OHP组、L-OHP组、H-CWQ组均高于Control组, 有显著性差异(P<0.01); H-CWQ+L-OHP组、L-CWQ+L-OHP组高于L-OHP组, 有显著性差异(P<0.01); H-CWQ+L-OHP组高于L-CWQ+L-OHP组, 有显著性差异(P<0.01). 提示肠胃清联合L-OHP可促进细胞凋亡, 提高L-OHP的疗效, 并存在量效关系(表2, 图3).
目前结直肠癌的治疗方法包括手术、化疗、放疗、分子靶向药物及中医药治疗等, Ⅰ期的结直肠癌患者五年生存率90%以上, 而Ⅱ期仅50%[4]. 化疗可以杀灭微小转移灶, 减少复发, 还可使不能手术切除的肿瘤缩小而获得手术机会, 对于丧失手术治愈机会的患者进行姑息化疗可延长其生存期. 结直肠癌的化疗药物主要有5-氟尿嘧啶、伊立替康、奥沙利铂等, 其中奥沙利铂是二氨基环己烷的第三代铂类复合药物, 通过阻断肿瘤细胞DNA的复制转录诱导细胞凋亡来发挥其细胞毒性. 目前化疗是肿瘤治疗中较为重要的治疗方法, 但50%以上的肿瘤细胞会对化疗产生耐药, 据估计90%以上的肿瘤死亡病例与化疗耐药有关[5,6]. 耐药是多因素多机制共同作用的结果, 深入探讨肿瘤耐药产生的机制并寻找有效的逆转药物, 是当前肿瘤研究中的热点和难点.
肠胃清由生黄芪、党参、生白术、八月札、薏苡仁、野葡萄藤、红藤、猪苓组成, 全方具有健脾理气、燥湿解毒之功. 前期研究发现肠胃清口服液加化疗组对晚期胃肠癌患者临床证候、生存质量改善情况优于单纯化疗组(P<0.05), 生存期较单纯化疗组长(P<0.05), 治疗后不良反应较单纯化疗组减轻(P<0.05); 肠胃清口服液加化疗组治疗后可降低外周血多药耐药基因(mdr1 mRNA)、细胞角蛋白(cytokerain, CK)CK20 mRNA的表达(P<0.05), 提示中药肠胃清对胃肠癌化疗有增效作用, 其机制与逆转肿瘤耐药有关, 并具有改善患者临床症状、提高生存质量的作用[7]. 肠胃清能协同L-OHP导致DNA损伤加重和干扰DNA复制而抗肿瘤[8]. 肠胃清药物血清能有效地逆转人结肠癌耐奥沙利铂细胞株HCT116/L-OHP对奥沙利铂的耐药, 改变细胞周期分布, 诱导细胞凋亡[9].
自噬, 是指自体吞噬, 由科学家Ashford和Porten在1962年用电子显微镜观察到的一种现象[10], 自噬主要分为三种类型: 大自噬、小自噬和分子伴侣介导的自噬(chaperonmediate-dautophagy, CMA). 其中大自噬的发生过程为: (1)起始阶段: 在饥饿、生长因子缺乏、氧化应激、放化疗损伤等情况下, 线粒体、粗面内质网的非核糖体区域、高尔基体等来源的自噬体膜脱落形成分隔膜, 包绕需要被降解的物质; (2)延伸阶段: 分隔膜逐渐延伸, 将要被降解的内容物完全包绕形成自噬体; (3)融合阶段: 自噬体通过细胞骨架微管系统运输至溶酶体, 并与之融合形成自噬溶酶体并降解其内成分, 自噬体膜脱落后循环再利用. 而小自噬与大自噬有相似的包绕过程, 但小自噬中的被降解物可直接被自身溶酶体膜内陷所摄取. CMA则需要被降解的可溶性蛋白质和分子伴侣蛋白形成复合物转运入溶酶体, 进而引起目标蛋白质的降解. 通常所说的"细胞自噬"是指大自噬[11-14]. 近年来研究[15]发现肿瘤中存在自噬活性的改变, 肿瘤细胞可通过自噬的途径逃避和修复化疗对细胞的损伤, 肿瘤中自噬信号通路与凋亡通路相互影响. 研究[16-19]发现多种化疗药物如奥沙利铂、顺铂、多柔比星、长春新碱等均可诱导肿瘤细胞发生自噬, 并提示自噬可导致化疗耐药. 采用对5-氟尿嘧啶(5-fluorouracil, 5-Fu)不同浓度耐药的细胞株SW480, 发现随着耐药浓度的增加, 结直肠癌细胞的自噬水平也逐渐增加, 而5-Fu对其抑制率却相应降低, 说明细胞自噬参与结直肠癌细胞对5-Fu的耐药[20]. 通过ATG7干扰抑制自噬可增加顺铂对食管癌细胞诱导的细胞凋亡, 提示抑制自噬可能是治疗食管癌的潜在治疗方法[21]. 5-Fu能诱导肺癌A549细胞的自噬, 采用自噬抑制剂3-MA或siATG7预处理癌细胞抑制自噬后可增强5-Fu诱导的caspase依赖性细胞凋亡[22].
研究[23]证实miRNA参与化疗耐药, 其有望成为重要的肿瘤耐药相关分子标志物及治疗靶点. 研究发现在乳癌细胞MCF-7中, miR-101可抑制4-羟三苯氧胺(4-OHT)诱导的自噬活性, 而增加细胞死亡, 其抑制效应的机制的一部分可能与通过抑制RAB5A、STMN1和ATG4D介导的自噬有关. miR-205是一种抑制肿瘤的miRNA, miR-205在前列腺癌细胞中可抑制自噬通量并增强顺铂的细胞毒性[24]. miR-21的表达下调增加了白血病细胞K562和KYO-1依托泊苷或阿霉素的细胞化疗敏感性[25]. miR-30a通过下调Beclin1和ATG5抑制慢性粒细胞白血病细胞的自噬, 提高白血病细胞对伊马替尼的药物敏感性和促进线粒体依赖的细胞凋亡[26]. miR-30a通过抑制Beclin1表达增加子宫颈癌HeLa细胞对顺铂的敏感性, 同时体内实验发现V-miR-30a可减小裸鼠肝癌Heps细胞移植瘤的瘤体体积而增加顺铂抑制肿瘤的疗效[27]. 目前发现中药可调控miRNA及其相应靶基因或靶蛋白发挥逆转耐药的作用, 为深入研究中药通过miRNA途径逆转耐药开辟了新领域. 研究[28]发现姜黄素中药单体干预人肺腺癌耐药细胞株A549/DDP后可降低的其miR-186的表达水平, 转染miR-186类似物后抑制姜黄素诱导的细胞凋亡. 表没食子儿茶素没食子酸酯(epigallocatechingallate, EGCG), 是从茶叶中分离的儿茶素类单体, 是茶多酚生物活性的主要成份, 研究发现EGCG可影响人肝癌HepG2细胞中miRNA的表达, 其中有13个上调和48个表达下调. 其中, EGCG可上调miR-16抑制Bcl-2的表达介导细胞凋亡的效应[29]. 雷公藤甲素通过调节miR-21的表达, 增加白血病多药耐药细胞株K562/A02对阿霉素的敏感性[30].
本实验构建结肠癌耐奥沙利铂细胞HCT116/L-OHP裸鼠皮下移植瘤的动物模型, 可更好模拟体内化疗耐药的特征, 以研究肠胃清对结肠癌化疗耐药的逆转作用. 前期研究结果表明: 肠胃清联合奥沙利铂可抑制裸鼠结肠癌皮下移植瘤的生长, 减轻瘤质量, 增加瘤体抑制率及瘤质量抑制率, 并存在量效关系. 提示肠胃清可有效逆转结肠癌细胞HCT116/L-OHP裸鼠皮下移植瘤模型的耐药性, 增加奥沙利铂的疗效[31]. 接下来进一步研究肠胃清逆转耐药的机制, 结果发现奥沙利铂上调Beclin1、LC3蛋白和Beclin1 mRNA的表达, 激活肿瘤发生自噬, 而肠胃清联用奥沙利铂后可下调Beclin1、LC3蛋白和Beclin1 mRNA的表达, 提示肠胃清有抑制自噬的作用, 同时发现联用后可增加细胞凋亡, 并存在量效关系, 说明肠胃清通过抑制细胞自噬而促进细胞凋亡, 增加奥沙利铂疗效. 同时研究发现奥沙利铂可下调miR-30a的表达, 肠胃清联用奥沙利铂后可上调miR-30a的表达, 推测肠胃清可能是通过对miR-30a/Beclin1通路的调控, 上调miR-30a的表达抑制其靶基因Beclin1而发挥抑制自噬的作用, 从而逆转耐药, 为探索肠胃清逆转耐药新的作用靶点及临床应用提供实验依据.
结直肠癌是一种高发的消化系恶性肿瘤, 据2017年美国癌症预测数据显示: 结直肠癌的发病率及死亡率在美国十大癌症中均位居第3位. 2015年中国癌症总发病429.16万例, 总死亡281.42万例, 结直肠癌位居全国癌症发病及死亡的第5位.
结直肠癌是一种高发的消化系恶性肿瘤, 目前化疗是主要治疗方法, 但肿瘤化疗耐药严重影响其疗效, 降低患者生存率, 因此探讨肿瘤耐药的机制并寻找有效的逆转药物, 是当前肿瘤研究中的热点和难点.
Zou等发现miR-30a通过抑制Beclin1表达增加子宫颈癌HeLa细胞对顺铂的敏感性, 同时体内实验发现V-miR-30a可减小裸鼠肝癌Heps细胞移植瘤的瘤体体积而增加顺铂抑制肿瘤的疗效.
本实验构建结肠癌耐奥沙利铂细胞HCT116/L-OHP裸鼠皮下移植瘤的动物模型, 可更好模拟体内化疗耐药的特征, 观察中药复方肠胃清通过对miR-30a/Beclin1通路的调控, 逆转结肠癌化疗耐药的作用及机制.
本文以结肠癌耐奥沙利铂细胞、裸鼠结肠癌皮下移植瘤模型为研究对象, 阐明肠胃清逆转结肠癌耐药的分子机制及新的作用靶点, 为其在现代医学中进一步开发应用、研制新的高效低毒的抗肿瘤药物提供实验依据.
自噬: 自体吞噬, 其特征是细胞内出现大量双层膜自吞噬泡, 吞噬泡内为胞质及受损的细胞器. 肿瘤细胞在接触细胞毒药物后能够利用自噬而保持生存, 自噬发挥着保护肿瘤细胞逃避凋亡的作用而导致化疗耐药.
霍介格, 主任中医师, 江苏省中医药研究院肿瘤科; 李杰, 主任医师, 中国中医科学院广安门医院肿瘤科; 禹正杨, 副教授, 南华大学附属第一医院
本文是在前期基础上的深入研究, 实验思路可行, 方法科学, 特别是探讨了中药复方肠胃清通过miRNA及自噬介导化疗耐药这一临床难题, 有一定的创新性和较好的学术价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 上海市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 1. | Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017. CA Cancer J Clin. 2017;67:7-30. [PubMed] [DOI] |
| 2. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 3. | 黄 继汉, 陈 志扬, 孙 瑞元. 药理试验中动物间和动物与人体间的等效剂量换算. 中国临床药理学与治疗学. 2004;9:1069-1072. |
| 4. | O'Connell JB, Maggard MA, Ko CY. Colon cancer survival rates with the new American Joint Committee on Cancer sixth edition staging. J Natl Cancer Inst. 2004;96:1420-1425. [PubMed] [DOI] |
| 5. | Palmeira A, Sousa E, Vasconcelos MH, Pinto MM. Three decades of P-gp inhibitors: skimming through several generations and scaffolds. Curr Med Chem. 2012;19:1946-2025. [PubMed] [DOI] |
| 6. | Higgins CF. Multiple molecular mechanisms for multidrug resistance transporters. Nature. 2007;446:749-757. [PubMed] [DOI] |
| 7. | 许 建华, 范 忠泽, 孙 珏, 朱 美华, 费 瑞银, 韩 建宏, 石 晓兰, 李 朝衡, 张 勇. 肠胃清治疗晚期胃肠癌及对外周血MDR1 mRNA的影响. 上海中医药杂志. 2007;41:40-42. |
| 8. | 陆 海, 范 忠泽, 孙 珏, 王 金玉, 许 建华. 肠胃清对逆转耐草酸铂结肠癌细胞的DNA损伤切除修复机制研究. 全国中西医结合肿瘤学术大会. 2010;. |
| 10. | Kim EH, Sohn S, Kwon HJ, Kim SU, Kim MJ, Lee SJ, Choi KS. Sodium selenite induces superoxide-mediated mitochondrial damage and subsequent autophagic cell death in malignant glioma cells. Cancer Res. 2007;67:6314-6324. [PubMed] [DOI] |
| 11. | Hussey S, Terebiznik MR, Jones NL. Autophagy: healthy eating and self-digestion for gastroenterologists. J Pediatr Gastroenterol Nutr. 2008;46:496-506. [PubMed] [DOI] |
| 12. | Saftig P, Beertsen W, Eskelinen EL. LAMP-2: a control step for phagosome and autophagosome maturation. Autophagy. 2008;4:510-512. [PubMed] |
| 14. | Glick D, Barth S, Macleod KF. Autophagy: cellular and molecular mechanisms. J Pathol. 2010;221:3-12. [PubMed] [DOI] |
| 15. | Abedin MJ, Wang D, McDonnell MA, Lehmann U, Kelekar A. Autophagy delays apoptotic death in breast cancer cells following DNA damage. Cell Death Differ. 2007;14:500-510. [PubMed] [DOI] |
| 16. | Tan S, Peng X, Peng W, Zhao Y, Wei Y. Enhancement of oxaliplatin-induced cell apoptosis and tumor suppression by 3-methyladenine in colon cancer. Oncol Lett. 2015;9:2056-2062. [PubMed] [DOI] |
| 17. | Sun Y, Jin L, Liu JH, Sui YX, Han LL, Shen XL. Interfering EZH2 Expression Reverses the Cisplatin Resistance in Human Ovarian Cancer by Inhibiting Autophagy. Cancer Biother Radiopharm. 2016;31:246-252. [PubMed] [DOI] |
| 18. | Xu XD, Zhao Y, Zhang M, He RZ, Shi XH, Guo XJ, Shi CJ, Peng F, Wang M, Shen M. Inhibition of Autophagy by Deguelin Sensitizes Pancreatic Cancer Cells to Doxorubicin. Int J Mol Sci. 2017;18:pii E370. [PubMed] [DOI] |
| 19. | Liang B, Liu X, Liu Y, Kong D, Liu X, Zhong R, Ma S. Inhibition of autophagy sensitizes MDR-phenotype ovarian cancer SKVCR cells to chemotherapy. Biomed Pharmacother. 2016;82:98-105. [PubMed] [DOI] |
| 20. | 胡 万乐, 何 占红, 蒋 芳, 刘 长宝. 5-Fu诱导人大肠癌SW480细胞株耐药与自噬活性的变化. 中国中西医结合外科杂志. 2013;19:279-282. |
| 21. | Zhu L, Du H, Shi M, Chen Z, Hang J. ATG7 deficiency promote apoptotic death induced by Cisplatin in human esophageal squamous cell carcinoma cells. Bull Cancer. 2013;100:15-21. [PubMed] [DOI] |
| 22. | Pan X, Zhang X, Sun H, Zhang J, Yan M, Zhang H. Autophagy inhibition promotes 5-fluorouraci-induced apoptosis by stimulating ROS formation in human non-small cell lung cancer A549 cells. PLoS One. 2013;8:e56679. [PubMed] [DOI] |
| 23. | Frankel LB, Wen J, Lees M, Høyer-Hansen M, Farkas T, Krogh A, Jäättelä M, Lund AH. microRNA-101 is a potent inhibitor of autophagy. EMBO J. 2011;30:4628-4641. [PubMed] [DOI] |
| 24. | Pennati M, Lopergolo A, Profumo V, De Cesare M, Sbarra S, Valdagni R, Zaffaroni N, Gandellini P, Folini M. miR-205 impairs the autophagic flux and enhances cisplatin cytotoxicity in castration-resistant prostate cancer cells. Biochem Pharmacol. 2014;87:579-597. [PubMed] [DOI] |
| 25. | Seca H, Lima RT, Lopes-Rodrigues V, Guimaraes JE, Almeida GM, Vasconcelos MH. Targeting miR-21 induces autophagy and chemosensitivity of leukemia cells. Curr Drug Targets. 2013;14:1135-1143. [PubMed] [DOI] |
| 26. | Yu Y, Yang L, Zhao M, Zhu S, Kang R, Vernon P, Tang D, Cao L. Targeting microRNA-30a-mediated autophagy enhances imatinib activity against human chronic myeloid leukemia cells. Leukemia. 2012;26:1752-1760. [PubMed] [DOI] |
| 27. | Zou Z, Wu L, Ding H, Wang Y, Zhang Y, Chen X, Chen X, Zhang CY, Zhang Q, Zen K. MicroRNA-30a sensitizes tumor cells to cis-platinum via suppressing beclin 1-mediated autophagy. J Biol Chem. 2012;287:4148-4156. [PubMed] [DOI] |
| 28. | Zhang J, Zhang T, Ti X, Shi J, Wu C, Ren X, Yin H. Curcumin promotes apoptosis in A549/DDP multidrug-resistant human lung adenocarcinoma cells through an miRNA signaling pathway. Biochem Biophys Res Commun. 2010;399:1-6. [PubMed] [DOI] |
| 29. | Tsang WP, Kwok TT. Epigallocatechin gallate up-regulation of miR-16 and induction of apoptosis in human cancer cells. J Nutr Biochem. 2010;21:140-146. [PubMed] [DOI] |
| 30. | Li H, Hui L, Xu W, Shen H, Chen Q, Long L, Zhu X. Triptolide modulates the sensitivity of K562/A02 cells to adriamycin by regulating miR-21 expression. Pharm Biol. 2012;50:1233-1240. [PubMed] [DOI] |