修回日期: 2016-01-27
接受日期: 2016-02-18
在线出版日期: 2016-03-28
目的: 观察针对CXCR4基因慢病毒Lentiviral(LV)介导的RNAi转染胰腺癌细胞株AsPC-1后细胞增殖、迁移、侵袭的影响, 探讨可能机制.
方法: 人CXCR4基因干扰靶点设计后成功转染人胰腺癌细胞系AsPC-1细胞, 然后分为转染组(LV-siCXCR4-1)、阴性对照组(AsPC-1-LV-con)和空白对照组(AsPC-1细胞), 实验组加入基质细胞衍生因子-1α(stromal cell-derived factor-1α, SDF-1α), MTT法检测细胞增殖, 迁移实验检测细胞迁移, Transwell检测细胞的体外侵袭, Western blot检测血管内皮生长因子(vascular endothelial growth factor, VEGF)、基质蛋白金属酶(matrix metalloproteinases, MMP)2和MMP9的表达.
结果: 在SFM或10%NCS培养条件下, SDF-1α均可刺激AsPC-1细胞、AsPC-1-LV-Con细胞增殖(P<0.01), 对LV-siCXCR4-1增殖均无明显促进作用; SDF-1α可促进AsPC-1、AsPC-1-LV-Con细胞迁移和侵袭(P<0.01), 对LV-siCXCR4-1无明显促进作用; 在SDF-1α作用下, LV-siCXCR4-1细胞的MMP9及VEGF的蛋白表达低于AsPC-1、AsPC-1-LV-Con细胞(P<0.01).
结论: CXCR4基因RNAi可显著抑制SDF-1α引起的AsPC-1细胞的增殖、体外迁移和侵袭, 进一步证实SDF-1/CXCR4受体配体系统参与了胰腺癌的增殖、侵袭及转移, 通过RNAi技术可抑制胰腺癌细胞的增殖、侵袭及转移.
核心提示: 间质细胞衍生因子(stromal cell-derived factor 1, SDF-1)/CXCR4轴在胰腺肿瘤细胞的播散和转移中起重要作用, 因此阻断SDF-1/CXCR4可能是预防肿瘤转移的一种策略, 而应用LV介导的RNAi可能是实现这个策略的一个途径.
引文著录: 黄继英, 高振军, 沈曼茹, 孟鑫. RNA干扰阻断CXCR4基因对胰腺癌AsPC-1细胞侵袭转移的影响. 世界华人消化杂志 2016; 24(9): 1342-1348
Revised: January 27, 2016
Accepted: February 18, 2016
Published online: March 28, 2016
AIM: To explore the changes in proliferation, migration, and invasion of pancreatic cancer line AsPC-1 after CXCR4 is knocked down by RNA interference, and to validate the potential mechanism underlying these changes.
METHODS: AsPC-1 cells were transfected with recombinant lentivirus containing specific shRNA targeting CXCR-4 and included in an experimental group (LV-siCXCR4-1), whereas AsPC-1 cells treated with recombinant lentivirus containing scramble shRNA were used as a negative control (AsPC-1-LV-con). Besides, non-treated AsPC-1 cells were used as a blank control (AsPC-1). After cell cultures were treated with SDF-1α, cell proliferation, migration and invasion in vitro were analyzed, and expression of vascular endothelial growth factor (VEGF), matrix metalloproteinases (MMP)-2 and -9 were quantified.
RESULTS: Under the culture conditions with SFM or 10% normal calf serum, SDF-1α could stimulate the proliferation of AsPC-1 cells and AsPC-1-LV-Con cells (P < 0.01), but had no significant effect on the proliferation of AsPC-1-LV-siCXCR4-1 cells. SDF-1α displayed a promoting effect on the migration and invasion of AsPC-1 and AsPC-1-LV-Con cells (P < 0.01), but showed no significant effect in LV-siCXCR4-1 cells. In the presence of SDF-1α, the protein expression of MMP9 and VEGF in LV-siCXCR4-1 cells was less than that in AsPC-1-LV-Con cells (P < 0.01).
CONCLUSION: RNA interference targeting CXCR-4 could significantly suppress excessive proliferation, migration and invasion of AsPC-1 cells induced by SDF-1α intervention, suggesting that CXCR4/SDF-1 axis contributes to proliferation, invasion and metastasis of pancreatic cancer. RNA interference could be used as a promising approach for therapy of pancreatic cancer.
- Citation: Huang JY, Gao ZJ, Shen MR, Meng X. Effect of RNA inference mediated CXCR4 knockdown on metastasis of AsPC-1 cells. Shijie Huaren Xiaohua Zazhi 2016; 24(9): 1342-1348
- URL: https://www.wjgnet.com/1009-3079/full/v24/i9/1342.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i9.1342
胰腺癌是一种具有高度侵袭倾向的恶性肿瘤, 80%以上的病例会发生局部蔓延和淋巴结转移[1], 5年生存率不到5%. 其预后极差主要与早期局部或远处转移有关[2,3], 故探讨胰腺癌侵袭转移的相关机制对胰腺癌治疗具有重要的临床意义. 间质细胞衍生因子(stromal cell-derived factor 1, SDF-1)及其特异性受体CXCR4所构成的生物学轴在多种肿瘤的播散和器官特异性转移中发挥重要的作用. 已有证据证实在乳腺、口腔、胃肠道及卵巢肿瘤细胞CXCR4的表达增加与淋巴结转移密切相关[4-8]. SDF-1/CXCR4轴通过促进肿瘤细胞迁移和血管生成在胰腺癌的进展中起重要作用[9]. 研究显示, SDF-1/CXCR4在促进肿瘤转移相关基因血管内皮生长因子(vascular endothelial growth factor, VEGF)、基质蛋白金属酶(matrix metalloproteinases 2, MMP2)和/或MMP9的表达及活化中起重要作用[10]. 这些研究均提示阻断SDF-1/CXCR4有可能是预防肿瘤转移的一种策略[11]. 小发夹结构RNA(small hairpin RNA, shRNA)表达载体系统已被广泛用于哺乳动物细胞的RNAi[12,13]. 在应用慢病毒Lentiviral(LV)载体编码针对HIV包膜反义序列治疗艾滋病的临床试验中未发现明显的不良反应, 因而LV载体对人体是安全的[14,15]. 在本实验中, 为了明确SDF-1/CXCR4轴在胰腺癌侵袭中的作用, 我们利用针对CXCR4的LV介导的RNAi有效靶点转染AsPC-1细胞, 观察SDF-1α对AsPC-1细胞增殖、迁移、侵袭的影响及探讨可能机制.
人胰腺癌细胞株AsPC-1购自中国科学院细胞库, SDF-1α购自Peprotech公司, Transwell小室购自Corning公司, DMEM培养基购自Gibco公司, NCS(新生牛血清)购自普飞公司, FBS(胎牛血清)购自Gibco公司, 兔抗人MMP2抗体购自NewMarkers公司, 兔抗人MMP9抗体购自Cell Signal公司, 兔抗人VEGF抗体购自NewMarkers公司.
1.2.1 人CXCR4基因干扰靶点设计: 根据我们已有的实验数据[16], 采用Ambion公司的设计软件, 按照RNA干扰序列设计原则设计针对人CXCR4基因(CXCR4 mRNA NM_001008540, GenBank GI: 56790926)的起始位点为450, 靶点序列为CTCCATCATCTTCTTAACT, 以慢病毒(LV)作为载体, 包装病毒转染AsPC-1细胞, 并命名为LV-siCXCR4-1. 上述含人CXCR4基因shRNA有效靶点的LV载体转染人胰腺癌细胞系AsPC-1细胞后荧光显微镜观察, 转染效率在90%以上, 进一步通过real-time PCR和Western blot验证基因敲除效率, 发现在mRNA及蛋白水平基因沉默效率均在70%以上, 证实LV介导的CXCR4基因RNAi能够有效地抑制AsPC-1细胞CXCR4的表达.
1.2.2 细胞培养: 采用含10%小牛血清的DMEM完全培养基, 39 ℃、50 mL/L CO2饱和湿度孵箱培育. 细胞层贴壁生长至70%-80%融合时以0.25%胰蛋白酶消化传代.
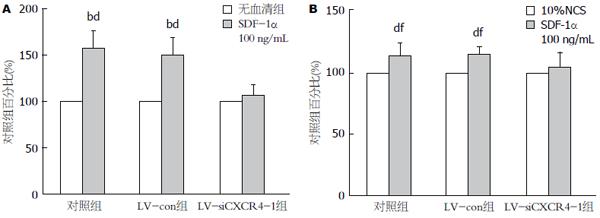
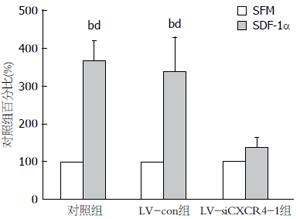
1.2.3 四甲基偶氮唑盐试验: 5×103个/孔(每孔100 μL)的转染组(LV-siCXCR4-1)、阴性对照组(LV-con)和空白对照组的AsPC-1细胞并分别加入96孔板, 实验组加终浓度为SDF-1α 100 ng/mL的无血清培养基(serum free medium, SFM)或10%NCS, 对照组只加SFM或10%NCS, 每组设7个平行孔, 继续培养24 h后每孔加入浓度为5 mg/mL的四甲基偶氮唑盐(MTT)20 μL, 培养4 h; 每孔加入150 μL DMSO, 振荡10 min; 用酶标仪测定490 nm 波长处每孔的吸光度(A)值. 实验重复3次.
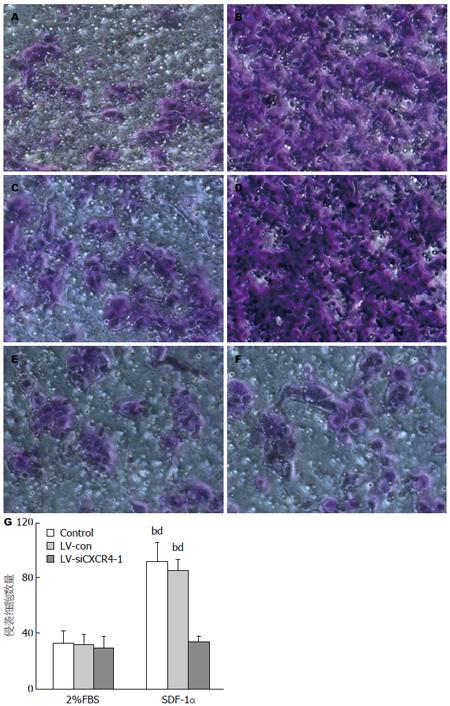
1.2.4 迁移实验: 取对数生长期细胞, 胰酶消化,收集细胞, 加入SFM, 制成2×105/mL的单细胞悬液, 200 μL的LV-siCXCR4-1组、LV-con组和空白对照组的AsPC-1细胞悬液加入上室, 100 ng/mL SDF-1α溶解在500 μL无血清培养基中加入下室, 对照组只加无血清培养基, 常规培育12 h; 加0.1%结晶紫染色20 min; 400倍倒置显微镜下随机计数10个视野, 计数穿膜细胞数, 取均值. 实验重复3次.
1.2.5 Transwell体外侵袭实验: 取对数生长期细胞, 胰酶消化, 收集细胞, 加入SFM, 制成1×106/mL的单细胞悬液, 300 μL的LV-siCXCR4-1组、LV-con组和空白对照组的AsPC-1细胞悬液加入上室, 100 ng/mL SDF-1α溶解在500 μL的2%FBS培养基中加入下室, 对照组只加2%FBS培养基. 每组重复3次, 孵育48 h后随机计数10个高倍镜视野中浸润细胞的数量, 取均值. 实验重复3次.
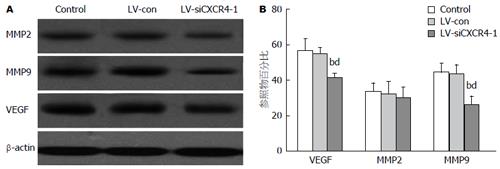
1.2.6 Western blot检测: 细胞贴壁长至90%时, 换SFM+SDF-1α 100 ng/mL, 继续培养24 h后, 提取总蛋白, 用BCA蛋白定量试剂盒测定. 等量蛋白上样, 电泳, 转PVDF膜, 封闭, TBST洗涤, 依次与一抗(稀释浓度同前)、二抗(1:500)反应, 化学发光法(ECL)曝光显影, 冲洗胶片, β-actin为内参照.
统计学处理 用SAS6.12统计学软件处理, 总体及总体中两样本均数之间比较采用ANOVA方差分析, 以P<0.05为差异有统计学意义.
在SFM或10%NCS培养条件下, SDF-1α均可刺激AsPC-1、AsPC-1-LV-Con细胞增殖(P<0.01); 对LV-siCXCR4-1增殖均无明显促进作用(图1).
SDF-1α可促进AsPC-1、AsPC-1-LV-Con细胞迁移(P<0.01), 对LV-siCXCR4-1迁移无明显促进作用(图2). SDF-1α可刺激AsPC-1、AsPC-1-LV-Con细胞侵袭(P<0.01), 对LV-siCXCR4-1侵袭无明显促进作用(图3).
在SDF-1α作用下, LV-siCXCR4-1细胞的MMP9及VEGF的蛋白表达低于AsPC-1、AsPC-1-LV-Con细胞(P<0.01)(图4).
RNAi技术是一种反向遗传学手段, 被广泛地应用于基因功能分析、信号转导通路研究和基因治疗. 他是指生物体内由dsRNA介导同源序列mRNA的特异性降解, 从而导致基因沉默的现象[12-15]. 由于RNAi的高度特异性及表观无毒不良反应, 因此已被众多研究者广泛采用来沉默目的基因的表达并发展成重要的哺乳动物基因治疗技术. 与传统的基因治疗方法相比, RNAi在下调基因表达方面具有更高的特异性和有效性, 因而有可能成为治疗疾病包括肿瘤的新的治疗手段[17,18]. 此外, LV载体为shRNA介导的稳定表达的基因沉默提供了有效的解决途径[19]. 在这个研究中, 我们选用前面实验中验证的LV包装的RNAi有效靶点转染人胰腺癌细胞系[16]. 在本实验中发现, CXCR4基因RNAi在SFM和血清组中均可显著抑制SDF-1α引起的AsPC-1细胞的增殖, 并且能显著抑制SDF-1α所致的AsPC-1的体外迁移、侵袭, 进一步证实SDF-1/CXCR4受体配体系统参与了胰腺癌的增殖及侵袭, 通过RNAi技术可抑制胰腺癌细胞的增殖、侵袭及转移.
SDF-1可促进多种肿瘤细胞的增殖, 其中也包括胰腺癌细胞[20,21]. 越来越多的文献表明了在多种肿瘤中CXCR4的重要性[22-25], 尤其是提示了CXCR4可作为肿瘤治疗的合适靶点. 在一些试验中, 令人信服的证据显示选择性地抑制CXCR4可抑制SDF-1引起的肿瘤迁移[26,27]. 与此相似, CXCR4抑制剂T140在体外也可抑制SDF-1引起的乳腺癌细胞、白血病细胞和内皮细胞的迁移[28].
侵袭转移能力的降低被认为与蛋白水解酶及血管生成相关的基因下调有关. 在人类的很多肿瘤中, MMPs, 尤其是MMP2和MMP9, 一直被认为与肿瘤进展、转移播散和预后不良有关[29]. 他们在胰腺癌的局部侵袭及转移中也起关键作用[30,31]. 癌细胞在体内生长和侵袭转移中需有新生血管的存在, VEGF是一种有效的促血管生成因子, 与MVD增加、局部侵袭、肝转移及术后早期复发有关[32]. 有研究认为VEGF是一种CXCR4下游的靶基因[33]. 在本实验中也发现, 沉默CXCR4表达可抑制AsPC-1细胞中SDF-1α引起的MMP9及VEGF表达.
总之, LV介导的针对CXCR4基因的RNAi能显著抑制SDF-1α所致的AsPC-1的增殖、体外迁移、侵袭能力, 并且能抑制SDF-1α所致的AsPC-1的MMP9和VEGF表达. 因此针对CXCR4基因的RNAi是一项新的预防胰腺癌侵袭及转移的策略.
胰腺癌预后差, 早期即可局部或远处转移, 间质细胞衍生因子(stromal cell-derived factor 1, SDF-1)及其特异性受体CXCR4所构成的生物学轴在胰腺癌的转移中发挥重要的作用. SDF-1可促进肿瘤细胞的增殖, 而抑制CXCR4可抑制SDF-1引起的肿瘤迁移, 因此阻断或抑制SDF-1/CXCR4受体配体系统对于阻断胰腺癌的转移有重要意义.
郑建明, 教授, 主任医师, 第二军医大学附属长海医院病理科
阻断SDF-1/CXCR4有可能是预防肿瘤转移的一种策略. 小发夹结构RNA(small hairpin RNA, shRNA)表达载体系统已被广泛用于RNAi. 应用慢病毒Lentiviral(LV)载体治疗的临床试验中未发现明显的不良反应, LV载体为shRNA介导的稳定表达的基因沉默提供了有效的解决途径. 因此通过RNAi技术阻断SDF-1/CXCR4受体配体系统, 从而抑制胰腺癌的转移, 可能成为胰腺癌治疗的新的途径.
高振军等通过胰腺星状细胞培养上清液对AsPC-1细胞的增殖、迁移、侵袭能力有促进作用而应用抗SDF-1后促进能力被抑制, 提示SDF-1/CXCR4在胰腺星状细胞与胰腺癌细胞的相互作用和转移中有重要作用.
本实验通过针对CXCR4的LV介导的RNAi有效靶点转染胰腺癌AsPC-1细胞后, 观察SDF-1作用下AsPC-1细胞的增殖、迁移、侵袭能力, 证实阻断SDF-1/CXCR4受体配体系统可以抑制胰腺癌细胞的增殖及侵袭, 因此RNAi有可能成为治疗肿瘤的新手段.
该课题对CXCR4基因采用RNAi技术观察AsPC-1细胞在RNAi前后细胞增殖、迁移、侵袭的改变, 并探讨其可能机制. 结果显示, CXCR4基因RNAi可显著抑制SDF-1α引起的AsPC-1细胞的增殖、体外迁移和侵袭, 证实CXCR4/SDF-1受体配体系统参与了胰腺癌的增殖、侵袭及转移机制, 通过RNAi技术可抑制胰腺癌细胞的增殖、侵袭及转移能力, 这也为探讨胰腺癌的治疗提供了一种新的思路.
本实验设计合理, 方法较为先进, 结果可靠, 论文写作规范, 统计方法正确, 讨论充分, 具有一定的创新性和学术价值, 为胰腺癌的治疗提供新的思路.
编辑: 郭鹏 电编:都珍珍
| 1. | Del Chiaro M, Segersvärd R, Lohr M, Verbeke C. Early detection and prevention of pancreatic cancer: is it really possible today? World J Gastroenterol. 2014;20:12118-12131. [PubMed] [DOI] |
| 3. | Papatheodorou H, Papanastasiou AD, Sirinian C, Scopa C, Kalofonos HP, Leotsinidis M, Papadaki H. Expression patterns of SDF1/CXCR4 in human invasive breast carcinoma and adjacent normal stroma: correlation with tumor clinicopathological parameters and patient survival. Pathol Res Pract. 2014;210:662-667. [PubMed] [DOI] |
| 4. | Uchida D, Begum NM, Almofti A, Nakashiro K, Kawamata H, Tateishi Y, Hamakawa H, Yoshida H, Sato M. Possible role of stromal-cell-derived factor-1/CXCR4 signaling on lymph node metastasis of oral squamous cell carcinoma. Exp Cell Res. 2003;290:289-302. [PubMed] |
| 5. | Yu Y, Li H, Xue B, Jiang X, Huang K, Ge J, Zhang H, Chen B. SDF-1/CXCR7 axis enhances ovarian cancer cell invasion by MMP-9 expression through p38 MAPK pathway. DNA Cell Biol. 2014;33:543-549. [PubMed] [DOI] |
| 6. | Sasaki K, Natsugoe S, Ishigami S, Matsumoto M, Okumura H, Setoyama T, Uchikado Y, Kita Y, Tamotsu K, Sakurai T. Expression of CXCL12 and its receptor CXCR4 correlates with lymph node metastasis in submucosal esophageal cancer. J Surg Oncol. 2008;97:433-438. [PubMed] [DOI] |
| 7. | Lee HJ, Jo DY. The role of the CXCR4/CXCL12 axis and its clinical implications in gastric cancer. Histol Histopathol. 2012;27:1155-1161. [PubMed] |
| 9. | Liekens S, Schols D, Hatse S. CXCL12-CXCR4 axis in angiogenesis, metastasis and stem cell mobilization. Curr Pharm Des. 2010;16:3903-3920. [PubMed] |
| 10. | Pan F, Ma S, Cao W, Liu H, Chen F, Chen X, Shi R. SDF-1α upregulation of MMP-2 is mediated by p38 MAPK signaling in pancreatic cancer cell lines. Mol Biol Rep. 2013;40:4139-4146. [PubMed] [DOI] |
| 11. | de Nigris F, Schiano C, Infante T, Napoli C. CXCR4 inhibitors: tumor vasculature and therapeutic challenges. Recent Pat Anticancer Drug Discov. 2012;7:251-264. [PubMed] |
| 12. | Brummelkamp TR, Bernards R, Agami R. A system for stable expression of short interfering RNAs in mammalian cells. Science. 2002;296:550-553. [PubMed] |
| 13. | Paul CP, Good PD, Winer I, Engelke DR. Effective expression of small interfering RNA in human cells. Nat Biotechnol. 2002;20:505-508. [PubMed] |
| 14. | Manilla P, Rebello T, Afable C, Lu X, Slepushkin V, Humeau LM, Schonely K, Ni Y, Binder GK, Levine BL. Regulatory considerations for novel gene therapy products: a review of the process leading to the first clinical lentiviral vector. Hum Gene Ther. 2005;16:17-25. [PubMed] |
| 15. | Li M, Rossi JJ. Lentiviral vector delivery of siRNA and shRNA encoding genes into cultured and primary hematopoietic cells. Methods Mol Biol. 2005;309:261-272. [PubMed] |
| 17. | Kaur IP, Chopra K, Rishi P, Puri S, Sharma G. Small RNAs: the qualified candidates for gene manipulation in diverse clinical pathologies. Crit Rev Ther Drug Carrier Syst. 2014;31:305-329. [PubMed] |
| 18. | Ren YJ, Zhang Y. An update on RNA interference-mediated gene silencing in cancer therapy. Expert Opin Biol Ther. 2014;14:1581-1592. [PubMed] [DOI] |
| 19. | Wang TB, Hu BG, Liu DW, Shi HP, Dong WG. The influence of lentivirus-mediated CXCR4 RNA interference on hepatic metastasis of colorectal cancer. Int J Oncol. 2014;44:1861-1869. [PubMed] [DOI] |
| 20. | Wu PF, Lu ZP, Cai BB, Tian L, Zou C, Jiang KR, Miao Y. Role of CXCL12/CXCR4 signaling axis in pancreatic cancer. Chin Med J (Engl). 2013;126:3371-3374. [PubMed] |
| 21. | Cojoc M, Peitzsch C, Trautmann F, Polishchuk L, Telegeev GD, Dubrovska A. Emerging targets in cancer management: role of the CXCL12/CXCR4 axis. Onco Targets Ther. 2013;6:1347-1361. [PubMed] [DOI] |
| 22. | Shen B, Zheng MQ, Lu JW, Jiang Q, Wang TH, Huang XE. CXCL12-CXCR4 promotes proliferation and invasion of pancreatic cancer cells. Asian Pac J Cancer Prev. 2013;14:5403-5408. [PubMed] |
| 23. | Shakir M, Tang D, Zeh HJ, Tang SW, Anderson CJ, Bahary N, Lotze MT. The chemokine receptors CXCR4/CXCR7 and their primary heterodimeric ligands CXCL12 and CXCL12/high mobility group box 1 in pancreatic cancer growth and development: finding flow. Pancreas. 2015;44:528-534. [PubMed] [DOI] |
| 24. | Wang Z, Ma Q, Li P, Sha H, Li X, Xu J. Aberrant expression of CXCR4 and β-catenin in pancreatic cancer. Anticancer Res. 2013;33:4103-4110. [PubMed] |
| 25. | Liu Z, Teng XY, Meng XP, Wang BS. Expression of stromal cell-derived factor 1 and CXCR7 ligand receptor system in pancreatic adenocarcinoma. World J Surg Oncol. 2014;12:348. [PubMed] [DOI] |
| 28. | Burger M, Hartmann T, Krome M, Rawluk J, Tamamura H, Fujii N, Kipps TJ, Burger JA. Small peptide inhibitors of the CXCR4 chemokine receptor (CD184) antagonize the activation, migration, and antiapoptotic responses of CXCL12 in chronic lymphocytic leukemia B cells. Blood. 2005;106:1824-1830. [PubMed] |
| 29. | Egeblad M, Werb Z. New functions for the matrix metalloproteinases in cancer progression. Nat Rev Cancer. 2002;2:161-174. [PubMed] |
| 30. | Bloomston M, Zervos EE, Rosemurgy AS. Matrix metalloproteinases and their role in pancreatic cancer: a review of preclinical studies and clinical trials. Ann Surg Oncol. 2002;9:668-674. [PubMed] |
| 31. | Tan X, Egami H, Ishikawa S, Sugita H, Kamohara H, Nakagawa M, Nozawa F, Abe M, Ogawa M. Involvement of matrix metalloproteinase-7 in invasion-metastasis through induction of cell dissociation in pancreatic cancer. Int J Oncol. 2005;26:1283-1289. [PubMed] |
| 32. | Domigan CK, Ziyad S, Iruela-Arispe ML. Canonical and noncanonical vascular endothelial growth factor pathways: new developments in biology and signal transduction. Arterioscler Thromb Vasc Biol. 2015;35:30-39. [PubMed] [DOI] |
| 33. | Billadeau DD, Chatterjee S, Bramati P, Sreekumar R, Shah V, Hedin K, Urrutia R. Characterization of the CXCR4 signaling in pancreatic cancer cells. Int J Gastrointest Cancer. 2006;37:110-119. [PubMed] [DOI] |