修回日期: 2016-01-29
接受日期: 2016-01-31
在线出版日期: 2016-03-18
目的: 研究CD44v6基因过表达对SW480细胞侵袭和迁移能力的影响.
方法: 慢病毒介导的CD44v6过表达细胞(CD44v6组)和空载体对照细胞(NC组)由前期实验构建. 采用荧光显微镜观察增强型绿色荧光蛋白(enhanced green fluorescent protein, EGFP)表达、实时荧光定量PCR检测CD44v6 mRNA表达水平、免疫荧光检测Flag标签蛋白三种方法重新鉴定过表达细胞模型; CCK-8法检测细胞增殖活性; 划痕试验和Transwell试验检测细胞侵袭和迁移能力.
结果: 绿色荧光蛋白观察显示细胞转染效率近100%; 实时荧光定量PCR显示CD44v6组细胞CD44v6 mRNA表达水平较对照组显著升高(P<0.001); Flag标签蛋白免疫荧光染色显示过表达CD44v6蛋白主要定位于细胞膜. CCK-8结果显示2组细胞增殖无明显差异; 划痕试验结果显示CD44v6组细胞划痕愈合指数较对照组显著增高(P<0.05); Transwell试验结果显示CD44v6组细胞迁移和侵袭相关指数均较对照组显著增高(均P<0.05), 且CD44v6抗体处理后, CD44v6组细胞迁移和侵袭相关指数均较前显著减低(均P<0.05).
结论: CD44v6基因过表达能显著增强SW480细胞侵袭和迁移能力.
核心提示: 本研究采用慢病毒介导基因过表达技术, 成功建立CD44v6稳定过表达SW480细胞, 通过划痕试验和Transwell试验证实CD44v6过表达可显著增强细胞侵袭和迁移能力.
引文著录: 吕林, 刘海光, 张筱骅. 过表达CD44v6基因对人大肠癌SW480细胞侵袭迁移能力的影响. 世界华人消化杂志 2016; 24(8): 1175-1183
Revised: January 29, 2016
Accepted: January 31, 2016
Published online: March 18, 2016
AIM: To investigate the impact of CD44v6 overexpression on the invasion and metastasis of human colon cancer SW480 cells.
METHODS: SW480 cells stably overexpressing CD44v6 (CD44v6 group) and negative control cells (NC group) were developed through lentivirus infection. Transfection efficiency was evaluated by detecting the expression of enhanced green fluorescent protein (EGFP). CD44v6 mRNA levels were determined using quantitative real-time PCR. Localization of the overexpressed protein was observed by immunofluorescence staining of Flag protein. Cell proliferation was determined by cell counting kit (CCK)-8 assay. Cell invasion and metastasis were examined by scratch assay and transwell assay.
RESULTS: EGFP detection indicated that transfection efficiency was close to 100% in both groups. CD44v6 mRNA levels in CD44v6 overexpressing cells were significantly higher than those in the control cells (P < 0.001). The overexpressed CD44v6 protein was mainly localized on the cell membrane. No difference was revealed in cell proliferation between the two groups by CCK-8 assay. Scratch assay showed that the wound healing index was significantly increased in the CD44v6 group compared with the NC group (P < 0.05). Transwell assay showed that the invasion and metastasis index was significantly increased in the CD44v6 group compared with the NC group (P < 0.05), and the index was significantly decreased after the cells in the CD44v6 group were treated with CD44v6 antibody (P < 0.05).
CONCLUSION: Overexpression of CD44v6 significantly enhances the invasion and metastasis ability of SW480 cells.
- Citation: Lv L, Liu HG, Zhang XH. Impact of CD44v6 overexpression on invasion and metastasis of colon cancer SW480 cells. Shijie Huaren Xiaohua Zazhi 2016; 24(8): 1175-1183
- URL: https://www.wjgnet.com/1009-3079/full/v24/i8/1175.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i8.1175
大肠癌是最常见恶性肿瘤之一, 在美国其发病率和死亡率均处于第3位[1], 在中国两者均呈逐年上升趋势[2]. 虽然目前在大肠癌诊断和治疗方面取得了较大进展, 但仍有50%-60%的患者最终出现远处转移, 5年生存率低[3,4]. 因此, 对大肠癌转移相关分子标志物进行鉴定和研究具有重要临床意义.
CD44属于黏附分子家族跨膜糖蛋白, 广泛表达于多种内皮细胞、间充质细胞及中胚层来源的组织和细胞; 但其变异体CD44v6仅表达于肿瘤细胞和少数正常上皮源性细胞, 是目前最为公认的大肠癌肿瘤干细胞标志物之一[5,6]. 许多研究[7-9]表明大肠癌中CD44v6高表达与肿瘤侵袭转移及不良预后显著相关, 但各研究之间结论并不一致, 亦有报道认为其对预后起保护作用. 此外, 既往报道大多局限于临床相关性研究水平, 尚缺乏细胞及动物水平的功能机制研究. 我们通过检索CellMiner开放数据库[10], 发现SW480细胞中CD44基因处于低表达水平. 为进一步阐明CD44v6在肿瘤细胞播散中的作用及机制, 本研究采用慢病毒介导基因过表达技术, 构建CD44v6稳定过表达细胞模型, 检测其对SW480细胞侵袭和转移能力的影响.
人大肠癌SW480细胞株购自上海中科院细胞库; Leibovitz's L-15培养基和胎牛血清购自美国Gibco公司; 带有增强型绿色荧光蛋白(enhanced green fluorescent protein, EGFP)、Flag标签和嘌呤霉素抗性筛选标记的CD44v6基因过表达重组慢病毒颗粒和空载体对照慢病毒颗粒由上海吉凯基因技术有限公司提供; 嘌呤霉素购自美国AMRESCO公司; TRIzol试剂购自美国Invitrogen公司; 逆转录试剂盒(Revert Aid First Strand cDNA Synthesis Kit)和实时荧光定量PCR试剂盒(Power SYBR Green PCR Master Mix)购自美国Thermo公司; CD44v6和GAPDH引物由美国Invitrogen公司合成; CD44v6单抗(VFF-7)购自美国Abcam公司; Flag单抗(1B10)和Dylight-549标记荧光二抗购自美国Abbkine公司; 激光共聚焦专用玻底小皿购自无锡耐思生物科技有限公司; Cell Counting Kit-8(CCK-8)试剂盒购自日本Dojindo公司; Transwell小室(8 μm)购自美国Corning公司; Matrigel基质胶购自美国BD公司; DAPI染料和0.5%结晶紫染液购自上海碧云天生物技术有限公司.
1.2.1 细胞培养和转染: CD44v6过表达及空载体对照SW480细胞由本实验小组前期研究构建[11], 冻存于液氮中. 培养和转染方法简述如下: 细胞用含10%胎牛血清的Leibovitz's L-15培养基, 在37 ℃、无CO2条件下培养. 转染前接种细胞于6孔板预先培养24 h, 以感染复数(multiplicity of infection, MOI)为20, 分别加入CD44v6基因过表达重组慢病毒颗粒和空载体对照慢病毒颗粒进行转染, 24 h后更换培养基. 转染后72 h开始添加2 μg/mL嘌呤霉素筛选稳定转染细胞, 共筛选1 wk. 本次实验在复苏细胞后对CD44v6表达情况进行了重新鉴定. 实验均分2组进行: CD44v6过表达组(CD44v6)和空载体对照组(NC).
1.2.2 实时荧光定量PCR: 首先用TRIzol试剂提取细胞总RNA, 采用吸光度法进行质量评估, 确保A260/280介于1.9-2.1之间, 浓度不低于300 ng/μL. 然后用Revert Aid First Strand cDNA Synthesis Kit试剂盒逆转录为cDNA. 最后用Power SYBR Green PCR Master Mix试剂盒进行实时荧光定量PCR检测, 每个基因设3个复孔, 仪器为美国ABI 7500 Real-time PCR System. 以GAPDH作为内参, 采用2-△△Ct法分析CD44v6 mRNA表达水平. CD44v6上游引物: 5'-AGGAACAGTGGTTTGGCAAC-3', 下游引物: 5'-CGAATGGGAGTCTTCTTTGG-3', 扩增片段68 bp; GAPDH上游引物: 5'-ATGGGTGTGAACCATGAGAA-3', 下游引物: 5'-GTGCTAAGCAGTTGGTGGTG-3', 扩增片段79 bp.
1.2.3 免疫荧光: 细胞接种于激光共聚焦专用玻底小皿, 培养24 h至融合度约80%. 依次用4%多聚甲醛固定20 min、0.3% Triton X-100通透20 min、Flag单抗(1:500)4 ℃孵育过夜、Dylight-549标记荧光二抗(1:200)室温孵育30 min、DAPI染色4 min. 各步骤之间均以PBS洗涤, 完成后立即于荧光显微镜下观察并拍照.
1.2.4 CCK-8试验: 细胞接种于96孔板, 密度1×104个/孔, 体积100 μL. 每组各设5排, 每排5个复孔, 另设1排无细胞对照. 接种后24 h起, 每隔24 h各检测1排, 共5 d. 测定时每孔加入10 μL CCK-8试剂, 37 ℃孵育1 h, 然后用多功能酶标仪测定450 nm吸光度(A450), 并以630 nm(A630)作为参比波长. 每组以无细胞对照孔A450校正, 绘制生长曲线.
1.2.5 划痕试验: 在6孔板底面预先绘制数条参考线, 用于定位划痕位置. 细胞以6×105个/孔接种, 每组3个复孔. 培养24 h后, 使用200 μL枪头进行划痕处理, PBS洗涤2次, 加入无血清培养基培养, 观察并拍摄0 h划痕照片. 培养24 h后, 于相同部位拍摄24 h划痕照片. 使用Image Pro Plus 6.0软件读取划痕面积(S), 计算划痕愈合指数: (S0 h-S24 h)/S0 h.
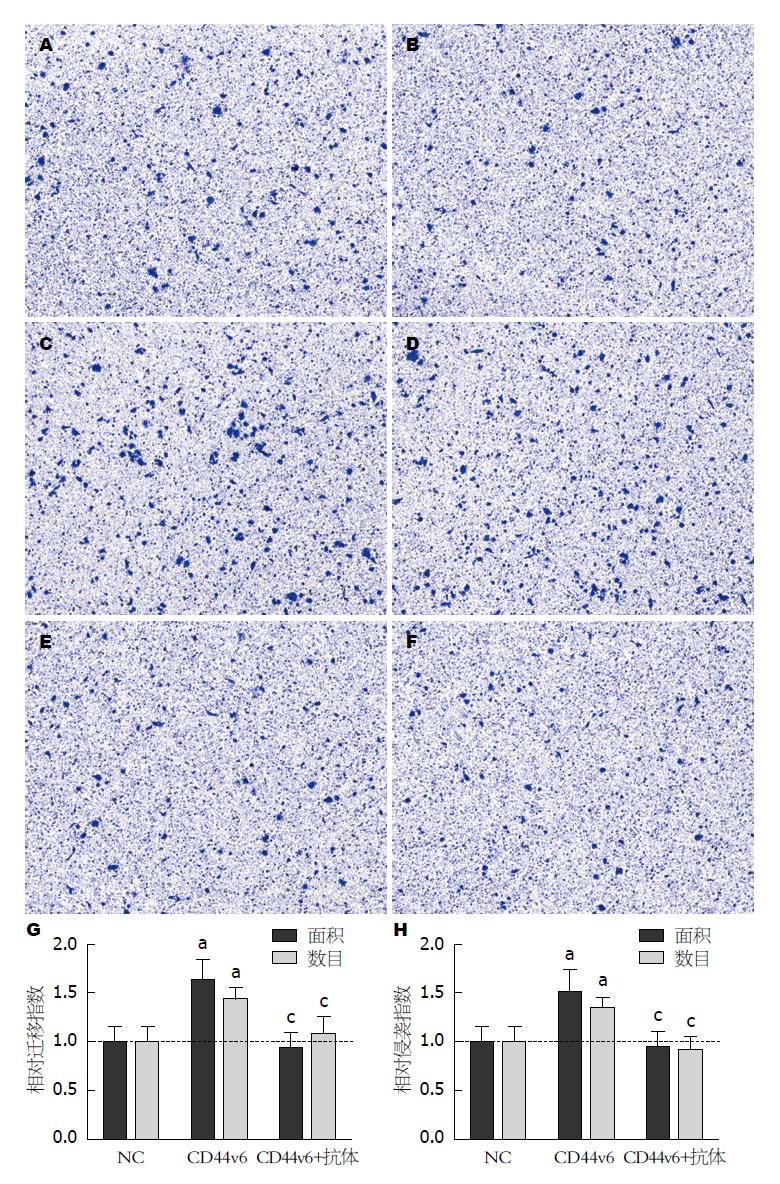
1.2.6 Transwell侵袭迁移试验: 为观察CD44v6单抗处理对过表达细胞侵袭迁移能力的影响, 本试验设为3组: CD44v6组、NC组和CD44v6+抗体组, 每组3个复孔. 迁移试验采用无基质胶Transwell小室, 接种前用无血清培养基预平衡30 min. 细胞消化后用无血清培养基重悬, 调整密度至5×105个/mL. 上室加入200 μL细胞悬液, 下室加入600 μL含10%胎牛血清的完全培养基, 培养24 h. 然后取出小室, 甲醇固定20 min, 0.5%结晶紫染色40 min, 用湿棉签拭去膜上表面细胞, 漂洗后晾干. 侵袭试验采用含基质胶Transwell小室, 基质胶用无血清培养基1:2稀释, 每个小室铺10 μL, 并于37 ℃成胶30 min, 其余步骤同迁移试验. 最后每个小室用10倍物镜拍摄上、下、左、右、中共5个视野. 使用Image Pro Plus 6.0软件读取穿膜细胞累积面积和数目, 以NC组均值为1计算相对迁移和侵袭指数.
统计学处理 应用SPSS21.0统计软件进行分析, 数据均采用mean±SD表示, 两组间均数比较采用独立样本t检验, P<0.05为差异具有统计学意义.
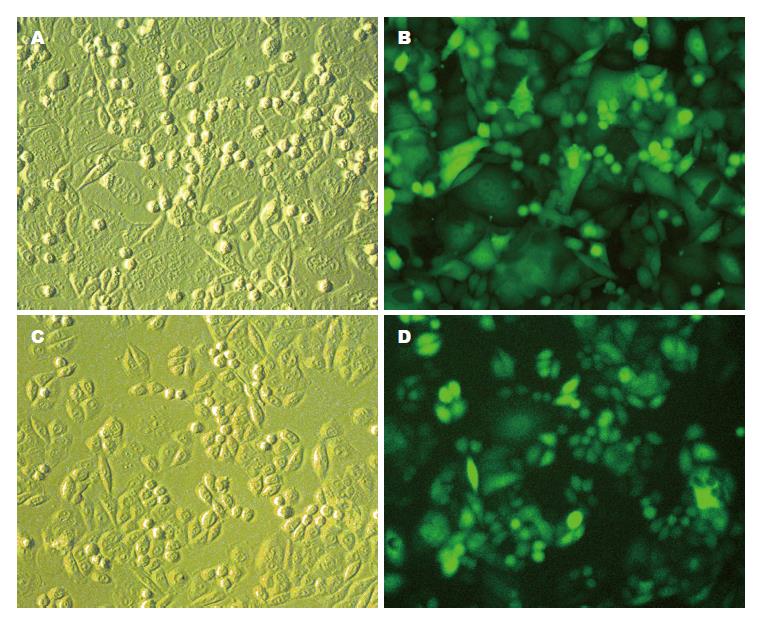
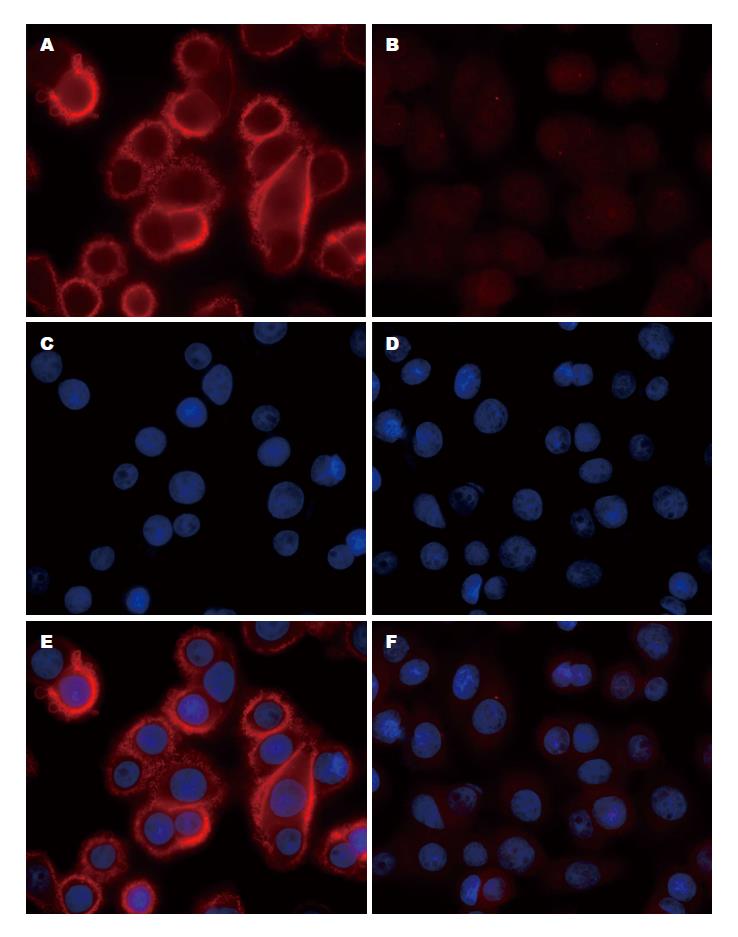
采用荧光显微镜观察EGFP表达、实时荧光定量PCR检测CD44v6 mRNA表达水平、免疫荧光检测Flag标签蛋白3种方法重新评估过表达细胞模型. 发现2组细胞均可见明显EGFP表达, 提示转染效率均近100%(图1). 实时荧光定量PCR结果显示, CD44v6组CD44v6 mRNA相对表达水平较NC组显著升高, 差异具有统计学意义(62.33±6.81 vs 1.00±0.00, P<0.001). Flag标签为过表达目的蛋白尾部由8个氨基酸组成的短肽, 易于检测而不影响目的蛋白功能. Flag标签免疫荧光染色显示, CD44v6组可见明亮红色荧光, 主要定位于细胞膜; 而NC组可见较弱的红色荧光, 呈弥漫性分布, 提示CD44v6蛋白的良好表达和正确定位(图2). 以上结果从不同层面证实过表达细胞模型状态良好.
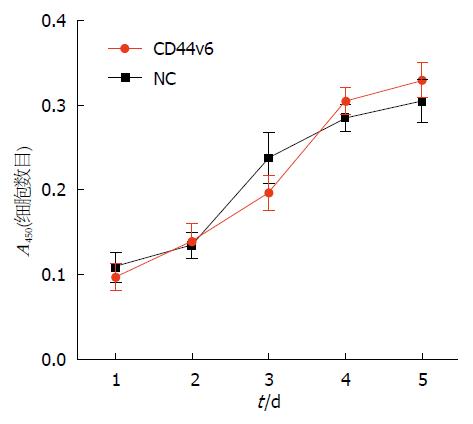
通过CCK-8细胞增殖活性检测, 发现各检测点2组细胞A450值均无明显差异, 细胞倍增时间均约为48 h(图3). 提示CD44v6过表达对SW480细胞增殖无明显影响.
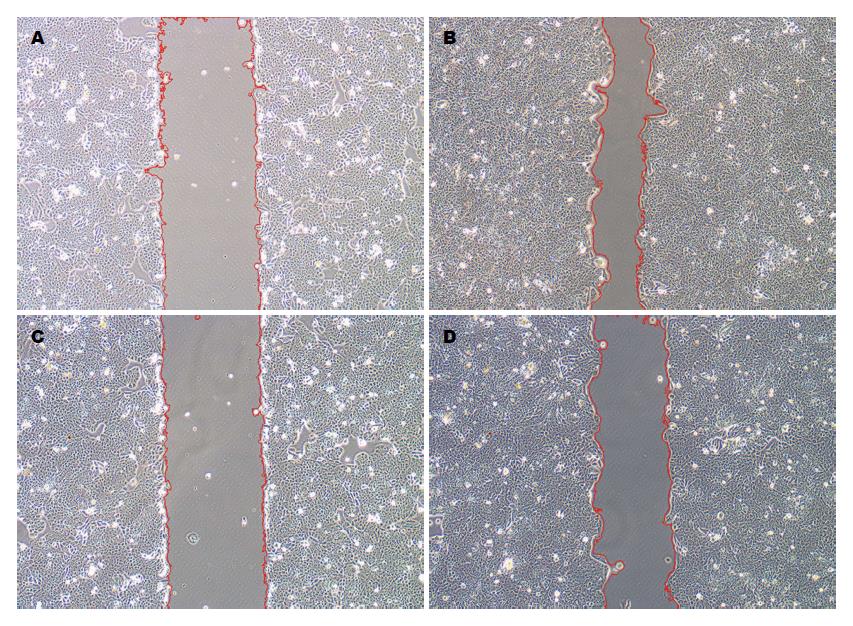
采用划痕试验和Transwell试验共同检测细胞侵袭迁移能力. 划痕试验表明, CD44v6组划痕愈合能力较NC组显著增强, 划痕愈合指数分别为0.55±0.045和0.29±0.075, 差异具有统计学意义(P = 0.007)(图4). Transwell试验表明(图5), 不论是否含有基质胶, 不论以累积面积(S)或数目(N)评价, CD44v6组细胞穿膜能力均强于NC组, 差异具有统计学意义(迁移: S: 1.62±0.21 vs 1.00±0.16, N: 1.44±0.11 vs 1.00±0.15; 侵袭: S: 1.52±0.22 vs 1.00±0.17, N: 1.35±0.10 vs 1.00±0.15; 均P<0.05); 此外, 经抗体封闭后, CD44v6组细胞穿膜能力较前明显减弱, 差异具有统计学意义(迁移: S: 0.93±0.16 vs 1.62±0.21, N: 1.09±0.17 vs 1.44±0.11; 侵袭: S: 0.96±0.16 vs 1.52±0.22, N: 0.91±0.16 vs 1.35±0.10; 均P<0.05). 以上实验表明, CD44v6过表达可显著增加SW480细胞侵袭和迁移能力, 而这种功能可以被CD44v6单抗阻断.
CD44分子家族为跨膜糖蛋白. 其胞外结构域与透明质酸(hyaluronic acid, HA)、胶原、层黏连蛋白等细胞外基质成分相互作用; 胞内结构域与ERM家族成员(埃兹蛋白、根蛋白、膜突蛋白)、锚蛋白等细胞骨架成分交联; 在造血、淋巴细胞归巢与活化、胚胎发育、创口愈合等方面具有广泛功能[12]. 在胞外结构域近胞膜处可插入不同可变外显子的产物, 从而形成多种CD44变异体(CD44v), 其中不含任何可变外显子产物的CD44称为标准型CD44(CD44s), 包含可变外显子v6产物的变异体即为CD44v6[13]. 在结直肠组织中, CD44v6具有良好的肿瘤特异性, 其广泛表达于肿瘤原发灶和转移灶, 而在正常上皮组织中几乎不表达[14,15].
作为良好的潜在靶向治疗位点, 目前已有大量针对CD44v6的相关报道, 然而各研究之间结论并不一致. 在不同肿瘤, 甚至相同类型肿瘤中, 也常可见结论截然相反的报道. 在大肠癌中, Zlobec等[9]采用大样本组织芯片染色, 发现CD44v6膜表达缺失与肿瘤进展及不良预后相关; 另外, 该作者通过对30篇大肠癌免疫组织化学染色相关文献进行分析, 发现其中6篇认为CD44v6高表达提示预后不良, 3篇提示预后良好, 8篇则提示与预后无关. 研究结果的不一致可能与以下因素有关: (1)实验方法未标准化. 例如, 不同克隆号的CD44v6抗体具有不同的抗原亲和力, 可以直接影响表达水平的检测[15]; 免疫组织化学结果的判定也缺乏统一标准, 从而减弱了不同研究之间的可比性; (2)CD44v6表达存在异质性[16]. 其存在膜型、浆型、分泌型等多种表达模式, 可能预示着不同的功能, 同时也增加了结果检测和分析的难度; (3)CD44v6功能机制复杂多样. CD44v6保留了CD44s的基本功能, 同时拥有v6结构域特有的功能. 肿瘤微环境中, CD44v6在不同配体作用下可激活不同的下游信号通路, 从而发挥不同的生物学功能[13]. 因此, 深入研究CD44v6与不同因子之间的相互作用关系, 对于阐明其具体作用机制具有重要的指导意义.
基因沉默与过表达是基因功能研究的重要技术. 其中, 过表达技术在研究分子间相互作用关系方面更具优势, 但由于不易构建等原因, 目前尚未发现关于人CD44v6过表达的报道. 本研究采用在CD44基因可变外显子区插入v6外显子的方式重组CD44v6, 构建过表达慢病毒载体, 并最终转染SW480细胞成功建立CD44v6过表达细胞模型; 划痕试验和Transwell侵袭迁移试验表明, CD44v6过表达可显著促进肿瘤细胞侵袭和迁移, 与Saito等[8]、Jung等[17]及Ni等[18]RNA干扰相关研究结论一致. 在增殖方面, Marhaba等[19]发现在小鼠胸腺瘤细胞中CD44v6通过持续激活MAPK通路促进细胞增殖, 而本研究显示其对细胞增殖无明显影响, 差异可能与细胞类型和所处微环境有关.
CD44v6介导大肠癌细胞侵袭转移为多种机制共同作用的结果. 首先, 作为细胞黏附分子, CD44v6与HA交联可直接影响细胞骨架的构象和分布, 调节细胞黏附和运动[20,21]; 其次, 多项研究表明肝细胞生长因子(hepatocyte growth factor, HGF)对肿瘤细胞中受体酪氨酸激酶c-Met的激活依赖于v6结构域的协同作用[22,23], 而HGF/c-Met通路在肿瘤侵袭转移中扮演重要角色, 包括促进细胞增殖、促进细胞变形和迁移、诱导肿瘤血管生成等[24,25]. 此外, CD44v6-HA交联可促进细胞外基质聚集, 并在此基础上募集特定细胞因子, 如基质金属蛋白酶家族(matrix metalloproteinases, MMPs)、骨桥蛋白(osteopontin, OPN)、多种生长因子等, 从而改造肿瘤微环境使其适合肿瘤细胞存活和转移[26]. 其中, MMPs聚集和活化可有效降解细胞外基质屏障, 为肿瘤细胞侵袭转移提供必要基础[27,28]; CD44v6与OPN相互作用可进一步促进肿瘤细胞黏附和迁移[29]; 而各种生长因子不但促进肿瘤细胞的存活和增殖, 也参与肿瘤血管与淋巴管的生成, 继而促进肿瘤细胞全身转移. Tremmel等[30]亦发现CD44v6可直接激活血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor 2, VEGFR-2)促进肿瘤中脉管的形成. 另外, 上皮间质转化(epithelial-mesenchymal transition, EMT)被认为是肿瘤转移的重要机制之一[31], 我们前期研究[11]和Ni等[18]均证实CD44v6亦参与了EMT过程.
总之, 以CD44v6为中心, 多种因子共同参与了肿瘤细胞的浸润和转移, 而具体相互作用关系及调节机制有待进一步阐明. 本研究进一步证实了CD44v6在肿瘤细胞侵袭和迁移中的作用, 同时也证明了过表达细胞模型的有效性, 为后续分子机制的研究奠定了基础.
CD44v6是最为公认的大肠癌肿瘤干细胞标志物之一, 被认为与肿瘤侵袭转移及不良预后相关. 但目前研究大多局限于临床相关性水平, 缺乏细胞及动物水平的功能机制研究. 建立可靠的细胞模型, 对深入研究分子机制具有重要意义.
肖秀英, 副主任医师, 上海交通大学医学院附属仁济医院; 白雪, 副主任医师, 中国人民解放军北京军区总医院普通外科
肿瘤转移和复发是导致肿瘤治疗失败的主要原因. 肿瘤干细胞被认为是肿瘤转移、复发和耐药的根源. 如何准确鉴定和靶向肿瘤干细胞是目前研究的难点, 相关机制亦有待进一步阐明.
Ni等通过RNA干扰技术, 在前列腺癌细胞中证实CD44v6基因沉默后, 细胞侵袭迁移能力降低, 药物敏感性增加、增殖能力减弱等, 此过程可能为CD44v6通过影响PI3K/Akt/mTOR和Wnt信号通路所致.
既往CD44v6细胞水平研究均使用RNA干扰技术. 本研究首次使用慢病毒介导基因过表达技术, 从另一层面证实CD44v6在肿瘤细胞侵袭和迁移中的作用, 为后续机制研究提供基础.
本研究进一步证实CD44v6过表达后大肠癌细胞侵袭和迁移能力显著增强, 为CD44v6作为肿瘤干细胞标志物和潜在治疗靶点, 以及深入机制研究提供新的理论支持和实验基础.
慢病毒介导基因过表达技术: 通常将目的基因CDS序列与慢病毒载体重组, 慢病毒转染细胞后, 可将目的基因序列逆转录整合到宿主细胞中, 从而实现目的基因稳定过表达. 与RNA干扰技术共同为基因功能机制研究的重要技术.
本文立题较新颖, 采用慢病毒介导基因过表达技术, 构建CD44v6稳定过表达细胞模型, 发现CD44v6过表达可显著增加SW480细胞侵袭和转移能力, 具有一定的科学性、创新性.
编辑: 郭鹏 电编: 闫晋利
| 1. | Siegel R, Desantis C, Jemal A. Colorectal cancer statistics, 2014. CA Cancer J Clin. 2014;64:104-117. [PubMed] [DOI] |
| 2. | Zhang Y, Shi J, Huang H, Ren J, Li N, Dai M. [Burden of colorectal cancer in China]. Zhonghua Liuxingbingxue Zazhi. 2015;36:709-714. [PubMed] [DOI] |
| 3. | Van Cutsem E, Nordlinger B, Adam R, Köhne CH, Pozzo C, Poston G, Ychou M, Rougier P. Towards a pan-European consensus on the treatment of patients with colorectal liver metastases. Eur J Cancer. 2006;42:2212-2221. [PubMed] [DOI] |
| 4. | Yoo PS, Lopez-Soler RI, Longo WE, Cha CH. Liver resection for metastatic colorectal cancer in the age of neoadjuvant chemotherapy and bevacizumab. Clin Colorectal Cancer. 2006;6:202-207. [PubMed] [DOI] |
| 5. | Todaro M, Gaggianesi M, Catalano V, Benfante A, Iovino F, Biffoni M, Apuzzo T, Sperduti I, Volpe S, Cocorullo G. CD44v6 is a marker of constitutive and reprogrammed cancer stem cells driving colon cancer metastasis. Cell Stem Cell. 2014;14:342-356. [PubMed] [DOI] |
| 6. | Fan CW, Wen L, Qiang ZD, Chen T, Zhou ZG, Mo XM, Hu JK. Prognostic significance of relevant markers of cancer stem cells in colorectal cancer - a meta analysis. Hepatogastroenterology. 2012;59:1421-1427. [PubMed] [DOI] |
| 7. | Avoranta ST, Korkeila EA, Syrjänen KJ, Pyrhönen SO, Sundström JT. Lack of CD44 variant 6 expression in rectal cancer invasive front associates with early recurrence. World J Gastroenterol. 2012;18:4549-4556. [PubMed] [DOI] |
| 8. | Saito S, Okabe H, Watanabe M, Ishimoto T, Iwatsuki M, Baba Y, Tanaka Y, Kurashige J, Miyamoto Y, Baba H. CD44v6 expression is related to mesenchymal phenotype and poor prognosis in patients with colorectal cancer. Oncol Rep. 2013;29:1570-1578. [PubMed] [DOI] |
| 9. | Zlobec I, Günthert U, Tornillo L, Iezzi G, Baumhoer D, Terracciano L, Lugli A. Systematic assessment of the prognostic impact of membranous CD44v6 protein expression in colorectal cancer. Histopathology. 2009;55:564-575. [PubMed] [DOI] |
| 10. | Reinhold WC, Sunshine M, Liu H, Varma S, Kohn KW, Morris J, Doroshow J, Pommier Y. CellMiner: a web-based suite of genomic and pharmacologic tools to explore transcript and drug patterns in the NCI-60 cell line set. Cancer Res. 2012;72:3499-3511. [PubMed] [DOI] |
| 11. | Lv L, Liu HG, Dong SY, Yang F, Wang QX, Guo GL, Pan YF, Zhang XH. Upregulation of CD44v6 contributes to acquired chemoresistance via the modulation of autophagy in colon cancer SW480 cells. Tumour Biol. 2016; Jan 9. [Epub ahead of print]. [PubMed] [DOI] |
| 12. | Naor D, Sionov RV, Ish-Shalom D. CD44: structure, function, and association with the malignant process. Adv Cancer Res. 1997;71:241-319. [PubMed] |
| 13. | Zöller M. CD44: can a cancer-initiating cell profit from an abundantly expressed molecule? Nat Rev Cancer. 2011;11:254-267. [PubMed] [DOI] |
| 14. | Coppola D, Hyacinthe M, Fu L, Cantor AB, Karl R, Marcet J, Cooper DL, Nicosia SV, Cooper HS. CD44V6 expression in human colorectal carcinoma. Hum Pathol. 1998;29:627-635. [PubMed] |
| 15. | Heider KH, Kuthan H, Stehle G, Munzert G. CD44v6: a target for antibody-based cancer therapy. Cancer Immunol Immunother. 2004;53:567-579. [PubMed] [DOI] |
| 16. | Koretz K, Möller P, Lehnert T, Hinz U, Otto HF, Herfarth C. Effect of CD44v6 on survival in colorectal carcinoma. Lancet. 1995;345:327-328. [PubMed] |
| 17. | Jung T, Gross W, Zöller M. CD44v6 coordinates tumor matrix-triggered motility and apoptosis resistance. J Biol Chem. 2011;286:15862-15874. [PubMed] [DOI] |
| 18. | Ni J, Cozzi PJ, Hao JL, Beretov J, Chang L, Duan W, Shigdar S, Delprado WJ, Graham PH, Bucci J. CD44 variant 6 is associated with prostate cancer metastasis and chemo-/radioresistance. Prostate. 2014;74:602-617. [PubMed] [DOI] |
| 19. | Marhaba R, Bourouba M, Zöller M. CD44v6 promotes proliferation by persisting activation of MAP kinases. Cell Signal. 2005;17:961-973. [PubMed] [DOI] |
| 20. | Lokeshwar VB, Fregien N, Bourguignon LY. Ankyrin-binding domain of CD44(GP85) is required for the expression of hyaluronic acid-mediated adhesion function. J Cell Biol. 1994;126:1099-1109. [PubMed] |
| 22. | Orian-Rousseau V, Chen L, Sleeman JP, Herrlich P, Ponta H. CD44 is required for two consecutive steps in HGF/c-Met signaling. Genes Dev. 2002;16:3074-3086. [PubMed] [DOI] |
| 23. | Damm S, Koefinger P, Stefan M, Wels C, Mehes G, Richtig E, Kerl H, Otte M, Schaider H. HGF-promoted motility in primary human melanocytes depends on CD44v6 regulated via NF-kappa B, Egr-1, and C/EBP-beta. J Invest Dermatol. 2010;130:1893-1903. [PubMed] [DOI] |
| 24. | Gherardi E, Birchmeier W, Birchmeier C, Vande Woude G. Targeting MET in cancer: rationale and progress. Nat Rev Cancer. 2012;12:89-103. [PubMed] [DOI] |
| 25. | Elliott VA, Rychahou P, Zaytseva YY, Evers BM. Activation of c-Met and upregulation of CD44 expression are associated with the metastatic phenotype in the colorectal cancer liver metastasis model. PLoS One. 2014;9:e97432. [PubMed] [DOI] |
| 26. | Ponta H, Sherman L, Herrlich PA. CD44: from adhesion molecules to signalling regulators. Nat Rev Mol Cell Biol. 2003;4:33-45. [PubMed] [DOI] |
| 27. | Yu Q, Stamenkovic I. Localization of matrix metalloproteinase 9 to the cell surface provides a mechanism for CD44-mediated tumor invasion. Genes Dev. 1999;13:35-48. [PubMed] |
| 28. | Murray D, Morrin M, McDonnell S. Increased invasion and expression of MMP-9 in human colorectal cell lines by a CD44-dependent mechanism. Anticancer Res. 2004;24:489-494. [PubMed] |
| 29. | Huang J, Pan C, Hu H, Zheng S, Ding L. Osteopontin-enhanced hepatic metastasis of colorectal cancer cells. PLoS One. 2012;7:e47901. [PubMed] [DOI] |
| 30. | Tremmel M, Matzke A, Albrecht I, Laib AM, Olaku V, Ballmer-Hofer K, Christofori G, Héroult M, Augustin HG, Ponta H. A CD44v6 peptide reveals a role of CD44 in VEGFR-2 signaling and angiogenesis. Blood. 2009;114:5236-5244. [PubMed] [DOI] |
| 31. | Cao H, Xu E, Liu H, Wan L, Lai M. Epithelial-mesenchymal transition in colorectal cancer metastasis: A system review. Pathol Res Pract. 2015;211:557-569. [PubMed] [DOI] |