修回日期: 2015-12-18
接受日期: 2015-12-29
在线出版日期: 2016-02-18
目的: 探讨肝脏Wilson病(Wilson disease, WD)的临床病理特征、诊断、鉴别诊断、治疗方法和预后, 以提高对WD的认识, 尽早明确诊断.
方法: 对5例WD的肝脏穿刺活检组织进行HE、免疫组织化学、网纤/Masson、PAS、罗丹宁铜染色及透射电镜超微结构观察, 并结合文献进行复习.
结果: 5例WD患者中, 男性2例, 女性3例, 首诊年龄24-47岁, 中位年龄38岁. 临床主要表现黄疸、肝功能异常、眼底检查示角膜色素环(Kayser-Fleischer环, K-F环)等, 所有病例血清铜蓝蛋白均>89.3 mg/L. 光镜: 中-重度慢性肝炎伴肝纤维化或肝硬化3例, 轻度慢性肝炎1例, 肝组织轻微病变1例; 罗丹宁铜染色示肝细胞内多少不等的不均匀颗粒样物质沉积, 部分病例以汇管区周围Ⅰ区带的肝细胞多见. 电镜: 肝细胞胞浆内可见高电子密度特征性Wilson颗粒, 并见大小泡脂滴及色素颗粒小体.
结论: WD的常规实验室检查、临床表现、光镜组织学改变均不具有特异性, 电镜超微结构特征性Wilson颗粒是WD明确诊断的重要依据, 故肝脏穿刺活检有助于WD的诊断.
核心提示: 本文总结5例Wilson病(Wilson disease, WD)患者的临床特点、实验室检查及组织病理学特征. WD的早期排铜治疗效果好, 因此对于不明原因肝功异常且疑似WD的患者应尽早行肝脏穿刺病理活检.
引文著录: 延永琴, 郑智勇, 曾德华, 刘庆宏, 朱育连, 郑巧灵, 曲利娟. 肝脏Wilson病的临床病理特征. 世界华人消化杂志 2016; 24(5): 782-789
Revised: December 18, 2015
Accepted: December 29, 2015
Published online: February 18, 2016
AIM: To discuss the clinicopathologic features of Wilson disease (WD) of the liver as well as its diagnosis, treatment and prognosis, so as to deepen the understanding of WD and benefit its early diagnosis.
METHODS: Five WD biopsy specimens were examined by HE staining, Masson staining, PAS staining, and rhodanine staining. Cell ultra microstructure observation was enabled by utilizing an electron microscope.
RESULTS: Among the 5 WD cases, 2 were male. The age at first diagnosis was 24 to 47 years, with a mean age of 38 years. Main clinical manifestations included jaundice, liver dysfunction, and Kayser-Fleischer loop indicated by fundus examinations. All patients revealed a serum ceruloplasmin level less than 89.3 mg/L, and light microscopy suggested that 3 of them were chronic severe hepatitis cases with liver fibrosis or cirrhosis, 1 suffered from mild chronic hepatitis and 1 yielded minimal lesions in the hepatic tissue. Rhodamine staining showed deposit of heterogeneous and varying amounts of particles in hepatic cells, especially in those cells located in zone I around portal areas in some cases. Transmission electron microscopy showed Wilson particles with high electron density in the cytoplasm, accompanied with lipid droplets and/or pigmentary granular bodies.
CONCLUSION: Routine laboratory tests, clinical features, as well as histological changes under a light microscope are unspecific in diagnosing WD, whereas Wilson particles detected by transmission electron microscopy can provide an important diagnostic basis for WD. Therefore, liver biopsy is conducive to diagnosis of WD.
- Citation: Yan YQ, Zheng ZY, Zeng DH, Liu QH, Zhu YL, Zheng QL, Qu LJ. Clinicopathologic features of Wilson disease of the liver. Shijie Huaren Xiaohua Zazhi 2016; 24(5): 782-789
- URL: https://www.wjgnet.com/1009-3079/full/v24/i5/782.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i5.782
Wilson病(Wilson disease, WD)又称肝豆状核变性(hepatolenticular degeneration, HLD), 是一种常染色体隐性遗传且主要累及肝脏的铜代谢性疾病, 于1912年和1948年, 由SAK和Cumings首先对WD及肝脏铜蓄积分别进行报道. 发病人群多为青少年或中青年, 临床上多以肝脏损害为首发症状, 主要表现慢性肝炎、进行性肝硬化和肝功能衰竭[1]. 因该病缺乏特征性临床表现、组织病理学改变及常规实验室检查, 确诊颇为困难, 但尽早对WD进行肝脏穿刺活检、尽早期确诊与排铜治疗对改善WD预后具有重要临床意义. 本文收集5例中国人民解放军南京军区福州总医院确诊WD的病例, 并结合文献进行复习, 以提高对WD临床病理特征的认识.
收集2013-01/2015-04在中国人民解放军南京军区福州总医院行肝脏穿刺活检并确诊为WD的患者5例, 其中男性2例、女性3例, 年龄24-47岁, 中位年龄38岁, 均为首诊病例. 临床表现: 4例以尿黄, 下肢水肿, 皮肤瘙痒, 乏力为首发症状; 1例表现乏力伴抽搐, 其母血清铜蓝蛋白降低, 且该患者和其弟弟有长期出现四肢不自主震颤的病史. 体格检查: 5例均有皮肤巩膜黄染, 3例眼底镜检查均出现角膜色素环(Kayser-Fleischer环, K-F环), 2例未行眼底检查. 实验室检查: 所有患者血清铜蓝蛋白不同程度降低(范围27.9-89.3 mg/L), 肝功能: 总胆红素(32.8-60.5 μmol/L); 直接胆红素(19.4-44.4 μmol/L); 丙氨酸转氨酶(61-93 U/L); 谷草转氨酶(75-148 U/L); 谷氨酰转肽酶(266-312 U/L)不同程度升高, 病原学检查甲、乙、丙、戊型肝炎抗原均阴性, 自身免疫性相关抗体、梅毒螺旋体抗体及艾滋病毒抗体均阴性. 一抗乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg)、乙型肝炎核心抗原(hepatitis B core antigen, HBcAg)和EliVision试剂盒购自福州迈新公司, HE、网纤/Masson、PAS、罗丹宁铜染色及电镜制片所用试剂原材料均购自上海国药集团化学试剂有限公司.
B超引导下经皮肝脏穿刺活检标本一分为二. 一份投入4%中性甲醛溶液固定, 常规石蜡包埋, 4 μm厚切片, HE染色; 免疫组织化学染色采用EliVision两步法, 实验步骤参照说明书. 网纤/Masson染色: 切片常规脱蜡至水, 0.25%高锰酸钾氧化5 min, 1%草酸漂白, Gomori氨性银溶液染色5 min, 至切片呈棕黄色, 4%甲醛还原5 min; Masson染色7 min, 1%磷钼酸分化3 min, 0.5%固绿液染色3 min; 中性树胶封固; 以上每个步骤之间均予蒸馏水水洗. PAS染色步骤: 切片常规脱蜡至水, 高碘酸氧化20 min, Schiff液染色20 min, 水洗5 min, 苏木精复染, 0.5%盐酸乙醇分化、返蓝, 中性树胶封固. 罗丹宁铜染色: 切片常规脱蜡至水, 二甲氨基亚苄基罗丹宁工作液56 ℃孵育3.5 h, 苏木精复染; 水洗返蓝, 中性树胶封固. 另一份标本投入3%戊二醛溶液前固定2 h, 1%锇酸后固定1 h, 500 mL/L乙醇、700 mL/L乙醇、900 mL/L乙醇、900 mL/L乙醇与900 mL/L丙酮(1:1)、900 mL/L丙酮、1000 mL/L丙酮逐级梯度脱水, 环氧树脂618包埋, 半薄切片定位, 超薄切片经醋酸铀和枸橼酸铅双重电子染色, HITACHI7700型透射电镜观察.
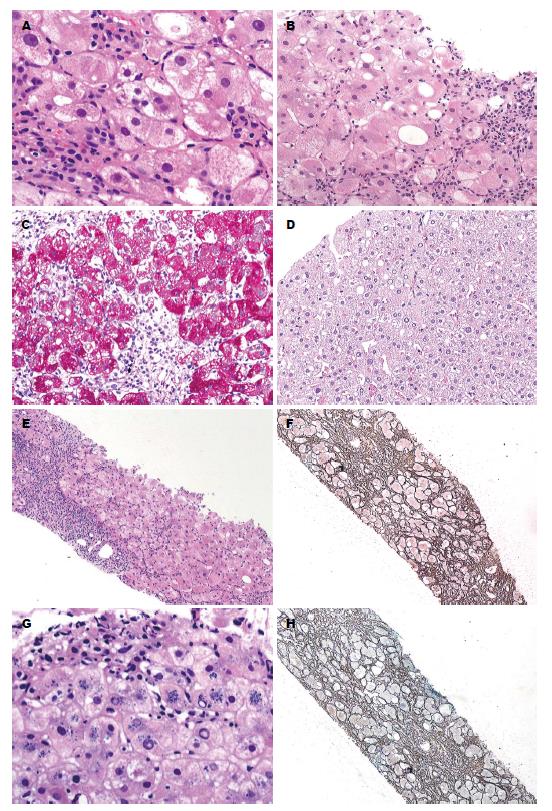
本组5例病理分期不同, 组织学改变差异较大. 其中1例早期, 表现为肝组织轻微病变; 3例肝硬化前期, 表现为病变程度不等的慢性肝炎肝纤维化; 1例肝硬化期, 表现为慢性肝炎肝硬化. 早期: 肝细胞浊肿变性, 严重时部分肝细胞出现气球样变性和羽毛状变性(图1A); 肝细胞内见多少不等的大小泡混合性脂肪变性(图1B), PAS染色可清楚显示小泡性脂肪变性(图1C); 可见肝细胞糖原核(图1D); 肝小叶内轻度点状和灶性肝细胞坏死; 汇管区炎症轻微. 肝硬化前期: 肝细胞可见程度不等的浊肿变性、气球样变性、羽毛状变性及大小泡混合性脂肪变性; 汇管区炎症及肝细胞坏死比早期明显, 肝小叶内中到重度点状和/或灶性坏死, 汇管区较多淋巴细胞、单核细胞及浆细胞浸润, 伴有明显界面性肝炎, 出现碎屑样坏死、融合性坏死, 甚至桥接坏死(图1E); 汇管区的胶原纤维增多, 延伸至小叶内并形成纤维间隔(图1F). 其中1例汇管区周围Ⅰ区带肝细胞胞浆内可见蓝紫色脂褐素样粗颗粒(图1G). 肝硬化期: 汇管区明显扩大, 纤维组织增生形成纤维间隔、弓形纤维进一步延伸包绕肝组织, 假小叶形成(图1H), 小胆管增生、淤胆.
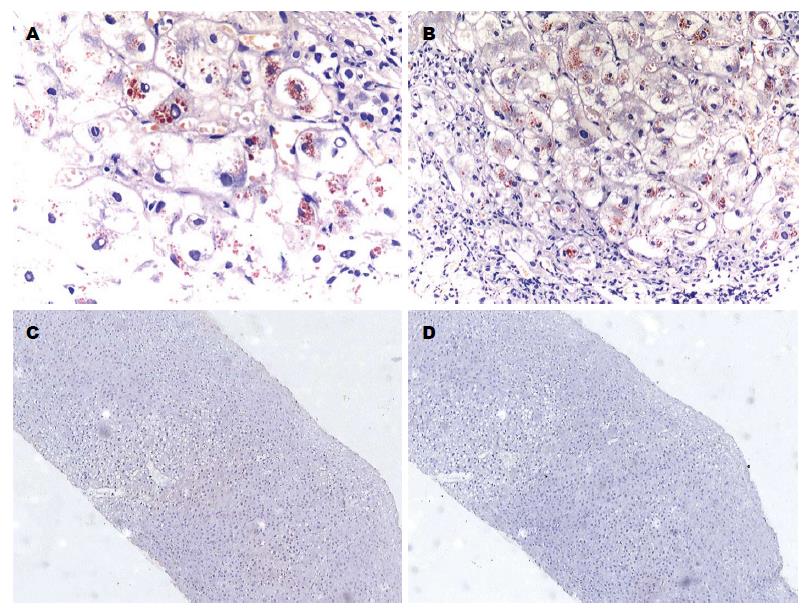
本组罗丹宁铜染色5例均为阳性, 主要表现汇管区周围Ⅰ区带肝细胞胞浆内橘红色铜颗粒沉积(图2A), 其中1例上述汇管区周围肝细胞内HE染色可见蓝紫色脂褐素样粗颗粒, 罗丹宁铜染色强阳性(图2B). 本组5例HBsAg和HBcAg均阴性(图2C, D).
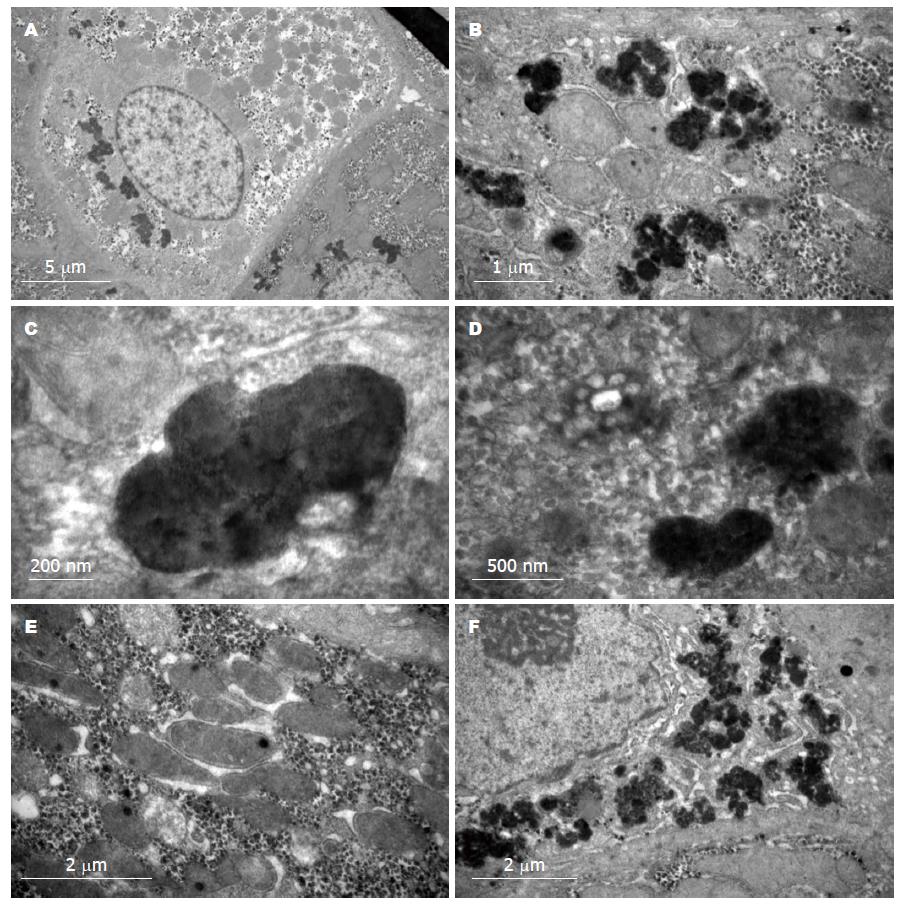
5例肝细胞内均可见大量大小不等、类圆形或不规则形的高电子致密物, 致密物在肝细胞内弥漫或靠近核旁分布(图3A, B), 密度不均、有双层单位膜包绕(图3C), 有时致密物周围可见线粒体水肿、嵴间隙扩大、基质密度不规则增高(图3D, E). 肝细胞浊肿变性, 可见多少不等的大小泡混合性脂滴, 此外肝细胞内色素颗粒小体增多, 毛细胆管瘀胆明显(图3F).
WD是罕见的常染色体隐性遗传铜代谢障碍性疾病, 任何年龄均可发病, 多在6-30岁之间, >40岁的相对少见, 但这一疾病最晚也可以发生在70岁之后[2], 男女发病无明显差异. WD世界范围发病率为1/10万-1/3万[3], 其中我国是高发区.
WD临床表现多样, 个体差异明显. 主要表现为乏力、腹胀、黄疸, 部分患者伴有神经、血液和心理的症状[4], 典型病例眼底检查可见K-F环; 也有一些患者没有肝脏疾病的症状或体征[2]. WD早期确诊十分困难, 多达50%的患者发病时已为肝纤维化[5]甚至是肝硬化. 实验室检查血清铜蓝蛋白降低、血清铜和尿铜增加.
该病组织学变化差异较大, 依据病变进展程度分为早期、肝硬化前期和肝硬化期3期. 早期: 轻度肝细胞损伤, 肝细胞不同程度浊肿变性或伴脂肪变性, 肝小叶及汇管区炎症轻微或缺如. 肝硬化前期: 该期病理改变类似慢性病毒性肝炎或自身免疫性肝炎. 肝细胞显著浊肿变性, 甚至出现气球样变性、羽毛状变性, 显著大小泡混合性脂肪变性; 肝细胞不同程度坏死, 包括点状和/或灶性坏死、碎屑样坏死、融合性坏死、桥接坏死等; 汇管区较多淋巴细胞、单核细胞及浆细胞浸润, 纤维组织增生, 桥接纤维、弓形纤维形成并向周围肝小叶内延伸形成纤维间隔, 汇管区细胆管增生; 有时在Ⅰ区带肝细胞内可见蓝紫色脂褐素样的粗颗粒状铜沉积. 肝硬化期: 肝细胞坏死严重, 形成较多桥接坏死; 汇管区明显扩大伴大量慢性炎症细胞浸润, 纤维组织增生, 进一步延伸包绕周围肝组织, 假小叶形成, 细胆管增生明显. 本组5例中早期1例, 肝硬化前期3例, 肝硬化期1例. 病理改变与王艳昕等[6]的研究相符. 孙艳玲等[7]报道部分WD患者肝细胞内有糖原核和/或Mallory小体, 本组亦有1例肝细胞内糖原核.
尽管肝组织中铜沉积是WD的特征性改变, 但光镜下几乎无法辨认, 仅极少数病例在汇管区周围Ⅰ区带肝细胞胞浆内可见蓝紫色脂褐素样铜颗粒, 故罗丹宁铜染色对诊断WD具有重要提示意义[8].
电镜超微结构特征性Wilson颗粒是WD的重要诊断依据, 肝细胞内Wilson颗粒的多少和分布与病程有关. 在疾病早期, 仅表现线粒体大小、形态不规则, 线粒体水肿, 嵴间隙增大[3]. 随着疾病进展, 线粒体基质密度不规则增高, 形成类圆形或不规则形的高电子致密物. 致密物密度不均、其间可见透亮的空泡、外周包绕不规则的双层单位膜, 即所谓的特征性Wilson颗粒. 因此, 电镜下线粒体特殊形态变化对早期(无症状期)WD的诊断具有重要价值[3,9,10]. 但由于电镜设备成本较高, WD肝脏穿刺活检的电镜检查在普通医院难以开展, 目前国内仅少数医院开展此项目检查.
WD的发病机制与13号染色体ATP7B基因的突变有关[11,12], ATP7B基因编码的蛋白质是铜转运相关蛋白, 几乎只在肝脏表达[13]. ATP7B基因突变使铜不能充分转运至胆汁内, 继而造成铜在组织内聚集[14]. 除了肝脏, 铜还可沉积于机体其他脏器尤其是大脑豆状核、角膜及肾脏等部位, 出现复杂多样的临床表现, 如震颤、扭转痉挛、精神障碍、肝脾肿大及腹水等[15]. 由于铜是细胞色素氧化酶和铜蓝蛋白等的活性元素, 在线粒体电子传递和ATP酶功能中起重要作用. 当铜离子过量时, 通过Feton反应产生大量的H2O2、OH, 降低抗氧化酶活性和诱发脂质过氧化作用, 从而破坏细胞膜的结构和功能, 使线粒体形态也随之发生变化. WD早期, 在其他细胞器变化尚不明显时, 线粒体已经出现了多种异常改变. 因此, 对疑似WD患者进行肝组织超微结构检查, 可为WD早期诊断提供重要的诊断依据.
WD的常规实验室检查、临床表现、光镜组织学改变均不具有特异性, 电镜超微结构特征性Wilson颗粒是WD的重要诊断依据, 故肝脏穿刺活检可为WD的明确诊断提供重要诊断依据. 目前, 临床上WD的诊断依据以下标准[16]: (1)家族遗传史: 父母是近亲婚配, 同胞有WD患者或死于原因不明的肝病; (2)慢进行性震颤、肌僵直、构音障碍等锥体外系症状、体征或/和肝症状; (3)眼或裂隙灯证实有K-F角膜色素环; (4)血清铜蓝蛋白<200 mg/L或血清铜氧化酶<0.2活力单位; (5)24 h尿铜排泄量>100 μg(1.56 μmo1); (6)肝铜>250 μg/g(干质量). 凡完全具备上述(1)-(3)项或(1)及(4)项者, 可确诊为临床表现型; 具备(3)-(5)者或(3)-(4)项者属症状前型; 仅有(1)、(2)项或(1)、(3)项者, 应怀疑WD, 通过第f项确诊.
然而, WD的临床表现多样, 个体差异也很明显, 有些患者因临床症状不典型或缺乏特异性诊断指标, 且国内根据上文诊断依据早期确诊十分困难. 此外, 肝铜干重检测非常困难, 依靠该项确诊难以完成, 因此, 肝组织活检成为该病早期诊断的重要方法. 但依靠肝活检进行病理诊断也存在一些困难. 比如, 肝脏穿刺活检为有创检查, 实施较困难; 对于肝硬化的患者, 肝脏穿刺穿取标本成功率低, 标本质量不能保证.
WD光镜下不同患者组织学改变差异较大, 根据疾病分期不同可类似急性肝炎和慢性肝炎, 需要与以下肝病进行鉴别诊断: (1)病毒性肝炎: 病毒性肝炎急性期表现为肝细胞水肿变性, 和/或少量炎症细胞的浸润, 慢性期表现为多少不等的慢性炎症细胞浸润和肝细胞坏死, 但血清学检测为病毒阳性; (2)自身免疫性肝病: 包括原发性胆汁性肝硬化(primary biliary cirrhosis, PBC)和原发性硬化性胆管炎(primary sclerosing cholangitis, PSC), PBC可见铜沉积和/或Mallory小体, 胆管上皮细胞变性、胆管炎甚至胆管减少和消失, 但PBC中年妇女多发, 且血清自身抗体阳性(多为抗线粒体抗体阳性); PSC组织学表现为慢性肝炎, 界板炎明显, 汇管区纤维化, 细胆管增生常见, 可伴铜颗粒沉积和/或Mallory小体, 但影像学独特征象为胆管串珠样改变; (3)胆管胆道阻塞: 包括慢性大胆管阻塞和肝内胆道闭锁, 前者肝细胞浊肿明显, 毛细胆管及小叶间胆管胆栓形成为其特征, 伴明显细胆管增生及祖细胞双向分化; 后者表现为多数患者在出生后1-2 wk出现结合性高胆红素血症, 汇管区细胆管增生及纤维化, 胆管淤胆明显; (4)酒精性/非酒精性肝炎: 均表现为肝细胞气球样变, 且Mallory小体多位于气球样变的肝细胞内, 炎症细胞围绕在这些变性的肝细胞周围, 且病变以中央静脉周围为主, 窦周纤维化明显.
Wilson病(Wilson disease, WD)即肝豆状核变性, 是一种常染色体隐性遗传且主要累及肝脏的铜代谢性疾病, 该病临床表现、组织病理学改变及实验室检查均不特异, 临床确诊困难.
顾生旺, 主任医师, 江苏省淮安市解放军第八二医院感染内科
WD无特征性的临床表现及特异性的实验室检查, 早期确诊困难, 且国内外对WD光镜及电镜的组织病理学改变报道较少.
WD是罕见的常染色体隐性遗传与ATP7B基因突变相关的铜代谢障碍性疾病, 任何年龄均可发病, 多在6-30岁之间, 男女发病无明显差异. WD世界范围发病率为1/10万-1/3万, 其中我国是高发区.
本文罗丹宁铜染色证实汇管区周围肝细胞胞浆内蓝紫色脂褐素样颗粒为铜颗粒, 且电镜下胞浆内线粒体特殊形态变化及高电子密度特征性Wilson颗粒对WD的诊断具有重要价值.
光镜及电镜的病理特征有助于WD的早期诊断, 尽早对疑似WD的患者行肝脏穿刺活检、尽早确诊与排铜治疗对改善WD预后具有重要临床意义.
Wilson颗粒: 是肝细胞胞浆内线粒体基质密度不规则增高形成的类圆形或不规则形的高电子致密物. 该致密物密度不均、其间可见透亮的空泡、外周包绕不规则的双层单位膜.
本文虽然例数较少, 但研究的内容重要、新颖, 且重点分析了WD光镜及电镜的组织病理学特征, 为临床诊断提供了充足有意义的信息.
编辑: 郭鹏 电编:都珍珍
| 1. | Gitlin JD. Wilson disease. Gastroenterology. 2003;125:1868-1877. [PubMed] [DOI] |
| 2. | Ferenci P, Członkowska A, Merle U, Ferenc S, Gromadzka G, Yurdaydin C, Vogel W, Bruha R, Schmidt HT, Stremmel W. Late-onset Wilson's disease. Gastroenterology. 2007;132:1294-1298. [PubMed] [DOI] |
| 3. | Sternlieb I. Mitochondrial and fatty changes in hepatocytes of patients with Wilson's disease. Gastroenterology. 1968;55:354-367. [PubMed] |
| 4. | Merle U, Schaefer M, Ferenci P, Stremmel W. Clinical presentation, diagnosis and long-term outcome of Wilson's disease: a cohort study. Gut. 2007;56:115-120. [PubMed] [DOI] |
| 5. | Langner C, Denk H. Wilson disease. Virchows Arch. 2004;445:111-118. [PubMed] [DOI] |
| 8. | Aaseth J, Flaten TP, Andersen O. Hereditary iron and copper deposition: diagnostics, pathogenesis and therapeutics. Scand J Gastroenterol. 2007;42:673-681. [PubMed] [DOI] |
| 9. | Sternlieb I, Feldmann G. Effects of anticopper therapy on hepatocellular mitochondria in patients with Wilson's disease: an ultrastructural and stereological study. Gastroenterology. 1976;71:457-461. [PubMed] |
| 10. | Lough J, Wiglesworth FW. Wilson disease. Comparative ultrastructure in a sibship of nine. Arch Pathol Lab Med. 1976;100:659-653. [PubMed] |
| 11. | Bull PC, Thomas GR, Rommens JM, Forbes JR, Cox DW. The Wilson disease gene is a putative copper transporting P-type ATPase similar to the Menkes gene. Nat Genet. 1993;5:327-337. [PubMed] [DOI] |
| 12. | Tomić A, Dobricić V, Novaković I, Svetel M, Pekmezović T, Kresojević N, Potrebić A, Kostić VS. Mutational analysis of ATP7B gene and the genotype-phenotype correlation in patients with Wilson's disease in Serbia. Vojnosanit Pregl. 2013;70:457-462. [PubMed] [DOI] |
| 13. | Cuthbert JA. Wilson's disease. Update of a systemic disorder with protean manifestations. Gastroenterol Clin North Am. 1998;27:655-681, vi-vii. [PubMed] |
| 14. | Ferenci P, Steindl-Munda P, Vogel W, Jessner W, Gschwantler M, Stauber R, Datz C, Hackl F, Wrba F, Bauer P. Diagnostic value of quantitative hepatic copper determination in patients with Wilson's Disease. Clin Gastroenterol Hepatol. 2005;3:811-818. [PubMed] [DOI] |
| 16. | Roberts EA, Schilsky ML. Diagnosis and treatment of Wilson disease: an update. Hepatology. 2008;47:2089-2111. [PubMed] [DOI] |
| 17. | Rosencrantz R, Schilsky M. Wilson disease: pathogenesis and clinical considerations in diagnosis and treatment. Semin Liver Dis. 2011;31:245-259. [PubMed] [DOI] |
| 18. | Harada M. Wilson disease and its current problems. Intern Med. 2010;49:807-808. [PubMed] [DOI] |