修回日期: 2015-12-28
接受日期: 2016-01-06
在线出版日期: 2016-02-18
目的: 探讨阿帕替尼用于二线及二线以上治疗失败的晚期胃癌患者的临床疗效分析及预后因素研究.
方法: 研究对象为2014-10/2015-08曾接受过二线及二线以上治疗失败的60例晚期胃癌患者, 均经病理确诊. 给予阿帕替尼口服850 mg/d, 直至疾病进展, 观察临床疗效及不良反应发生情况. 应用Kaplan-Meier法进行生存分析.
结果: 根据实体瘤的疗效评定标准(Response Evaluation Criteria in Solid Tumors, RECIST)全部可评价疗效. 其中完全缓解(complete response, CR)占0%(0/60), 部分缓解(partial response, PR)占3.33%(2/60), 疾病稳定(stable disease, SD)占38.33%(23/60), 疾病进展(progressive disease, PD)占58.33%(35/60). 客观缓解率(CR+PR)为3.33%, 疾病控制率(CR+PR+SD)为38.33%(23/60). 中位无进展生存期为3.76 mo. 甲胎蛋白(α-fetoprotein, AFP)阳性胃癌患者的疾病控制以及生存受益优于AFP阴性患者. 高血压、骨髓抑制是影响阿帕替尼治疗的最主要的不良反应.
结论: 阿帕替尼治疗二线及二线以上治疗失败的晚期胃癌仍有较好的疾病控制及生存获益, 不良反应可控制, 值得临床上广泛应用.
核心提示: 本文探讨阿帕替尼用于二线及二线以上治疗失败的晚期胃癌患者的临床疗效及预后因素, 得出阿帕替尼治疗二线或二线以上治疗失败的晚期胃癌患者仍有较好的疾病控制及生存获益, 不良反应可控制, 且甲胎蛋白阳性患者是阿帕替尼治疗的获益人群.
引文著录: 王博, 宋丽杰, 牛鹏云, 李晚露, 刘清存, 樊青霞. 阿帕替尼治疗晚期胃癌的临床疗效及预后. 世界华人消化杂志 2016; 24(5): 759-764
Revised: December 28, 2015
Accepted: January 6, 2016
Published online: February 18, 2016
AIM: To evaluate the efficacy and safety of Apatinib in advanced gastric cancer patients after failure of second-line or beyond treatment.
METHODS: From October 2014 to August 2015, 60 patients with pathologically confirmed advanced gastric cancer who failed second line or beyond treatment were enrolled in the study. All the patients were given Apatinib 850 mg/d orally until disease progression. Clinical efficacy and adverse reactions were observed. Kaplan-Meier method was used for survival analysis.
RESULTS: According to the Response Evaluation Criteria in Solid Tumors (RECIST) standard, all the patients can be evaluated for therapeutic effects. Complete response (CR) rate was 0% (0/60), partial response (PR) rate was 3.33% (2/60), stable disease (SD) rate 38.33 (23/60), and progressive disease (PD) rate 58.33% (35/60). The objective response rate (CR + PR) and the disease control rate (CR + PR + SD) were 3.33% and 38.33% (23/60), respectively. The median progression-free survival time was 3.76 mo. Patients with α-fetoprotein (AFP) positive gastric cancer had the higher disease control rate and better survival compared to the AFP negative patients. Main adverse reactions were hypertension and bone marrow suppression.
CONCLUSION: Administration of Apatinib in advanced gastric cancer patients after failure of second-line or beyond treatment is still beneficial in terms of higher disease control rate and better survival, and adverse reactions are tolerable.
- Citation: Wang B, Song LJ, Niu PY, Li WL, Liu QC, Fan QX. Clinical efficacy of Apatinib in treatment of advanced gastric cancer. Shijie Huaren Xiaohua Zazhi 2016; 24(5): 759-764
- URL: https://www.wjgnet.com/1009-3079/full/v24/i5/759.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i5.759
胃癌在全球每年新增病例100万例, 70%以上在东南亚地区, 其中一半在中国. 胃癌在我国的恶性肿瘤中发病率占第2位, 死亡率占第3位. 晚期胃癌的治疗仍是临床上的治疗难点之一. 胃癌患者通常早期无特异性症状, 临床诊断时已达局部晚期或全身多处转移, 无手术指征, 通常采用以化疗为主的综合治疗, 以延长患者的生存期[1]. 但随着化疗周期的增加, 不良反应越容易出现[2]. 靶向治疗不良反应较化疗轻, 患者耐受性良好. 目前关于胃癌的靶向治疗探索越来越多, 其中抗血管生成药物是研究热点之一. 国外抗血管生成药物贝伐单抗通过AVAGAST Ⅲ期临床研究结果令人失望, 而阿帕替尼作为我国研制成的作为小分子血管内皮生长因子酪氨酸激酶抑制剂的新型靶向药物, 目前国内对其较深入的报道较少. 本研究通过对2014-10/2015-08接受阿帕替尼用于治疗的二线及二线以上治疗失败的60例晚期胃癌患者的临床资料进行回顾性分析, 探讨阿帕替尼的临床疗效、影响因素及不良反应.
2014-10/2015-08郑州大学第一附属医院、河南省人民医院、河南省肿瘤医院等河南省三甲医院经细胞学和/或组织病理学确诊为胃癌的患者60例. 纳入标准: 既往均接受二线及二线以上治疗失败、疾病进展(progressive disease, PD)或者复发的患者, 年龄≥18岁, 根据美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分0-2分, 预计生存期≥3 mo. 临床分期均为Ⅳ期. 根据RECIST实体瘤的疗效评定标准有可测量的靶病灶. 排除靶病灶经过放疗的患者. 阿帕替尼, 甲磺酸阿帕替尼片, 商品名: 艾坦, 江苏恒瑞医药股份有限公司, 国药准字: H20140105; 规格: 425 mg×7片, 2板/盒.
1.2.1 治疗: 每例患者均接受阿帕替尼: 850 mg, 每日1次, 餐后半小时口服, 每4 wk为1个周期, 直至PD或出现不可耐受的不良反应. 当治疗过程中出现与阿帕替尼相关的Ⅲ度或Ⅲ度以上的不良反应时, 可暂停或减量阿帕替尼剂量为425 mg, 1片/d.
1.2.2 疗效观察: 开始服药4 wk后评价疗效, 以后每8 wk评价疗效1次. 采用实体瘤的疗效评定标准[3](Response Evaluation Criteria in Solid Tumors, RECIST)评价临床疗效, 分为完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)、疾病进展(progressive disease, PD), 总缓解率(objective response, RR) = CR+PR; 疾病控制率(disease control rate, DCR) = CR+PR+SD. 无进展生存期(progression free survival, PFS): 服用阿帕替尼开始直至肿瘤进展、患者失访或死亡时间. 生存期(overall survival time, OS): 从阿帕替尼治疗开始直至死亡或失访时间. 不良反应评价按照世界卫生组织(World Health Organization, WHO)抗肿瘤药物不良反应评分标准进行评价, 共分为0-Ⅳ度. 随访截止日期为2015-11.
统计学处理 所有数据均采用SPSS17.0统计学软件进行分析, 分类资料采用χ2检验, 生存分析采用Kaplan-Meier法. P<0.05为差异有统计学意义.
共60例晚期胃癌患者, 年龄39-79岁, 平均56.7岁±2.8岁, 其中男性34例, 女性26例. 病理组织学分型: 腺癌. 分化程度: 高分化13例, 中分化24例, 低分化23例. 既往均未接受手术治疗. 血清学检查甲胎蛋白(α-fetoprotein, AFP)增高11例, AFP正常49例. 肝转移7例, 腹膜转移14例. 资料分析如表1.
| 项目 | n | 百分比(%) |
| 性别 | ||
| 男 | 34 | 56.7 |
| 女 | 26 | 43.3 |
| 年龄(岁) | ||
| <65 | 17 | 28.3 |
| ≥65 | 43 | 71.7 |
| ECOG评分 | ||
| 0-1 | 55 | 91.7 |
| 2 | 5 | 8.3 |
| 肿瘤位置 | ||
| 胃底部 | 8 | 13.3 |
| 胃体部 | 27 | 45.0 |
| 胃窦部 | 25 | 41.7 |
| 组织分化 | ||
| 高分化 | 4 | 6.7 |
| 中分化 | 23 | 38.3 |
| 低分化 | 33 | 55.0 |
| 既往化疗 | ||
| 二线 | 19 | 31.7 |
| 二线以上 | 41 | 68.3 |
| 血清甲胎蛋白 | ||
| 正常 | 49 | 81.7 |
| 异常 | 11 | 18.3 |
| 转移部位 | ||
| 肝脏 | 7 | 11.67 |
| 腹膜 | 14 | 23.33 |
2.2.1 近期疗效: 60例患者均进行疗效评价, 其中CR占0%(0/60), PR占3.33%(2/60), SD占38.33(23/60), PD占58.33%(35/60). 客观缓解率(CR+PR)为3.33%, 疾病控制率(CR+PR+SD)为41.67%. 其中AFP阳性胃癌患者的疾病控制率为63.64%, 且与AFP阴性胃癌患者比较差异有统计学意义(63.64% vs 32.65%, P = 0.012<0.05).
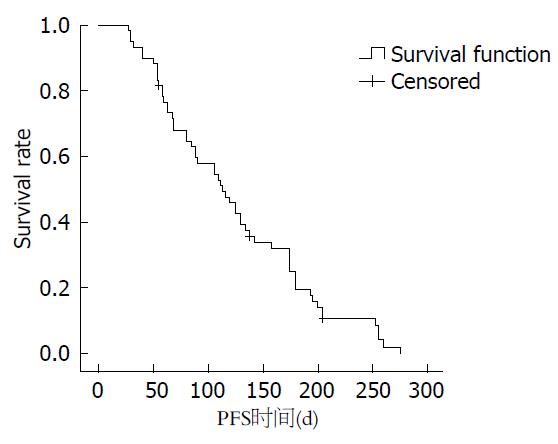
2.2.2 远期疗效及影响阿帕替尼疗效的因素: 本组患者的中位PFS为3.76 mo, 其生存曲线如图1. 采用Kaplan-Meier法对可能影响阿帕替尼的疗效的单因素分析结果如表2, 结果显示AFP阳性胃癌患者的PFS与AFP阴性患者相比差异有统计学意义(2.9 mo vs 5.7 mo, P<0.05).
| 因素 | n | PFS | ||
| 中位数 | 95%CI | P值 | ||
| 年龄(岁) | 0.163 | |||
| <65 | 17 | 3.5 | 2.1-4.8 | |
| ≥65 | 43 | 3.8 | 2.8-4.9 | |
| ECOG(分) | 0.038 | |||
| 0-1 | 55 | 4.2 | 3.3-5.0 | |
| 2 | 5 | 2.2 | 1.6-2.9 | |
| 肿瘤位置 | 0.794 | |||
| 胃底 | 8 | 3.8 | 1.7-5.8 | |
| 胃体、胃窦 | 52 | 3.7 | 2.5-4.9 | |
| 组织分化 | 0.426 | |||
| 高分化 | 4 | 3.7 | 1.5-5.7 | |
| 中、低分化 | 56 | 3.9 | 2.8-4.8 | |
| 既往化疗 | 0.424 | |||
| 二线 | 19 | 3.7 | 2.5-4.8 | |
| 二线以上 | 41 | 4.0 | 3.0-5.0 | |
| 甲胎蛋白 | 0.040 | |||
| 正常 | 49 | 2.9 | 1.6-4.2 | |
| 异常 | 11 | 5.7 | 3.7-6.9 | |
| 肝脏 | 0.678 | |||
| 转移 | 7 | 2.8 | 2.4-3.3 | |
| 未转移 | 53 | 3.8 | 3.1-4.6 | |
| 腹膜 | 0.202 | |||
| 转移 | 14 | 2.9 | 2.5-3.4 | |
| 未转移 | 46 | 4.1 | 2.7-4.8 | |
本组患者常见的不良反应有高血压、蛋白尿、骨髓抑制、手足综合症和腹泻. 其中高血压发生率为41.67%(25/60), 3-4级5例, 占8.33%. 蛋白尿发生率为26.67%(16/60), 3-4级2例, 占3.33%. 白细胞减少发生率为46.67%(28/60), 均为1-2度. 血小板减少发生率为31.67%(19/60), 3-4级3例, 占5.00%. 贫血发生率为16.67%(10/60), 3-4级1例, 占1.67%. 手足综合症发生率为25.00%(15/60), 3-4级2例, 占3.33%. 腹泻发生率为18.33%(11/60), 均为1-2度. 3例患者分别因高血压、3-4级骨髓抑制而减少阿帕替尼剂量继续治疗.
近年来, 胃癌的靶向治疗探索越来越多[4,5], 其中抗血管生成靶向药物是一个研究热点. 血管生成是肿瘤恶性生长的关键环节之一, 持续的血管生成和肿瘤的发生、发展、转移有关[6], 抗血管生成是肿瘤治疗的重要方法. 血管内皮生长因子(vascular endothelial growth factor, VEGF)/VEGFR信号传导通路是血管生成的重要通路, VEGF与VEGFR的胞外区特异性结合, 从而激活丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)、磷脂酰肌醇-3激酶(phosphatidylinositol 3-kinase, PI3K)、蛋白激酶C(protein kinase C, PKC)、FAK等多条下游信号传导通路, 参与了内皮细胞的生长、迁移、血管通透以及肿瘤细胞的存活[7,8]. 其中VEGFR2在血管生成中起重要作用, 抗血管生成的靶向治疗药物主要分为抗VEGF抗体、抗VEGFR抗体、可溶性VEGFR、小分子TKI[9].
贝伐单抗为重组的人源化抗VEGF单克隆抗体, Ohtsu研究[10]是以卡培他滨联合顺铂加或不加贝伐单抗一线治疗774例晚期胃腺癌患者的随机、双盲、以安慰剂对照的Ⅲ期临床研究, 结果显示中位OS在联合治疗组为12.1 mo, 对照组为10.1 mo(HR = 0.87, P = 0.1002), 未达到主要研究终点. 阿替帕尼也称为YN968D1, 是一种抑制VEGFR-2的小分子TKI, 可与血管内皮生长因子VEGFR-2等配体结合, 抑制肿瘤新生血管的形成[11]. 临床前数据显示阿帕替尼可有效抑制静脉血管内皮细胞的增殖、迁移和血管形成. 无论单独应用阿帕替尼还是联合化疗[12]应用均可抑制大鼠主动脉环上异种移植物的生长. 研究[13]显示阿帕替尼能抑制P-糖蛋白和ABCG2介导的多药耐药性乳腺癌, 结肠癌和口腔表皮样癌细胞跨膜转运. Li等[14]对144例晚期胃癌患者的随机对照临床研究结果显示服用850 mg阿帕替尼患者组的PFS为3.67 mo(95%CI: 2.17-6.80 mo). 阿帕替尼用于三线治疗晚期胃癌的大型临床实验已经结束, 已获我国国家食品药品监督管理总局批准用于三线及三线以上的晚期胃腺癌获胃食管结合部癌患者.
目前, 临床上对阿帕替尼的了解较少, 本研究通过对阿帕替尼治疗胃癌患者的临床资料进行回顾性研究分析, 了解其临床疗效以及其获益优势人群, 从而达到胃癌患者的个体化及精准医学治疗. 本研究结果显示阿帕替尼治疗晚期胃癌的疾病控制率为41.67%, 中位PFS为3.76 mo, 与上述研究结果相似. 对本研究结果进一步分析显示AFP阳性胃癌患者的疾病控制率与AFP阴性胃癌患者比较有显著差异(63.64% vs 32.65%, P<0.05), AFP阳性胃癌患者的PFS与AFP阴性患者相比有显著差异(2.9 mo vs 5.7 mo, P<0.05), 表明AFP阳性患者是阿帕替尼治疗的获益人群, 这可能与AFP阳性胃癌比AFP阴性胃癌有更高的VEGF表达频率有关[15,16], 但本研究样本量较少, 需要扩大样本量进一步证实. 而肝脏、腹膜转移与未转移患者疗效差异无统计学意义, 这可能与样本量较少有关, 需扩大样本量进一步探讨. 另外, 在安全性方面, 本研究观察到的主要不良反应是高血压、蛋白尿、骨髓抑制、手足综合症和腹泻, 这些不良反应较易控制, 总的来说, 阿帕替尼耐受性较好, 能显著提高晚期胃癌患者的疾病控制率, 延长患者的生存时间, 带来临床获益, 值得推广应用. 目前临床上阿帕替尼大多数是单药用于三线或三线以上晚期胃癌患者, 也有其与替吉奥或紫杉醇等化疗药物联合治疗, 但是否联合化疗会有更好的临床疗效、联合哪种化疗药物从疗效和耐受方面更优以及是否可以把阿帕替尼提前用于二线或更早治疗可能会带来更大的临床获益等问题, 仍然需要大量的高质量随机、对照前瞻性临床实验来研究. 进一步寻找能够预测和识别阿帕替尼获益人群的生物标志物仍需更多的临床观察来探索.
抗血管生成靶向药物贝伐珠单抗治疗晚期胃癌一线失守, 但国产新药阿帕替尼治疗晚期胃癌的疗效及预后的相关报道较少.
邱江锋, 主任医师, 上海交通大学医学院附属仁济医院胃肠外科
探索阿帕替尼治疗胃癌更加明确的受益人群以及是否联合化疗, 联合什么化疗方案等问题需要进一步探讨.
本文通过对阿帕替尼治疗晚期胃癌患者的临床资料进行分析, 结果发现甲胎蛋白(α-fetoprotein, AFP)阳性患者的疾病控制率以及生存受益优于AFP阴性患者.
本文发现AFP阳性患者是阿帕替尼治疗晚期胃癌患者的受益人群, 具有一定的临床参考意义.
无进展生存期: 从随机分组之日起首次观察到疾病进展(以影像学为准)之间的时间, 如果在疾病进展前因其他原因死亡的患者, 则计算从随机分组之日起到死亡的时间.
阿帕替尼是我国研发的抗血管生成的新药, 其临床效果值得研究和探讨. 本文通过60例晚期胃癌患者的治疗对此进行了初步的疗效分析, 有一定临床指导意义.
编辑: 郭鹏 电编:都珍珍
| 1. | Kadokawa Y, Sonoda K, Nakajima S, Kawabe A, Egawa H. [Advanced gastric cancer in an elderly woman showing histopathologic CR after a course of S-1 and CDDP combination therapy]. Gan To Kagaku Ryoho. 2010;37:711-713. [PubMed] |
| 2. | Akaza H, Kawai K, Tsuruo T, Tsukagoshi S, Aiba K, Shimada Y, Kakeji Y, Ishikawa H, Ikeda T, Nakamura S. [Future directions of anticancer drug development in Japan]. Gan To Kagaku Ryoho. 2008;35:351-360. [PubMed] |
| 3. | Kozloff M, Yood MU, Berlin J, Flynn PJ, Kabbinavar FF, Purdie DM, Ashby MA, Dong W, Sugrue MM, Grothey A. Clinical outcomes associated with bevacizumab-containing treatment of metastatic colorectal cancer: the BRiTE observational cohort study. Oncologist. 2009;14:862-870. [PubMed] [DOI] |
| 6. | Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011;144:646-674. [PubMed] [DOI] |
| 7. | Olsson AK, Dimberg A, Kreuger J, Claesson-Welsh L. VEGF receptor signalling - in control of vascular function. Nat Rev Mol Cell Biol. 2006;7:359-371. [PubMed] |
| 8. | Holmes K, Roberts OL, Thomas AM, Cross MJ. Vascular endothelial growth factor receptor-2: structure, function, intracellular signalling and therapeutic inhibition. Cell Signal. 2007;19:2003-2012. [PubMed] |
| 10. | Ohtsu A, Shah MA, Van Cutsem E, Rha SY, Sawaki A, Park SR, Lim HY, Yamada Y, Wu J, Langer B. Bevacizumab in combination with chemotherapy as first-line therapy in advanced gastric cancer: a randomized, double-blind, placebo-controlled phase III study. J Clin Oncol. 2011;29:3968-3976. [PubMed] [DOI] |
| 11. | Li J, Zhao X, Chen L, Guo H, Lv F, Jia K, Yv K, Wang F, Li C, Qian J. Safety and pharmacokinetics of novel selective vascular endothelial growth factor receptor-2 inhibitor YN968D1 in patients with advanced malignancies. BMC Cancer. 2010;10:529. [PubMed] [DOI] |
| 12. | Tian S, Quan H, Xie C, Guo H, Lü F, Xu Y, Li J, Lou L. YN968D1 is a novel and selective inhibitor of vascular endothelial growth factor receptor-2 tyrosine kinase with potent activity in vitro and in vivo. Cancer Sci. 2011;102:1374-1380. [PubMed] [DOI] |
| 13. | Mi YJ, Liang YJ, Huang HB, Zhao HY, Wu CP, Wang F, Tao LY, Zhang CZ, Dai CL, Tiwari AK. Apatinib (YN968D1) reverses multidrug resistance by inhibiting the efflux function of multiple ATP-binding cassette transporters. Cancer Res. 2010;70:7981-7991. [PubMed] [DOI] |
| 14. | Li J, Qin S, Xu J, Guo W, Xiong J, Bai Y, Sun G, Yang Y, Wang L, Xu N. Apatinib for chemotherapy-refractory advanced metastatic gastric cancer: results from a randomized, placebo-controlled, parallel-arm, phase II trial. J Clin Oncol. 2013;31:3219-3225. [PubMed] [DOI] |
| 16. | Gretschel S, Astrosini Ch, Vieth M, Jöns T, Tomov T, Höcker M, Schlag PM, Kemmner W. Markers of tumour angiogenesis and tumour cells in bone marrow in gastric cancer patients. Eur J Surg Oncol. 2008;34:642-647. [PubMed] [DOI] |