修回日期: 2015-12-21
接受日期: 2016-01-11
在线出版日期: 2016-02-18
目的: 探讨肠道碱性磷酸酶(intestine alkaline phosphatase, IAP)对2,4,6-三硝基苯磺酸(2,4,6-trinitro-benzenesulfonic acid, TNBS)诱导的小鼠结肠炎中Muc2、Stat4和磷酸化Stat4(P-Stat4)表达的影响.
方法: 以对TNBS敏感的45只Balb/C小鼠为研究对象, 随机分为3组. 分别给予对照组(control)、模型组(TNBS)和治疗组(TNBS/IAP)生理盐水灌肠、TNBS灌肠加生理盐水灌胃和TNBS灌肠加IAP灌胃. 于1 wk后评估小鼠肠道炎症情况, 用HE染色检测肠道病理改变, 免疫组织化学染色检测小鼠肠道上皮中Muc2、Stat4和P-Stat4的表达情况. 用不同浓度的IAP预处理DC2.4细胞系, 用蛋白免疫印迹试验检测LPS诱导后细胞中Stat4和P-Stat4的表达.
结果: 与对照组比较, 模型组小鼠结肠炎症明显, 而治疗组较模型组改善. 在小鼠结肠上皮中, Muc2染色阳性率在3组间有差异(χ2 = 19.62, P<0.05); 模型组低于对照组(13.33% vs 93.33%)(χ2 = 19.29, P<0.05); 治疗组高于模型组(60.00% vs 13.33%)(χ2 = 7.033, P<0.05). Stat4染色阳性率在3组间有差异(χ2 = 7.22, P<0.05); 模型组高于对照组(66.67% vs 20.00%)(χ2 = 6.652, P<0.05); 治疗组和模型组(50.00% vs 66.67%)之间的差异无统计学意义(χ2 = 3.333, P>0.05). P-Stat4染色阳性率在3组间有差异(χ2 = 12.95, P<0.05); 模型组高于对照组(60.00% vs 6.67%)(χ2 = 9.6, P<0.05);治疗组低于模型组(13.33% vs 60.00%)(χ2 = 7.033, P<0.05). 20、100 IU/mL的IAP处理DC2.4后, Stat4和P-Stat4的表达下调(P<0.05).
结论: IAP促进结肠炎小鼠肠道Muc2的表达, 下调Stat4的磷酸化, 可缓解TNBS诱导的小鼠结肠炎.
核心提示: Muc2与炎症性肠病(inflammatory bowel disease, IBD)发病有关, 而碱性磷酸酶(intestine alkaline phosphatase, IAP)可抑制Stat4的磷酸化和上调Muc2表达, 缓解结肠炎. 因此, 补充IAP有望成为IBD治疗的新方法, 且IAP的检测可能为临床IBD的诊断提供参考.
引文著录: 马娜, 赵美华, 李林静, 李展, 周力为, 冯百岁. 肠道碱性磷酸酶对结肠炎小鼠Muc2、Stat4及P-Stat4表达的影响. 世界华人消化杂志 2016; 24(5): 678-685
Revised: December 21, 2015
Accepted: January 11, 2016
Published online: February 18, 2016
AIM: To investigate the effect of intestinal alkaline phosphatase (IAP) on the expression of Muc2, Stat4 and phospholated-Stat4 (P-Stat4) in colitis in mice.
METHODS: Forty-five mice were divided into three groups randomly: a control group, a TNBS group and a TNBS/IAP group. Mice in the latter two groups had TNBS induced colitis. The TNBS/IAP group was treated with TNBS and IAP (200 IU/d; via gavage). One week later, colonic pathology was observed by HE staining. Immunochemistry and Western blot were employed to assess the expression of Muc2, Stat4 and phospholated-Stat4 (P-Stat4).
RESULTS: The grade of colonic inflammation in the TNBS group increased significantly compared with that in the control group, and improvements were observed in the TNBS/IAP group. The positive expression rates of Muc2 among three groups were significantly different (χ2 = 19.62, P < 0.05); the rate was significantly lower in the TNBS group than in the control group (13.33% vs 93.3%, χ2 = 19.29, P < 0.05), but was significantly higher in the TNBS/IAP group than in the TNBS group (60.00% vs 13.3%, χ2 = 7.033, P < 0.05). The positive expression rates of Stat4 among three groups were significantly different (χ2 = 7.22, P < 0.05); the rate was significantly higher in the TNBS group than in the control group (66.67% vs 20.00%, χ2 = 6.652, P < 0.05), but had no significant difference between the TNBS/IAP group (50.00%) and TNBS group (50.00% vs 66.67%, χ2 = 3.333, P > 0.05). The positive expression rates of P-Stat4 among the three groups were significantly different (χ2 = 12.95, P < 0.05); the rate was significantly higher in the TNBS group than in the control group (60.00% vs 6.67%, χ2 = 9.6, P < 0.05, but was significantly lower in the TNBS/IAP group than in the TNBS group (13.33% vs 60.00%, χ2 = 7.033, P < 0.05). After pretreatment with IAP, the expression of Stat4 and P-Stat4 in DC2.4 cells was down-regulated.
CONCLUSION: The therapeutic role of IAP may be associated with the down-regulation of Stat4 pathway and the increase of Muc2 expression in mice with colitis.
- Citation: Ma N, Zhao MH, Li LJ, Li Z, Zhou LW, Feng BS. Effect of intestinal alkaline phosphatase on expression of Muc2, Stat4 and P-Stat4 in colitis in mice. Shijie Huaren Xiaohua Zazhi 2016; 24(5): 678-685
- URL: https://www.wjgnet.com/1009-3079/full/v24/i5/678.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i5.678
炎症性肠病(inflammatory bowel disease, IBD)是反复发作的慢性非特异性肠炎, 临床分型为溃疡性结肠炎和克罗恩病. 近年来在我国发病率也明显升高, 成为消化系统的常见病[1]. 但目前对炎症性肠病的治疗缺乏特异的针对性的治疗, 因此对该疾病的发病机制的研究十分必要. 虽然病因尚不明确, 但是由肠道共生菌产物如LPS导致的失调的黏膜免疫反应参与了IBD的发病[2]. 研究[3,4]表明, Muc2是肠道黏液的主要成份, 能够保护肠道黏膜免于细菌的侵袭和肠液的腐蚀, 而IBD患者肠道碱性磷酸酶(intestinal alkaline phosphatase, IAP)和Muc2的表达减少. Stat4是参与机体Th1/Th2分化的核因子, 可以调控下游的细胞因子如白介素(interleukin, IL)-12等基因的转录[5]. 我们观察了IAP对IBD小鼠Muc2和Stat4磷酸化的影响, 探讨IBD的发病机制及IAP的作用.
♂Balb/C小鼠45只, 6-8 wk(河南省实验动物中心, 合格证号No. 41003100002469). IAP(Sigma-Aldrich, Lot: 071P7640)和TNBS(Sigma-Aldrich, Lot: SLBK1620V), Rb pAb to Muc2(Abcam, Lot: GR115545-3), Stat4抗体(Santa Cruz, Lot: H2014)和P-Stat4抗体(Santa Cruz, Lot: H1914), phosphatase inhibitor cocktail 2(Sigma-Aldrich, Lot: 054M4014V), LPS(Sigma-Aldrich, Lot: 081M4035), 羊抗兔二抗(abgent, Lot: G2612-MH93D).
1.2.1 鼠实验分组与标本收集: 将45只小鼠随机分为对照组、TNBS模型组和IAP治疗组. 对照组: 第1天用100 μL生理盐水灌肠, 第2-7天用300 μL生理盐水灌胃. 模型组: 第1天用2.5 mg TNBS加500 mL/L乙醇共100 μL灌肠, 第2-7天用300 μL生理盐水灌胃. 治疗组: 除第1天用TNBS灌肠外, 第2-7天用处理好的IAP溶液(200 IU/d)灌胃. 参照文献[3]的方法, 将IAP提前溶解于含有10 mmol/L Tris-HCl(pH 8.0), 1 mmol/L MgCl2和0.1 mmol/L ZnCl2的50%甘油中, 并于用前漩涡混匀.
1.2.2 HE染色: 距肛门约5 cm处取结肠标本, 4%多聚甲醛固定后常规石蜡包埋, 作连续4 μm切片. 所有标本经脱蜡, 水化后, 伊红染色, 盐酸酒精分化, 苏木素染色, 二甲苯浸泡, 封片. 对组织进行组织学评分. 0分: 无炎症证据; 1分: 低度炎症, 伴随少量炎性细胞浸润; 2分: 中度炎症, 伴随大量炎细胞浸润; 3分: 高度炎症伴随血管密度增加和肠壁水肿增厚; 4分: 重度炎症伴随突破黏膜层的炎细胞浸润和杯状细胞的缺失.
1.2.3 免疫组织化学染色法: 所有标本经脱蜡, 水化后, 3%H2O2灭活内源性过氧化物酶, 枸橼酸盐高压修复, 3%BSA封闭45 min, 一抗(稀释100倍)4 ℃过夜, PBS代替一抗作阴性对照, 二抗(稀释1000倍)37 ℃下孵育0.5 h, DAB显色2 min, 苏木素复染、脱水、透明、封片后在显微镜下观察, 结果判断以细胞胞浆呈淡黄色、棕黄色到棕褐色的颗粒为阳性细胞. 判定标准按照许良中等[6]的方法. 每个视野100个细胞, 综合阳性染色的强度及数量, 无阳性细胞为0分, 阳性细胞≤25%为1分, 26%-50%为2分, 51%-75%为3分, >75%为4分. 着色强度无色为0分, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分. 着色强度积分与数量积分相加: 0分为(-), 2-3分为(±), 4-5分为(+), 6-7分为(++), 其中(+)(++)均为阳性.
1.2.4 DC2.4细胞实验分组和蛋白质免疫印迹试验: 用2、20、100 IU/mL的IAP处理DC2.4细胞24 h后, 加LPS刺激4 h, 冰上裂解30 min, 4 ℃ 14000 r/min离心20 min, 取上清, 用BCA试剂盒测浓度. 每孔上样40 μg蛋白, 10%的SDS-PAGE电泳, 转膜, 5%BSA室温摇床封闭1 h, 一抗(稀释400倍)4 ℃过夜, 二抗(稀释4000倍)室温2 h. ECL显色成像. 用ImageJ对结果进行灰度分析, 得出绝对灰度值后, 除以各组内参的灰度值得到相对灰度值. 对各相对灰度值进行统计学分析.
统计学处理 采用Prism6.0v(GraphPad)处理数据, 组织中Muc2、Stat4和P-Stat4阳性率的比较采用χ2检验, 结肠组织学评分和细胞中Stat4和P-Stat4的比较采用两组间的t检验. 检验水准α = 0.05, P<0.05为差异具有统计学意义.
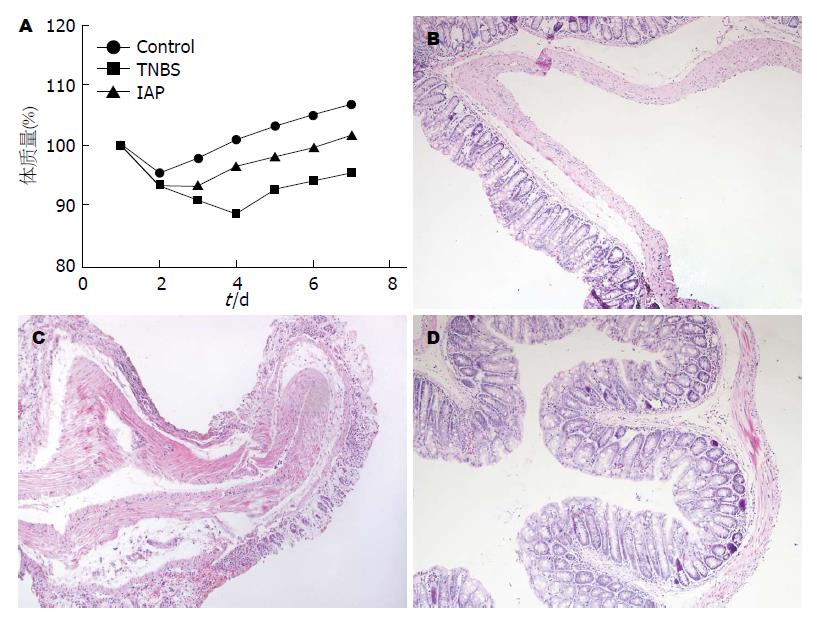
对照组的体质量仅在灌肠后1 d内有所下降, 之后持续稳定增加; 无血便和腹泻, 临床评分低; 镜下可见结肠黏膜完整, 腺体排列整齐, 无充血和白细胞浸润, 无组织水肿增厚. 模型组的体质量在灌肠后下降明显, 第5天后有缓慢回升; 小鼠有不同程度的血便和腹泻; 镜下可见结肠黏膜有不同程度的充血和小的出血溃烂点, 白细胞浸润明显增多, 浸润处腺体结构不清甚至消失, 炎症局限在黏膜层, 白细胞浸润百分比增高, 组织学评分高于对照组(3.13分±0.17分 vs 1.40分±0.13分)(t = 8.22, P<0.05).干预组的体质量在灌肠后小幅度降低, 于第4天开始回升; 小鼠有不同程度粪便隐血和软便; 镜下可见组织黏膜相对完整, 白细胞浸润降低, 组织学评分低于模型组(2.07分±0.12分 vs 3.13分±0.17分)(t = 5.25, P<0.05)(图1, 表1).
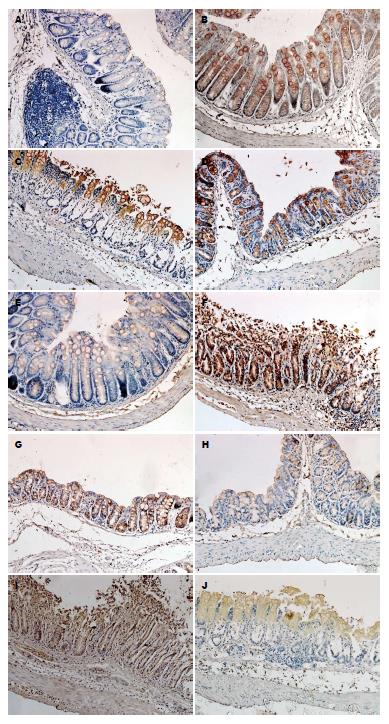
Muc2染色定位于结肠黏膜层的杯状细胞的胞浆, 尤其是核周, 呈棕黄色到棕褐色. 对照组多为阳性到强阳性, 模型组多为弱阳性, 治疗组多为阳性. Stat4和P-Stat4的染色定位于结肠黏膜层细胞的胞浆和细胞核, 呈棕黄色到棕褐色. 对照组多为弱阳性, 模型组多为阳性到强阳性, 治疗组多为弱阳性. 在小鼠结肠上皮中, Muc2染色阳性率在3组间有差异(χ2 = 19.62, P<0.05); 模型组低于对照组(13.33% vs 93.33%)(χ2 = 19.29, P<0.05); 治疗组高于模型组(60.00% vs 13.33%)(χ2 = 7.033, P<0.05). Stat4染色阳性率在3组间有差异(χ2 = 7.22, P<0.05); 模型组高于对照组(66.67% vs 20.00%)(χ2 = 6.652, P<0.05); 治疗组和模型组(50.00% vs 66.67%)之间的差异无统计学意义(χ2 = 3.333, P>0.05). P-Stat4染色阳性率在3组间有差异(χ2 = 12.95, P<0.05); 模型组高于对照组(60.00% vs 6.67%)(χ2 = 9.6, P<0.05); 治疗组低于模型组(13.33% vs 60.00%)(χ2 = 7.033, P<0.05)(表1, 图2).
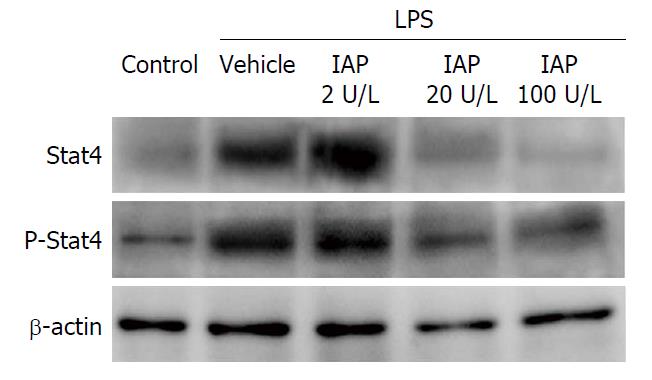
用2、20、100 IU/mL的IAP处理DC2.4细胞24 h后, 加LPS刺激4 h. 冰上裂解提取蛋白后检测不同浓度的IAP对LPS刺激的树突状细胞Stat4和P-Stat4的影响. 从蛋白免疫印迹结果来看, 内参条带均一, LPS可以诱导DC2.4细胞Stat4和P-Stat4表达, 而20、100 IU/mL的IAP处理后, 表达的Stat4和P-Stat4降低. 经过相对灰度分析后, 数据表明20、100 IU/mL的IAP均可抑制LPS可以诱导DC2.4细胞Stat4和P-Stat4表达(P<0.05)(表2, 图3).
炎症性肠病是一组慢性非特异性的肠道炎症, 包括溃疡性结肠炎和克罗恩病. 溃疡性结肠炎主要累及结肠, 而克罗恩病则可累及从口腔到肛门整个消化道[7]. 患者多有血便、腹痛等症状, 且症状从轻到重不等. 由于该病易反复, 严重影响患者的生活, 且正规治疗费用不低又需长疗程反复用药, 给患者带来了经济负担, 近年来我国的发病率也逐年上升[1]. 然而, 目前该病具体发病机制不明, 缺乏特异的治疗. 多数学者认为遗传、环境、心理和免疫因素参与了炎症性肠病的发病, 其中肠道黏膜屏障的破坏是发病的基础[8]. 肠道黏膜屏障功能的损伤可能会引起肠道内病原体及其产物的过量吸收而激活免疫细胞启动异常免疫反应, 释放促炎细胞因子加剧黏膜屏障破坏, 这被认为是IBD的发病机制之一[9]. 然而, 肠道黏膜屏障功能失调的发生机制尚未完全阐明, 在修复肠屏障损伤方面, 更没有找到满意的方法.
上皮细胞表面覆盖的黏液层在黏膜屏障功能中发挥了关键的作用[10]. 这些黏液主要由肠道杯状细胞分泌的黏蛋白组成, 其中Muc2是结肠黏液层的主要成分[11]. 多项研究检测了溃炎性结肠炎患者Muc2表达情况, 活动期UC患者的Muc2的生物合成与正常人相比下降可达40%[12-14]. 有研究[4,15,16]表明, Muc2基因敲除小鼠可自发形成结肠炎, 且Jak/Stat信号通路的基因高度上调, 与结肠炎症呈显著相关性. 这是Muc2参与结肠炎发病的有力证据. 研究[17]发现其碳氢结构是细菌黏附受体的类似物, 其位点可与肠上皮细胞上的结合位点竞争, 以阻止细菌与肠上皮细胞结合, 使细菌留在黏液层, 利于肠蠕动时被清除. 最近研究[18]发现Muc2的减少, 使细菌更容易侵袭肠上皮, 引起黏膜固有层炎症细胞的聚集和肠道的炎症反应. 此外, Muc2和多糖通过组装Galectin 3-Dectin 1-FcγRⅡB受体复合物, 增强DC的抗炎能力, 促进肠道免疫耐受[19]. 这些都论证了Muc2对结肠炎的多重保护作用.
肠道特异性的碱性磷酸酶(intestinal alkaline phosphatase, IAP)是肠组织中特异表达的碱性磷酸酶. IAP在肠黏膜屏障的维护中具有重要作用, 包括调节十二指肠表面pH值, 解除LPS和游离核苷酸的毒性, 抑制肠道炎症反应, 调节肠道菌群等[20-26]. IBD患者的结肠中IAP表达减少[27]. IAP可以去掉细菌及其产物的磷酸基, 使病原微生物的毒性减低甚至丧失, 从而起到为肠道减毒的作用[28,29]. IAP还可抑制由LPS刺激的巨噬细胞和肠上皮细胞COLO205的炎性细胞因子的分泌, 且通过灌胃补充IAP可改善小鼠的结肠炎症, 这可能与其抑制核因子-κB通路的磷酸化有关[3,30].
因此, 本实验拟通过对IAP治疗结肠炎模型小鼠的研究来验证补充IAP对Muc2表达的调节与机制以及在IBD的发病中的作用. 本实验采用TNBS诱导的结肠炎模型, 这是公认的广泛应用于IBD研究的模型. 该模型用TNBS和乙醇灌肠, 乙醇侵蚀肠道黏膜屏障后, TNBS结合肠道组织蛋白成为完全抗原, 激发肠黏膜的免疫炎性反应, 从而诱导出实验性的结肠炎[31]. 参照Lee等[3]的方法, 将IAP提前溶解于含有10 mmol/L Tris-HCl(pH 8.0), 1 mmol/L MgCl2和0.1 mmol/L ZnCl2的50%甘油中, 充分震荡混匀, 这样可以给IAP提供发挥作用所必需的辅基, 小分子甘油的包裹可以减少IAP在胃肠道中被各种蛋白酶分解, 有效运输到结肠发挥作用. 研究结果表明, 在TNBS诱导出的结肠炎小鼠的肠黏膜中Muc2表达减少, 黏膜炎症明显; 给予IAP灌胃后, Muc2的表达增多, 而P-Stat4表达减少, 缓解了TNBS诱导的结肠炎. Stat4通路是近年来研究较热门的一条细胞因子调控通路, 他的激活可以增加DC细胞IL-12的分泌, 促进Th1的分化, 使机体Th1/Th2失衡, 导致结肠炎的发生[5]. Stat4通路的激活方式主要是对蛋白的结构修饰, 如磷酸化、乙酰化等, 而磷酸化是最常见的Stat4通路的活化机制[16]. 在IAP对DC2.4细胞表达Stat4的影响的结果中可以看到, 在LPS模拟的炎症刺激条件下, Stat4和磷酸化Stat4的表达都上升, 而加入IAP后Stat4和磷酸化Stat4的表达都下降. Stat4和磷酸化Stat4变化的一致性说明IAP不仅可以抑制Stat4的磷酸化, 还可以抑制总的Stat4的表达. 结肠切片的免疫组织化学结果显示IAP除了使结肠Muc2的表达增加外, 还可以抑制结肠P-Stat4的表达. 这些都说明了IAP抑制Stat4磷酸化, 上调Muc2表达, 缓解结肠炎, 进一步表明Stat4的促炎作用与Muc2的保护作用. 总之, Muc2与IBD发病有关, 而IAP可抑制Stat4的磷酸化和上调Muc2表达, 缓解结肠炎. 因此, 补充IAP有望成为IBD治疗的新方法, 且IAP的检测可能为临床IBD的诊断提供参考.
Muc2是肠道黏液的主要成分, 能够保护肠道黏膜免于细菌的侵袭和肠液的腐蚀, 而炎症性肠病(inflammatory bowel disease, IBD)患者肠道碱性磷酸酶和Muc2的表达减少. Stat4是参与机体Th1/Th2分化的核因子, 可以调控下游的细胞因子如白介素-12等基因的转录.
阴赪宏, 研究员, 首都医科大学附属北京友谊医院感染与急救医学; 杜群, 研究员, 广州中医药大学脾胃研究所
有报道表明肠道特异性碱性磷酸酶可以抑制肠上皮细胞核因子-κB的磷酸化, 而该信号通路可以调控多种炎症性细胞因子的转录和表达.
本文将肠道特异性碱性磷酸酶(intestine alkaline phosphatase, IAP)对结肠炎小鼠的作用进行分析, 补充IAP有望成为IBD治疗的新方法, 且IAP的检测可能为临床IBD的诊断提供参考. 此外, 还发现其对DC细胞Stat4磷酸化的抑制作用.
IAP: 是肠道特有的碱性磷酸酶, 分泌在肠腔和组织液中可以灭活肠道有害菌的磷酸基, 起到减毒作用.
本文有一定的科学意义, 观点新颖,对临床有一定的指导作用.
编辑: 于明茜 电编:都珍珍
| 2. | Geremia A, Biancheri P, Allan P, Corazza GR, Di Sabatino A. Innate and adaptive immunity in inflammatory bowel disease. Autoimmun Rev. 2014;13:3-10. [PubMed] [DOI] |
| 3. | Lee C, Chun J, Hwang SW, Kang SJ, Im JP, Kim JS. The effect of intestinal alkaline phosphatase on intestinal epithelial cells, macrophages and chronic colitis in mice. Life Sci. 2014;100:118-124. [PubMed] [DOI] |
| 4. | Wenzel UA, Magnusson MK, Rydström A, Jonstrand C, Hengst J, Johansson ME, Velcich A, Öhman L, Strid H, Sjövall H. Spontaneous colitis in Muc2-deficient mice reflects clinical and cellular features of active ulcerative colitis. PLoS One. 2014;9:e100217. [PubMed] [DOI] |
| 5. | Thierfelder WE, van Deursen JM, Yamamoto K, Tripp RA, Sarawar SR, Carson RT, Sangster MY, Vignali DA, Doherty PC, Grosveld GC. Requirement for Stat4 in interleukin-12-mediated responses of natural killer and T cells. Nature. 1996;382:171-174. [PubMed] [DOI] |
| 7. | Ko JK, Auyeung KK. Inflammatory bowel disease: etiology, pathogenesis and current therapy. Curr Pharm Des. 2014;20:1082-1096. [PubMed] |
| 8. | Gómez-Gómez GJ, Masedo Á, Yela C, Martínez-Montiel Mdel P, Casís B. Current stage in inflammatory bowel disease: What is next? World J Gastroenterol. 2015;21:11282-11303. [PubMed] [DOI] |
| 9. | Merga Y, Campbell BJ, Rhodes JM. Mucosal barrier, bacteria and inflammatory bowel disease: possibilities for therapy. Dig Dis. 2014;32:475-483. [PubMed] [DOI] |
| 10. | Cornick S, Tawiah A, Chadee K. Roles and regulation of the mucus barrier in the gut. Tissue Barriers. 2015;3:e982426. [PubMed] [DOI] |
| 11. | Boltin D, Perets TT, Vilkin A, Niv Y. Mucin function in inflammatory bowel disease: an update. J Clin Gastroenterol. 2013;47:106-111. [PubMed] [DOI] |
| 12. | Van Klinken BJ, Van der Wal JW, Einerhand AW, Büller HA, Dekker J. Sulphation and secretion of the predominant secretory human colonic mucin MUC2 in ulcerative colitis. Gut. 1999;44:387-393. [PubMed] |
| 13. | Tytgat KM, van der Wal JW, Einerhand AW, Büller HA, Dekker J. Quantitative analysis of MUC2 synthesis in ulcerative colitis. Biochem Biophys Res Commun. 1996;224:397-405. [PubMed] [DOI] |
| 14. | Hanski C, Born M, Foss HD, Marowski B, Mansmann U, Arastéh K, Bachler B, Papenfuss M, Niedobitek F. Defective post-transcriptional processing of MUC2 mucin in ulcerative colitis and in Crohn's disease increases detectability of the MUC2 protein core. J Pathol. 1999;188:304-311. [PubMed] [DOI] |
| 15. | Lu P, Burger-van Paassen N, van der Sluis M, Witte-Bouma J, Kerckaert JP, van Goudoever JB, Van Seuningen I, Renes IB. Colonic gene expression patterns of mucin Muc2 knockout mice reveal various phases in colitis development. Inflamm Bowel Dis. 2011;17:2047-2057. [PubMed] [DOI] |
| 16. | Heneghan AF, Pierre JF, Kudsk KA. JAK-STAT and intestinal mucosal immunology. JAKSTAT. 2013;2:e25530. [PubMed] [DOI] |
| 17. | Ouwerkerk JP, de Vos WM, Belzer C. Glycobiome: bacteria and mucus at the epithelial interface. Best Pract Res Clin Gastroenterol. 2013;27:25-38. [PubMed] [DOI] |
| 18. | Johansson ME, Gustafsson JK, Holmén-Larsson J, Jabbar KS, Xia L, Xu H, Ghishan FK, Carvalho FA, Gewirtz AT, Sjövall H. Bacteria penetrate the normally impenetrable inner colon mucus layer in both murine colitis models and patients with ulcerative colitis. Gut. 2014;63:281-291. [PubMed] [DOI] |
| 19. | Shan M, Gentile M, Yeiser JR, Walland AC, Bornstein VU, Chen K, He B, Cassis L, Bigas A, Cols M. Mucus enhances gut homeostasis and oral tolerance by delivering immunoregulatory signals. Science. 2013;342:447-453. [PubMed] [DOI] |
| 20. | Malo MS, Alam SN, Mostafa G, Zeller SJ, Johnson PV, Mohammad N, Chen KT, Moss AK, Ramasamy S, Faruqui A. Intestinal alkaline phosphatase preserves the normal homeostasis of gut microbiota. Gut. 2010;59:1476-1484. [PubMed] [DOI] |
| 21. | Vaishnava S, Hooper LV. Alkaline phosphatase: keeping the peace at the gut epithelial surface. Cell Host Microbe. 2007;2:365-367. [PubMed] [DOI] |
| 22. | Bates JM, Akerlund J, Mittge E, Guillemin K. Intestinal alkaline phosphatase detoxifies lipopolysaccharide and prevents inflammation in zebrafish in response to the gut microbiota. Cell Host Microbe. 2007;2:371-382. [PubMed] [DOI] |
| 23. | Hamarneh SR, Mohamed MM, Economopoulos KP, Morrison SA, Phupitakphol T, Tantillo TJ, Gul SS, Gharedaghi MH, Tao Q, Kaliannan K. A novel approach to maintain gut mucosal integrity using an oral enzyme supplement. Ann Surg. 2014;260:706-714; discussion 714-715. [PubMed] [DOI] |
| 24. | Goldberg RF, Austen WG, Zhang X, Munene G, Mostafa G, Biswas S, McCormack M, Eberlin KR, Nguyen JT, Tatlidede HS. Intestinal alkaline phosphatase is a gut mucosal defense factor maintained by enteral nutrition. Proc Natl Acad Sci U S A. 2008;105:3551-3556. [PubMed] [DOI] |
| 25. | Bentala H, Verweij WR, Huizinga-Van der Vlag A, van Loenen-Weemaes AM, Meijer DK, Poelstra K. Removal of phosphate from lipid A as a strategy to detoxify lipopolysaccharide. Shock. 2002;18:561-566. [PubMed] |
| 26. | Akiba Y, Mizumori M, Guth PH, Engel E, Kaunitz JD. Duodenal brush border intestinal alkaline phosphatase activity affects bicarbonate secretion in rats. Am J Physiol Gastrointest Liver Physiol. 2007;293:G1223-G1233. [PubMed] [DOI] |
| 27. | Tuin A, Poelstra K, de Jager-Krikken A, Bok L, Raaben W, Velders MP, Dijkstra G. Role of alkaline phosphatase in colitis in man and rats. Gut. 2009;58:379-387. [PubMed] [DOI] |
| 28. | Estaki M, DeCoffe D, Gibson DL. Interplay between intestinal alkaline phosphatase, diet, gut microbes and immunity. World J Gastroenterol. 2014;20:15650-15656. [PubMed] [DOI] |
| 29. | Molnár K, Vannay A, Szebeni B, Bánki NF, Sziksz E, Cseh A, Győrffy H, Lakatos PL, Papp M, Arató A. Intestinal alkaline phosphatase in the colonic mucosa of children with inflammatory bowel disease. World J Gastroenterol. 2012;18:3254-3259. [PubMed] [DOI] |
| 30. | Rentea RM, Liedel JL, Fredrich K, Pritchard K, Oldham KT, Simpson PM, Gourlay DM. Enteral intestinal alkaline phosphatase administration in newborns decreases iNOS expression in a neonatal necrotizing enterocolitis rat model. J Pediatr Surg. 2013;48:124-128. [PubMed] [DOI] |
| 31. | Scheiffele F, Fuss IJ. Induction of TNBS colitis in mice. Curr Protoc Immunol. 2002;Chapter 15:Unit 15.19. [PubMed] [DOI] |