修回日期: 2016-08-16
接受日期: 2016-09-13
在线出版日期: 2016-10-28
初步研究PPTA对肝癌细胞HCCLM3增殖、周期和迁移的作用及机制.
分别采用四甲基偶氮唑蓝法(methyl thiazolyl tetrazolium, MTT)、流式细胞术、细胞划痕实验, 观察PPTA对肝癌细胞HCCLM3增殖、周期和迁移的影响; 采用细胞免疫荧光实验法观察PPTA对HCCLM3细胞肌动蛋白纤维的分布、丝状和片状伪足形成等的影响; 采用Western blot法检测肝癌细胞HCCLM3中蛋白激酶B(protein kinase B, AKT)和细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)的表达.
PPTA对HCCLM3细胞有抑制作用, 抑制HCCLM3细胞增殖的IC50在50 μmol/L以下. 当PPTA浓度为40 μmol/L时, 对HCCLM3细胞周期有抑制作用. PPTA对HCCLM3细胞划痕的相对愈合速度有抑制作用, 随着浓度的升高抑制作用显著增强. 细胞免疫荧光显示, HCCLM3细胞中丝状伪足增多, 片状伪足减少, 细胞排列更为紧密, 当PPTA浓度为40 μmol/L, 作用显著; Western blot显示, 当PPTA浓度为20、40 μmol/L时, 上调HCCLM3细胞的AKT表达, 下调pAKT表达.
PPTA抑制肝癌细胞HCCLM3的增殖、周期、迁移, 其作用机制可能是调控AKT和ERK相关的信号通路.
核心提要: 本实验通过四甲基偶氮唑蓝法、流式细胞术、细胞划痕实验、细胞免疫荧光法以及Western blot法等研究发现PPTA明显抑制肝癌细胞HCCLM3的增殖、周期和迁移, 并探讨了其抑制机制可能是调控蛋白激酶B和细胞外信号调节激酶相关的信号通路.
引文著录: 张志杨, 朱海杭, 贾平, 陈春燕, 郁飞. PPTA抑制肝癌细胞HCCLM3的增殖、周期和迁移. 世界华人消化杂志 2016; 24(30): 4177-4184
Revised: August 16, 2016
Accepted: September 13, 2016
Published online: October 28, 2016
To investigate the effects of pholidotaphenanthrene A (PPTA) on the proliferation, apoptosis, migration, and cell cycle progression of hepatocellular carcinoma HCCLM3 cells and the underlying mechanism.
Methyl thiazolyl tetrazolium (MTT) assay, flow cytometry and wound healing assay were used to evaluate the effects of PPTA on the viability, cell cycle progression and migration of HCCLM3 cells, respectively. Immunofluorescence staining and Western blot assays were performed to explore the effects of PPTA on F-actin distribution, the formation of lamellipodia and filopodia, and the expression of related signaling molecules.
PPTA decreased the viability of HCCLM3 cells, with IC50 < 50 μmol/L. PPTA at a dose of 40 μmol/L obviously delayed the cell cycle progression of HCCLM3 cells. Results of wound healing assay showed that PPTA can inhibit the relative healing rate of HCCLM3 cells in a dose-dependent manner. Immunofluorescence staining showed that HCCLM3 cells after incubation with different concentrations of PPTA displayed more close arrangement, decreased lamellipodia formation and increased filopodia formation, especially in cells treated with PPTA at a dose of 40 μmol/L. Western blot analysis showed that PPTA at 20 and 40 μmol/L can up-regulate protein kinase B(AKT) and down-regulate pAKT expression.
PPTA can inhibit the proliferation, cycle progression, and migration HCCLM3 cells possibly via mechanisms related to altering the levels of pAKT and pERK.
- Citation: Zhang ZY, Zhu HH, Jia P, Chen CY, Yu F. Effects of pholidotaphenanthrene A on proliferation, apoptosis, migration, and cell cycle progression of hepatocellular carcinoma HCCLM3 cells. Shijie Huaren Xiaohua Zazhi 2016; 24(30): 4177-4184
- URL: https://www.wjgnet.com/1009-3079/full/v24/i30/4177.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i30.4177
PPTA, 化学名1,5-二羟基-2,7-二甲氧基-9,10-二氢菲, 是刘量等[1]通过硅胶柱色谱、ODS柱色谱等方法从中药细叶石仙桃中分离纯化得到的一种具有新颖结构的菲类化合物. 国内外文献报道[2-6]菲类化合物具有良好的抗癌活性及肿瘤毒性作用. PPTA作为一种新型菲类化合物, 其抗肿瘤活性有待进一步研究. 本实验以人肝癌细胞株HCCLM3为研究对象, 研究不同浓度的新型菲类化合物PPTA对人肝癌细胞株HCCLM3增殖、周期及细胞迁移的影响, 初步探讨其可能的作用机制, 以期为该新型菲类化合物抗肿瘤活性开发提供实验依据和理论基础.
人肝癌细胞株HCCLM3购自江苏凯基生物技术股份有限公司; 胎牛血清(上海洛神生物工程有限公司); DMEM培养基(美国Gibco公司); 四甲基偶氮唑蓝(methyl thiazolyl tetrazolium, MTT)(Sigma公司); DAPI(美国Sigma公司); 胰蛋白酶(上海碧云天生物公司); SDS-PAGE凝胶配置试剂盒、免疫荧光固定液(上海碧云天生物公司); 超敏ECL化学发光试剂盒、BCA蛋白定量试剂盒(南京诺唯赞生物科技有限公司); 小鼠抗GAPDH单克隆抗体、兔抗人pERK单克隆抗体、兔抗人细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)单克隆抗体、兔抗人pAKT单克隆抗体、兔抗人蛋白激酶B(protein kinase B, AKT)单克隆抗体、辣根过氧化物酶(horse radish peroxidase, HRP)标记的兔抗鼠IgG、HRP标记的羊抗兔IgG(美国CST公司); PPTA由本实验室从中药细叶石仙桃中分离纯化得到.
1.2.1 细胞培养: 人肝癌细胞株HCCLM3培养于含10%胎牛血清、1%双抗的高糖DMEM培养基中, 置于37 ℃、50 mL/L CO2饱和湿度的培养箱中培养.
1.2.2 MTT法测定细胞增殖率: 取处于对数生长期的HCCLM3细胞, 调整细胞悬液浓度, 按每孔6000个细胞接种于96孔板, 置于37 ℃、50 mL/L CO2饱和湿度培养箱中培养12 h; 向96孔板中加入不同浓度的PPTA, 按照其终浓度为0、10、20、30、40、50 μmol/L分为6组, 同时设空白组(仅有培养液), 每组6复孔, 在37 ℃培养箱中培养48 h后; 取出96孔板, 每孔中加入10 μL的MTT(5 mg/mL), 置于37 ℃培养箱中继续培养4 h后终止培养, 倒掉上清, 向每孔中加入150 μL二甲基亚砜, 孵育10 min后在酶标仪上490 nm波长处检测各孔的OD值. 以相对OD值(相对OD值 = 实验组平均OD值/阴性对照组平均OD值)为纵坐标, 以药物浓度为横坐标, 绘制细胞活力图[7].
1.2.3 流式细胞术检测细胞周期实验: 细胞接种于6孔板中, 待细胞汇合至70%, 无血清饥饿2 h, 加入含0、10、20、30、40 μmol/L PPTA的完全培养基2 mL, 置于37 ℃、50 mL/L CO2饱和湿度培养箱培养48 h; 胰蛋白酶消化细胞, 制备单细胞悬液, 1500 r/min离心7 min收集细胞, 弃上清, 用预冷PBS洗涤细胞两次, 快速加入预冷70%乙醇1 mL与细胞充分混匀, 于-20 ℃固定过夜; 细胞染色前, 1500 r/min离心7 min收集细胞, 以1 mL的PBS洗涤细胞一次, 用200目滤网过滤后加入500 μL含50 μg/mL溴化乙锭、100 μg/mL RNase A和0.2% Triton X-100的PBS染色液, 4 ℃避光孵育30 min; 上流式细胞仪检测细胞周期并分析实验结果[8].
1.2.4 细胞划痕实验: 取处于对数生长期的HCCLM3细胞, 接种于6孔板, 置于37 ℃、50 mL/L CO2饱和湿度培养箱中培养, 待细胞生长至70%-90%时, 在每孔的中央处按纵轴方向划出"伤痕"线, 用PBS洗涤细胞2-3次, 仔细清除刮起的、漂浮的细胞, 用记号笔在培养板每孔的底部划线做记号, 把"伤痕"线分成几个相等部分, 用于进一步在光学显微镜下计数、观察; 分别加入含0、10、20、30、40 μmol/L PPTA的完全培养基, 培养0、24、48 h后倒置相差显微镜下(×200)拍照[9,10].
1.2.5 免疫荧光实验: 在超净台中将无菌盖玻片置于6孔板中并接种一定数量的细胞, 分别加入含0、10、20、30、40 μmol/L PPTA的完全培养基, 置于37 ℃、50 mL/L CO2饱和湿度培养箱中培养; 待细胞生长至70%左右, 取出盖玻片, PBS漂洗2次, 用固定液(40 g/L多聚甲醛)固定30 min, PBST(即PBS溶液加上Tween-20)充分漂洗3次, 5 min/次; 加入Triton X-100(0.2%)透化10 min, 再用PBST充分漂洗3次, 每次5 min; 用3%牛血清白蛋白在室温下封闭1 h后, PBST漂洗3次, 5 min/次; 用稀释的罗丹明标记的鬼笔环肽室温避光处理1 h, PBST充分漂洗3次, 5 min/次; 再用5 μg/mL DAPI避光处理10 min, PBST充分漂洗3次后加抗荧光淬灭剂封片; 于荧光显微镜下观察, 随机拍照[11].
1.2.6 Western blot实验: 蛋白样品的提取. 将处于对数生长期的细胞接种于6孔板中, 待细胞贴壁后分别加入含0、10、20、30、40 μmol/L PPTA的完全培养基2 mL, 置于37 ℃、50 mL/L CO2饱和湿度的培养箱中培养48 h; 取出6孔板倒掉培养液, 用PBS漂洗2次后置于冰上, 每孔中加500 μL的PBS, 用干净的细胞刮子迅速将孔中的细胞刮至一侧, 并用移液器将含细胞碎片的PBS移至1.5 mL离心管中并作标记; 1500 r/min离心7 min收集细胞, 每管加入80 μL预先配好的RIPA裂解液(RIPA:PMSF = 100:1), 在冰上裂解30 min(为使细胞充分裂解, 每隔2 min漩涡混匀1次); 4 ℃、13000 r/min离心15 min, 吸取上清液, 每个样品取8 μL用来进行蛋白定量, 其余样品收集到离心管里按4:1比例加入5×SDS上样缓冲液, 混匀后在沸水中煮5-10 min, 样品冷却后可保存在-20 ℃冰箱中[12,13].
BCA法蛋白定量. 按A液:B液为50:1的比例配制适量BCA工作液, 充分混匀备用; 将蛋白标准溶液(1 mg/mL)分别按0、1、2、4、8、12、16、20 μL加到96孔板中相对应孔中, 加PBS补足使对应的孔中溶液总体积为20 μL; 分别加入2 μL蛋白样品到相应孔中, 每孔中加入18 μL PBS, 每组样品设3个复孔; 分别向对应的孔中加入200 μL BCA工作液, 在37 ℃摇床上以100 r/min孵育30 min; 在酶标仪上563 nm波长处检测各孔的OD值; 以OD值为纵坐标, 标准溶液浓度为横坐标绘制标准曲线图, 计算蛋白样品的浓度.
SDS-PAGE电泳. 取洁净玻璃板, 用超纯水洗净后放在架子中晾干备用. 将干净玻璃板对齐后放在专用夹子中卡紧(不对齐会发生漏胶, 可加水检漏5 min); 检漏期间可按配方配制电泳缓冲液与转膜缓冲液; 电泳缓冲液: 分别用电子天平称取3.02 g Tris Base, 14.4 g Glysine, l g SDS, 加入700 mL超纯水搅匀, 并用超纯水定容至1000 mL; 转膜缓冲液: 分别用电子天平称取分别取3.02 g Tris Base, 14.4 g Glysine, 加入超纯水500 mL搅匀, 再用量筒取甲醇150 mL, 并用超纯水定容到1000 mL, 置于室温保存; 按试剂盒说明书配制10%的分离胶, 加入10%APS和TEMED后用移液器快速混匀, 灌胶时用移液器沿玻璃板边缘均匀快速加入, 待胶面升至夹子的绿带中间线高度, 在分离胶上加入无水乙醇以去除泡沫并压平液面; 待分离胶完全凝固后, 按配方配置浓缩胶, 将玻璃板剩余空间灌满浓缩胶后将点样梳子插好, 待浓缩胶凝固后将梳子轻轻向上拔出; 将制作好的凝胶板放入电泳槽中, 小玻璃板朝内, 大玻璃板朝外, 在电泳槽中加入配置好的电泳缓冲液; 根据蛋白定量结果分别在每个加样孔加入相应体积蛋白样品; 连接电泳装置, 初始电泳条件设置为50 V, 随后更改为35 mA. 溴酚蓝跑到分离胶底部即可停止电泳.
转膜-用塑料板轻轻撬开玻璃板后切除浓缩胶, 将裁剪好的分离胶在转膜缓冲液中平衡约15 min备用; 根据分离胶的大小来裁剪PVDF膜, 将其放入甲醇中活化1 min; 将转膜夹中的阴极面(黑色面)向下在加有转膜缓冲液的搪瓷盘中制作"三明治"装置(依次放入海绵垫、滤纸、凝胶、PVDF膜、滤纸、海绵垫), 去除气泡后将夹子合上卡紧, 注意整个转膜过程均需在液面下进行; 夹子放入转膜槽中, 夹子的黑色面对应的是槽的黑色面, 整个转膜装置需在冰浴中以310 mA转移90 min.
免疫印迹. 转膜结束后迅速将膜放入5%脱脂奶粉(2.5 g脱脂奶粉, 50 mL TBST)中室温封闭1 h; 然后将膜放入稀释好的一抗(可用封闭液稀释)中4 ℃孵育过夜; 用TBST在摇床上以100-200 r/min洗涤3次, 每次10 min; 分别用一定浓度HRP标记的二抗室温孵育1.5 h; 用TBST洗涤3次, 每次10 min.
显影拍照. 将ECL发光液中的A液和B液按1:l的比例配制, 避光保存; 在化学发光凝胶成像系统中进行发光反应; 实验结果以GAPDH作为内参, 利用软件Image J对蛋白条带进行灰度分析.
统计学处理 所得数据运用SPASS16.0软件进行分析, 实验数据均用mean±SD表示, 组间、组内比较用方差分析并采用t检验, P<0.05为有统计学意义.
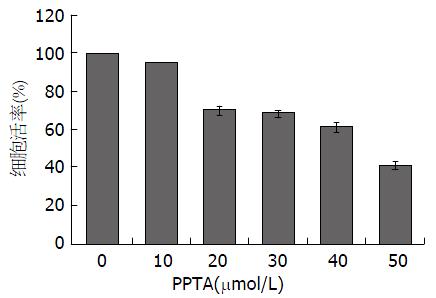
MTT法分别检测PPTA对HCCLM3细胞的增殖率, 由图1可知, PPTA对肝癌HCCLM3细胞作用48 h后, 与空白组(0 μmol/L)相比较, 10 μmol/L PPTA组对HCCLM3细胞活力无显著影响; 而随着PPTA浓度的逐渐增加, 细胞存活率则逐渐降低; 20、30、40 μmol/L的细胞存活率均在60%以上; PPTA抑制HCCLM3细胞增殖的IC50大约在50 μmol/L左右.
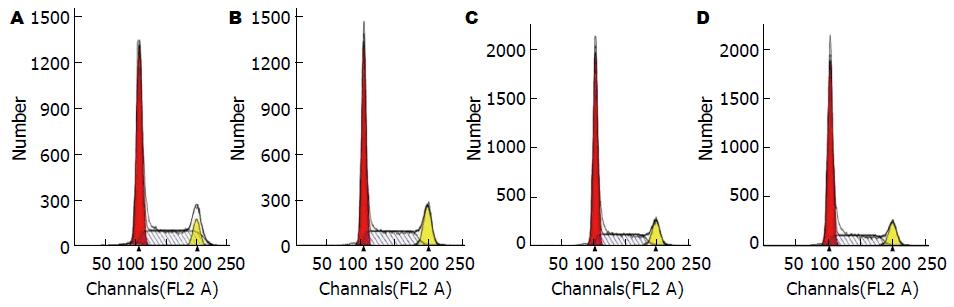
通过流式细胞术对不同浓度PPTA(0、10、20和40 μmol/L组)作用后的HCCLM3由图2可知, 与对照组比较, 10、20和40 μmol/L浓度的细胞周期中的S期细胞数均有所降低, 尤其以40 μmol/L浓度组S期的阻滞作用最明显. 结果提示PPTA可能通过阻滞细胞周期中的S期进程而抑制HCCLM3细胞的增殖或活力.
由图3可以看出, 以细胞在划痕不同时间的宽度变化来比较浓度对于细胞伤痕愈合的影响, 与空白对照组(0 μmol/L)细胞相比, PPTA可以抑制肝癌HCCLM3细胞划痕的相对愈合速度, 且随浓度升高抑制效果明显增强, 40 μmol/L组的抑制作用最显著.
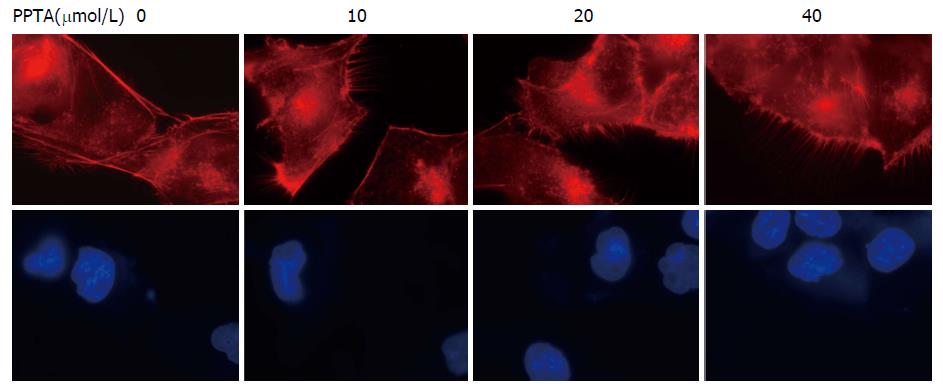
如图4所示, 与空白对照组(0 μmol/L)相比较, 随着PPTA浓度的增加, 肝癌HCCLM3细胞排列更为紧密, 细胞中张力纤维数目和细胞中片状伪足均减少, 而丝状伪足相对增多, 而这种现象在40 μmol/L组最为明显. PPTA对HCCLM3细胞迁移影响可能是通过调控细胞中肌动蛋白细胞骨架纤维的重排来实现的.
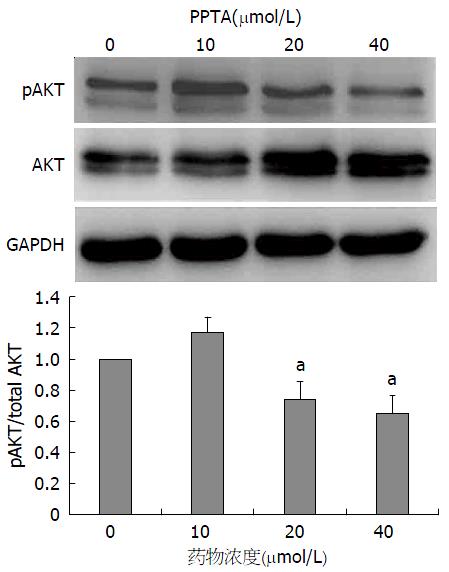
如图5和6显示, 与空白对照组(0 μmol/L)相比较, 随着药物浓度的上升, AKT的表达上调, 对应的pAKT的表达显著下调; 随着药物浓度的增加, pAKT/AKT比值显著下降, 尤其在PPTA浓度为20和40 μmol/L时下调最明显. 同样在PPTA在浓度为20和40 μmol/L时, pERK的表达也显著下调, pERK/ERK的值也显著下降; 结果提示, PPTA可以可能通过抑制AKT和ERK的磷酸化来抑制细胞周期的进程和细胞迁移的能力.
近年来肝癌发病率逐年增高, 在中国, 肝癌已经成为发病率最高的癌症之一, 严重威胁着人类的健康[14-16]. 中外文献多次报道菲类化合物具有很好的抗肿瘤作用, 对新型菲类化合物PPTA的抗肝癌作用及机制展开研究具有一定的科研意义. 肝癌细胞的无限增殖和扩散转移是导致肝癌患者高发死亡率的重要原因[17,18]. 肿瘤细胞的增殖和迁移过程均受到一系列信号分子表达及其活性调控的影响, 如AKT可通过影响细胞周期的进程来参与细胞生存途径[19], 而MAPKs信号通路中ERK的表达可通过调控肌动蛋白细胞骨架重排、张力纤维及伪足形成来影响细胞的迁移过程等[20]. AKT作为细胞中的一种丝氨酸/苏氨酸蛋白激酶, 他所组成的信号通路与人类肿瘤细胞的增殖密切相关[21-24]. 活化的AKT可通过磷酸化作用激活或抑制下游靶蛋白Caspase 9、Bad、GSK-3、核因子-κB、FKHR、p21Cip1和p27 Kip1等, 进而参与调节细胞的增殖、分化、凋亡以及迁移等过程[25,26]. 此外, ERK1/2, 又称p44/p42丝裂原活化蛋白激酶, 在恶性肿瘤细胞中, 由于各种机制可导致ERK的过度活化, 进而促进细胞增殖、抑制凋亡、促进细胞侵袭, 影响细胞分化[27-30].
本实验对高转移潜能的人肝癌细胞株HCCLM3进行体外研究, 与空白对照组(0 μmol/L)相比, 随着PPTA浓度的增加, 细胞活力则逐渐下降, 呈现显著的剂量依赖性, PPTA抑制HCCLM3细胞增殖的IC50大约在50 μmol/L左右, 因此后续实验中, 我们调整PPTA的最大药物浓度至40 μmol/L, 更具有统计学意义. 当PPTA浓度为40 μmol/L时, 明显使细胞阻滞在G1/S期, S期细胞数量显著减少, PPTA可能通过阻滞细胞周期中的S期进程而抑制细胞增殖. PPPTA还能显著抑制肝癌细胞HCCLM3"伤口愈合"的速度, 达到抑制HCCLM3细胞迁移的作用. 从免疫荧光实验看出, 随着PPTA浓度的增加, 肝癌HCCLM3细胞与细胞之间排列更为紧密, 细胞中张力纤维数目和细胞中片状伪足均减少, 而丝状伪足相对增多. 这提示PPTA对HCCLM3细胞迁移作用可能是通过调控细胞中肌动蛋白细胞骨架纤维的重排来实现的. 我们进一步采用Western blot实验, 发现PPTA可以上调AKT, 下调pAKT, 而且随着药物浓度的增加, pAKT/AKT比值显著下降, 同时PPTA可以显著下调pERK/ERK的比值. 这揭示PPTA可能通过抑制AKT和ERK的磷酸化来抑制HCCLM3细胞的增殖和迁移, 这也可能是PPTAK抗肝癌的关键作用机制之一, 有待进一步展开深入的分子机制研究.
近年来肝癌发病率逐年增高, 在中国, 肝癌已经成为发病率最高的癌症之一, 严重威胁着人类的健康. 寻找安全高效的抗肝癌转移药物迫在眉睫. 对新型菲类化合物PPTA的抗肝癌作用及机制的研究具有重要的科研意义与研究价值.
细胞增殖、周期和迁移等过程均受一系列信号分子表达及其活性调控的影响, 如蛋白激酶B(protein kinase B, AKT). 活化的AKT可通过磷酸化作用激活或抑制下游靶蛋白Caspase 9、Bad、GSK-3、核因子-κB、FKHR、p21Cip1和p27 Kip1等, 从而参与调节细胞增殖、分化、凋亡以及迁移等过程.
已有文献报道菲类化合物具有较好的抗肿瘤、抗菌、解痉、抗炎、抗血小板聚集、抗过敏活性等活性, 但对于新型菲类化合物PPTA的抗肝癌作用及机制尚未有报道, 故对其展开研究具有一定的科研意义.
PPTA是从中药细叶石仙桃中分离得到的一种新型菲类化合物, 对于其抗癌作用的研究尚未报道, 故本实验初步探讨了其对肝癌细胞的增殖、周期和迁移作用的影响, 具有一定的创新性和研究价值.
PPTA是从植物中分离纯化的到的一种天然菲类化合物, 本实验初步研究了其对人肝癌细胞株HCCLM3的增殖、周期和迁移的影响, 并初步探讨了可能作用机制, 为其在抗肿瘤活性的开发和应用提供了实验依据和理论基础.
细胞迁移: 也称为细胞爬行、细胞移动或细胞运动, 是指细胞在接收到迁移信号或感受到某些物质的梯度后而产生的移动. 细胞迁移为细胞头部伪足的延伸、新的黏附建立、细胞体尾部收缩在时空上的交替过程.
刘树业, 主任技师, 天津市第三中心医院医学检验中心; 傅晓辉, 副教授, 副主任医师, 东方肝胆外科医院
本文主要研究了菲类化合物PPTA对于肝癌细胞系LM3的增殖、周期和迁移的生物学作用, 以及初步探索了其发挥生物学作用的可能分子机制, 有一定的创新性及研究价值, 且实验设计合理, 方法得当, 思路清晰, 为进一步机制研究打下基础.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 江苏省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:胡珊
| 1. | 刘 量, 王 委, 殷 启蒙, 严 鑫, 黄 怡新, 樊 逸云, 范 云, 邵 梦楠, 倪 晨晖, 刘 涛. 细叶石仙桃乙酸乙酯部位化学成分的分离与鉴定. 扬州大学学报(自然科学版). 2015;4:53-56. |
| 3. | Pettit GR, Singh SB, Niven ML, Schmidt JM. Cell growth inhibitory dihydrophenanthrene and phenanthrene constituents of the african tree Combretum caffrum. Can J Chem. 2011;66:406-413. |
| 4. | Lee YH, Park JD, Baek NI, Kim SI, Ahn BZ. In vitro and in vivo antitumoral phenanthrenes from the aerial parts of Dendrobium nobile. Planta Med. 1995;61:178-180. [PubMed] [DOI] |
| 5. | Zhang GN, Zhong LY, Bligh SW, Guo YL, Zhang CF, Zhang M, Wang ZT, Xu LS. Bi-bicyclic and bi-tricyclic compounds from Dendrobium thyrsiflorum. Phytochemistry. 2005;66:1113-1120. [PubMed] [DOI] |
| 6. | Park EH, Kang SS, Lee YS, Kim SJ, Jin EJ, Tak EN, Sonn JK. Integrity of the cortical actin ring is required for activation of the PI3K/Akt and p38 MAPK signaling pathways in redifferentiation of chondrocytes on chitosan. Cell Biol Int. 2008;32:1272-1278. [PubMed] [DOI] |
| 9. | 李 红梅, 聂 丽娟, 霍 强, 赵 素容, 马 涛, 吴 成柱, 刘 浩. Hsp90抑制剂槚如酸对乳腺癌MDA-MB-231细胞增殖、侵袭、迁移的影响. 南方医科大学学报. 2015;35:355-359. |
| 15. | Hu B, Sun M, Liu J, Hong G, Lin Q. The preventative effect of Akt knockout on liver cancer through modulating NF-κB-regulated inflammation and Bad-related apoptosis signaling pathway. Int J Oncol. 2016;48:1467-1476. [PubMed] [DOI] |
| 16. | Isohanni M. The organization of the ward treating psychotic patients. Nord Psykiatr Tidsskr. 1990;44:261-267. [DOI] |
| 17. | Xu X, Jiang C, Wang S, Tai Y, Wang T, Kang L, Fan Z, Li S, Li L, Fu J. HPIP is upregulated in liver cancer and promotes hepatoma cell proliferation via activation of G2/M transition. IUBMB Life. 2013;65:873-882. [PubMed] [DOI] |
| 18. | Cao L, Zhou Y, Zhai B, Liao J, Xu W, Zhang R, Li J, Zhang Y, Chen L, Qian H. Sphere-forming cell subpopulations with cancer stem cell properties in human hepatoma cell lines. BMC Gastroenterol. 2011;11:71. [PubMed] [DOI] |
| 19. | Hatano E, Brenner DA. Akt protects mouse hepatocytes from TNF-alpha- and Fas-mediated apoptosis through NK-kappa B activation. Am J Physiol Gastrointest Liver Physiol. 2001;281:G1357-G1368. [PubMed] |
| 20. | Wang X, Wang C, Wang J, Zhao S, Zhang K, Wang J, Zhang W, Wu C, Yang J. Pseudoginsenoside-F11 (PF11) exerts anti-neuroinflammatory effects on LPS-activated microglial cells by inhibiting TLR4-mediated TAK1/IKK/NF-κB, MAPKs and Akt signaling pathways. Neuropharmacology. 2014;79:642-656. [PubMed] [DOI] |
| 21. | Kim CS, Vasko VV, Kato Y, Kruhlak M, Saji M, Cheng SY, Ringel MD. AKT activation promotes metastasis in a mouse model of follicular thyroid carcinoma. Endocrinology. 2005;146:4456-4463. [PubMed] [DOI] |
| 22. | Fresno Vara JA, Casado E, de Castro J, Cejas P, Belda-Iniesta C, González-Barón M. PI3K/Akt signalling pathway and cancer. Cancer Treat Rev. 2004;30:193-204. [PubMed] [DOI] |
| 23. | Manning BD, Cantley LC. AKT/PKB signaling: navigating downstream. Cell. 2007;129:1261-1274. [PubMed] [DOI] |
| 24. | Mohammad DK, Nore BF, Hussain A, Gustafsson MO, Mohamed AJ, Smith CI. Dual phosphorylation of Btk by Akt/protein kinase b provides docking for 14-3-3ζ, regulates shuttling, and attenuates both tonic and induced signaling in B cells. Mol Cell Biol. 2013;33:3214-3226. [PubMed] [DOI] |
| 25. | Lee SH, Kim HS, Park WS, Kim SY, Lee KY, Kim SH, Lee JY, Yoo NJ. Non-small cell lung cancers frequently express phosphorylated Akt; an immunohistochemical study. APMIS. 2002;110:587-592. [PubMed] |
| 26. | Balsara BR, Pei J, Mitsuuchi Y, Page R, Klein-Szanto A, Wang H, Unger M, Testa JR. Frequent activation of AKT in non-small cell lung carcinomas and preneoplastic bronchial lesions. Carcinogenesis. 2004;25:2053-2059. [PubMed] [DOI] |
| 27. | Li L, Qi L, Liang Z, Song W, Liu Y, Wang Y, Sun B, Zhang B, Cao W. Transforming growth factor-β1 induces EMT by the transactivation of epidermal growth factor signaling through HA/CD44 in lung and breast cancer cells. Int J Mol Med. 2015;36:113-122. [PubMed] [DOI] |
| 28. | Tsiamtsiouris J, Cairns HS. Effects of sentence-structure complexity on speech initiation time and disfluency. J Fluency Disord. 2013;38:30-44. [PubMed] [DOI] |
| 29. | Liao A, Wang W, Sun D, Jiang Y, Tian S, Li J, Yang X, Shi R. Bone morphogenetic protein 2 mediates epithelial-mesenchymal transition via AKT and ERK signaling pathways in gastric cancer. Tumour Biol. 2015;36:2773-2778. [PubMed] [DOI] |
| 30. | Gibbs PE, Tudor C, Maines MD. Biliverdin reductase: more than a namesake - the reductase, its Peptide fragments, and biliverdin regulate activity of the three classes of protein kinase C. Front Pharmacol. 2012;3:31. [PubMed] [DOI] |