修回日期: 2015-12-14
接受日期: 2015-12-21
在线出版日期: 2016-01-28
目的: 探讨苦参碱对人胰腺癌CFPAC-1细胞增殖、凋亡的影响及其可能的分子机制.
方法: 应用MTT法检测苦参碱对人胰腺癌CFPAC-1细胞增殖的抑制作用, 流式细胞仪分析细胞的凋亡率, Western blot法检测苦参碱对Hedgehog(Hh)通路中Ptch、Smo、Gli-l、Bcl-2蛋白表达的影响.
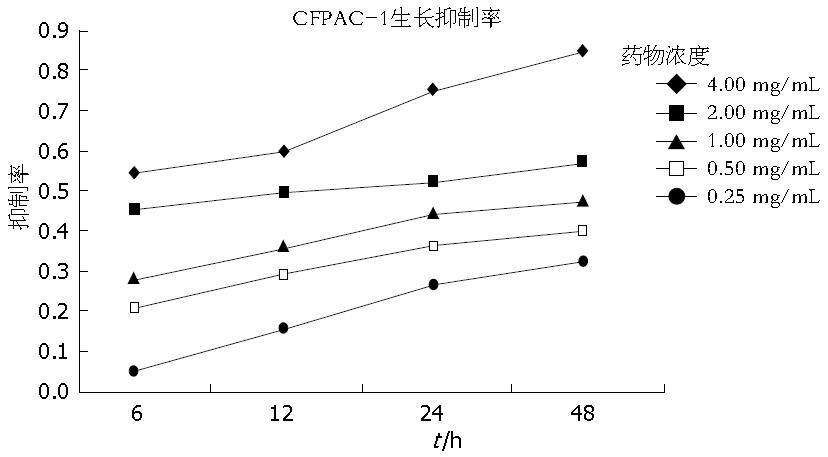
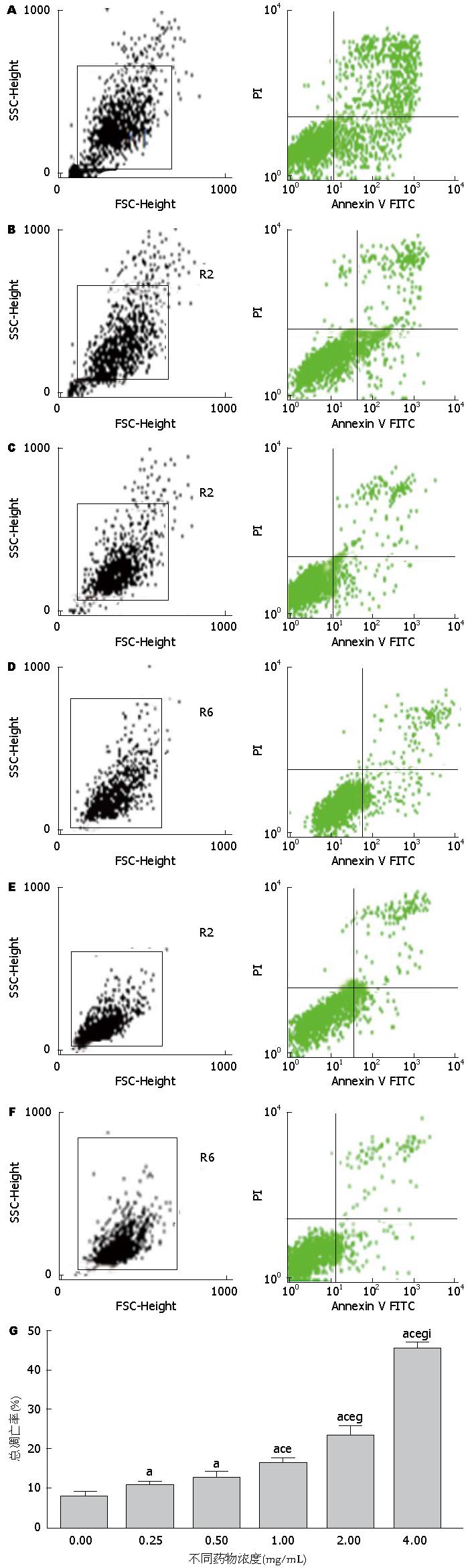
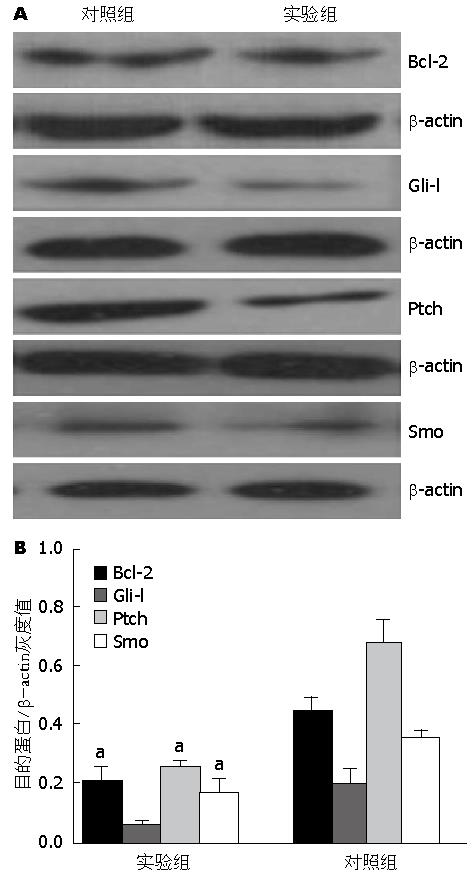
结果: MTT实验显示: 经浓度为0.25、0.50、1.00、2.00、4.00 mg/mL的苦参碱作用6、12、24、48 h后, 苦参碱对CFPAC-1细胞的生长抑制作用呈明显的浓度依赖性和时间依赖性(P<0.05), 其中24 h的IC50为1.266 mg/mL. FCM分析显示与对照组(8.2367%±1.685%)比较, 不同浓度苦参碱作用24 h后CFPAC-1细胞的凋亡率分别11.3867%±0.4652%、13.6167%±0.5785%、17.0433%±0.72501%、23.8700%±3.31107%、46.1333%±1.61398%, 均高于对照组(P<0.05). 其中除药物浓度为0.25 mg/mL与0.50 mg/mL浓度组比较时, 无统计学意义(P>0.05), 余浓度组两两对比均有统计学意义(P<0.05). Western blot结果显示: 1.00 mg/mL苦参碱作用24 h后, CFPAC-1细胞的Bcl-2、Gli-l、Ptch、Smo蛋白表达均显著低于阴性对照组(F值分别为: 15.557, 8.745, 24.386, 12.768, P<0.05).
结论: 苦参碱能够有效地抑制胰腺癌细胞的增殖并促进其凋亡, 其机制可能与Hh通路及其下游的Bcl-2有关.
核心提示: Hedgehog(Hh)信号转导通路的激活与胰腺癌的发病机制密切相关. 苦参碱可能通过影响Hh信号通路的激活, 从而抑制胰腺癌细胞的增殖并促进其凋亡.
引文著录: 何春游, 张法灿, 郭先文, 黄海宁, 梁列新, 莫可元. 苦参碱对胰腺癌CFPAC-1细胞增殖、凋亡及Hedgehog信号通路的影响. 世界华人消化杂志 2016; 24(3): 338-346
Revised: December 14, 2015
Accepted: December 21, 2015
Published online: January 28, 2016
AIM: To assess the effect of matrine on the proliferation and apoptosis of human pancreatic carcinoma CFPAC-1 cells and the potential molecular mechanism.
METHODS: MTT assay was used to detect the inhibitory effect of matrine on the proliferative rate of CFPAC-1 cells. Flow cytometry was performed to evaluate cell apoptosis. Western blot was applied to determine the expression levels of Hedgehog signaling pathway molecules such as Ptch, Smo, Gli-l and Bcl-1.
RESULTS: Matrine treatment dose- and time-dependently suppressed proliferation of CFPAC-1 cells (P < 0.05). IC50 of matrine at 24 h was 1.266 mg/mL. Compared with control cells, treatment with matrine at a concentration of 0.25, 0.50, 1.00, 2.00, or 4.00 mg/mL for 24 h significantly increased cell apoptosis, and the apoptosis rates were 8.2367% ± 1.685%, 11.3867% ± 0.4652%, 13.6167% ± 0.5785%, 17.0433% ± 0.72501%, 23.8700% ± 3.31107% and 46.1333% ± 1.61398%, respectively (P < 0.05). There was a significant difference in cell apoptosis between matrine treated groups (P < 0.05) except for the comparison between the concentrations of 0.25 mg/mL and 0.50 mg/mL. Western blot analysis indicated that compared with control cells, protein expression of Bcl-2, Gli-l, Ptch and Smo was significantly decreased in CFPAC-1 cells treated with 1 mg/mL matrine for 24 h (F = 15.557, 8.745, 24.386, 12.768, P < 0.05).
CONCLUSION: Matrine can effectively inhibit proliferation and induce apoptosis of human pancreatic carcinoma CFPAC-1 cells, via mechanisms possibly involving the Hedgehog signal pathway and Bcl-2.
- Citation: He CY, Zhang FC, Guo XW, Huang HN, Liang LX, Mo KY. Effect of matrine on Hedgehog signaling pathway, cell proliferation and apoptosis in pancreatic carcinoma CFPAC-1 cells. Shijie Huaren Xiaohua Zazhi 2016; 24(3): 338-346
- URL: https://www.wjgnet.com/1009-3079/full/v24/i3/338.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i3.338
胰腺癌是一种常见的、恶性程度极高且预后极差的消化系肿瘤. 近年来, 胰腺癌在全球的发病率呈逐年上升趋势[1]. 胰腺癌的发生、发展是遗传和环境因素相互作用的结果, 其发病机制与原癌基因的过度表达及抑癌基因的失活密切相关[2]. 原癌基因的突变可通过异常激活一系列信号转导通路调控癌细胞分化、增殖、浸润及转移, 与胰腺癌相关的主要细胞信号通路包括Ras-raf-MEK-ERK、PI3K/AKT、Wnt/β-catenin、MAPK、JAK/STAT和Hedgehog(Hh)通路[3]. Hh信号转导通路是一条高度保守的信号转导通路, 该信号途径中的许多分子已经被作为癌基因或抑癌基因所认识[4]. 苦参碱广泛存在于苦参、苦豆子及广豆根等中草药中, 目前苦参碱抗肿瘤作用已成为中药抗癌研究的热点[5]. 体外研究[6]表明, 苦参碱通过促进凋亡抑制胰腺癌细胞生长, 并下调血管内皮生长因子、基质金属蛋白酶(matrix metalloproteinase, MMP)-2的表达而抑制癌细胞的侵袭能力. 但苦参碱抑制胰腺癌细胞的信号通路并未清楚. 本研究以人胰腺癌CFPAC-1细胞系为研究对象, 应用分子生物学的方法, 研究苦参碱对胰腺癌CFPAC-1细胞增殖、凋亡的影响, 并初步探讨苦参碱抗胰腺癌作用及其分子机制, 为深入了解胰腺癌的发病机制和治疗药物开发提供一定的理论依据.
人胰腺癌细胞株CFPAC-1细胞来自中国科学院上海生物研究所细胞库, 苦参碱(纯度>98%)来自广西大学, DMEM/(高糖)培养基购于Hyclon公司, 现配现用. MTT试剂盒购自美国Sigma公司, Annexin V-FITC凋亡检测试剂盒购自美国BD公司. 胎牛血清型号为A96D22E购自澳洲. Ptch、Smo、Gli-l、Bcl-2抗体购自Santa Crus Biotechnology公司, 其二抗抗体均购自Bioss博奥森公司. Actin抗体购自碧云天公司. 酶标仪型号为GF-M300, 流式细胞仪购自BD FACSCalibur, Western Blot相关设备使用的是Bio-rad系统购自美国Bio-rad公司. CO2培养箱购自Thermo SCIENTIFIC.
1.2.1 细胞培养: 人胰腺癌CFPAC-1细胞培养于含10%胎牛血清、1%双抗的DMEM/(高糖)培养基中, 37 ℃、50 mL/L CO2培养箱中培养, 每4-5 d传代1次.
1.2.2 MTT法检测苦参碱对胰腺癌细胞增殖的影响: 设对照组(0 mg/mL苦参碱)和加药组(0.25、0.50、1.00、2.00、4.00 mg/mL浓度的苦参碱), 取对数生长期细胞, 常规胰酶消化计数细胞后用含10%胎牛血清DMEM培养液制成单细胞悬液, 按约6×103个细胞(200 μL)接种于96孔培养板, 待第2天细胞贴壁后去除培养液, 用PBS 100 μL洗3遍后加入含有0.25、0.50、1.00、2.00、4.00 mg/mL浓度的苦参碱的DMEM培养完全培养基, 每个浓度设3个复孔, 另设3个空白对照孔(不加细胞, 只加200 μL培养液), 继续培养6、12、24、48 h后检测. 弃上清, 每孔加入200 μL含有5 mg/mL MTT溶液20 μL及180 μL的完全培养基溶液后再培养4 h. 后弃上清, 每孔加入DMSO 150 μL, 37 ℃水平摇床上振荡15 min, 在全自动酶标仪上选490 nm波长测定各孔吸光度(A)值. 以空白组平均值调零. 实验重复3次. 按以下公式计算细胞的生长抑制率: 生长抑制率 = (1-加药组平均A值/对照组平均A值)×100%; 绘制生长抑制率-苦参碱浓度曲线.
1.2.3 流式细胞仪检测苦参碱对胰腺癌细胞凋亡的影响: 取对数生长期细胞, 常规胰酶消化后用含10%胎牛血清的DMEM培养液制成单细胞悬液, 计数后接种于六孔板中, 每孔约含5×105个细胞, 待细胞贴壁后去培养液并加药, 分别加入4 mL含有0.00、0.25、0.50、1.00、2.00、4.00 mg/mL苦参碱的培养液, 培养24 h后检测, 用不含EDTA的胰酶消化, 1500 r/min, 离心5 min, 收集细胞, 去上清, 用冷的PBS洗涤细胞2次. 然后用100 μL 1×Binding Buffer悬浮细胞, 在细胞悬液中加入5 μL Annexin V-FITC染色液及5 μL PI染色液, 混匀25 ℃避光反应15 min, 后再加入200 μL 1×Binding Buffer, 1 h内上流式细胞仪行细胞凋亡检测. 实验重复3次.
1.2.4 Western blot检测苦参碱对胰腺癌细胞中Ptch、Smo、Gli-l、Bcl-2蛋白表达的影响: 将细胞分别接种于六孔培养板中, 1.00 mg/mL苦参碱处理24 h后提取细胞总蛋白并使用考马斯亮蓝法测定蛋白含量. 配制10%分离胶使胶充分凝固加入5%浓缩胶, 将Marker液及已加入上样缓冲液的待测样品加入样品槽内后通电: 100 V电泳30 min, 后改为120 V 90 min电泳. 转移蛋白质到PVDF膜, 按要求浸泡膜后由下至上逐张叠放: 海绵垫、2层厚滤纸、凝胶、转印膜、1层滤纸、海绵垫插入电极, 打开电泳仪开关调至300 mA转膜, 转膜时间为Bcl-2及Actin蛋白40 min, Ptch、Smo、Gli-l、蛋白100 min. 洗涤后用5%牛奶(TBST配制)室温振摇封闭60 min. 加入一抗[一抗分别为山羊抗人Ptch多抗(1:100)、小鼠抗人Smo单抗(1:200), 兔抗人Gli1多抗(1:100)和兔抗人Bcl-2多抗(1:400), 小鼠抗人β-actin单抗(1:1000)]检测作为内对照4 ℃过夜, 后加入二抗IgG孵育2 h. 最后使用ECL发光试剂盒, 目标蛋白在暗室中显影. 以ImageJ软件测定显影条带的灰度值大小, 计算目的蛋白与内参灰度值比值. 实验重复3次.
统计学处理 采用SPSS16.0软件进行统计分析, 计量资料以mean±SD表示, 计数资料以率或百分比表示, 应用单因素方差分析进行统计学处理, P<0.05为差异具有统计学意义.
MTT结果显示, 在不同时间条件下, 不同浓度苦参碱对CFPAC-1细胞的生长抑制作用均显著增加. 同一时间, 不同浓度苦参碱对CFPAC-1细胞的抑制率随着苦参碱作用浓度的增加抑制率逐渐增大, 且不同浓度之间的抑制率存在明显差异, 差异有显著性统计学意义(P<0.05); 同一浓度苦参碱, 不同时间点对CFPAC-1细胞的抑制作用随着时间的增加抑制率逐渐增加, 且不同时间点之间的抑制率存在明显差异, 且差异有显著性统计学意义(P<0.05). 且随着苦参碱处理的时间不同, 半数抑制浓度(IC50)也有明显的不同, 6 h为2.175 mg/mL, 12 h为2.156 mg/mL, 24 h为1.266 mg/mL, 48 h为0.850 mg/mL. 苦参碱抑制胰腺癌细胞CFPAC-1呈现量-效与时-效关系(表1, 图1).
| 剂量(mg/mL) | 6 h | 12 h | 24 h | 48 h |
| 0.25 | 0.053±0.021 | 0.209±0.021 | 0.283±0.015 | 0.453±0.010 |
| 0.50 | 0.157±0.034 | 0.292±0.018 | 0.362±0.007 | 0.495±0.009 |
| 1.00 | 0.270±0.016 | 0.365±0.016 | 0.446±0.004 | 0.528±0.005 |
| 2.00 | 0.326±0.029 | 0.405±0.020 | 0.475±0.006 | 0.576±0.010 |
| 4.00 | 0.278±0.001 | 0.315±0.007 | 0.285±0.015 | 0.213±0.009 |
细胞在培养皿中贴壁生长, 在苦参碱作用下, 他们生长速度减慢, 形态发生改变, 部分细胞变圆、脱壁. 经0.25、0.50、1.00、2.00、4.00 mg/mL浓度的苦参碱作用24 h后CFPAC-1细胞的凋亡率分别11.38670%±0.46520%、13.61670%±0.57850%、17.04330%±0.72501%、23.87000%±3.31107%、46.13330%±1.61398%, 细胞总凋亡率逐渐增加. 分别与对照组(0 mg/mL)的凋亡率(8.2367%±1.685%)比较, 差异均有显著性统计学意义(P<0.05). 其中除药物浓度为0.25 mg/mL与0.50 mg/mL浓度组比较时, 无统计学意义(P>0.05), 余浓度组两两对比均有统计学意义(P<0.05)(图2).
实验组经浓度1.00 mg/mL苦参碱作用24 h后, CFPAC-1细胞中Bcl-2、Gli-l、Ptch、Smo蛋白表达量受到不同程度的抑制, 与对照组相比均有统计学意义(P<0.05)(图3).
苦参碱广泛存在于苦参、苦豆子及广豆根等中草药中[7]. 近年来对苦参碱的研究发现他的化学式为C15H24N20, 属于四环的喹嗪啶类[8]. 众多基础和临床研究[8,9]表明苦参碱具有抗病毒、抗菌消炎、抗肝损伤、调节免疫、抗寄生虫、治疗皮肤病、抗纤维化、抑制血管内皮细胞生长、抗心律失常、抗哮喘等多种药理作用. 近年来大量研究[10-14]发现苦参碱还对多种肿瘤细胞具有细胞毒作用, 可以抑制肿瘤细胞的生长并诱导凋亡. 范悦等[15]发现, 苦参碱对肝癌细胞HepG2的抑制作用与药物浓度及作用时间正相关, 苦参碱处理后, 细胞数量减少, 散在生长, 形态呈多形性, 细胞浆内充满圆形、透明的颗粒. 杨昨非等[16]和侯武卫等[17]研究发现, 苦参碱作用于人胰腺癌pc-3、SW990细胞后呈现明显的浓度依赖性和时间依赖性的生长抑制作用. Liu等[18]也研究发现, 苦参碱能够抑制体外培养的人胰腺癌细胞BxPC-3和PANC-1细胞的生长. 本研究中MTT实验结果显示, 经不同浓度苦参碱作用6、12、24及48 h后, 胰腺癌细胞CFPAC-1的增殖明显受到抑制, 且药物浓度越大, 增殖抑制越明显, 呈时间剂量依赖性. 因此. 苦参碱对胰腺癌细胞的增殖具有抑制作用. 从表1中可以看出, CEPAC-1细胞在高浓度苦参碱长时间作用时效果最佳. 但随着药物浓度的加大, 特别是4.00 mg/mL浓度苦参碱作用于CFPAC-1细胞时, 其A值偏小, 且随着作用时间的延长反而出现A值越来越小, 可能原因为高浓度苦参碱作用于CFPAC-1细胞时由于存活细胞比较少, 且CFPAC-1细胞属于生长速度稍慢的细胞, 活细胞竞争性生长少导致细胞生长慢, 甚至出现死亡. 并且在高浓度苦参碱长时间作用下, 细胞生长所需营养少从而出现A值越来越小.
细胞凋亡是指为维持内环境稳定, 由基因控制的细胞自主地有序地死亡. 他涉及一系列基因的激活、表达以及调控等作用, 凋亡过程的紊乱与许多疾病的发生、发展有着直接或间接的关系, 尤其与肿瘤的发展有着密切关系. 有研究[19]表明苦参碱具有诱导人骨肉瘤细胞的凋亡的作用, 其机制可能通过上调Fas/FasL及Bax、下调Bcl-2或者激活Caspase3、8、9等密切相关. 本研究FCM分析结果显示, 随苦参碱浓度增大, 总凋亡细胞百分比逐渐增多, 呈量效关系, 表明苦参碱够明显抑制胰腺癌细胞的生长并促进其凋亡, 与Liu等[18]的研究一致. 但药物浓度为0.25 mg/mL与0.50 mg/mL浓度组比较总凋亡率时, 组间无统计学意义, 说明当苦参碱药物浓度过低时, 对CFPAC-1细胞的凋亡影响小, 其具体原因还有待进一步研究. 结合本研究MTT实验的结果, 参照各时间段的IC50的浓度, 我们选择了浓度为1.00 mg/mL的苦参作用于CFPAC-1细胞24 h进行下一步Western blot实验.
Hh信号转导通路是一条高度保守的信号转导通路, 其组成包括: 分泌型信号糖蛋白配体(Hh), 跨膜蛋白受体(Ptch, Smo)受体复合物及下游转录因子Gli家族等组成[20]. 早期发现Hh信号通路异常激活可以诱发内胚层组织器官的肿瘤. 该信号通路异常激活最早在痣样基底细胞癌综合征中被证实, 其后在基底细胞癌、胃癌、结直肠癌、食管癌、胰腺癌、前列腺癌、乳腺癌、肺癌、乳腺癌、卵巢癌、子宫内膜癌及原发性肝癌等肿瘤中相继被发现[21,22]. Lau等[23]研究发现Hh信号转导通路参予调控胰腺的正常发育, 而在正常的成熟胰腺组织中却无表达或仅轻度表达. Thayer等[24]对26株来自原发及继发人胰腺癌的细胞系进行Hh信号成员的筛查发现每株均可检测到两种及以上的Hh信号成员(Ptch1、Smo、Gli-l)的表达; Rodova等[25]发现Hh信号通路在胰腺癌干细胞中高度活化. 因此, Hh信号转导通路的激活可能在胰腺癌的发生和发展中起一定的作用.
苦参碱类生物碱对消化、血液、生殖系统等各种肿瘤具有治疗作用[26]. 目前发现苦参碱抗肿瘤的机制主要有: (1)抑制细胞增殖; (2)诱导肿瘤细胞凋亡; (3)阻止癌细胞的浸润及转移; (4)抑制端粒酶活性; (5)调控细胞信号转导. 多项研究[27-29]发现, 苦参碱对肝癌SMMC-7721细胞MAPK、JAK-STAT信号通路具有抑制作用. 此外, 苦参碱还可通过通路抑制肿瘤细胞内皮生长因子/血管内皮生长因子及受体产生[30]. 黄建等[31]发现苦参碱可作用环氧合酶-2(cyclooxygenase-2, COX-2)通路下调大肠癌HT-29细胞COX-2 mRNA、PGE2及COX-2蛋白表达水平的表达. 然而, 苦参碱抑制胰腺癌细胞增殖作用是否与Hh信号通路相关未见报道. 本研究表明: 苦参碱对Smo、Gli、Ptch蛋白表达有明显的抑制作用, 提示苦参碱能可能通过影响Hh信号通路的激活, 而抑制胰腺癌细胞增殖.
Bcl-2是细胞凋亡的抑制基因, 有研究发现Hh信号通路中GLi可能直接诱导其下游具有抗凋亡作用的Bcl-2基因的表达以抑制癌细胞凋亡. 曹双双等[32]研究发现胰腺癌组织中Bcl-2表达水平明显上调, 从而抑制了癌细胞凋亡. 金刚等[20]通过阻断Hh信号通路, Bcl-2表达下调导致细胞周期阻滞和促进细胞凋亡, 对胰腺癌细胞增殖产生了抑制效应. 多项实验证明凋亡抑制基因Bcl-2在苦参碱作用下表达下降[33-35]. 本研究发现, 苦参碱对Bcl-2蛋白表达有明显的抑制作用. 因此, 苦参碱可能通过影响Hh信号通路的激活, 抑制Bcl-2的表达, 从而促进胰腺癌细胞的凋亡.
总之, 苦参碱能显著抑制胰腺癌细胞的体外增殖及促进凋亡, 其作用可能与Hh信号通路有关. 但是, 苦参碱的确切抗胰腺癌作用仍有待进一步的体内研究阐明. 且本实验显示苦参碱具有较好的诱导胰腺癌细胞凋亡的作用, 在治疗胰腺癌方面具有较好的应用前景.
Hedgehog(Hh)信号转导通路是一条高度保守的信号转导通路, 该信号通路异常激活可以诱发内胚层组织器官的肿瘤如胰腺癌、胃癌等. 苦参碱具有明显的抗肿瘤作用, 其作用机制是否与Hh信号有关尚不清楚.
高道键, 副教授, 副主任医师, 第二军医大学附属东方肝胆外科医院内镜科; 吕农华, 教授, 主任医师, 南昌大学第一附属医院
近年来, 以肿瘤细胞内异常信号通路为靶点的特异性抗肿瘤药物的研究已成为肿瘤防治研究领域的热点.
2011年杨昨非等研究发现, 苦参碱能抑制胰腺癌PC-3细胞的生长且诱导凋亡, 且呈药物浓度及时间依耐性, 其作用与PC-3细胞Bcl-2和bax基因mRNA的表达密切相关.
部分研究表明, 苦参碱对胰腺癌细胞具有抑制增殖、诱导凋亡的作用. 但到目前为止, 苦参碱抗胰腺癌作用的体外实验研究资料甚少. 本研究主要探讨苦参碱对人胰腺癌CFPAC-1细胞增殖、凋亡的影响及其可能的分子机制.
本实验显示苦参碱具有较好的诱导胰腺癌细胞凋亡的作用, 在治疗胰腺癌方面具有较好的应用前景.
本文主要就苦参碱对CFPAC-1细胞的增殖、凋亡及Hh信号通路的影响进行初步的探讨, 有一定的意义.
编辑: 郭鹏 电编: 都珍珍
| 1. | Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-2917. [PubMed] [DOI] |
| 2. | 叶 尔买克, 张 明鑫, 王 健生. 胰腺癌发病分子机制研究进展. 北京联合大学学报(自然科学版). 2010;24:23-28. |
| 8. | Sun M, Cao H, Sun L, Dong S, Bian Y, Han J, Zhang L, Ren S, Hu Y, Liu C. Antitumor activities of kushen: literature review. Evid Based Complement Alternat Med. 2012;2012:373219. [PubMed] [DOI] |
| 10. | Dai ZJ, Gao J, Ji ZZ, Wang XJ, Ren HT, Liu XX, Wu WY, Kang HF, Guan HT. Matrine induces apoptosis in gastric carcinoma cells via alteration of Fas/FasL and activation of caspase-3. J Ethnopharmacol. 2009;123:91-96. [PubMed] [DOI] |
| 11. | Luo C, Zhu Y, Jiang T, Lu X, Zhang W, Jing Q, Li J, Pang L, Chen K, Qiu F. Matrine induced gastric cancer MKN45 cells apoptosis via increasing pro-apoptotic molecules of Bcl-2 family. Toxicology. 2007;229:245-252. [PubMed] [DOI] |
| 12. | Zhang LP, Jiang JK, Tam JW, Zhang Y, Liu XS, Xu XR, Liu BZ, He YJ. Effects of Matrine on proliferation and differentiation in K-562 cells. Leuk Res. 2001;25:793-800. [PubMed] |
| 13. | Zhang S, Qi J, Sun L, Cheng B, Pan S, Zhou M, Sun X. Matrine induces programmed cell death and regulates expression of relevant genes based on PCR array analysis in C6 glioma cells. Mol Biol Rep. 2009;36:791-799. [PubMed] [DOI] |
| 14. | Liu XY, Fang H, Yang ZG, Wang XY, Ruan LM, Fang DR, Ding YG, Wang YN, Zhang Y, Jiang XL. Matrine inhibits invasiveness and metastasis of human malignant melanoma cell line A375 in vitro. Int J Dermatol. 2008;47:448-456. [PubMed] [DOI] |
| 18. | Liu T, Song Y, Chen H, Pan S, Sun X. Matrine inhibits proliferation and induces apoptosis of pancreatic cancer cells in vitro and in vivo. Biol Pharm Bull. 2010;33:1740-1745. [PubMed] |
| 19. | Liang CZ, Zhang JK, Shi Z, Liu B, Shen CQ, Tao HM. Matrine induces caspase-dependent apoptosis in human osteosarcoma cells in vitro and in vivo through the upregulation of Bax and Fas/FasL and downregulation of Bcl-2. Cancer Chemother Pharmacol. 2012;69:317-331. [PubMed] [DOI] |
| 22. | Berman DM, Karhadkar SS, Maitra A, Montes De Oca R, Gerstenblith MR, Briggs K, Parker AR, Shimada Y, Eshleman JR, Watkins DN. Widespread requirement for Hedgehog ligand stimulation in growth of digestive tract tumours. Nature. 2003;425:846-851. [PubMed] [DOI] |
| 23. | Lau J, Kawahira H, Hebrok M. Hedgehog signaling in pancreas development and disease. Cell Mol Life Sci. 2006;63:642-652. [PubMed] [DOI] |
| 24. | Thayer SP, di Magliano MP, Heiser PW, Nielsen CM, Roberts DJ, Lauwers GY, Qi YP, Gysin S, Fernández-del Castillo C, Yajnik V. Hedgehog is an early and late mediator of pancreatic cancer tumorigenesis. Nature. 2003;425:851-856. [PubMed] [DOI] |
| 25. | Rodova M, Fu J, Watkins DN, Srivastava RK, Shankar S. Sonic hedgehog signaling inhibition provides opportunities for targeted therapy by sulforaphane in regulating pancreatic cancer stem cell self-renewal. PLoS One. 2012;7:e46083. [PubMed] [DOI] |
| 27. | Zheng YM, Li X, Zhao HY, Zhao JY. [Effect of matrine and oxymatrine on proliferation and expression of Stat3 and Stat5 in SMMC-7721 cell line]. Zhongguo Zhongyao Zazhi. 2008;33:2234-2237. [PubMed] |
| 30. | Yu P, Liu Q, Liu K, Yagasaki K, Wu E, Zhang G. Matrine suppresses breast cancer cell proliferation and invasion via VEGF-Akt-NF-kappaB signaling. Cytotechnology. 2009;59:219-229. [PubMed] [DOI] |
| 32. | 曹 双双, 苏 安平, 杜 晓炯, 李 昂, 胡 伟明, 张 肇达, 田 伯乐, 陆 慧敏, 柯 能文, 何 兆鹏. Bcl-2和Beclin-1在胰腺癌中的表达及其相关性研究. 四川大学学报(医学版). 2012;43:156-160. |
| 33. | Zhang Z, Wang X, Wu W, Wang J, Wang Y, Wu X, Fei X, Li S, Zhang J, Dong P. Effects of matrine on proliferation and apoptosis in gallbladder carcinoma cells (GBC-SD). Phytother Res. 2012;26:932-937. [PubMed] [DOI] |
| 34. | Zhao B, Li B, Bai S, Shen L, Ren R, Jonas JB, Xu X, Lu Q, Liu Q. Effects of matrine on proliferation and apoptosis of cultured retinoblastoma cells. Graefes Arch Clin Exp Ophthalmol. 2012;250:897-905. [PubMed] [DOI] |
| 35. | Zhang S, Cheng B, Li H, Xu W, Zhai B, Pan S, Wang L, Liu M, Sun X. Matrine inhibits proliferation and induces apoptosis of human colon cancer LoVo cells by inactivating Akt pathway. Mol Biol Rep. 2014;41:2101-2108. [PubMed] [DOI] |