修回日期: 2016-05-24
接受日期: 2016-06-03
在线出版日期: 2016-10-18
断流术是临床常用的治疗门脉高压上消化道出血的术式. 其优点是止血确切且对肝功能影响较小, 然而由于术后血液高凝状态以及血流动力学的变化, 门静脉血栓(portal vein thrombosis, PVT)的发生率大大增加, 引起严重并发症. 超声、CT、核磁共振成像是临床常用的诊断PVT的方法. 确诊后可通过抗凝、介入、手术等方法给予有效控制及治疗. 因为PVT多数出现在断流术围手术期, 而且治疗效果局限, 所以围手术期PVT的预防显得尤为重要. 术前给予抗凝药物预防PVT形成, 术中防止对门静脉系统血管内皮损伤, 减少脾静脉盲端的形成, 稳定术后门静脉的血流动力学. 术后常规彩超复查, 早期诊断, 早期治疗.
核心提要: 断流术门静脉血栓多数出现在围手术期, 而且治疗效果局限, 所以围手术期门静脉血栓(portal vein thrombosis, PVT)的预防尤为重要. 术前给予抗凝药物预防PVT形成, 术中防止对门静脉系统血管内皮损伤, 减少脾静脉盲端的形成, 稳定术后门静脉的血流动力学.
引文著录: 薛帅, 张强, 刘嘉, 王培松, 陈光. 断流术后门静脉血栓的诊疗现状. 世界华人消化杂志 2016; 24(29): 4063-4069
Revised: May 24, 2016
Accepted: June 3, 2016
Published online: October 18, 2016
Splenectomy and gastroesophageal devascularization is the most common clinical treatment for upper gastrointestinal bleeding in patients with portal hypertension. Its advantages include exact treatment and little impact on liver function. However, due to the postoperative high blood coagulation state and hemodynamic changes, it greatly increases the incidence of portal vein thrombosis (PVT), which causes serious complications. Ultrasound, CT and MRI are main methods for the diagnosis of PVT. After diagnosis, using anticoagulation, intervention and surgery can achieve effective control and treatment. PVT mostly occurs perioperatively and therapeutic effects are therefore limited, so perioperative PVT prevention is particularly important. It is recommended that anticoagulation drugs be given preoperatively to prevent PVT formation, injury to the vascular endothelium of the portal vein system be avoided intraoperatively to reduce the formation of spleen vein stump and stabilize postoperative portal vein blood flow dynamics, and ultrasound be performed postoperatively to achieve early diagnosis and treatment.
- Citation: Xue S, Zhang Q, Liu J, Wang PS, Chen G. Diagnosis and treatment of portal vein thrombosis after splenectomy and gastroesophageal devascularization. Shijie Huaren Xiaohua Zazhi 2016; 24(29): 4063-4069
- URL: https://www.wjgnet.com/1009-3079/full/v24/i29/4063.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i29.4063
断流术即脾切除, 同时手术阻断门奇静脉反常血流, 是临床常用的治疗肝硬化门静脉高压上消化道出血的手术方式, 其优点是止血确切且对肝功能影响较小, 然而, 断流术后门静脉系统血栓发生率高达18.9%-100.0%[1-4], 是临床亟待解决的问题. 门静脉血栓(portal vein thrombosis, PVT)是指发生于门静脉主干及其分支、肠系膜上下静脉或脾静脉的血栓[4]. PVT的存在导致持续性腹水、胸水, 肠管淤血、水肿, 肠道缺血坏死, 门静脉管壁硬化、管腔狭窄, 使门静脉压力升高, 加重消化道再出血的风险[1], 因此, PVT的诊疗一直是临床关注的重点.
综合国内外文献就肝硬化门静脉高压断流术后PVT的诊疗现状做一综述.
断流术后, 短期内血液中的血小板数量增加, 使血液呈高凝状态, 可能是导致术后并发PVT的原因[1,2,5-7]. 研究[8]表明, 血小板不仅数量增加, 而且功能活化. 血小板膜表面糖蛋白CD62P, 反映血小板活化程度及功能状态. 术后CD62P升高与PVT发生密切相关, 可作为诊断评价术后PVT的敏感指标.
断流术后由于血细胞数量增多; 红细胞聚集性增加; 红细胞变形性降低等原因导致全血黏度升高, 与PVT形成相关[5,9].
肝硬化患者由于肝脏合成功能下降, 体内促凝与抗凝相关的蛋白均下降, 常常基本维持在动态平衡中, 使机体既不易出血, 也不易形成血栓. 然而, 断流术后, 静脉内膜损伤, 门静脉流量减少, 流速降低, 使抗凝相关蛋白S、蛋白C水平下降, 抗凝血酶Ⅲ水平降低, 同时手术消耗大量凝血因子[1,10,11]. 凝血因子Ⅷ、Ⅶ因子相关抗原, 抗心磷脂抗体含量也上升, 都与术后PVT形成相关[12]. 文献报道一些体内促凝基因突变, 包括凝血因子V莱顿G1691A突变, 亚甲基四氢叶酸还原酶C677T突变, 凝血酶原G20210A突变等可能均与断流术后PVT的形成相关[10,12-14]. 近期研究[15]表明, 血凝酶活化纤溶抑制剂基因突变及凝血因子Ⅷ增加与PVT的发生密切相关.
断流术后门静脉是否形成血栓除了与术后血液高凝状态有关外, 还与肝内阻力和门静脉血流量有关[10]. 由于术中钳夹、挤压造成脾静脉内膜损伤, 胶原纤维暴露, 激活凝血系统[2,5,16], 同时断流术后脾静脉的残端血流动力学产生变化, 血流相对缓慢, 易形成湍流, 加上静脉血流减少, 促进脾静脉血栓形成, 并可向门静脉主干蔓延[1,11].
门静脉血流速度与PVT形成有重要关系, 研究[4,6]表明门静脉血流速度<15 cm/s的患者PVT发生率明显升高. 毋庸置疑, 无论分流术还是断流术, 术后门静脉血流均呈现流量减少、流速降低的共同特征, 但门静脉压力却根据侧支循环建立的不同有明显不同. 门静脉压力越大, 门静脉或脾静脉直径越粗, 流速降低的程度将越明显[2,4,6]. 所以常常以门静脉直径和/或脾静脉直径作为PVT形成的独立危险因素[3,4,17].
选择性断流术脾静脉血栓的形成原因如同传统断流术一样, 因为食管旁静脉的阻力较肝内阻力小, 肠系膜上静脉回流的血液经食管旁静脉分流直接回流至体循环, 肝侧门静脉向肝血流较少, 肝内阻力高, 血流速度可能极为缓慢, 导致PVT的发生[4,18,19].
总之, 治疗肝硬化门静脉高压症的各种术式, 由于均存在门静脉血流动力学的改变, 所以术后PVT的发生率均相当高. 但是不同术式血流动力学改变的部位存在差异, 所以只是PVT出现的部位不同[4,18].
脾静脉在长期的高压状态下, 会出现内膜平滑肌肥大增生, 纤维断裂、玻璃样变, 胶原纤维和细胞外基质增生, 内膜损伤, 内皮细胞受损, 胶原纤维暴露, 血细胞黏附, 从而促进血栓形成[11].
急性PVT形成时, 腹痛一般是最早出现的临床症状. 腹痛多为局限性, 少数为全腹弥漫性. 间歇性绞痛, 持续时间较长, 约50%的患者会出现恶心和呕吐, 少数患者有腹泻或便血, 如突然产生完全性梗阻, 可出现脐周剧烈, 腹痛呈阵发性, 多伴有明显恶心、呕吐, 无排气排便, 此时查体多无明显体征, 即腹痛程度与腹部体征不一致. PVT形成后, 由于增加了肝前阻塞性因素, 使肝门静脉血流量减少而加重肝功能损害, 增加门静脉压力, 反复出现上消化道出血及难治性腹水等; 如病情进一步发展可出现肠坏死的表现, 持续性腹痛, 腹胀, 便血, 呕血、休克及腹膜刺激征等. 腹穿可抽出血性腹水[10,12,20,21]. 一旦发生肠坏死, 病死率高达20%-60%, 常有持续性的腹痛, 便血, 腹肌痉挛, 腹水, 多器官功能衰竭等[22].
慢性PVT可因胃肠道淤血和肝脏门静脉血流灌注不足, 出现不易缓解的腹胀、腹泻、上腹部隐痛、 顽固性腹水等. PVT的临床表现不一, 所以PVT的临床诊断多以相关影像学检查为主[10,12,20,21].
超声检查是最常见的检查手段之一, 超声可以准确地评价PVT, 简便易行而且无创伤, 为首选影像检查方法[12,19,23]. PVT超声诊断的特点为[24]: 门静脉腔内异常回声病变, 与管壁分界清晰, CDFI无血流信号[10,13]; 门静脉海绵状血管瘤; 血栓形成部位门静脉扩张; PVT形成范围广, 无法显示门静脉等[20]; 超声检查的敏感性及特异性可达到60%及100%[24-27], 超声能够清晰的观察到血液流速及血管内径的变化以及血栓的存在, 通过血流观察同时可以明确是否形成侧支循环等[24,28]; 但是超声不能直观反映门静脉及其属支的情况, 而且操作者经验水平影响诊断的准确性[25-27]. 应用超声造影或者超声内镜检查能够更明确的诊断PVT, 甚至能够将诊断的敏感性提升到81%左右, 但是超声造影和超声内镜均无法准确地观察到门静脉的肝内部分及肠系膜上静脉的远端, 以及不能同时评价周围脏器是否受累, 存在一定的局限性[24-27].
增强CT或增强核磁共振成像(magnetic resonance imaging, MRI)检查通过静脉注入造影剂能够有效的解决上述不足, 通过造影剂的对比, 在影像显影的不同时期能够准确的发现血管腔内充盈缺损及附近脏器是否灌注良好[12,21]. CT血管造影(CT angiography, CTA)和磁共振血管造影(magnetic resonance angiography, MRA)的应用大大增加了诊断的准确性. 研究[29,30]显示CTA的敏感性为86%, 特异性为95%. MRA敏感性为100%, 特异性为98%. PVT的CT典型征象非常直观, 主要是门静脉腔内出现不强化低密度条状或块状病灶[10]. 部分由于血栓段血管壁有滋养小血管, 偶尔可发现其周边有环形强化, 同时可以协助诊断原发性肝癌、肝硬化, 评价肠道缺血坏死的情况[29,30]. CTA具有扫描时间短、成像速度快、减少运动伪影的优点, 扫描可以在一次屏气的短时间内完成. 但其不足主要是可以产生造影剂过敏、造影剂肾病等不良反应. MRA造影剂的安全性明显优于CTA, 但其同样存在呼吸运动伪影、信号采集时间长、成像范围局限等不足[24,29,30]. 所以, 针对可疑PVT的患者进行增强CT或MRI检查能够更准确地进行临床诊断.
血管造影是诊断PVT传统方法, 具有创伤性, 所以并不作为PVT的常规检查. 血管造影包括间接造影和直接造影两类[10]. 间接造影是经脾动脉及经肠系膜上动脉造影. 不仅可以观察到门静脉充盈缺损, 而且可以清晰显示侧支循环[21]. 最重要的是间接法造影术后, 可将导管选择插入肠系膜上动脉和/或脾动脉分支灌注溶栓药物, 在诊断同时可以进一步进行治疗. 直接造影分为: 经皮经肝门静脉造影, 可以直接显示门静脉系统、直接评价门脉血流动力学状况; 经脐门静脉造影, 适用于合并脾静脉血栓、脾脏切除以及动脉性门静脉造影失败的病例[24].
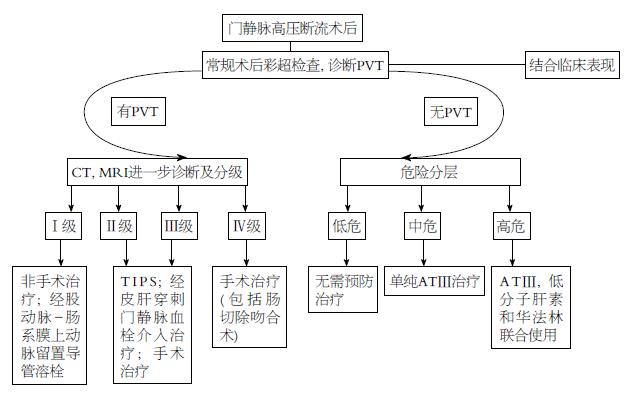
根据PVT术前的影像学检查结果, Yerdel将PVT进行分级: Ⅰ级: 小于50%门静脉管腔堵塞±肠系膜上静脉微小血栓; Ⅱ级: 大于等于50%门静脉管腔堵塞±肠系膜上静脉微小血栓; Ⅲ级: 门静脉完全堵塞合并肠系膜上静脉近端堵塞; Ⅳ级: 门静脉完全堵塞合并肠系膜上静脉完全堵塞[23,24,31].
PVT的治疗的总体目标可以归纳为降低PVT形成的高危因素, 防止血栓进一步扩展, 保持门静脉的通畅, 预防并治疗因PVT导致的并发症[34].
虽然门静脉高压断流术后PVT的发生率较高, 但是临床研究[35,36]发现, 30%-50%的PVT患者不经过任何治疗可以自行缓减. 最大侧支循环静脉的直径和血流量与PVT自行缓减的发生率密切相关[36], 然而PVT一旦确定无法自行缓减, 往往已经错过了最佳的预防治疗期, 发生严重的并发症, 大大增加门脉高压患者的病死率. 所以建议对患者常规术后进行彩超评估, 早期诊断, 早期给予抗凝、溶栓等治疗, 能够有效改善患者预后[5,37]. 常用的治疗药物包括华法林、低分子右旋糖酐、低分子肝素、尿激酶等[10,38-41]. 断流术后PVT多数是急性的, 对于急性期PVT建议早期抗凝治疗, 同时建议至少抗凝6 mo[20], 不仅可以大大降低PVT的发生率, 而且使PVT再通率达到39.3%-100.0%, 同时使血栓继续发展的发生率降低到0%-15%[5]. 而且研究[42,43]表明, 全身抗凝溶栓并不会增加术后出血和感染等并发症的发生.
近年来, 活化凝血因子Xa的抑制剂(比如立伐沙班)已经应用于临床PVT的预防. 优点是口服给药方便, 对国际标准化比值无影响, 不需要监测血中各项凝血指标. 缺点是没有有效的拮抗剂, 抗凝治疗过程中一旦出现出血并发症, 后果严重[13,36].
总之, 临床上非手术方法仍然是治疗断流术后PVT的主要方法.
局部溶栓分为间接途径(经股动脉-肠系膜上动脉留置导管溶栓)和直接途径(经皮肝穿刺门静脉血栓溶栓)[10].
经股动脉-肠系膜上动脉留置导管溶栓的方法优点为操作简单、创伤相对较小, 仅仅适用于PVT较轻, 无血管闭塞的轻度患者, 主要由于当通过此法发现PVT时, 门静脉属支多由于血栓处于狭窄甚至闭塞的状态, 注射的溶栓药物多数无法有效到达血栓存在的部位, 所以适应证有限[20,34,36,44].
经皮肝穿刺门静脉血栓溶栓的方法优点操作简单, 成功率高[45,46]. 然而, 当随访凝血功能APTT明显延长, 国际标准化比值>2, 出现明显腹痛、腹胀、呕血便血、穿刺点渗血增多、皮下淤斑扩大、血红蛋白持续减少, 甚至出现心率增快、血压下降等活动性出血征象时必须停止治疗[34,36].
PVT多数出现在断流术围手术期, 由于术后PVT发生率高, 而且治疗效果局限, 所以围手术期PVT的预防显得尤为重要[20].
Kawanaka等[47]研究表明, 抗凝血酶Ⅲ活性度与脾静脉直径是断流术后PVT发生的危险因素, 就此制定了门脉高压术后PVT发生的危险分层, 根据危险分层决定是否给予预防性治疗. 低危: ATIII活性度≥70%和脾静脉直径<10 mm, 无需预防治疗; 中危: ATⅢ活性度<70%或脾静脉直径≥10 mm, 单纯ATⅢ预防治疗; 高危: 脾静脉直径≥15 mm或者离肝的侧支循环静脉直径≥10 mm, ATⅢ, 低分子肝素和华法林联合使用.
Zhang等[48]则以门静脉血流最大流速与最大直径的比值(Vmax/D)作为预测PVT的指标, 当Vmax/D≤19.43/s, PVT的发生率大大增加, 需要给予预防性治疗, 由于应用华法林需要长期监测国际标准化比值, 所以临床工作中常通过长期使用低分子肝素预防PVT的发生. 低分子肝素不仅安全性较高, 而且可以抑制肝实质的坏死性炎症反应[49,50]. 预防治疗的常规剂量为4000单位/d, 治疗周期为1年[50].
术中对门静脉系统血管的操作需轻柔、准确, 防止不必要的操作损伤血管内皮, 避免大块结扎组织, 尽量靠近肠系膜下静脉处确切结扎脾静脉, 从而可以减少脾静脉盲端的形成, 稳定术后门静脉的血流动力学. 如无明显出血倾向, 术后尽量不使用止血药, 以防止血栓形成[20].
术后常规定期行彩色超声多普勒检查, 以便及时发现PVT形成; 行断流术的患者, 常规应用抗血小板凝集和抗凝药物, 能够有效预防术后PVT的形成, 增加PVT形成后门静脉再通的概率. 维持抗凝治疗6-12 mo以巩固疗效, 并根据血小板和凝血情况调整维持, 逐渐停药.
PVT作为临床少见的深静脉血栓, 尽管在断流术后患者中是高发疾病, 但局部或全身性血栓形成的因素, 单独或共同作用着PVT的发生, 由于PVT能够导致严重的临床并发症, 严重威胁患者的生命健康, 在临床工作中应给与足够的重视. 门脉高压断流术后PVT的发生率较高, 总体处理原则为早期诊断, 早期治疗, 预防为主, 治疗为辅, 预防与治疗相结合. 结合国内外文献及作者经验, 总结门静脉高压断流术后PVT诊疗体系(图1). 在不久的将来, 随着对PVT认识的不断深入, 由于血管成像手段的不断进步和临床治疗血栓药物的不断创新, 更好的减少疾病并发症是每个关注PVT研究者的最终追求目标.
断流术后门静脉系统血栓发生率高达18.9%-100.0%, 是临床亟待解决的问题. 门静脉血栓常常导致严重的并发症, 因此, 门静脉血栓的诊疗一直是临床关注的重点.
刘德良, 教授, 主任医生, 中南大学湘雅二医院消化内科; 谭学瑞, 教授, 汕头大学医学院第一附属医院内科
预测断流术后门静脉血栓形成的危险因素一直是临床研究的热点, 针对不同人群危险因素的差异, 决定是否给予预防性抗凝治疗.
断流术: 即脾切除, 同时手术阻断门奇静脉反常血流, 是临床常用的治疗肝硬化门静脉高压上消化道出血的手术方式.
本文综述了继发于腹部手术后的门静脉血栓的病因机制、诊断、治疗及预防等, 有一定的新颖性.
手稿来源: 邀请约稿
学科分类: 胃肠病学和肝病学
手稿来源地: 吉林省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D
E级 (差): 0
编辑: 于明茜 电编:李瑞芳
| 1. | 匡 洁, 杨 卫平, 严 佶祺, 马 迪, 陈 皓, 彭 承宏, 李 宏为. 贲门周围血管离断术后门静脉血栓形成的预测因素分析. 中国普外基础与临床杂志. 2015;22:1305-1309. |
| 2. | 刘 礼军, 匡 勇军, 余 伟, 张 能平. 断流术后门静脉系统血栓形成及其防治. 中国血吸虫病防治杂志. 2015;27:96-97. |
| 7. | 刘 波, 姚 志成, 胡 昆鹏, 林 继宗, 黄 河, 许 世磊, 王 庆亮, 张 鹏, 杨 培生. 门静脉高压症脾切除术后门静脉血栓发生影响因素分析. 中华肝脏外科手术学电子杂志. 2015;4:284-287. |
| 8. | 梅 斌, 郑 凯, 陈 孝平. 断流术后门静脉血栓形成与血小板膜蛋白CD62P的关系. 华中科技大学学报(医学版). 2006;35:548-552. |
| 11. | 徐 国森, 徐 长禄, 于 波, 王 庆历, 张 学锋. 门静脉高压症断流术后门静脉血栓形成的多因素分析. 世界最新医学信息文摘. 2015;15:76-77. |
| 13. | Harding DJ, Perera MT, Chen F, Olliff S, Tripathi D. Portal vein thrombosis in cirrhosis: Controversies and latest developments. World J Gastroenterol. 2015;21:6769-6784. [PubMed] [DOI] |
| 14. | Ghaznavi H, Soheili Z, Samiei S, Soltanpour MS. Role of Hyperhomocysteinemia and Methylene Tetrahydrofolate Reductase C677T Polymorphism in Idiopathic Portal Vein Thrombosis. Vasc Specialist Int. 2016;32:6-10. [PubMed] [DOI] |
| 15. | Chawla YK, Bodh V. Portal vein thrombosis. J Clin Exp Hepatol. 2015;5:22-40. [PubMed] [DOI] |
| 17. | 韩 建波, 易 永祥, 丁 海, 刘 俊卯, 张 郁峰, 胡 亮, 赵 亮, 刘 涛. 门静脉高压症脾切断流术后门静脉血栓的术前相关危险因素分析. 中华肝脏病杂志. 2014;22:739-7743. |
| 18. | 吴 婷婷, 吴 志勇. 门静脉高压症术后门静脉血栓形成机制的新认识. 中华普通外科学文献(电子版). 2012;6:99-102. |
| 21. | Garcia-Pagán JC, Hernández-Guerra M, Bosch J. Extrahepatic portal vein thrombosis. Semin Liver Dis. 2008;28:282-292. [PubMed] |
| 22. | Trebicka J, Strassburg CP. Etiology and Complications of Portal Vein Thrombosis. Viszeralmedizin. 2014;30:375-380. [PubMed] [DOI] |
| 23. | Basit SA, Stone CD, Gish R. Portal vein thrombosis. Clin Liver Dis. 2015;19:199-221. [PubMed] [DOI] |
| 24. | Berzigotti A, García-Criado A, Darnell A, García-Pagán JC. Imaging in clinical decision-making for portal vein thrombosis. Nat Rev Gastroenterol Hepatol. 2014;11:308-316. [PubMed] [DOI] |
| 25. | 王 艳华, 王 涌臻. 彩色多普勒在门静脉高压脾切除术后门静脉血栓形成中的诊断价值. 中国中西医结合外科杂志. 2014;20:624-625. |
| 28. | 王 博, 李 卫校, 翟 水亭. 门静脉血栓的诊疗策略. 中国血管外科杂志(电子版). 2015;7:223-225. |
| 31. | Qi X, Han G, Wang J, Wu K, Fan D. Degree of portal vein thrombosis. Hepatology. 2010;51:1089-1090. [PubMed] [DOI] |
| 32. | Weber A, Krebs S, Lenhardt C, Wagenpfeil S, Schmid RM, Schulte-Frohlinde E. Correlation of routinely used coagulation parameters and presence of portal vein thrombosis in patients with liver cirrhosis. Hepatol Res. 2009;39:882-887. [PubMed] [DOI] |
| 33. | Kapoor S, Pal S, Sahni P, Chattopadhyay TK. Thromboelastographic evaluation of coagulation in patients with extrahepatic portal vein thrombosis and non-cirrhotic portal fibrosis: a pilot study. J Gastroenterol Hepatol. 2009;24:992-997. [PubMed] [DOI] |
| 34. | Hall TC, Garcea G, Metcalfe M, Bilku D, Dennison AR. Management of acute non-cirrhotic and non-malignant portal vein thrombosis: a systematic review. World J Surg. 2011;35:2510-2520. [PubMed] [DOI] |
| 35. | Maruyama H, Okugawa H, Takahashi M, Yokosuka O. De novo portal vein thrombosis in virus-related cirrhosis: predictive factors and long-term outcomes. Am J Gastroenterol. 2013;108:568-574. [PubMed] [DOI] |
| 36. | Qi X, Han G, Fan D. Management of portal vein thrombosis in liver cirrhosis. Nat Rev Gastroenterol Hepatol. 2014;11:435-446. [PubMed] [DOI] |
| 37. | 罗 乾坤, 秦 涛, 刘 传江, 胡 明星, 王 玉柱, 付 强, 张 宏伟. 华法林与低分子肝素联合应用预防门脉高压脾切断流术后门静脉血栓形成的临床治疗分析. 中国实用医刊. 2015;42:47-49. |
| 38. | 蒋 国庆, 柏 斗胜, 钱 建军, 陈 平, 姚 捷, 金 圣杰, 杨 逵生. 华法林防治改良腹腔镜脾切除联合贲门周围血管断流术后门静脉血栓的临床疗效. 中华消化外科杂志. 2016;15:71-74. |
| 40. | 伏 志, 王 鑫, 张 媛媛, 张 静, 王 璐, 吴 晓峰, 臧 运金, 林 栋栋. 经静脉尿激酶溶栓在治疗门静脉高压症脾切除术后门静脉血栓的疗效观察. 医学研究杂志. 2015;44:107-109. |
| 41. | Martinez M, Tandra A, Vuppalanchi R. Treatment of acute portal vein thrombosis by nontraditional anticoagulation. Hepatology. 2014;60:425-426. [PubMed] [DOI] |
| 43. | Naeshiro N, Aikata H, Hyogo H, Kan H, Fujino H, Kobayashi T, Fukuhara T, Honda Y, Nakahara T, Ohno A. Efficacy and safety of the anticoagulant drug, danaparoid sodium, in the treatment of portal vein thrombosis in patients with liver cirrhosis. Hepatol Res. 2015;45:656-662. [PubMed] [DOI] |
| 46. | 林 栋栋, 卢 实春, 刘 晋宁, 王 孟龙, 张 劲光, 伏 志, 张 振, 朱 岳, 李 宁. 门静脉插管防治脾切除断流术后门静脉血栓形成. 首都医科大学学报. 2007;28:26-28. |
| 47. | Kawanaka H, Akahoshi T, Itoh S, Iguchi T, Harimoto N, Uchiyama H, Yoshizumi T, Shirabe K, Takenaka K, Maehara Y. Optimizing risk stratification in portal vein thrombosis after splenectomy and its primary prophylaxis with antithrombin III concentrates and danaparoid sodium in liver cirrhosis with portal hypertension. J Am Coll Surg. 2014;219:865-874. [PubMed] [DOI] |
| 48. | Zhang Y, Wen TF, Yan LN, Yang HJ, Deng XF, Li C, Wang C, Liang GL. Preoperative predictors of portal vein thrombosis after splenectomy with periesophagogastric devascularization. World J Gastroenterol. 2012;18:1834-1839. [PubMed] [DOI] |
| 49. | Borensztajn K, Stiekema J, Nijmeijer S, Reitsma PH, Peppelenbosch MP, Spek CA. Factor Xa stimulates proinflammatory and profibrotic responses in fibroblasts via protease-activated receptor-2 activation. Am J Pathol. 2008;172:309-320. [PubMed] [DOI] |
| 50. | Shi J, Hao JH, Ren WH, Zhu JR. Effects of heparin on liver fibrosis in patients with chronic hepatitis B. World J Gastroenterol. 2003;9:1611-1614. [PubMed] [DOI] |