修回日期: 2016-08-15
接受日期: 2016-08-23
在线出版日期: 2016-10-08
探讨微小RNA(microRNA, miR)-138-5p对胰腺癌(pancreatic cancer, PC)细胞增殖能力的影响.
分别构建稳定表达的lv-miR-138-U、lv-miR-138-KD以及lv-NC慢病毒载体, 并将慢病毒表达载体分别感染人PC细胞株PANC-1以及Capan-2; 将感染后的PC细胞在体外分别采用CCK-8实验、平板克隆实验以及EdU实验检测miR-138-5p对PC细胞增殖能力的影响; 并在体内建立裸鼠皮下成瘤模型, 模拟体内环境中miR-138-5p对PC细胞增殖能力的影响.
成功地构建了重组慢病毒表达载体, 并成功感染PC细胞株PANC-1和Capan-2; CCK-8、平板克隆以及EdU实验结果均提示lv-miR-138-U组较lv-NC组增殖能力明显减弱(P<0.05), 而lv-miR-138-KD组较lv-NC组增殖能力明显增强(P<0.05); 体内裸鼠皮下成瘤实验显示, 过表达miR-138-5p可以抑制PC细胞皮下成瘤的能力.
miR-138-5p可以抑制人PC细胞的增殖, 为PC的治疗提供了潜在的治疗靶点.
核心提要: 微小RNA(microRNA, miR)-138-5p在胰腺癌(pancreatic cancer, PC)中低表达, 且与PC细胞增殖能力相关, miR-138-5p可能扮演抑癌基因的角色抑制PC细胞的增殖.
引文著录: 王杰, 喻超, 周显飞, 江建新. MiRNA-138-5p抑制人胰腺癌细胞增殖能力. 世界华人消化杂志 2016; 24(28): 3970-3977
Revised: August 15, 2016
Accepted: August 23, 2016
Published online: October 8, 2016
To investigate the effect of microRNA-138-5p (miR-138-5p) on the proliferation of pancreatic cancer (PC) cells.
We constructed lentiviral vectors for miR-138-5p overexpression or knockdown and a negative control lentiviral vector, and transfected them into human PC cell lines PANC-1 and Capan-2. Cell counting kit-8 assay (CCK-8), colony-forming assay and EdU incorporation assay were employed to detect cell proliferation in vitro. The PANC-1 and Capan-2 cells were implanted subcutaneously in Balb/c nude mice to detect cell proliferation in vivo.
Lentiviral vectors were successfully constructed and transfected. CCK-8 assay, colony-forming assay and EdU incorporation assay showed that overexpression of miR-138-5p inhibited cell proliferation compared with the negative control (P < 0.05), while miR-138-5p knockdown promoted cell proliferation compared with the negative control (P < 0.05). In addition, miR-138-5p suppressed tumor growth in the subcutaneous xenograft model of human PC cells in Balb/c nude mice.
Our results indicate that miR-138-5p inhibits the proliferation of PC cells, suggesting a potential new therapeutic agent for PC.
- Citation: Wang J, Yu C, Zhou XF, Jiang JX. MiRNA-138-5p inhibits proliferation of pancreatic cancer cells. Shijie Huaren Xiaohua Zazhi 2016; 24(28): 3970-3977
- URL: https://www.wjgnet.com/1009-3079/full/v24/i28/3970.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i28.3970
胰腺癌(pancreatic cancer, PC)是当前最致命的消化系恶性肿瘤之一, 在美国其致死率在所有恶性肿瘤中占第4位[1]. 而在我国, 随着生活、社会环境的变化, PC的患病率开始逐年上升[2]. PC早期不易诊断, 恶性程度高, 预后能力差, 对放化疗治疗不敏感, 故死亡率极高, 据统计PC的5年生存率不足5%[3,4]. 然而miRNA的异常表达与PC肿瘤的发生、发展密切相关, 有望成为PC诊治的新靶点[5]. 研究[6-8]表明, miRNA在细胞的正常生命周期中发挥至关重要的作用. miR-138-5p在多种肿瘤细胞(如结肠癌、尤文肉瘤、肾癌、黑色素瘤)中呈低表达, 上调miR-138-5p能抑制肿瘤细胞的增殖[9-12]. 我们前期研究[13]表明miR-138-5p在PC中呈低表达. 本研究前期已成功构建lv-miR-138-5p并已验证感染效率[13], 本次实验通过体内体外两方面分别验证miR-138-5p对PC细胞增殖的影响, 为深入探讨其机制提供一定的理论基础.
1.1.1 细胞株和制剂: 人PC细胞系购自美国ATCC细胞库; 慢病毒载体由上海吉凯公司负责包装和构建; CCK-8试剂盒购自日本同仁化学研究所; Cell-LightTM EdU Apollo® 567 In Vitro Imaging Kit购自广州锐博生物科技有限公司; Ki67抗体购自美国CST公司.
1.1.2 动物: Balb/c nude mice(免疫缺陷小鼠)购自北京华阜康生物科技股份有限公司, ♀, 周龄4 wk, 体质量14-15 g.
1.2.1 细胞培养和分组: PC细胞Capan-2采用RPMI 1640培养基(含10%FBS), 置于37 ℃、50 mL/L CO2恒温培养箱培养, PANC-1采用高糖DMEM培养基(含10%FBS), 置于37 ℃、50 mL/L CO2恒温培养箱培养. 待其贴壁生长至70%-80%融合时, 用0.05%胰酶消化传代培养. 按慢病毒感染手册感染PC细胞. 实验分3组: lv-NC组、过表达组lv-miR-138-U以及抑制组lv-miR-138-KD.
1.2.2 CCK-8检测miR-138-5p对PC细胞增殖活性的影响: 制备细胞悬液, 调整细胞密度为1×105个/mL; 接种到96孔板中, 每孔约100 μL细胞悬液, 每个样约5个副孔; 分别于24、48、72、96 h加入含10%CCK8的培养液; 培养3 h, 测定波长为450 nm时每孔的吸光度.
1.2.3 Edu检测miR-138-5p对PC细胞增殖能力的影响: 细胞转染48 h后, 换用50 μmol/L EdU培养液孵育2 h, 4%多聚甲醛室温固定30 min. 按照Cell-LightTM EdU Apollo® 567 In Vitro Imaging Kit说明书步骤染色. 染色完成后荧光显微镜观察并拍照记录, 重复3次实验, 计算Apollo染色阳性细胞与Hoechst染色阳性细胞的比值.
1.2.4 平板克隆实验检测miR-138-5p对PC细胞克隆形成的影响: 收集对数生长期细胞, 调整细胞悬液浓度为1×103个/mL, 于六孔板中种植2000个细胞, 37 ℃培养箱中培养7-8 d后40 g/L多聚甲醛固定30 min, 0.1%结晶紫染色30 min, 计数每孔克隆形成数量并拍照记录.
1.2.5 裸鼠皮下成瘤模型检测miR-138-5p对PC细胞体内成瘤的影响: 将裸鼠随机分成两组: 阴性对照组(lv-NC组)与过表达组(lv-miR-138-U组). 分别收集对数生长期稳定表达的细胞, 用PBS重悬后弃上清, 再将PBS与Matrigel按1:1体积混合, 用混合液重悬调整细胞浓度为1×107个/mL. 于每只裸鼠的右后腿部皮下注射200 μL细胞悬液. 在相同条件下(间断12 h光照与黑暗, 自由进食等)饲养6 wk, 观察1次/wk裸鼠, 并做好相应记录(体质量、肿瘤大小). 6 wk后采用颈部脱臼法处死裸鼠, 解剖裸鼠取出肿瘤并拍照记录.
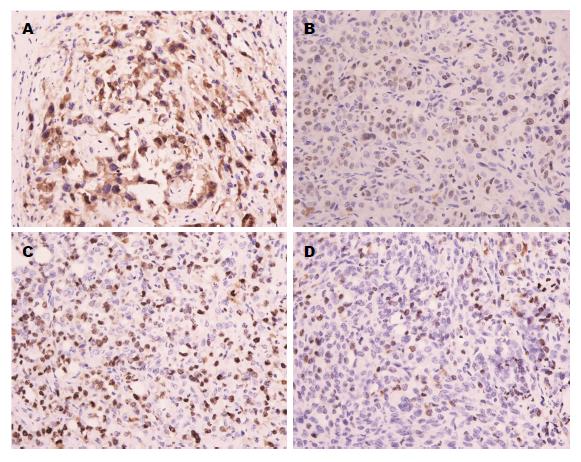
1.2.6 免疫组织化学法检测裸鼠肿瘤相关增殖指标的变化: 将解剖的裸鼠肿瘤组织用40 g/L多聚甲醛固定, 石蜡包埋, HE染色; 将细胞增殖相关蛋白Ki67按1:400稀释后染色. 每组肿瘤切片随机选取5张切片, 每张切片随机选取5个视野, 观察并拍照记录.
统计学处理 采用SPSS19.0对实验数据进行分析、整理, 计量资料采用mean±SD, 两组间分析采用t检验, 各组间差异采用单因素方差分析(One-Way ANOVA), P<0.05为差异具有统计学意义.
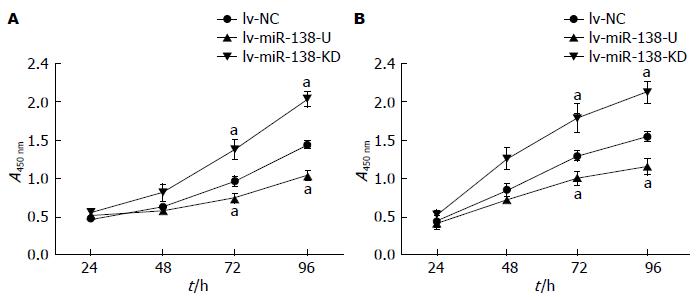
CCK-8结果显示, 当培养72 h和96 h后, lv-miR-138-U组细胞增殖活性为PANC-1: 72 h: 0.75±0.06, 96 h: 1.04±0.07; Capan-2: 72 h: 1.00±0.05, 96 h: 1.16±0.05; lv-NC组增殖活性为PANC-1: 72 h: 0.97±0.07, 96 h: 1.44±0.05; Capan-2: 72 h: 1.30±0.03, 96 h: 1.56±0.04; lv-miR-138-KD组增殖活性为PANC-1: 72 h: 1.38±0.06, 96 h: 2.04±0.05; Capan-2: 72 h: 1.80±0.09, 96 h: 2.14±0.07; lv-miR-138-U组较lv-NC组增殖活性明显减弱, 而lv-miR-138-KD较lv-NC组增殖活性明显增强, 差异均有统计学意义(P<0.05)(图1).
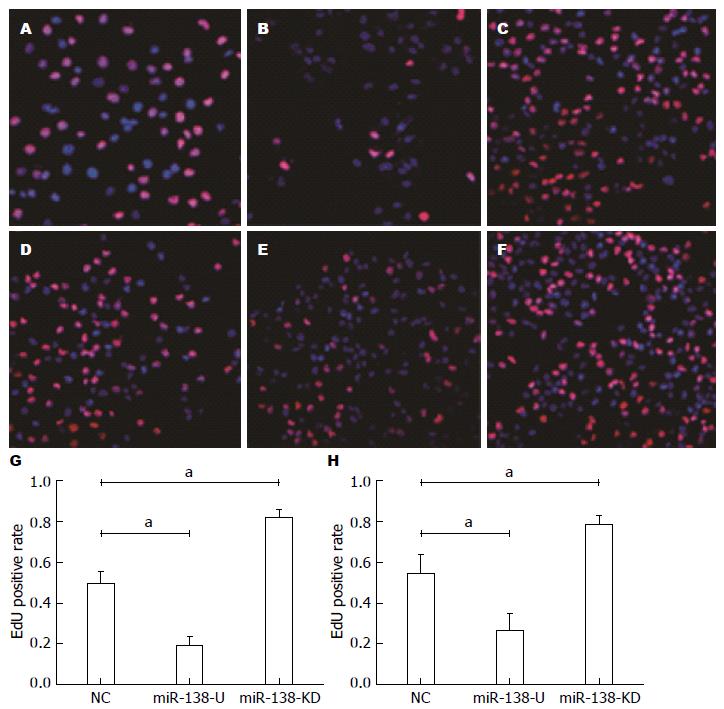
EdU实验结果显示: Apollo染色阳性细胞与Hoechst染色阳性细胞比值分别为lv-miR-138-U组: PANC-1: 0.27±0.05; Capan-2: 0.19±0.02; lv-NC组: PANC-1: 0.55±0.05; Capan-2: 0.50±0.03; miR-138-KD组: PANC-1: 0.79±0.03; Capan-2: 0.82±0.02; lv-miR-138-U较lv-NC组增殖能力明显减弱, 而lv-miR-138-KD较lv-NC组增殖能力明显增强, 差异均有统计学意义(P<0.05)(图2).
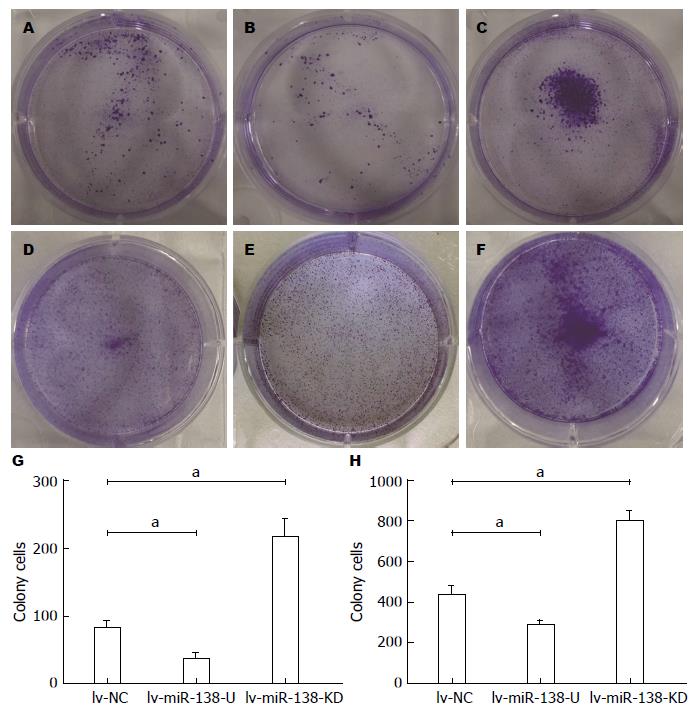
平板克隆实验结果显示: 集落形成数量分别为; lv-miR-138-U组: PANC-1: 39.67±3.28; Capan-2: 292.70±11.35; lv-NC组: PANC-1: 84.33±5.21; Capan-2: 441.30±24.23; lv-miR-139-KD: PANC-1: 218.00±14.57; Capan-2: 797.70±29.87; lv-miR-138-U组较lv-NC组集落形成数量明显减少, 而lv-miR-138-KD组较lv-NC组集落形成数量明显增多, 差异均有统计学意义(P<0.05)(图3).
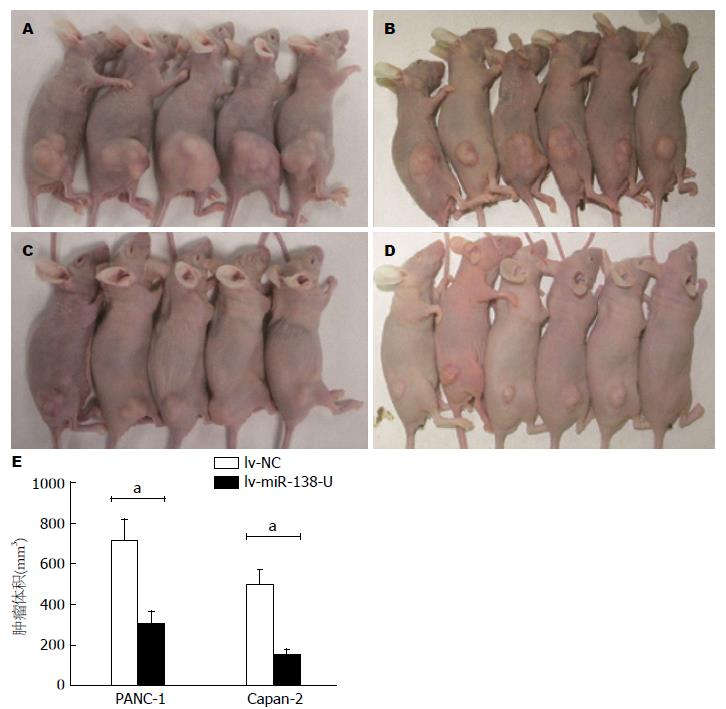
裸鼠饲养6 wk后, 取出肿瘤, 通过测定肿瘤体积(mm3), 肿瘤体积分别为lv-miR-138-U组: PANC-1: 297.2±27.77; Capan-2: 158.20±10.76; lv-NC组: PANC-1: 700.40±44.34; Capan-2: 480.20±31.09; lv-miR-138-U组较lv-NC组肿瘤体积明显变小, 差异均有统计学意义(P<0.05)(图4).
免疫组织化学结果显示: lv-miR-138-U组Ki67的表达量明显低于lv-NC组(图5).
MicroRNA是一组由19-22个核苷酸组成的内源性非编码小RNA, 他能通过与靶mRNA的3'UTR特异性结合, 在转录后水平调控基因的表达[6-8]. MiRNA的异常表达与疾病的进展及演变乃至肿瘤形成都密切相关, 且扮演了重要的角色[14].
据报道miR-138在众多肿瘤组织中低表达, 其中包括结肠癌、头颈部鳞状细胞癌、肺癌以及胆管癌[15-18]. 仅有少数研究[19]显示miR-138能够促进肿瘤的生长. miR-138被誉是一种抑癌基因, 当下调miR-138的表达, 结肠癌的淋巴转移增强, 远处转移增多, 预后不良. 但高表达的miR-138能在体内体外实验中抑制结肠癌的侵袭转移和增殖能力[15]. 已有文献报道, miR-138能通过作用于"癌蛋白"YAP1, 他是Hippo信号通路下游的重要调控蛋白, 主要参与细胞的生长、增殖、修复及内环境的稳定, 异常表达的YAP1促进多种肿瘤的增殖, 而miR-138通过抑制其表达从而抑制肺小细胞癌的增殖能力[19]. Liu等[20]采用双荧光素酶报告分析确定SOX9是miR-138直接作用的靶蛋白, 并采用qRT-PCR和Western bolt证实过表达的miR-138能抑制SOX9的表达, 上调miR-138或者下调SOX9的表达均能抑制肝癌细胞的增殖. Jiang等[21]通过一系列体外实验表明miR-138能抑制骨肉瘤细胞的增殖, 同样采用双荧光素酶报告确定DEC2是miR-138直接作用的靶蛋白, 参与调控骨肉瘤的增殖. 在宫颈癌与胆囊癌的报道中, Li等[22]和Ma等[23]分别证实miR-138能够通过调控c-Met和Bag-1抑制宫颈癌和恶性黑色素瘤的增殖. 在PC中, miR-138相关报道较少, 其靶基因并不明确, 我们前期研究[13]表明miR-138-5p在PC中低表达, 并可能通过EMT途径参与调控PC细胞的侵袭转移. 为了进一步探讨miR-138-5p影响PC细胞增殖的作用机制, 我们课题组从生物信息网站(TargetScan等)预测并筛选出FOXC1基因. 转录因子叉头框蛋白C1(forkhead box C1, FOXC1)主要参与中胚层的发育, 也有研究表明FOXC1与乳腺癌[24-26]、垂体瘤[27]、卵巢癌[28]的发生发展有关. FOXC1在PC中的报道甚少, 我们前期通过研究[29]证实沉默FOXC1能抑制PC细胞的增殖, 其部分机制可能通过调控周期蛋白Cyclin D1的表达而影响增殖. miR-138-5p的直接作用靶蛋白是否是FOXC1还需进一步实验证实. 另一方面, 影响PC细胞增殖的主要信号通路包括MAPK通路[30]、Hedgehog通路[31]、PI3K/AKT通路[32]等, miR-138-5p是否参与激活上述通路影响PC细胞增殖还需进一步实验探究.
为了研究miR-138-5p对PC增殖能力是否有影响, 本课题组分别从体外、体内两方面进行着手研究, 体外采用CCK-8实验证实miR-138-5p能够减弱PC细胞的增殖活性; EdU实验证实miR-138-5p能减弱PC细胞的增殖能力、平板克隆实验证实miR-138-5p能减少集落形成的数量. 进一步采用裸鼠皮下成瘤实验证实miR-138-5p能明显抑制肿瘤生长. 故可以得出结论, miR-138-5p与PC细胞增殖能力相关, 且可能扮演抑癌基因的角色抑制PC细胞的增殖.
总之, 本研究发现miR-138-5p在PC中是作为抑癌基因形式存在, 能显著抑制PC细胞的体外增殖以及体内成瘤, 这为进一步深入探究其机制提供了理论基础, 有望成为PC诊治的新靶点.
胰腺癌(pancreatic cancer, PC)是一种高度恶性的消化系肿瘤, 其发病率逐年上升, 早期不易诊断, 治疗及预后效果极差是导致高死亡率的关键因素. miRNA参与肿瘤的发生发展, 研究miRNA与肿瘤的发病机制对治疗PC具有重要意义.
李刚, 教授, 北京大学医学部生物化学与分子生物学系; 吴道澄, 教授, 西安交通大学生命学院
miR-138在众多肿瘤中扮演抑癌基因的角色, 抑制肿瘤细胞的增殖、侵袭以及转移等. 而miR-138-5p在PC中很少报道, 深入研究miR-138-5p在PC中的作用以及机制可进一步对PC的治疗提供理论基础.
有研究报道, miR-138的异常表达可促进肿瘤的增殖和侵袭. 过表达miR-138后与其直接相关的目的靶基因SOX9、DEC2、c-Met等的表达受到抑制, 肿瘤增殖能力减弱.
PC的相关文献报道中, miR-138的研究甚少, 其作用机制仍不清楚, 本实验主要探讨miR-138-5p对PC细胞增殖是否有影响, 为进一步探讨相关机制提供理论基础.
本研究发现, miR-138-5p在PC中是一种抑癌基因, 其过表达能抑制PC细胞增殖, 为PC的治疗提供新的治疗靶点.
微小RNA(miRNA): 是一组由19-22个核苷酸组成的内源性非编码小RNA, 他能通过与靶mRNA的3'UTR特异性结合, 在转录后水平调控基因的表达, 参与细胞正常的生命周期及肿瘤的发生与发展.
本文立意清晰, 实验方法成熟, 所得结果明确, 具有一定的学术价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 贵州省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:胡珊
| 1. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012. CA Cancer J Clin. 2012;62:10-29. [PubMed] [DOI] |
| 2. | Xu Y, An Y, Wang X, Zha W, Li X. Inhibition of the Hedgehog pathway induces autophagy in pancreatic ductal adenocarcinoma cells. Oncol Rep. 2014;31:707-712. [PubMed] [DOI] |
| 3. | Hidalgo M. Pancreatic cancer. N Engl J Med. 2010;362:1605-1617. [PubMed] [DOI] |
| 4. | Schultz NA, Dehlendorff C, Jensen BV, Bjerregaard JK, Nielsen KR, Bojesen SE, Calatayud D, Nielsen SE, Yilmaz M, Holländer NH. MicroRNA biomarkers in whole blood for detection of pancreatic cancer. JAMA. 2014;311:392-404. [PubMed] [DOI] |
| 5. | Szafranska AE, Davison TS, John J, Cannon T, Sipos B, Maghnouj A, Labourier E, Hahn SA. MicroRNA expression alterations are linked to tumorigenesis and non-neoplastic processes in pancreatic ductal adenocarcinoma. Oncogene. 2007;26:4442-4452. [PubMed] [DOI] |
| 7. | He L, Hannon GJ. MicroRNAs: small RNAs with a big role in gene regulation. Nat Rev Genet. 2004;5:522-531. [PubMed] [DOI] |
| 8. | Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 2004;116:281-297. [PubMed] |
| 9. | Zhao L, Yu H, Yi S, Peng X, Su P, Xiao Z, Liu R, Tang A, Li X, Liu F. The tumor suppressor miR-138-5p targets PD-L1 in colorectal cancer. Oncotarget. 2016; May 27. [Epub ahead of print]. [PubMed] [DOI] |
| 10. | Tanaka K, Kawano M, Itonaga I, Iwasaki T, Miyazaki M, Ikeda S, Tsumura H. Tumor suppressive microRNA-138 inhibits metastatic potential via the targeting of focal adhesion kinase in Ewing's sarcoma cells. Int J Oncol. 2016;48:1135-1144. [PubMed] [DOI] |
| 11. | Yamasaki T, Seki N, Yamada Y, Yoshino H, Hidaka H, Chiyomaru T, Nohata N, Kinoshita T, Nakagawa M, Enokida H. Tumor suppressive microRNA138 contributes to cell migration and invasion through its targeting of vimentin in renal cell carcinoma. Int J Oncol. 2012;41:805-817. [PubMed] [DOI] |
| 12. | Chen Y, Cao KE, Wang S, Chen J, He B, He GU, Chen Y, Peng B, Zhou J. MicroRNA-138 suppresses proliferation, invasion and glycolysis in malignant melanoma cells by targeting HIF-1α. Exp Ther Med. 2016;11:2513-2518. [PubMed] [DOI] |
| 13. | Yu C, Wang M, Chen M, Huang Y, Jiang J. Upregulation of microRNA1385p inhibits pancreatic cancer cell migration and increases chemotherapy sensitivity. Mol Med Rep. 2015;12:5135-5140. [PubMed] [DOI] |
| 14. | Tétreault N, De Guire V. miRNAs: their discovery, biogenesis and mechanism of action. Clin Biochem. 2013;46:842-845. [PubMed] [DOI] |
| 15. | Long L, Huang G, Zhu H, Guo Y, Liu Y, Huo J. Down-regulation of miR-138 promotes colorectal cancer metastasis via directly targeting TWIST2. J Transl Med. 2013;11:275. [PubMed] [DOI] |
| 16. | Wong TS, Liu XB, Wong BY, Ng RW, Yuen AP, Wei WI. Mature miR-184 as Potential Oncogenic microRNA of Squamous Cell Carcinoma of Tongue. Clin Cancer Res. 2008;14:2588-2592. [PubMed] [DOI] |
| 17. | Wang Q, Tang H, Yin S, Dong C. Downregulation of microRNA-138 enhances the proliferation, migration and invasion of cholangiocarcinoma cells through the upregulation of RhoC/p-ERK/MMP-2/MMP-9. Oncol Rep. 2013;29:2046-2052. [PubMed] [DOI] |
| 18. | Seike M, Goto A, Okano T, Bowman ED, Schetter AJ, Horikawa I, Mathe EA, Jen J, Yang P, Sugimura H. MiR-21 is an EGFR-regulated anti-apoptotic factor in lung cancer in never-smokers. Proc Natl Acad Sci USA. 2009;106:12085-12090. [PubMed] [DOI] |
| 19. | Xiao L, Zhou H, Li XP, Chen J, Fang C, Mao CX, Cui JJ, Zhang W, Zhou HH, Yin JY. MicroRNA-138 acts as a tumor suppressor in non small cell lung cancer via targeting YAP1. Oncotarget. 2016; May 19. [Epub ahead of print]. [PubMed] [DOI] |
| 20. | Liu Y, Zhang W, Liu K, Liu S, Ji B, Wang Y. miR-138 suppresses cell proliferation and invasion by inhibiting SOX9 in hepatocellular carcinoma. Am J Transl Res. 2016;8:2159-2168. [PubMed] |
| 21. | Jiang B, Mu W, Wang J, Lu J, Jiang S, Li L, Xu H, Tian H. MicroRNA-138 functions as a tumor suppressor in osteosarcoma by targeting differentiated embryonic chondrocyte gene 2. J Exp Clin Cancer Res. 2016;35:69. [PubMed] [DOI] |
| 22. | Li B, Yang XX, Wang D, Ji HK. MicroRNA-138 inhibits proliferation of cervical cancer cells by targeting c-Met. Eur Rev Med Pharmacol Sci. 2016;20:1109-1114. [PubMed] |
| 23. | Ma F, Zhang M, Gong W, Weng M, Quan Z. MiR-138 Suppresses Cell Proliferation by Targeting Bag-1 in Gallbladder Carcinoma. PLoS One. 2015;10:e0126499. [PubMed] [DOI] |
| 24. | Ray PS, Wang J, Qu Y, Sim MS, Shamonki J, Bagaria SP, Ye X, Liu B, Elashoff D, Hoon DS. FOXC1 is a potential prognostic biomarker with functional significance in basal-like breast cancer. Cancer Res. 2010;70:3870-3876. [PubMed] [DOI] |
| 25. | Ray PS, Bagaria SP, Wang J, Shamonki JM, Ye X, Sim MS, Steen S, Qu Y, Cui X, Giuliano AE. Basal-like breast cancer defined by FOXC1 expression offers superior prognostic value: a retrospective immunohistochemical study. Ann Surg Oncol. 2011;18:3839-3847. [PubMed] [DOI] |
| 26. | Wang J, Ray PS, Sim MS, Zhou XZ, Lu KP, Lee AV, Lin X, Bagaria SP, Giuliano AE, Cui X. FOXC1 regulates the functions of human basal-like breast cancer cells by activating NF-κB signaling. Oncogene. 2012;31:4798-4802. [PubMed] [DOI] |
| 27. | Wang DS, Zhang HQ, Zhang B, Yuan ZB, Yu ZK, Yang T, Zhang SQ, Liu Y, Jia XX. miR-133 inhibits pituitary tumor cell migration and invasion via down-regulating FOXC1 expression. Genet Mol Res. 2016;15. [PubMed] [DOI] |
| 28. | Wang LY, Li LS, Yang Z. Correlation of FOXC1 protein with clinicopathological features in serous ovarian tumors. Oncol Lett. 2016;11:933-938. [PubMed] [DOI] |
| 30. | Ji S, Qin Y, Shi S, Liu X, Hu H, Zhou H, Gao J, Zhang B, Xu W, Liu J. ERK kinase phosphorylates and destabilizes the tumor suppressor FBW7 in pancreatic cancer. Cell Res. 2015;25:561-573. [PubMed] [DOI] |
| 31. | Bai Y, Bai Y, Dong J, Li Q, Jin Y, Chen B, Zhou M. Hedgehog Signaling in Pancreatic Fibrosis and Cancer. Medicine (Baltimore). 2016;95:e2996. [PubMed] [DOI] |