修回日期: 2016-04-23
接受日期: 2016-05-03
在线出版日期: 2016-05-28
目的: 探讨宝石能谱CT碘定量量化分析在结直肠癌肝脏小转移(<3 cm)中的临床价值.
方法: 所有915例肝占位患者采用宝石能谱CT行双期增强扫描, 140例诊断为肝转移. 在工作站上重建为最佳单能量图像, 分析<3 cm的转移性肝肿瘤的病灶检出率. 对其中41例结直肠癌的106个病灶进行回顾性分析, 分别在CT图和碘基图上测量病灶中心、病灶边缘、正常肝组织的动脉期和静脉期的CT值和碘基值. 比较分析病灶边缘、病灶中心及正常肝组织的CT值和碘基值的差异, 探讨能谱CT碘定量量化分析的临床价值.
结果: 对于小转移瘤的病灶检出率上, 最佳单能量图像优于传统CT混合能量图像(Z = 3.306, P = 0.001). 动脉期病灶边缘部分较中心部分CT值升高37.65%, 而碘值升高65.95%, 差异具有显著地统计学意义(P<0.001). 正常肝组织较病灶边缘部分CT值升高22.99%, 而碘值升高17.96%, 无明显统计学意义(P = 0.225). 静脉期病灶边缘部分较中心部分CT值升高32.13%, 而碘值升高40.01%, 具有显著地统计学差异(P<0.001). 正常肝组织较病灶边缘部分CT值升高34.47%, 而碘值升高40.92%, 差异具有显著地统计学意义(P<0.001).
结论: 能谱CT的碘定量分析可能有利于提高小病灶的检出率, 有助于显示结直肠癌转移性肝肿瘤强化特征, 有利于提高对转移性病灶诊断的准确率.
核心提示: 通过能谱CT碘的定量分析对微小结直肠癌转移病灶的特点分析, 能谱CT碘的定量分析能在很大程度上直观和全面体现结直肠癌转移性肝肿瘤强化特征, 有利于提高对转移性病灶诊断的准确率和小病灶的检出率.
引文著录: 冯琴, 李琼, 胡瑶, 王秋霞, 胡道予, 李震. 小结直肠癌肝转移: 能谱CT碘定量量化增强特点. 世界华人消化杂志 2016; 24(15): 2421-2428
Revised: April 23, 2016
Accepted: May 3, 2016
Published online: May 28, 2016
AIM: To retrospectively assess the diagnostic value of quantitative iodine-based material decomposition images of spectral CT in evaluating small liver metastases (<3 cm) from colorectal cancer.
METHODS: Nine hundred and fifteen consecutive patients with liver lesions were recruited, and 140 of them were confirmed to have metastatic liver cancer. All the patients underwent double-phase [arterial phase (AP) and portal venous phase (PVP)] spectral CT scans and the best single energy images were obtained at the workstation. Fifteen different sources of small metastatic liver lesions (<3 cm) were analyzed, and the diagnosis rate was compared between the best single energy images and traditional images. The final study group included 41 patients with hepatic metastases from colorectal cancer. Iodine concentrations and CT values of normal liver parenchyma and metastatic lesions were derived from iodine-based material-decomposition CT or conventional CT images. The differences in iodine concentration and CT values between the AP and PVP were recorded and the lesion-to-normal liver parenchyma differences were calculated. The paired t-test was employed to compare CT value and iodine concentrations between AP and PVP. Two readers qualitatively assessed lesion types on the basis of conventional CT characteristics. The two-sample t-test was performed to compare the iodine concentrations and CT values changes between AP and PVP in normal liver parenchyma and metastatic lesions (central and marginal).
RESULTS: Compared with traditional CT hybrid energy images, the detection rate of small metastases was much higher by spectral CT images (Wilcoxon sighed-rank test Z = 3.306, P = 0.001). In the AP, comparing the marginal with the central parts of the lesions, the CT values increased by 37.65% while the iodine value increased by 65.95%, and there was a significant difference between them (P < 0.001). Comparing normal liver tissues with the marginal parts of the lesions, the CT values increased by 22.99% while the iodine value increased by 17.96%, and there was no significant difference between them (P = 0.225). In the PVP, comparing the marginal with the central parts of the lesions, the CT values increased by 32.13% while the iodine value increased by 40.01%, and the difference was significant (P < 0.001). Comparing normal liver tissues with the marginal parts of the lesions, the CT values increased by 34.47% while the iodine value increased by 40.92%, and the difference was significant (P = 0.033).
CONCLUSION: Quantitative CT iodine value analysis may be able to improve the detection rate of small lesions, and it can display the enhancement features of colorectal cancer liver metastases. This technique may help to improve the diagnostic accuracy of small metastatic lesions.
- Citation: Feng Q, Li Q, Hu Y, Wang QX, Hu DY, Li Z. Small colorectal cancer liver metastases: Clinical value of quantitative iodine-based material decomposition images of spectral CT. Shijie Huaren Xiaohua Zazhi 2016; 24(15): 2421-2428
- URL: https://www.wjgnet.com/1009-3079/full/v24/i15/2421.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i15.2421
结直肠癌肝转移是肝脏最常见的转移性肿瘤之一, 对于转移灶的定性及定量的评估对于病变的分期和疗效评估具有重要的临床价值[1,2]. CT是目前临床上常用的诊断手段, 对于较大的典型肝转移诊断一般多无问题[3-5]. 对于小转移瘤的发现和鉴别目前临床上尚有一定的困难, 有文献报道对于小转移瘤的敏感性只有68%[6,7]. 因此, 提高CT对小转移瘤的诊断和鉴别能力具有重要的临床意义.
CT能谱技术的出现为肝转移的诊断和鉴别提供了新的手段和可能[6-8]. 有研究[9,10]表明, 能谱CT可以提高肿瘤病灶的检出率, 单能量图像和碘基图上的病灶显示率高于普通增强CT混合能量图像. 而碘基值和能谱曲线能够为肿瘤的诊断提供更多的参数和依据, 例如有研究表明碘定量分析有利于区别纵膈、颈部、前列腺等肿瘤的良恶性[11-14]以及鉴别肝占位和其他良性病变[15], 还有应用于甲状腺与病理对照、肺栓塞的评估及胃癌的分期[16,17]等. 但是, 目前碘基值和能谱曲线对于<3 cm的肝转移瘤的研究目前尚未见报道. 本研究选择结直肠癌肝转移患者, 进行能谱CT扫描, 探讨单能量图像、碘基值和能谱曲线对结直肠癌肝转移的诊断价值, 并与常规CT扫描结果相比较, 探讨宝石能谱CT在结直肠癌肝脏小转移瘤中的临床价值.
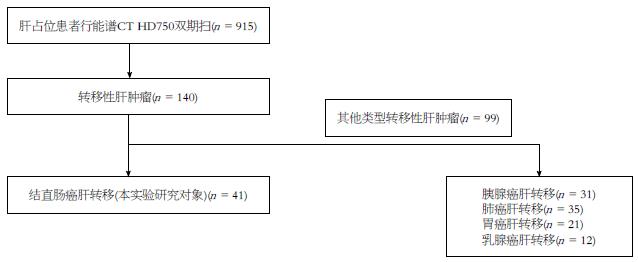
回顾性分析2012-02/2013-12在华中科技大学同济医学院附属同济医院行能谱CT(Discovery CT 750HD, GE Healthcare, Mliwaukee, USA)行肝脏双期增强检查的患者, 这些患者中具有<3 cm的肝占位结节者915例, 其中140例确诊为肝转移性肿瘤, 最终通过手术穿刺病理或者随访证实41例为结直肠癌肝转移(其中男21例, 女20例, 年龄范围在36-72岁, 平均年龄为55.8岁), 共106个病灶. 该研究获得了医院伦理委员会的批准和患者的知情同意. 患者的构成状况如图1.
1.2.1 CT检查: 所有患者均在宝石能谱CT行上腹部CT扫描, 先行常规上腹部平扫, 增强扫描采用能谱扫描模式(GSI), 螺旋扫描速度0.6 s/r, 螺距为0.983, 探测器宽度为0.625 mm×64, 电压为高低能量(140 kVp和80 kVp)瞬时高速切换, 管电流约为600 mA. 增强扫描为双期动态扫描, 对比剂为碘普胺(370 mgI/mL), 对比剂剂量范围为90-120 mL(每kg体质量使用剂量1.5 mL), 注射流率为3-4 mL/s, 采用高压注射器肘静脉注射. 动脉期扫描开始时间采用腹腔干水平腹主动脉内CT值监测(Smart Prep技术)触发扫描, 监测阈值为100 HU, 达到阈值后延迟8 s开始扫描, 门静脉期扫描开始时间为动脉期结束后30 s. 所有患者都行能谱平扫双期增强扫描[6,7], 将层厚为1.25 mm、层距为1.25 mm的动脉期和门静脉期的图像应用GSI viewer分析软件进行处理, 从扫描的能谱成像中可以重建出最佳单能量图像, 应用能谱分析软件进行分析.
1.2.2 图像分析及测量: 图像分析与测量均在工作站ADW 4.6上完成. 通过GSI viewer软件获得GSI能谱参数, 并自动重建出最佳单能量图像, 由两位影像医生(CT诊断经验分别为15年和8年)分别独立测量转移病灶数目, 并与混合能量图像比较, 两位医生意见不一致时Ð商解决. 分别在动脉期和静脉期的GSI图像上测量转移病灶中心和边缘、相对正常肝组织的CT值和碘基值, 比较他们之间的差异, 测量时ROI避开血管、钙化、坏死区域所有数据在同一层面不同位置均测量3次, 取平均值.
统计学处理 采用SPSS17.0统计学软件进行处理. 采用Wilcoxon带符号秩检验比较单能量图像和混合能量对小转移灶的检出率. 采用配对样本t检验比较单能量图像和混合能量图像对病灶和肝脏之间CT值、碘基值以及病灶的中心部分和边缘部分的CT值和碘基值及其变化百分比的差异. P<0.05为差异具有统计学意义.
表1中14种不同来源的<3 cm的转移性肝肿瘤患者, 传统CT混合能量和最佳单能量显示小病灶分别为330个和425个, 两个经Wilcoxon带符号秩检验(Z = 3.306, P = 0.001), 两者具有显著的统计学意义(表1).
| 病种 | 混合能量显示病灶个数 | 最佳单能量显示病灶个数 |
| 胰腺癌肝转移 | 62 | 73 |
| 胃癌肝转移 | 46 | 58 |
| 肺癌肝转移 | 63 | 82 |
| 乳腺癌肝转移 | 27 | 35 |
| 肝癌肝内转移 | 19 | 24 |
| 食管癌肝转移 | 10 | 15 |
| 宫颈癌肝转移 | 3 | 6 |
| 鼻咽癌肝转移 | 1 | 4 |
| 卵巢癌肝转移 | 6 | 12 |
| 膀胱癌肝转移 | 0 | 2 |
| 肾癌肝转移 | 2 | 3 |
| 恶性黑色素瘤肝转移 | 0 | 1 |
| 十二指肠腺癌肝转移 | 2 | 3 |
| 蝶窦癌肝转移 | 0 | 1 |
| 共计 | 330 | 425 |
| Z值 | 3.306 | |
| P值 | 0.001 |
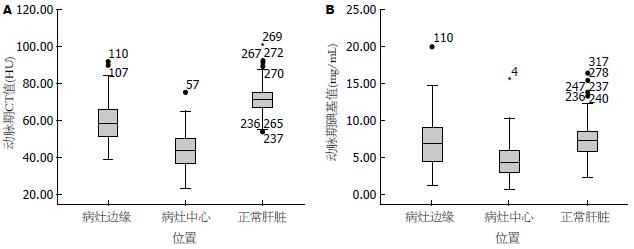
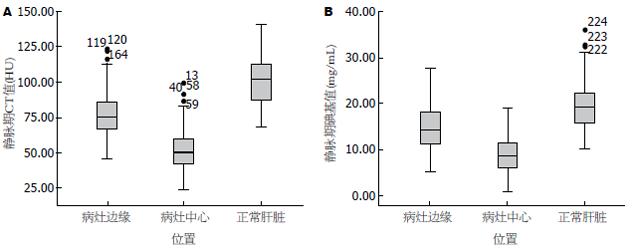
分别在动脉期和静脉期的GSI图像上测量转移病灶中心和边缘的CT值和碘基值(图2, 3), 比较碘基值和CT值在检测肿瘤结节强化百分比的差异(表2): 动脉期边缘CT值较肿瘤中心高37.65%, 碘基值高65.95, t = 3.936, P = 0.000, 碘基值升高的百分比明显高于CT值升高的百分比, 差异有统计学意义; 静脉期边缘CT值较肿瘤中心高32.13%, 碘基值高40.01%, t = 5.553, P = 0.000, 同样碘基值升高的百分比明显高于CT值升高的百分比.
| 项目 | CT值差异百分比 | 碘基值差异百分比 | t值 | P值 |
| 动脉期病灶中心 vs 边缘 | 37.65 | 65.95 | 3.936 | 0.000 |
| 动脉期病灶边缘 vs 肝组织 | 22.99 | 17.96 | 1.144 | 0.255 |
| 静脉期病灶中心 vs 边缘 | 32.13 | 40.01 | 5.553 | 0.000 |
| 静脉期病灶边缘 vs 肝组织 | 34.47 | 40.92 | 2.161 | 0.033 |
分别在动脉期和静脉期的GSI图像上测量转移病灶边缘相对正常肝组织的CT值和碘基值(图2, 3), 比较他们之间的变化值的百分比间的差异(表2): 动脉期肝组织CT值较肿瘤边缘高22.99%, 碘基值高17.96%, t = 1.144, P = 0.225, 差异没有明显统计学意义. 静脉期肝组织CT值较肿瘤边缘高34.47%, 碘基值高40.92%, t = 2.161, P = 0.033, 差异有明显统计学意义.
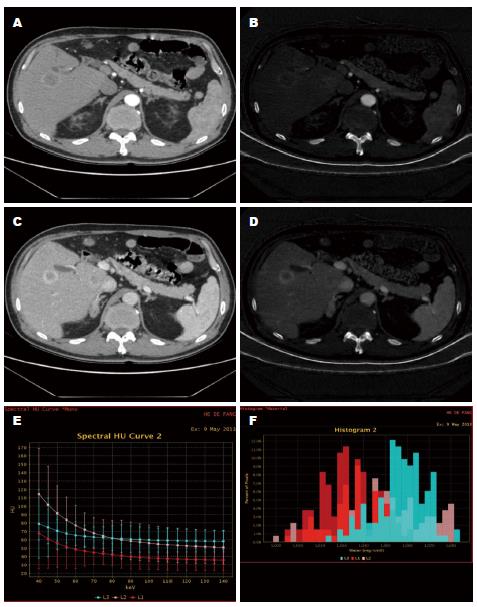
能谱曲线图的下降趋势的特点代表病灶的性质. 以图4为例, 其主要的特点是, 3E中显示动脉期病灶中心为低平曲线(红色), 病灶边缘为稍高的平直曲线(蓝色), 正常肝组织为较好的"抬头"样弧形曲线(粉色), 差别明显. 图3F为能谱柱状分布图, 显示动脉期病灶中心(红色), 病灶边缘(蓝色)和正常肝组织(粉色)的组织分布图差异明显.
本文研究结果发现, 在181例<3 cm转移瘤的患者中, 混合能量和最佳单能量图像对肝脏小转移灶的检出率比较发现, 传统CT混合能量和最佳单能量显示小病灶分别为330个、425个(Z = 3.306, P = 0.001)(表1), 可见在最佳单能量图像的肿瘤检出率高于常规混合能量图像. 这与前人的研究的结果相类似[10,11]. 这一现象可能是因为常规混合能量图像由于"硬化伪影"和"CT值漂移"的影响, 导致其CT值的不准确性的缘故. 也可能的因为最佳单能量图像能优化图像质量, 有利于小病灶的检出的缘故[9,17]. 能谱CT成像对于肝小转移灶的诊断可能较常规CT增强具有更大的优势.
对于较大的典型的结直肠癌肝转移, 表现为典型的"牛眼征"或者"靶征", 诊断多无困难. 但是, 小的转移癌常常缺乏这些典型征象, CT强化的边缘不明显, 或者病灶中心密度稍低, 与囊肿或者其他肝结节鉴别困难[18]. 本研究力图采用量化分析的方式, 定量研究CT值和碘基值在病灶边缘和中心区域的变化, 分析病变特点, 对动静脉期病灶边缘、病灶中心和正常肝组织间的CT值和碘基值之间的差异进行比较, 探讨小结直肠癌转移灶的病变变化特点.
本研究对碘基值和CT值在检测肿瘤结节强化率的差异比较发现, 在<3 cm的转移瘤中, 从表2中可以看出, 病灶边缘部分与病灶中心部分相比, 强化更加明显均升高, 这与前人的研究结果相同[2,9]. 但是本研究发现不论是动脉期还是静脉期, 中心对边缘的碘基值升高的百分比要明显高于CT值升高的百分比(均P<0.001), 碘基值可能对小的转移性肿瘤强化变化的显示更好. 虽然动脉期正常肝组织较病灶边缘部分CT值升高22.99%, 而碘值升高17.96%, 无明显统计学意义(P = 0.225), 但是静脉期两者间还是具有显著的统计学差异(t = 2.161, P = 0.033)(表2). 这表明碘基值对于肿瘤边缘和正常肝组织的变化显示还是有一定的意义.
碘基值对于转移的效果更好的Ô因可能是: CT值反映的是局部体素范围内所有物质的平均密度值, 且受到多种技术的影响. 而碘基值反应的是局部组织的实际碘含量, 就是代表了增强的物质吸收, 碘浓度可能能够更好的直接反应病灶的强化特征. 碘浓度越高, 就吸收的越多, 从而增强的就越明显[19,20]. 由于不典型的转移性肝肿瘤, 以常规组织密度差异来检测病灶可能较为困难, 从而导致肝脏的小转移灶的强化方式的显示上, 碘基值的定量分析差异性较CT值更大, 对于病变的增强变化可能更加敏感. 碘基值的定量分析可能更能精确体现组织强化特征的差异, 具有更显著的临床意义, 能够给临床提供更多的帮助.
本研究的不足之处是: (1)病例数较少, 没有对不同类型的病例的肝转移性肿瘤的能谱特点分别进行分析, 且不是前瞻性研究; (2)没有深入利用能谱其他分析工具, 例如能谱曲线、散点图、立方图等深入分析总结其特点; (3)由于病灶较小, 手工测量上可能造成能谱结果测量的误差; (4)由于GSI中感兴趣区的受主观因素选择, 其CT值、碘值及能谱曲线的斜率变化很大; (5)增强时, 根据患者增强的情况, 不同的单能量水平的最佳CNR也不同, 导致测量图像的选择也受影响. 今后我们加大样本, 增加转移性肝肿瘤的病理类型, 通过分析比较, 总结经验, 提高对转移性肝肿瘤性质的诊断准确率, 给临床带来有价值的参考信息.
本文的意义和结果是: GSI碘的定量分析在结直肠肝小转移的诊断的意义优于传统CT, 一方面增加了转移性病灶与正常肝组织之间的对比度, 优化了图像质量, 碘基图的变化传统CT明显, 有利于提高病灶的检出率; 另一方面, 病灶的强化特征在碘基图上量化显示较常规CT有优越性, 更能准确全面反映病灶的情况, 同时显示病灶的解剖和血供信息, 有利于提高对微小转移性肝肿瘤诊断的准确性, 降低漏诊误诊率.
结直肠癌肝转移是临床上常见的疾病, 对于<3 cm的肝转移性肿瘤, 传统CT容易发生漏诊和误诊. 能谱CT具有的单能量成像、碘定量和能谱曲线等多个参数, 能为诊断提供新的手段, 可能在一定程度上提高微小的结直肠癌肝转病灶的检出率, 对其定性评估有一定的临床价值.
丁永斌, 主任医师, 南京医科大学第一附属医院普外科
本文通过能谱CT碘的定量分析对<3 cm的结直肠癌转移病灶的研究, 有利于提高对转移性病灶诊断的准确率和小病灶的检出率. 由于GSI中感兴趣区受主观因素选择, 其CT值、碘值及能谱曲线的斜率变化很大, 所以今后需要扩大样本量, 辅助以能谱CT其他参数共同研究探讨结论.
Lv等深入研究了能谱CT碘基值和能谱曲线对肝癌与肝血管瘤的鉴别意义, 同时分析了小肝癌的能谱CT特点. Yu等重点关注了肝癌和肝脏结节样增生的能谱CT特点, 肝癌的CT碘基值和能谱曲线的诊断与鉴别诊断的意义. 这些研究对于肝肿瘤的诊断与鉴别具有重要临床价值.
本研究创新性的采用能谱CT碘的定量分析结直肠肝脏小转移的特点, 发现该方法的诊断的意义优于传统CT, 有利于提高病灶的检出率, 同时更能准确全面反映病灶的情况, 有利于提高对微小转移性肝肿瘤诊断的准确性, 降低漏诊误诊率.
本文通过碘的定量分析小结直肠癌肝转移的特征, 有利于提高对转移性病灶诊断的准确率和小病灶的检出率, 有利于患者治疗和预后, 从而有可能广泛应用于临床.
能谱CT: 就是利用物质在不同X射线能量下产生的不同的吸收系数, 来提供比常规CT更多的影像信息的CT成像技术; 单能量图像: 能谱CT扫描时, 获得的单个千伏值的X线图像信息得到的图像(例如100 kV的单个能量的X线获得的图像); 碘基值: 能谱CT的碘基分布图上获得的局部碘含量测量值.
本文通过宝石能谱CT双期扫描915例结直肠癌患者进行定量分析, 样本量较大, 课题设计合理, 结果可信, 有较好的科学性和可重复性. 在一定程度上提高了结直肠癌肝脏微小转移的检出率, 具有很好的临床实用性.
编辑: 郭鹏 电编:都珍珍
| 1. | Devun F, Biau J, Huerre M, Croset A, Sun JS, Denys A, Dutreix M. Colorectal cancer metastasis: the DNA repair inhibitor Dbait increases sensitivity to hyperthermia and improves efficacy of radiofrequency ablation. Radiology. 2014;270:736-746. [PubMed] [DOI] |
| 2. | Kijima S, Sasaki T, Nagata K, Utano K, Lefor AT, Sugimoto H. Preoperative evaluation of colorectal cancer using CT colonography, MRI, and PET/CT. World J Gastroenterol. 2014;20:16964-16975. [PubMed] [DOI] |
| 3. | Anzidei M, Napoli A, Zaccagna F, Cartocci G, Saba L, Menichini G, Cavallo Marincola B, Marotta E, Di Mare L, Catalano C. Liver metastases from colorectal cancer treated with conventional and antiangiogenetic chemotherapy: evaluation with liver computed tomography perfusion and magnetic resonance diffusion-weighted imaging. J Comput Assist Tomogr. 2011;35:690-696. [PubMed] [DOI] |
| 4. | Padman S, Padbury R, Beeke C, Karapetis CS, Bishnoi S, Townsend AR, Maddern G, Price TJ. Liver only metastatic disease in patients with metastatic colorectal cancer: impact of surgery and chemotherapy. Acta Oncol. 2013;52:1699-1706. [PubMed] [DOI] |
| 5. | O'Donnell C, Hislop-Jambrich J, Woodford N, Baker M. Demonstration of liver metastases on postmortem whole body CT angiography following inadvertent systemic venous infusion of the contrast medium. Int J Legal Med. 2012;126:311-314. [PubMed] [DOI] |
| 6. | Lv P, Lin XZ, Chen K, Gao J. Spectral CT in patients with small HCC: investigation of image quality and diagnostic accuracy. Eur Radiol. 2012;22:2117-2124. [PubMed] [DOI] |
| 7. | Lv P, Lin XZ, Li J, Li W, Chen K. Differentiation of small hepatic hemangioma from small hepatocellular carcinoma: recently introduced spectral CT method. Radiology. 2011;259:720-729. [PubMed] [DOI] |
| 8. | 周 悦, 王 明月, 高 剑波, 董 军强, 许 瀚, 侯 平. 宝石CT能谱成像及灌注成像评价兔VX2肝癌抗血管生成的治疗疗效. 世界华人消化杂志. 2014;22:4726-4733. [DOI] |
| 9. | 王 贵生, 高 建华, 赵 帅. 能谱CT对提高肝占位性结节检出率的应用价值. 中国医学计算机成像杂志. 2013;19:43-46. |
| 10. | Zhang XF, Lu Q, Wu LM, Zou AH, Hua XL, Xu JR. Quantitative iodine-based material decomposition images with spectral CT imaging for differentiating prostatic carcinoma from benign prostatic hyperplasia. Acad Radiol. 2013;20:947-956. [PubMed] [DOI] |
| 11. | Lee SH, Hur J, Kim YJ, Lee HJ, Hong YJ, Choi BW. Additional value of dual-energy CT to differentiate between benign and malignant mediastinal tumors: an initial experience. Eur J Radiol. 2013;82:2043-2049. [PubMed] [DOI] |
| 12. | Srinivasan A, Parker RA, Manjunathan A, Ibrahim M, Shah GV, Mukherji SK. Differentiation of benign and malignant neck pathologies: preliminary experience using spectral computed tomography. J Comput Assist Tomogr. 2013;37:666-672. [PubMed] [DOI] |
| 13. | Ahmed S, Johnson PT, Hruban R, Fishman EK. Metastatic disease to the pancreas: pathologic spectrum and CT patterns. Abdom Imaging. 2013;38:144-153. [PubMed] [DOI] |
| 14. | Yu Y, He N, Sun K, Lin X, Yan F, Chen K. Differentiating hepatocellular carcinoma from angiomyolipoma of the liver with CT spectral imaging: a preliminary study. Clin Radiol. 2013;68:e491-e497. [PubMed] [DOI] |
| 15. | Wu HW, Cheng JJ, Li JY, Yin Y, Hua J, Xu JR. Pulmonary embolism detection and characterization through quantitative iodine-based material decomposition images with spectral computed tomography imaging. Invest Radiol. 2012;47:85-91. [PubMed] [DOI] |
| 16. | Pan Z, Pang L, Ding B, Yan C, Zhang H, Du L, Wang B, Song Q, Chen K, Yan F. Gastric cancer staging with dual energy spectral CT imaging. PLoS One. 2013;8:e53651. [PubMed] [DOI] |
| 17. | Yu Y, Lin X, Chen K, Chai W, Hu S, Tang R, Zhang J, Cao L, Yan F. Hepatocellular carcinoma and focal nodular hyperplasia of the liver: differentiation with CT spectral imaging. Eur Radiol. 2013;23:1660-1668. [PubMed] [DOI] |
| 18. | Wolberink SV, Beets-Tan RG, de Haas-Kock DF, van de Jagt EJ, Span MM, Wiggers T. Multislice CT as a primary screening tool for the prediction of an involved mesorectal fascia and distant metastases in primary rectal cancer: a multicenter study. Dis Colon Rectum. 2009;52:928-934. [PubMed] [DOI] |
| 19. | Li M, Zheng X, Li J, Yang Y, Lu C, Xu H, Yu B, Xiao L, Zhang G, Hua Y. Dual-energy computed tomography imaging of thyroid nodule specimens: comparison with pathologic findings. Invest Radiol. 2012;47:58-64. [PubMed] [DOI] |