修回日期: 2016-03-31
接受日期: 2016-04-05
在线出版日期: 2016-05-08
目的: 系统评价结直肠癌血中C反应蛋白(C-reactive protein, CRP)对预后的影响.
方法: 在PubMed和Embase数据库中系统检索关于血中CRP和结直肠癌预后关系的文献, 文献检索日期截止至2015-05. 使用Stata12.0统计软件对数据进行Meta分析, 以风险比(hazard risk, HR)及95%可信区间(95% confidence interval, 95%CI)作为效应量. 同时进行亚组和敏感性分析.
结果: 本研究共纳入21篇文献, 包含4242例结直肠癌患者. 我们的结果显示结直肠癌患者血中CRP水平与总生存率、肿瘤特异性生存率和无病生存率相关且具有统计学差异. 总生存率: HR = 1.89, 95%CI: 1.52-2.35(P<0.001); 肿瘤特异性生存率: HR = 2.08, 95%CI: 1.42-3.04(P<0.001); 无病生存率: HR = 1.44, 95%CI: 1.25-1.67(P<0.001). 基于取样时间、样本量和研究区域的亚组分析也得到相似的结果. 此外, 敏感性分析证实了我们结果的稳定性、准确性和可靠性.
结论: 我们的研究结果表明血中CRP高水平与结直肠癌患者不良预后相关. 因此, CRP可以作为结直肠癌患者预后的重要指标.
核心提示: 本文研究目的在于系统评价结直肠癌血中C反应蛋白(C-reactive protein, CRP)对预后的影响. 共纳入21篇文献, 包含4242例结直肠癌患者. 结果显示结直肠癌患者血中CRP水平与总生存率、肿瘤特异性生存率和无病生存率相关且具有统计学差异, 基于取样时间、样本量和研究区域的亚组分析也得到相似的结果. 此外, 敏感性分析证实了结果的稳定性、准确性和可靠性.
引文著录: 章志丹, 李鑫, 鲁翀. 结直肠癌患者血中C反应蛋白对预后影响的系统评价. 世界华人消化杂志 2016; 24(13): 2093-2101
Revised: March 31, 2016
Accepted: April 5, 2016
Published online: May 8, 2016
AIM: To evaluate the association between prognosis and C-reactive protein (CRP) in patients with colorectal cancer.
METHODS: We systematically searched the relevant studies assessing prognostic value of C-reactive protein in patients with colorectal cancer in PubMed and Embase database (up to May 2015). This meta-analysis was completed with hazard ratio (HR) and 95% confidence intervals (CI) as effect measures, using Stata12.0 software. Subgroup and sensitivity analyses were also performed.
RESULTS: Twenty-one eligible studies were included in the present meta-analysis, including 4242 patients with colorectal cancer. Our results showed that elevated CRP was associated with poor survival in patients with colorectal cancer (overall survival: HR = 1.89, 95%CI: 1.52-2.35, P < 0.001; cancer-specific survival: HR = 2.08, 95%CI: 1.42-3.04, P < 0.001; disease-free survival: HR = 1.44, 95%CI: 1.25-1.67, P < 0.001). The subgroup analyses based on the sampling time, sample size and study region obtained similar results. Moreover, sensitivity analyses confirmed the stability of our results.
CONCLUSION: Our meta-analysis indicates that CRP is significantly associated with a poor prognosis for patients with colorectal cancer.
- Citation: Zhang ZD, Li X, Lu C. Prognostic value of C-reactive protein in patients with colorectal cancer: Meta-analysis. Shijie Huaren Xiaohua Zazhi 2016; 24(13): 2093-2101
- URL: https://www.wjgnet.com/1009-3079/full/v24/i13/2093.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i13.2093
结直肠癌是当今世界第三大常见的恶性肿瘤, 在肿瘤相关的致死率中位居第4位[1]. 目前, 结直肠癌的主要治疗手段是以手术为主, 辅以术前、术后放化疗的多科学综合治疗. 但是, 结直肠癌的转移率和复发率仍然是影响患者预后的主要不良因素. 近年来, 研究发现机体对肿瘤细胞的炎症反应与各类恶性肿瘤的预后相关, 如粒细胞-淋巴细胞比(neutrophil-to-lymphocyte ratio, NLR)、血清白蛋白和格拉斯哥预后评分(glasgow prognostic score, GPS)等[2-6]. 肿瘤相关炎症的研究有助于阐明炎症与肿瘤的关系和指导肿瘤的个体化临床治疗.
C反应蛋白(C-reactive protein, CRP)是一类被用于评价机体炎症反应的急性蛋白[7]. 在肝癌、肺癌等恶性肿瘤的研究中认为血中CRP水平可以作为预后指标[8-11]. 但是在结直肠癌中的意义尚有争议. 有研究[12,13]表明认为术前CRP不能预测结直肠癌患者预后. 但与此同时也有研究[14,15]表明术前CRP水平与预后相关. 本研究通过Meta分析系统评价结直肠癌患者血中CRP和预后关系.
对PubMed数据库和Embase数据库进行系统的电子检索, 检索日期截止至2015-05. 检索语种限定为英文, 主要的检索词为: c-reactive protein、C reactive protein、CRP、colorectal cancer、colon cancer和rectal cancer. 通过仔细筛选, 在检索出的所有文献中选出合格的文献. 此外, 我们对相关文献的参考文献进行手动检索, 确认并获得上述检索策略未发现的相关文献.
1.2.1 纳入标准: 纳入的文献应符合以下纳入标准: (1)文献的研究对象均为结、直肠癌患者; (2)研究类型为队列研究、病例对照研究或随机对照研究研究; (3)血液中CRP与结直肠癌患者预后的关系; (4)文献有明确的预后结局指标: 总生存率(overall survival, OS)、肿瘤特异性生存率(cancer-specific survival, CSS)或无病生存率(disease-free survival, DFS); (5)文献的预后分析资料完整, 并提供相关原始数据; (6)如果多篇文献来自于同一团队和机构, 只纳入最近发表的文献.
1.2.2 排除标准: 若文献符合以下条件之一, 则不能纳入本研究: (1)文献的纳入患者包含非结直肠癌; (2)检测CRP的样本不是来自于血液; (3)文献未提供本研究所需的原始数据; (4)病例报告、综述、会议摘要及相关单臂研究; (5)来自于同一团队和机构的重复文章.
1.2.3 数据的提取: 每篇纳入文献的原始数据均由两位作者独立提取. 提取的数据包括: 文献第一作者、发表国家及年份、研究对象的性别、人数及年龄、检测样本的取样时间、CRP的截点值、CRP阳性率、随访时间和预后数据(OS、CSS或DFS). 对于时间-事件(time-event)性质的预后结局采用风险比(hazard risk, HR)及95%可信区间(95% confidence interval, 95%CI)表示. 对于未直接提取相关预后数据的文献, 我们采用Tierney设计的方法间接计算[16]. 使用Cochran Q检验和I2统计量评价文献间的异质性[17]. 若在校对两位作者所提取数据时发现有不一致的地方, 2位作者再次仔细阅读全文并讨论解决. 如果研究存在明显的发表偏倚, 我们另外采用剪补法评价发表偏倚对结果的影响. 根据取样时间、发表区域和样本量进行亚组分析. 此外, 使用分剔除取每篇文献的敏感性分析评价结果的准确性和稳健性.
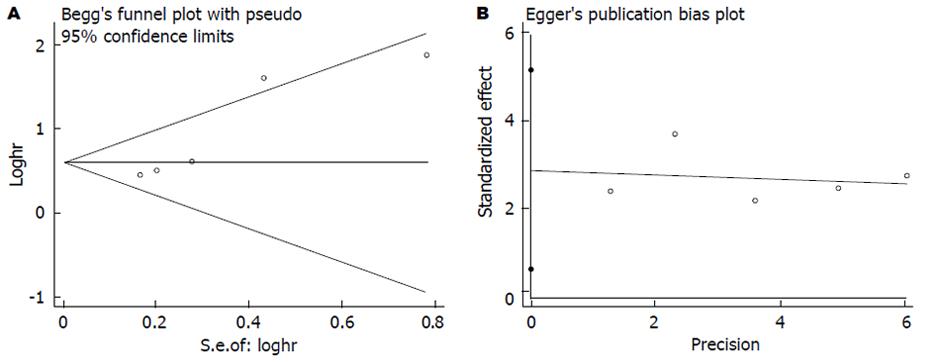
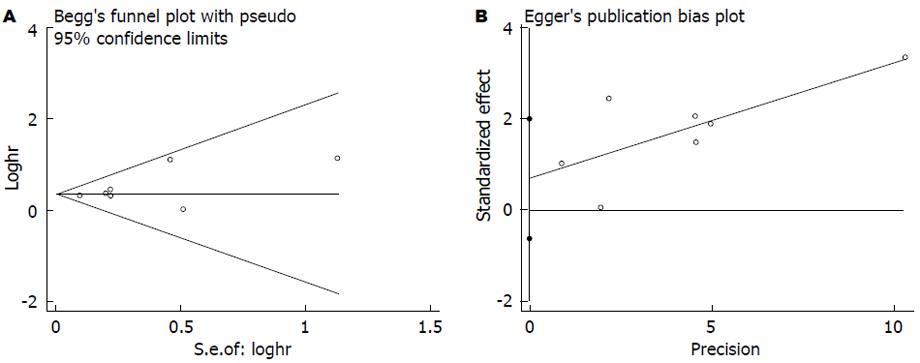
统计学处理 本研究所采用统计分析方法均使用Stata12.0统计软件(Stata Corporation, College Station, TX, USA). P<0.05表示差异有统计学意义. Q检验的P<0.10或者I2≥50%时认为研究间存在明显的异质性. 当研究间存在明显异质性时我们使用随机效应模型对数据进行分析, 否则使用固定模型对数据分析[18]. 我们使用Begg's检验和Egger's检验方法评价发表偏倚.
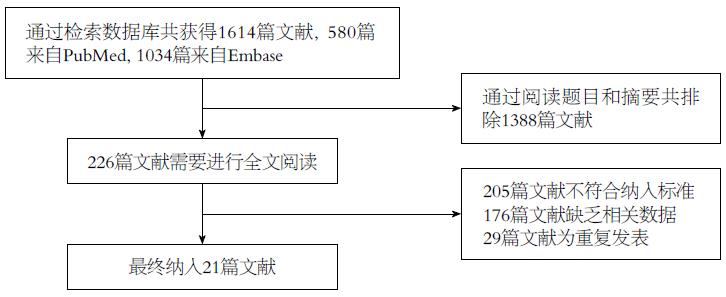
通过检索策略共检索出相关文献1614篇, 阅读文献标题和摘要后共排除无关文献1388篇. 对剩余的文献进行全文阅读后, 排除205篇文献, 最终纳入21篇文献进行分析[2,12-15,19-34](图1).
本研究共纳入21篇文献, 包含4242例结直肠癌患者. 文献样本量的平均数为202, 样本量的中位数为152(范围: 50-583). 纳入文献的发表时间分布在2003年至2015年之间. 文献分别来自于日本、意大利、加拿大、巴西、韩国、挪威、美国、瑞典、荷兰、希腊、英国.根据取样时间, 14篇文献评价术前CRP水平与预后的关系, 1篇文献同时评价术前和术后CRP水平与预后的关系, 6篇未明确评价取样时间. 纳入文献的详细基线特征如表1.
| 作者 | 发表国家 | 样本量(男/女) | 年龄(岁) | 取样时间 | CRP高水平率 | 结局变量 |
| Shibutani等[2]2015 | 日本 | 81/63 | 64.0(29.0-91.0) | 术前 | 53/144 | CSS, PFS, OS |
| Mori等[14]2015 | 日本 | 87/65 | 66.9(35.0-89.0) | 术前 | 33/152 | DFS |
| Lumachi等[19]2014 | 意大利 | 51/40 | 66.0(47.0-79.0) | 术前 | 48/91 | OS |
| Hamilton等[15]2014 | 加拿大 | 34/18 | 61.0(29.0-86.0) | 术前 | 25/52 | OS |
| Takasu等[12]2013 | 日本 | 99/68 | 41-93 | 术前 | 29/167 | OS |
| Spencer等[20]2013 | 巴西 | 583 | NR | NR | 291/583 | PFS, OS |
| Lin等[21]2013 | 中国 | 70/53 | NR | 术前 | 30/123 | OS |
| Lee等[22]2013 | 韩国 | 44/33 | 64.4(43.0-79.0) | 术前 | 12/77 | DFS |
| Kersten等[23]2013 | 挪威 | 232/293 | 73.0(31.0-97.0) | 术前 | 252/525 | DFS, CSS |
| Fukuchi等[24]2013 | 日本 | 70/42 | 66.0(31.0-85.0) | NR | NR | OS |
| Cooney等[25]2013 | 美国 | 216/152 | 64.80±11.20 | NR | NR | OS, CSS |
| Ishizuka等[26]2013 | 日本 | 112/57 | NR | NR | NR | OS |
| Byström等[27]2012 | 瑞典 | 67/39 | 60.0(37.0-75.0) | NR | NR | OS |
| van de Poll等[28]2011 | 荷兰 | 32/18 | 65.00±10.00 | 术前 | 19/42 | OS |
| Zacharakis等[29]2010 | 希腊 | 298/243 | 60.33±7.35 | 无手术 | 136/541 | OS |
| Kwon等[13]2010 | 韩国 | 79/53 | 62.0(26.0-83.0) | 术前 | NR | DFS, OS |
| Nozoe等[31]2008 | 日本 | 75/41 | 37-91 | 术前 | 47/116 | OS |
| Shiu等[30]2008 | 中国 | 140/72 | 70.0(28.0-91.0) | 术前 | 109/212 | CSS |
| Crozier等[33]2007 | 英国 | 99/81 | NR | 术前; 术后 | 80/180 | CSS, OS |
| Wong等[32]2007 | 英国 | 106/64 | 64.00±9.86 | 术前 | 54/170 | DFS, OS |
| Chung等[34]2003 | 中国 | 99/73 | NR | 术前 | 61/172 | OS |
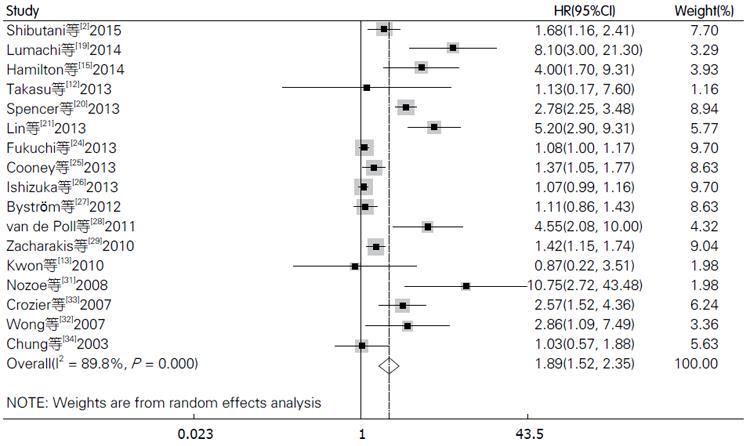
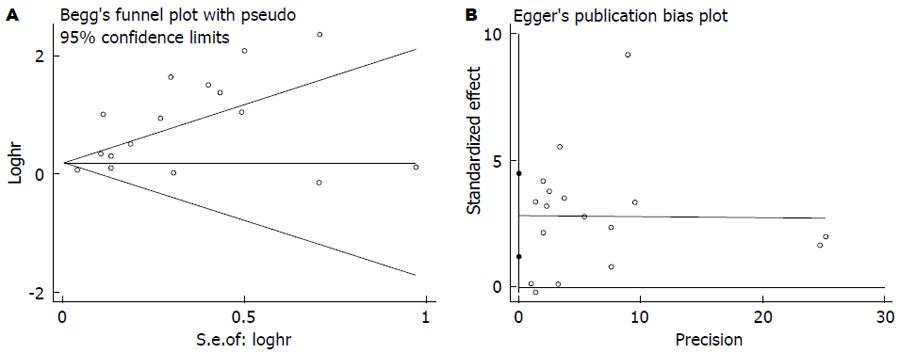
在纳入的文献中, 共17篇文献[2,12,13,15,19-21,24-29,31-34]评价CRP与结直肠癌总生存率的关系. 由于各研究间存在明显异质性(I2 = 89.8%), 故我们采用随机效应模型, 合成结果显示结直肠癌患者血中CRP与总生存率相关且具有统计学差异(HR = 1.89, 95%CI: 1.52-2.35, P<0.001, 图2), 使用Begg's和Egger's评价发表偏倚的结果如图3. 其中有11篇文献评价术前血中CRP与总生存率的关系, 检验结果显示各研究间存在明显异质性(I2 = 71.6%), 使用随机效应模型合成的结果依然提示血中CRP高水平患者的总生存率明显低于CRP低水平患者的总生存率(HR = 2.88, 95%CI: 1.86-4.45, P<0.001). 为探索研究间的区域和纳入的样本量是否会对结果产生影响, 我们进行了亚组分析, 亚组分析的结果显示研究区域和样本量对结果未产生实质性改变(亚洲组: HR = 1.45, 95%CI: 1.14-1.84, P = 0.003; 非亚洲组: HR = 2.29, 95%CI: 1.62-3.24, P<0.001); 样本量≥150: (HR = 1.63, 95%CI: 1.16-2.29, P = 0.005); 样本量<150: (HR = 2.56, 95%CI: 1.63-4.00, P<0.000)(表2).
| 项目 | OS | CSS | DFS | ||||||
| n | 95%CI | I2(%) | n | 95%CI | I2(%) | n | 95%CI | I2(%) | |
| 总体分析 | 17 | 1.893[1.522-2.353] | 89.80 | 5 | 2.079[1.423-3.038] | 55.80 | 7 | 1.443[1.248-1.669] | 0.00 |
| 时间 | |||||||||
| 术前 | 11 | 2.876[1.859-4.449] | 71.60 | 4 | 2.458[1.397-4.324] | 65.60 | 6 | 1.523[1.216-1.909] | 0.00 |
| 区域 | |||||||||
| 亚组 | 8 | 1.445[1.138-1.835] | 83.90 | 2 | 2.802[0.870-9.024] | 57.10 | 5 | 1.505[1.155-1.960] | 0.00 |
| 非亚组 | 9 | 2.291[1.621-3.238] | 86.40 | 3 | 2.019[1.246-3.271] | 68.30 | 2 | 1.417[1.190-1.686] | 0.00 |
| 样本量 | |||||||||
| ≥150 | 8 | 1.627[1.158-2.286] | 91.10 | 4 | 2.279[1.370-3.792] | 66.90 | 4 | 1.446[1.234-1.695] | 2.10 |
| <150 | 9 | 2.556[1.633-4.000] | 89.70 | / | 3 | 1.426[0.993-2.049] | 0.00 | ||
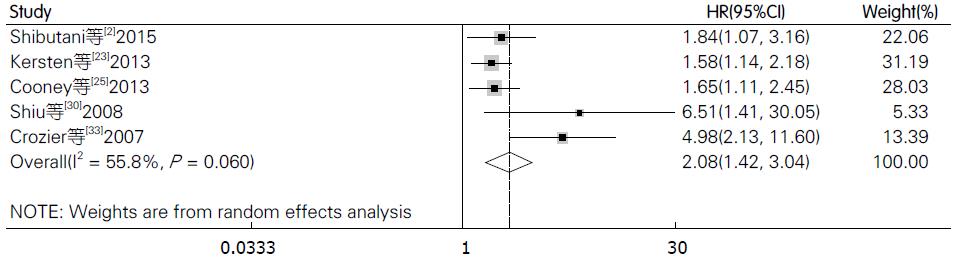
在纳入的文献中, 共5篇文献[2,23,25,30,33]评价CRP与结直肠癌肿瘤特异性生存率的关系. 由于各研究间存在明显异质性(I2 = 55.8%), 故我们采用随机效应模型, 结果显示结直肠癌患者血中CRP与不良的肿瘤特异性生存率相关且具有统计学差异(HR = 2.08, 95%CI: 1.42-3.04, P<0.001, 图4), 使用Begg's和Egger's评价发表偏倚的结果如图5. 其中有4篇文献评价术前血中CRP与肿瘤特异性生存率的关系, 检验结果显示各研究间存在明显异质性(I2 = 65.6%), 结果提示血中CRP水平与患者的肿瘤特异性生存率相关(HR = 2.46, 95%CI: 1.40-4.32, P = 0.002). 基于研究区域和样本量进行的亚组分析提示研究区域和样本量对结果未产生实质性改变, 具体结果详如表2.
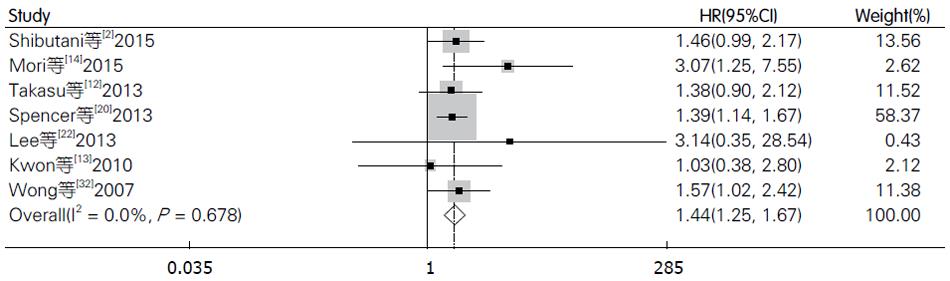
在纳入的文献中, 共7篇文献[2,12-14,20,22,32]评价CRP与结直肠癌无病生存率的关系. 各研究间无明显异质性(I2 = 0.00%), 故我们采用固定效应模型, 合成结果显示结直肠癌患者血中CRP与无病生存率相关且具有统计学差异(HR = 1.44, 95%CI: 1.25-1.67, P<0.001, 图6), 使用Begg's和Egger's评价发表偏倚的结果如图7. 其中有6篇文献评价术前血中CRP与无病生存率的关系, 结果显示CRP高水平患者的无病生存率明显低于CRP低水平患者的无病生存率(HR = 1.52, 95%CI: 1.22-1.91, P<0.001), 且各研究间无明显异质性. 基于研究区域和样本量, 我们进行了亚组分析. 亚组分析的结果显示研究区域和样本量对结果未产生实质性改变(亚洲组: HR = 1.51, 95%CI: 1.16-1.96, P = 0.002; 非亚洲组: HR = 1.42, 95%CI: 1.19-1.69, P<0.001; 样本量≥150: HR = 1.45, 95%CI: 1.23-1.70, P<0.001; 样本量<150: HR = 1.43, 95%CI: 0.99-2.05, P = 0.055), 具体结果详如表2.
敏感性分析的结果显示各个文献未明显主导本研究的结果, 证实结果具有良好的稳定性、准确性和可靠性.
近年来, 多数研究表明肿瘤的发生和进展与机体炎症有着密切的关系, 而且表明炎症在肿瘤的预后中起到关键作用[35,36]. 有研究认为血中CRP水平可以作为肿瘤预后的评价指标. 但是CRP在结直肠癌患者中预后价值尚存争议并且结论未达成一致意见. 因此我们进行本次研究探索CRP与结直肠癌患者预后的关系.
本研究是第一次全面、系统、定量地评价了血中CRP水平和结直肠癌患者预后的关系. 研究共纳入21篇合格的文献, 共计4242例结直肠癌患者. 我们的结果显示结直肠癌患者血中CRP高水平与不良的总生存率、肿瘤特异性生存率和无病生存率相关且具有统计学差异(总生存率: HR = 1.89, 95%CI: 1.52-2.35, P<0.001; 肿瘤特异性生存率: HR = 2.08, 95%CI: 1.42-3.04, P<0.001; 无病生存率: HR = 1.44, 95%CI: 1.25-1.67, P<0.001). 为探索取样时间、研究区域和纳入样本量是否会对结果产生影响, 我们进行了亚组分析. 亚组分析的结果均显示血中CRP高水平与结直肠癌患者不良预后相关. 此外, 敏感性分析证实了我们结果的稳健性. 总之, 我们的研究结果表明血中CRP高水平与结直肠癌患者不良预后相关, 可以作为结直肠癌患者预后的重要指标.
肿瘤的进展是个复杂的过程, 不仅与肿瘤所处的内环境有关, 还与肿瘤细胞与机体细胞间相互作用有关. 近年来, 研究[37]表明肿瘤细胞引发的机体系统炎症与肿瘤预后相关. 我们的结果也证实了作为炎症标志物的CRP与结直肠癌预后相关. 但是关于CRP高水平与不良预后的深层机制仍然不清. 可能的解释是肿瘤的进展能造成局部组织的损伤或坏死, 该过程引起局部非特异性炎症进而引起CRP的升高. 同时有研究[38-40]表明CRP高水平往往预示机体存在着利于肿瘤转移、进展的内环境, 如CRP与血管内皮生长因子、白介素1和白介素6等相关. CRP高水平还与结直肠癌淋巴结浸润、肿瘤大小相关[23,30]. 此外, 机体免疫在肿瘤进展中起到重要的抑制作用, 而肿瘤淋巴细胞浸润却与CRP水平呈负相关关系[41]. 因此, CRP的高水平能预测结直肠癌患者不良的预后. CRP对预后的具体机制及CRP是否可以作为结直肠癌患者预后的预测指标需要大样本、多中心的临床研究. 针对以炎症引起的肿瘤不良预后, 目前多项研究[42,43]表明阻断炎症途径能有效提高结直肠癌患者的预后.
在我们的研究中存在着局限性: (1)我们纳入的都是非随机对照试验, 存在着混杂偏倚, 即使我们进行了亚组分析探讨一些因素对结果的影响但是我们仍然无法消除所有潜在的混杂偏倚; (2)我们的纳入文献的研究间存在着一定的异质性, 在各研究间, 患者纳入的不一致性、CRP检测方法上及截点值设定的不一致都可能是本研究异质性的重要来源之一, 即使我们进行了亚组分析, 但是研究间的异质性仍不能完全消除; (3)由于各纳入文献检测CRP所使用的仪器不一致, 对CRP的截点值未作明确的统一, 而我们的研究也不能确定最佳的截点值用于判断结直肠癌患者的预后; (4)我们的研究是基于已发表的数据, 而我们有些数据是通过有效的发表数据间接推算出来的, 因此可能会对结果有一定影响.
总之, 我们的研究结果表明血中CRP高水平与结直肠癌患者不良预后相关. 因此, CRP可以作为结直肠癌患者预后的重要指标.
结直肠癌是当今世界第三大常见的恶性肿瘤, 在肿瘤相关的致死率中位居第4位. 目前, 结直肠癌的主要治疗手段是以手术为主, 辅以术前、术后放化疗的多科学综合治疗. 但是, 结直肠癌的转移率和复发率仍然是影响患者预后的主要不良因素.
丁健华, 主任医师, 第二炮兵总医院结直肠肛门外科/全军肛肠专病中心; 卢宁, 副主任医师, 兰州军区乌鲁木齐总医院肿瘤科
近年来, 研究发现机体对肿瘤细胞的炎症反应与各类恶性肿瘤的预后相关, 如粒细胞-淋巴细胞比、血清白蛋白和格拉斯哥预后评分等. 肿瘤相关炎症的研究有助于阐明炎症与肿瘤的关系和指导肿瘤的个体化临床治疗.
C反应蛋白(C-reactive protein, CRP)是一类被用于评价机体炎症反应的急性蛋白. 在肝癌、肺癌等恶性肿瘤的研究中认为血中CRP水平可以作为预后指标. 但是在结直肠癌中的意义尚有争议.
本文研究是第一次全面、系统、定量地评价了血中CRP水平和结直肠癌患者预后的关系. 研究共纳入21篇合格的文献, 共计4242例结直肠癌患者. 结果显示结直肠癌患者血中CRP高水平与不良的总生存率、肿瘤特异性生存率和无病生存率相关且具有统计学差异.
本文的研究结果表明血中CRP高水平与结直肠癌患者不良预后相关, 可以作为结直肠癌患者预后的重要指标.
CRP: 是指在机体受到感染或组织损伤时血浆中一些急剧上升的蛋白质(急性蛋白). CRP可以激活补体和加强吞噬细胞的吞噬而起调理作用, 从而清除入侵机体的病原微生物和损伤, 坏死, 凋亡的组织细胞, 在机体的天然免疫过程中发挥重要的保护作用.
本文使用Meta分析的方法, 系统评价结直肠癌患者血中CRP对预后的影响, 共纳入21篇文献, 包含4242例结直肠癌患者. 结果显示结直肠癌患者血中CRP水平与总生存率、肿瘤特异性生存率和无病生存率相关且具有统计学差异. 内容客观, 分析方法成熟, 观点真实, 具有一定的科学意义.
编辑: 于明茜 电编:都珍珍
| 1. | Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65:87-108. [PubMed] [DOI] |
| 2. | Shibutani M, Maeda K, Nagahara H, Noda E, Ohtani H, Nishiguchi Y, Hirakawa K. Prognostic significance of the preoperative serum C-reactive protein level in patients with stage IV colorectal cancer. Surg Today. 2015;45:315-321. [PubMed] [DOI] |
| 3. | Choi WJ, Cleghorn MC, Jiang H, Jackson TD, Okrainec A, Quereshy FA. Preoperative Neutrophil-to-Lymphocyte Ratio is a Better Prognostic Serum Biomarker than Platelet-to-Lymphocyte Ratio in Patients Undergoing Resection for Nonmetastatic Colorectal Cancer. Ann Surg Oncol. 2015;22 Suppl 3:603-613. [PubMed] [DOI] |
| 4. | Ishizuka M, Nagata H, Takagi K, Horie T, Kubota K. Inflammation-based prognostic score is a novel predictor of postoperative outcome in patients with colorectal cancer. Ann Surg. 2007;246:1047-1051. [PubMed] |
| 5. | Choi KW, Hong SW, Chang YG, Lee WY, Lee B, Paik IW, Lee H. Inflammation-based score (Glasgow prognostic score) as an independent prognostic factor in colorectal cancer patients. Ann Surg Treat Res. 2014;86:309-313. [PubMed] [DOI] |
| 6. | Sugimoto K, Komiyama H, Kojima Y, Goto M, Tomiki Y, Sakamoto K. Glasgow prognostic score as a prognostic factor in patients undergoing curative surgery for colorectal cancer. Dig Surg. 2012;29:503-509. [PubMed] [DOI] |
| 7. | Zimmerman MA, Selzman CH, Cothren C, Sorensen AC, Raeburn CD, Harken AH. Diagnostic implications of C-reactive protein. Arch Surg. 2003;138:220-224. [PubMed] [DOI] |
| 8. | Zhao X, Luo J, Li B, Liu S, Li D. The association between preoperative serum C-reactive protein and hepatocellular carcinoma recurrence in patients with chronic hepatitis B virus (HBV) infection--a retrospective study. PLoS One. 2015;10:e0116909. [PubMed] [DOI] |
| 9. | Shin JH, Kim CJ, Jeon EJ, Sung CO, Shin HJ, Choi J, Yu E. Overexpression of C-reactive Protein as a Poor Prognostic Marker of Resectable Hepatocellular Carcinomas. J Pathol Transl Med. 2015;49:105-111. [PubMed] [DOI] |
| 10. | Hong S, Kang YA, Cho BC, Kim DJ. Elevated serum C-reactive protein as a prognostic marker in small cell lung cancer. Yonsei Med J. 2012;53:111-117. [PubMed] [DOI] |
| 11. | Srimuninnimit V, Ariyapanya S, Nimmannit A, Wonglaksanapimon S, Akewanlop C, Soparattanapaisarn N. C-reactive protein as a monitor of chemotherapy response in advanced non-small cell lung cancer (CML study). J Med Assoc Thai. 2012;95 Suppl 2:S199-S207. [PubMed] |
| 12. | Takasu C, Shimada M, Kurita N, Iwata T, Nishioka M, Morimoto S, Yoshikawa K, Miyatani T, Kashihara H, Utsunomiya T. Impact of C-reactive protein on prognosis of patients with colorectal carcinoma. Hepatogastroenterology. 2013;60:507-511. [PubMed] |
| 13. | Kwon KA, Kim SH, Oh SY, Lee S, Han JY, Kim KH, Goh RY, Choi HJ, Park KJ, Roh MS. Clinical significance of preoperative serum vascular endothelial growth factor, interleukin-6, and C-reactive protein level in colorectal cancer. BMC Cancer. 2010;10:203. [PubMed] [DOI] |
| 14. | Mori K, Toiyama Y, Saigusa S, Fujikawa H, Hiro J, Kobayashi M, Ohi M, Araki T, Inoue Y, Tanaka K. Systemic Analysis of Predictive Biomarkers for Recurrence in Colorectal Cancer Patients Treated with Curative Surgery. Dig Dis Sci. 2015;60:2477-2487. [PubMed] [DOI] |
| 15. | Hamilton TD, Leugner D, Kopciuk K, Dixon E, Sutherland FR, Bathe OF. Identification of prognostic inflammatory factors in colorectal liver metastases. BMC Cancer. 2014;14:542. [PubMed] [DOI] |
| 16. | Tierney JF, Stewart LA, Ghersi D, Burdett S, Sydes MR. Practical methods for incorporating summary time-to-event data into meta-analysis. Trials. 2007;8:16. [PubMed] [DOI] |
| 17. | Higgins JP, Thompson SG, Deeks JJ, Altman DG. Measuring inconsistency in meta-analyses. BMJ. 2003;327:557-560. [PubMed] [DOI] |
| 18. | Schmidt FL, Oh IS, Hayes TL. Fixed- versus random-effects models in meta-analysis: model properties and an empirical comparison of differences in results. Br J Math Stat Psychol. 2009;62:97-128. [PubMed] [DOI] |
| 19. | Lumachi F, Basso SM, Santeufemia DA, Ermani M, Lo Re G, Chiara GB. Preoperative serum C-reactive protein and its prognostic significance in patients with stage III-IV colorectal cancer. Anticancer Res. 2014;34:7263-7266. [PubMed] |
| 20. | Spencer SK, Pommier AJ, Morgan SR, Barry ST, Robertson JD, Hoff PM, Jürgensmeier JM. Prognostic/predictive value of 207 serum factors in colorectal cancer treated with cediranib and/or chemotherapy. Br J Cancer. 2013;109:2765-2773. [PubMed] [DOI] |
| 21. | Lin M, Huang J, Zhu J, Shen H. Elevated pre-treatment levels of high sensitivity C-reactive protein as a potential prognosticator in patients with colorectal cancer. Exp Ther Med. 2013;6:1369-1374. [PubMed] [DOI] |
| 22. | Lee WS, Baek JH, You DH, Nam MJ. Prognostic value of circulating cytokines for stage III colon cancer. J Surg Res. 2013;182:49-54. [PubMed] [DOI] |
| 23. | Kersten C, Louhimo J, Ålgars A, Lahdesmaki A, Cvancerova M, Stenstedt K, Haglund C, Gunnarsson U. Increased C-reactive protein implies a poorer stage-specific prognosis in colon cancer. Acta Oncol. 2013;52:1691-1698. [PubMed] [DOI] |
| 24. | Fukuchi M, Kuwabara K, Tsuji Y, Baba H, Ishibashi K, Chika N, Hatano S, Matsuzawa T, Kumamoto K, Kumagai Y. C-reactive protein is a negative independent factor in patients with stage IV colorectal cancer undergoing oxaliplatin-based chemotherapy. Anticancer Res. 2013;33:5051-5055. [PubMed] |
| 25. | Cooney RV, Chai W, Franke AA, Wilkens LR, Kolonel LN, Le Marchand L. C-reactive protein, lipid-soluble micronutrients, and survival in colorectal cancer patients. Cancer Epidemiol Biomarkers Prev. 2013;22:1278-1288. [PubMed] [DOI] |
| 26. | Ishizuka M, Nagata H, Takagi K, Iwasaki Y, Shibuya N, Kubota K. Clinical significance of tumor pathology for postoperative survival of patients undergoing surgery for stage IV colorectal cancer. Anticancer Res. 2012;32:3291-3297. [PubMed] |
| 27. | Byström P, Berglund Å, Nygren P, Wernroth L, Johansson B, Larsson A, Glimelius B. Evaluation of predictive markers for patients with advanced colorectal cancer. Acta Oncol. 2012;51:849-859. [PubMed] [DOI] |
| 28. | van de Poll MC, Klaver YL, Lemmens VE, Leenders BJ, Nienhuijs SW, de Hingh IH. C-reactive protein concentration is associated with prognosis in patients suffering from peritoneal carcinomatosis of colorectal origin. Int J Colorectal Dis. 2011;26:1067-1073. [PubMed] [DOI] |
| 29. | Zacharakis M, Xynos ID, Lazaris A, Smaro T, Kosmas C, Dokou A, Felekouras E, Antoniou E, Polyzos A, Sarantonis J. Predictors of survival in stage IV metastatic colorectal cancer. Anticancer Res. 2010;30:653-660. [PubMed] |
| 30. | Shiu YC, Lin JK, Huang CJ, Jiang JK, Wang LW, Huang HC, Yang SH. Is C-reactive protein a prognostic factor of colorectal cancer? Dis Colon Rectum. 2008;51:443-449. [PubMed] [DOI] |
| 31. | Nozoe T, Mori E, Takahashi I, Ezaki T. Preoperative elevation of serum C-reactive protein as an independent prognostic indicator of colorectal carcinoma. Surg Today. 2008;38:597-602. [PubMed] [DOI] |
| 32. | Wong VK, Malik HZ, Hamady ZZ, Al-Mukhtar A, Gomez D, Prasad KR, Toogood GJ, Lodge JP. C-reactive protein as a predictor of prognosis following curative resection for colorectal liver metastases. Br J Cancer. 2007;96:222-225. [PubMed] [DOI] |
| 33. | Crozier JE, McKee RF, McArdle CS, Angerson WJ, Anderson JH, Horgan PG, McMillan DC. Preoperative but not postoperative systemic inflammatory response correlates with survival in colorectal cancer. Br J Surg. 2007;94:1028-1032. [PubMed] [DOI] |
| 34. | Chung YC, Chang YF. Serum C-reactive protein correlates with survival in colorectal cancer patients but is not an independent prognostic indicator. Eur J Gastroenterol Hepatol. 2003;15:369-373. [PubMed] [DOI] |
| 35. | Mariani F, Sena P, Roncucci L. Inflammatory pathways in the early steps of colorectal cancer development. World J Gastroenterol. 2014;20:9716-9731. [PubMed] [DOI] |
| 36. | Diakos CI, Charles KA, McMillan DC, Clarke SJ. Cancer-related inflammation and treatment effectiveness. Lancet Oncol. 2014;15:e493-e503. [PubMed] [DOI] |
| 38. | Miki C, Konishi N, Ojima E, Hatada T, Inoue Y, Kusunoki M. C-reactive protein as a prognostic variable that reflects uncontrolled up-regulation of the IL-1-IL-6 network system in colorectal carcinoma. Dig Dis Sci. 2004;49:970-976. [PubMed] [DOI] |
| 39. | Vidal-Vanaclocha F, Fantuzzi G, Mendoza L, Fuentes AM, Anasagasti MJ, Martín J, Carrascal T, Walsh P, Reznikov LL, Kim SH. IL-18 regulates IL-1beta-dependent hepatic melanoma metastasis via vascular cell adhesion molecule-1. Proc Natl Acad Sci U S A. 2000;97:734-739. [PubMed] [DOI] |
| 40. | Groblewska M, Mroczko B, Sosnowska D, Szmitkowski M. Interleukin 6 and C-reactive protein in esophageal cancer. Clin Chim Acta. 2012;413:1583-1590. [PubMed] [DOI] |
| 41. | Canna K, McArdle PA, McMillan DC, McNicol AM, Smith GW, McKee RF, McArdle CS. The relationship between tumour T-lymphocyte infiltration, the systemic inflammatory response and survival in patients undergoing curative resection for colorectal cancer. Br J Cancer. 2005;92:651-654. [PubMed] [DOI] |