修回日期: 2016-03-30
接受日期: 2016-04-05
在线出版日期: 2016-05-08
目的: 观察不同浓度粒-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor, GM-CSF)联合白介素4(interleukin, IL-4)对小鼠骨髓源性树突状细胞(dendritic cell, DC)形态、纯度、细胞数目的影响, 探究树突状细胞诱导培养的最适宜条件.
方法: 分离、纯化小鼠骨髓单个核样细胞, 分别加入不同浓度梯度的GM-CSF和定量的IL-4, 对其进行形态学观察和细胞表型检测, 以及对异基因淋巴细胞的激活作用测定.
结果: 在一定浓度范围内, 随着GM-CSF浓度的增加, 小鼠骨髓源性树突状细胞的数目、纯度及成熟度亦随之增加. 而过高浓度的GM-CSF反而导致抑制作用. 据此, 可推测理想的GM-CSF浓度范围应为10-20 ng/mL.
结论: 适宜浓度的GM-CSF联合IL-4可提升小鼠骨髓单个核样细胞向树突状细胞分化的能力, 两种细胞刺激因子的合理运用, 可增加树突状细胞的数目、纯度及成熟度.
核心提示: 本实验对粒-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor, GM-CSF)最适宜浓度范围做了初步探究, 用实验证明了其最适宜浓度, 为后续的树突状细胞(dendritic cell, DC)研究奠定了坚实的基础, 同样是肿瘤免疫、器官移植免疫等多种疾病研究中需要用到的相关DC培养诱导方式, 也阐明了GM-CSF的双重诱导结果.
引文著录: 谢楠, 张理超, 付必莽, 唐波, 李春满, 赵越, 胡明道, 张捷. GM-CSF浓度梯度对树突状细胞体外诱导培养的影响. 世界华人消化杂志 2016; 24(13): 2038-2044
Revised: March 30, 2016
Accepted: April 5, 2016
Published online: May 8, 2016
AIM: To investigate the effect of granulocyte-macrophage colony stimulating factor (GM-CSF) with interleukin (IL)-4 on the morphology, purity, and number of mouse bone marrow-derived dendritic-like cells, in order to explore the optimal conditions for culturing dendritic cells.
METHODS: Mouse bone marrow mononuclear cells were dissociated and purified, and then different concentrations of GM-CSF with IL-4 were added. The morphology and phenotype of dendritic-like cells were assessed, and their ability to activate allogeneic lymphocytes was measured.
RESULTS: In a certain concentration range, with the increase of the concentration of GM-CSF, the number, purity and maturity of mouse bone marrow-derived dendritic cells increased, but high concentrations of GM-CSF had an inhibitory effect. The optimal GM-CSF concentration range was 10-20 ng/mL.
CONCLUSION: Optimal concentrations of GM-CSF and IL-4 can be combined to enhance the ability to induce murine bone marrow mononuclear cells to differentiate into dendritic cells. Rational use of these two factors can increase the number, purity and maturity of dendritic cells.
- Citation: Xie N, Zhang LC, Fu BM, Tang B, Li CM, Zhao Y, Hu MD, Zhang J. Effect of different concentrations of GM-CSF on biological behavior of dendritic cells cultured in vitro. Shijie Huaren Xiaohua Zazhi 2016; 24(13): 2038-2044
- URL: https://www.wjgnet.com/1009-3079/full/v24/i13/2038.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i13.2038
树突状细胞(dendritic cell, DC)是专职的抗原提呈细胞(antigen present cells, APC), 与移植免疫识别关系密切, 在各种肿瘤和微生物感染性疾病中, 亦起到重要作用[1]. 其可作为诱导机体产生免疫耐受而用以治疗自身免疫性疾病和减轻器官移植免疫排斥, 诱导免疫耐受, 髓源性DC起源于骨髓, 其由CD34+造血干细胞诱导分化而来, 因成熟时有多样突起而得名. DC分布于全身各组织器官. 多数处于未成熟状态, 摄取抗原或被其他因素刺激分化成熟成mDC[1,2].
DC虽分布广泛, 但数量稀少. 在血液中, 其含量约为血细胞总数的1%左右, 因此DC的研究及应用主要依赖体外培养扩增而获得[1-4]. 当前体外培养获得DC的方法有多种, 培养较为常用的方法是细胞因子粒-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor, GM-CSF)联合白介素4(interleukin 4, IL-4)诱导法. 该方法主要为对采集的单个核细胞或骨髓干细胞, 用GM-CSF联合IL-4等细胞刺激因子进行体外定向诱导分化, 得到未成熟树突状细胞(immature dendritic cell, imDC), 再根据不同研究需要使用不同抗原刺激得到半成熟DC(semmi ature dendritic cell, smDC)[3-5]. 但对于培养DC和所要的最适宜的细胞因子浓度及不同细胞因子对于DC培养成熟状态及影响的研究尚存不少争议, 且文献使用浓度范围相差较大. 本研究通过不同浓度梯度GM-CSF诱导得到DC, 以期明确培养DC的最适宜细胞因子浓度, 为今后研究DC提供必要的理论支持及操作方法.
SPF级♂C57BL/6小鼠60只、LBALB/c小鼠60只, 6-8周龄, 体质量20 g±4 g, 由中山大学实验动物中心提供. FACSCalibur流式细胞仪(美国BD公司)、重组小鼠GM-CSF、IL-4(Peprotech公司), FITC标记的大鼠抗小鼠CD86, MHC-Ⅱ抗体(I-Ab), PE标记的大鼠抗小鼠CD80抗体和PE-CY5标记的鼠抗CDllc购自美国(Laboratories公司).
1.2.1 骨髓细胞的制备: 参考文献[5], 并稍做修改. 脱颈法处死小鼠, 置于700 mL/L的乙醇中, 浸泡5 min. 超净台内取出股骨和胫骨, 浸泡于PBS中. 用10 mL注射器吸取PBS从骨干的一端刺入骨髓腔, 将骨髓细胞冲入10 mL离心管, 反复冲洗, 直至骨变白为止. 离心, 3000 r/min, 离心10 min后弃上清, 加入红细胞裂解液, 吹打混匀, 室温静置5 min待红细胞溶解后, 再次离心, 3000 r/min, 离心l0 min后, 弃上清. PBS洗涤2次, 并以完全培养液重悬后分装培养, 恒温培养3-4 h, 换8孔培养板中培养, 加入完全培养基3 mL, 再加入不同浓度梯度的GM-CSF, 孵箱中继续培养, 适时补充培养基及细胞因子(同等浓度梯度), 7 d后吹打并收集细胞.
按加入细胞因子浓度不同共分7组, 每组设3个复孔. 第1组: GM-CSF 2 ng/mL, 第2组: GM-CSF为5 ng/mL, 第3组: GM-CSF为10 ng/mL, 第4组: GM-CSF为20 ng/mL, 第5组: GM-CSF为50 ng/mL, 第6组: GM-CSF为100 ng/mL, 以上各组IL-4的浓度均为40 ng/mL, 第7组为空白对照组, 培养基中不加任何细胞因子. 该研究实验操作重复5次.
1.2.2 细胞形态学观察: 倒置相差显微镜(日本OLYMPUS公司)观察细胞形态学变化, 并于第1、3、5、7天拍摄细胞照片.
1.2.3 DC细胞的表型鉴定: (1)细胞表面标志鉴定: 在培养的第6天收集上述各组的细胞, 离心后悬于100 µL, 分别加入8 µL鼠抗CD11c, 避光孵育15-30 min, PBS洗涤3次, 最后用400 µL的PBS悬浮细胞, 流式上机检测各组DC细胞CD11c、主要组织相容复合体二类分子(major histocompatibility complex class Ⅱ, MHC-Ⅱ)、CD80、CD86表达情况. 采用Flowjo流式细胞图分析软件分析流式图, 结果以图表列出; (2)细胞因子表达水平测定: 收集以上各组细胞上清液, 用ELISA试剂盒检测IL-6、IL-10等细胞因子表达水平, 每组设6复孔.
1.2.4 异基因淋巴细胞的激活作用: 参考文献[3]获取BALB/c小鼠脾脏淋巴细胞, 24孔板中加入100 µL BALB/c小鼠淋巴细胞作为反应细胞(细胞数约为107/mL). 各组DC经丝裂霉素灭活后作为刺激细胞, PBS洗涤细胞2次后, 将100 µL(约106个细胞)各组灭活细胞分别加入反应细胞中培养2 d后用细胞计数试剂盒(cell counting Kit-80, CCK-8)检测淋巴细胞活化情况. 用酶标仪检测450 nm波长处的光密度OD值. 各组设6个复孔.
统计学处理 采集数据用mean±SD表示, 采用方差分析, 组间差异有统计学意义(P<0.05)时选用Q检验(New-man-Keuls法)SAS6.12统计软件计算结果. P<0.05表示差异有统计学意义.
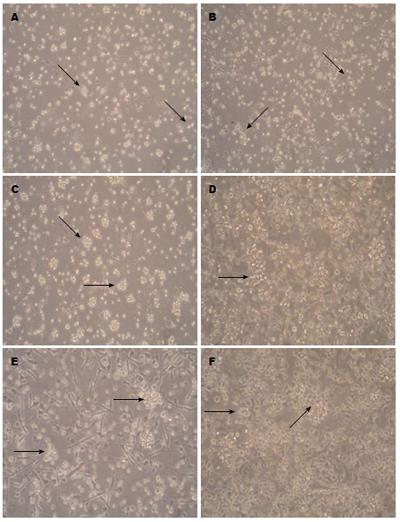
细胞置于37 ℃, 50 mL/L CO2的孵箱中培养3-4 h后, 除部分细胞贴壁外, 可见大量悬浮细胞. 各组可获得骨髓源性细胞数为(3.4-4.5)×107个, 去除悬浮细胞后继续培养24 h, 倒置显微镜下部分细胞呈簇状集聚. 细胞贴壁生长, 胞体较小, 多为圆形. 补充含细胞因子的完全培养基后第2天, 1-4组细胞体积增大, 1、2组未见明显的聚集情况, 3、4组出现贴壁细胞聚集生长趋势, 细胞呈梭形, 似蝌蚪状, 有集落开始形成, 第5、6组细胞数量减少, 可见细胞碎片. 7组细胞数目较少, 未出现聚集. 陪养至第4天, 各组均可见半贴壁DC集落形成, 镜下亦有少量巨噬细胞和成纤维细胞, 1、2组集落较小且较少、分布较为分散, 第3组形成集落数目较为密集, 形态较大, 偶见细小棘突, 第4组集落细胞表面可见数支短小突起, 集落大小及密度较前三组明显, 第5、6组细胞稀疏, 部分出现空泡, 无DC出现, 第7天, 1-4组细胞集落数开始减少, DC形态更趋明显. 3、4组较1、2组细胞集落数目多, 突起也较1、2组明显(图1A, B). 第4组细胞突起及集落数目在各组中最为明显, 突起细长且数量最多(图1D), 放大后可较为清晰地看到部分突起(图1E, F).
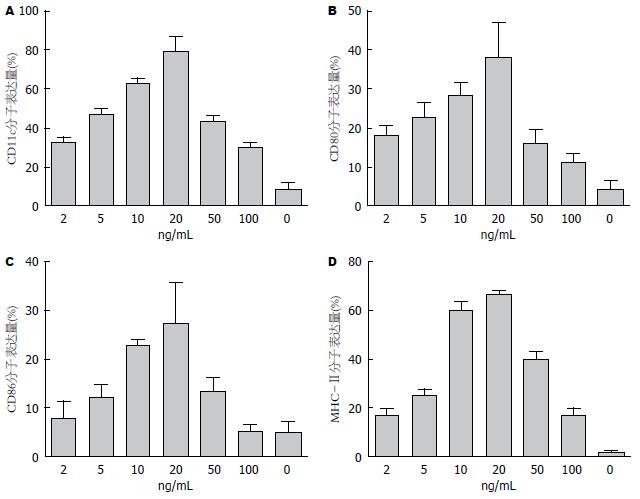
收集第7天的细胞, 检测各组活细胞率均>85%, 提示细胞生理状态正常. 荧光抗体染色后上机行流式细胞分析术. 以流式单克隆鼠抗CDllc抗体首先标出阳性表达的细胞, 再检测CDllc+细胞的MHC-Ⅱ、CD80及CD86分子表达量. 结果显示如图2.
IL-1β、IL-6、IL-12三种细胞因子的分泌, 4组显著高于前三组(P<0.05), 在IL-10的表达上, 三者之间无统计学差异(P>0.05)(表1).
| 因子 | 1组 | 2组 | 3组 | 4组 | 5组 |
| IL-1β | 52.973±3.046 | 54.053±4.743 | 60.721±5.533 | 72.638±2.277b | 58.577±2.359 |
| IL-6 | 109.330±11.320 | 157.831±9.710 | 276.540±5.620 | 308.278±12.284b | 225.336±7.128 |
| IL-10 | 60.690±4.389 | 61.498±5.390 | 56.430±4.348 | 52.896±2.750 | 50.720±3.192 |
| IL-12 | 60.825±3.956 | 196.760±8.795 | 224.880±5.795 | 500.560±14.959b | 337.280±8.848 |
CCK-8检测各组不同状态DC对异基因淋巴细胞的激活作用, 结果显示1组(OD450 = 0.17±0.09), 4组(OD450 = 2.35±0.26), 1、4组各组结果差别明显, 对淋巴细胞的激活数量呈渐进式增加. 其余3组结果均呈下降趋势.
DC膜表面高表达MHC-Ⅰ类和MHC-Ⅱ类分子, 具有特异性表面标志的细胞. 其对抗原摄取, 加工以及刺激T细胞使其激活, 并最终决定T细胞的分化方向[6,7]. 近年来随着对DC研究的不断深入, 已经明确其在肿瘤免疫、器官移植免疫等多种疾病中的机制及其治疗方法, 多项临床研究也已开展, 特别是在肿瘤免疫机制及治疗研究方面[8].
DC的不同成熟状态决定了其在免疫应答中的作用, imDC具有很强的抗原摄取和加工能力, 其低表达MHC-Ⅱ类分子和共刺激分子CD80、CD86和CD40等, 不能活化T细胞, 致使T细胞无反应能力或低反应性, 在诱导机体免疫耐受中起到关键作用, 在器官移植排斥反应中被广泛研究与应用[5-9]. 但由于DC在体内数量稀少, 致使研究受限. 因此如何简单、高效获得足量高纯度DC是免疫研究的前提条件. DC的前体是骨髓来源的CD34+干细胞, 由于小鼠骨髓易于取得, 目前多数方法都是建立在以小鼠骨髓来源细胞为模型并结合多种细胞因子诱导. 目前公认的诱导方法是由Inaba等人建立的[10-14], 随后Califano等[15]改进方法获得了更多的DC. 培养扩增DC最常用的细胞因子为GM-CSF联合IL-4. GM-CSF可诱导骨髓干细胞向单核细胞、巨噬细胞及DC方向分化, 因此, GM-CSF是公认的维持DC发育和分化必不可少的细胞因子, IL-4可抑制单核细胞前体分化为巨噬细胞, 从而诱导其向DC方向分化, 亦可维持DC处于未成熟状态, 所以被广泛用于小鼠骨髓DC的培养中. GM-CSF参与诱导CD34+细胞向粒系分化使其产生CFU-Mo-DC,该物质是维持DC发育及分化的最重要的细胞因子[12,13]. 已有文献报道GM-CSF联合IL-4诱导DC的分化及成熟, 但GM-CSF最佳培养浓度仍然没有统一认识, 报道浓度在2 ng/mL至500 ng/mL之间. 对IL-4的浓度及其作用机制亦无定论, 部分学者认为, IL-4能抑制单核细胞的发展, 抑制培养物中粒细胞和巨噬细胞的产生, 促使CD14表达量下调, 并使CD14+细胞向DC方向分化[14-17].
即使在同一培养基中, DC成熟分化也不是同步的, 获得的DC常为mDC与imDC的混合物, 但imDC所占比例易受诱导细胞因子浓度不同而有较大差别, 因此, 最适宜的细胞因子浓度的掌握显得极为关键[5,7,13,16].
本实验通过不同浓度GM-CSF联合定量IL-4培养DC, 旨在探索DC培养所需细胞因子最佳浓度以及不同浓度GM-CSF联合IL-4对DC分化、成熟及纯度的影响. 本研究结果表明, 两种细胞因子混合物具有双重作用, 在较低浓度时, 随着GM-CSF及IL-4浓度的提高, DC的集落生长趋势及细胞突起数目均明显提升, 但浓度过高, 反而不利于DC的生长、分化及成熟, 有明显的抑制作用.
CD11c阳性表达率在GM-CSF浓度较低时(多数<50 ng/mL时), 随着GM-CSF等浓度提高, CD11c阳性表达率随之提高(P<0.01), 提示DC的纯度等随之增加, 但在50-200 ng/mL时, 随着GM-CSF浓度增加, DC纯度等反而下降. MHC-Ⅱ类分子、CD80和CD86是DC成熟程度的指标, 未成熟DC低表达MHC-Ⅱ类分子、CD80和CD86分子. 通过图2可以看出, 本实验中培养至第7天的DC均主要为imDC, 且imDC的纯度、成熟度与细胞因子浓度有关, 细胞刺激物浓度增加, 各组CD80、CD86及MHC-Ⅱ类分子表达率均有不同程度提升, 第4组imDC纯度最高, 也说明了上述两种细胞因子的促成熟作用. 高剂量组imDC纯度及细胞数目降低, CD80、CD86及MHC-Ⅱ类分子表达随之降低, 考虑浓度过高对DC的抑制作用占据主导地位. 另外, 各组所得DC均对异基因淋巴细胞有较强的激活作用, 提示随着GM-CSF浓度的增加, 成熟状态DC所占比例逐渐提升, 说明该方法诱导DC的可靠性, 细胞增殖指数在5、6组达顶峰, 说明两组细胞mDC数目较多.
总之, 研究发现GM-CSF最适宜浓度范围为10-20 ng/mL, 在该浓度范围内, 低浓度与较高浓度细胞因子均可成功诱导培养出DC. 此外, 我们后期探究发现随着IL-4配伍浓度的增加, 能够使诱导所得DC在数量及纯度上亦有所增加, 且能够提升其成熟度, 但过高的两者浓度, 反而会使细胞凋亡(目前机制不清, 亦未见相关报道), 待进一步研究阐明其机制[15-17].
树突状细胞(dendritic cell, DC)是专职的抗原提呈细胞, 与移植免疫识别关系密切, 在各种肿瘤和微生物感染性疾病中, 起到重要作用. 其可作为诱导机体产生免疫耐受而用以治疗自身免疫性疾病和减轻器官移植免疫排斥, 诱导免疫耐受, 因此任何基础与临床研究均是建立在对其成功诱导的基础上的, 而用GM-CSF协同白介素4(interleukin 4, IL-4)是较为常用的方法之一. 但诸多报道其应用浓度范围太宽泛, 实用性欠缺.
陈淑珍, 研究员, 博士生导师, 中国协和医科大学; 中国医学科学院医药生物技术研究所肿瘤室; 高英堂, 研究员, 天津市第三中心医院
基于DC与肿瘤的发生和器官移植免疫耐受的相关研究一直是最热门的研究方向之一, 部分研究结果已经显示了其强大的临床效应, 但同样其中的诸多机制和通路依然未能阐述清楚, 需大量研究明确.
付必莽等报道半成熟DC的器官移植免疫耐受的诱导及相关机制, 并创新性的使用逆向解剖法游离股骨/胫骨快捷制备小鼠骨髓细胞, 相关研究结果具有极强新意.
目前, 大多数研究都未明确粒-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor, GM-CSF)协同IL-4诱导DC的最适宜浓度, 多数研究浓度范围太广且重复性欠佳, 未能证明GM-CSF对DC诱导的双重效果. 本实验最后得到一个具有探讨性的实验条件, 研究极具实用性.
对GM-CSF协同IL-4诱导DC提出了新的探究性实验结果, 同时比对不同浓度GM-CSF对DC诱导过程中的影响, 具有一定实验指导价值.
DC: 是机体功能最强的专职抗原递呈细胞, 他能高效地摄取、加工处理和递呈抗原, 未成熟DC具有较强的迁移能力, 成熟DC能有效激活初始型T细胞, 处于启动、调控、并维持免疫应答的中心环节. 其与肿瘤及器官移植免疫耐受的形成密切相关.
本文较系统地阐述了粒-巨噬细胞集落刺激因子联合IL-4对小鼠骨髓源性树突状细胞形态、纯度、细胞数目的影响, 探究树突状细胞诱导培养的最适宜条件. 得到一个具有探讨性的实验条件, 具有一定的实用性. 本文逻辑清楚, 重点突出, 有一定的学术价值.
编辑: 于明茜 电编:都珍珍
| 1. | Wijewardana V, Sugiura K, Yahata M, Akazawa T, Wijesekera DP, Imamoto S, Hatoya S, Inoue N, Inaba T. Production of canine soluble CD40 ligand to induce maturation of monocyte derived dendritic cells for cancer immunotherapy. Vet Immunol Immunopathol. 2013;156:121-127. [PubMed] [DOI] |
| 3. | 付 必莽, 苏 莹珍, 何 小文, 胡 安斌, 何 晓顺, 黄 洁夫. 逆向解剖法游离股骨/胫骨快捷制备小鼠骨髓细胞. 中国组织工程研究与临床康复. 2011;15:2601-2604. |
| 4. | Sauter A, Mc Duffie Y, Boehm H, Martinez A, Spatz JP, Appel S. Surface-mediated priming during in vitro generation of monocyte-derived dendritic cells. Scand J Immunol. 2015;81:56-65. [PubMed] [DOI] |
| 5. | Ho VT, Kim HT, Kao G, Cutler C, Levine J, Rosenblatt J, Joyce R, Antin JH, Soiffer RJ, Ritz J. Sequential infusion of donor-derived dendritic cells with donor lymphocyte infusion for relapsed hematologic cancers after allogeneic hematopoietic stem cell transplantation. Am J Hematol. 2014;89:1092-1096. [PubMed] [DOI] |
| 6. | Song Q, Meng Y, Wang Y, Li M, Zhang J, Xin S, Wang L, Shan F. Maturation inside and outside bone marrow dendritic cells (BMDCs) modulated by interferon-α (IFN-α). Int Immunopharmacol. 2013;17:843-849. [PubMed] [DOI] |
| 7. | Dokmanovic L, Krstovski N, Jankovic S, Janic D. Hemophagocytic lymphohistiocytosis arising in a child with Langerhans cell histiocytosis. Turk J Pediatr. 2014;56:452-457. [PubMed] |
| 9. | Braun D, Galibert L, Nakajima T, Saito H, Quang VV, Rubio M, Sarfati M. Semimature stage: a checkpoint in a dendritic cell maturation program that allows for functional reversion after signal-regulatory protein-alpha ligation and maturation signals. J Immunol. 2006;177:8550-8559. [PubMed] [DOI] |
| 10. | Verginis P, Li HS, Carayanniotis G. Tolerogenic semimature dendritic cells suppress experimental autoimmune thyroiditis by activation of thyroglobulin-specific CD4+CD25+ T cells. J Immunol. 2005;174:7433-7439. [PubMed] [DOI] |
| 11. | Liu YJ. Dendritic cell subsets and lineages, and their functions in innate and adaptive immunity. Cell. 2001;106:259-262. [PubMed] |
| 12. | Young JW, Merad M, Hart DN. Dendritic cells in transplantation and immune-based therapies. Biol Blood Marrow Transplant. 2007;13:23-32. [PubMed] [DOI] |
| 13. | Breckpot K, Emeagi P, Dullaers M, Michiels A, Heirman C, Thielemans K. Activation of immature monocyte-derived dendritic cells after transduction with high doses of lentiviral vectors. Hum Gene Ther. 2007;18:536-546. [PubMed] [DOI] |
| 14. | Bordoni V, Castelli G, Montesoro E, Federico M, Sacchi A, Morsilli O, Agrati C, Martini F, Chelucci C. HIV impairs CD34+-derived monocytic precursor differentiation into functional dendritic cells. Int J Immunopathol Pharmacol. 2013;26:717-724. [PubMed] |
| 15. | Califano D, Sweeney KJ, Le H, VanValkenburgh J, Yager E, O'Connor W, Kennedy JS, Jones DM, Avram D. Diverting T helper cell trafficking through increased plasticity attenuates autoimmune encephalomyelitis. J Clin Invest. 2014;124:174-187. [PubMed] [DOI] |
| 16. | Fassbinder T, Saunders U, Mickholz E, Jung E, Becker H, Schlüter B, Jacobi AM. Differential effects of cyclophosphamide and mycophenolate mofetil on cellular and serological parameters in patients with systemic lupus erythematosus. Arthritis Res Ther. 2015;17:92. [PubMed] [DOI] |
| 17. | Globisch T, Steiner N, Fülle L, Lukacs-Kornek V, Degrandi D, Dresing P, Alferink J, Lang R, Pfeffer K, Beyer M. Cytokine-dependent regulation of dendritic cell differentiation in the splenic microenvironment. Eur J Immunol. 2014;44:500-510. [PubMed] [DOI] |