修回日期: 2016-03-24
接受日期: 2016-03-29
在线出版日期: 2016-04-28
目的: 比较表柔比星、奥沙利铂和卡培他滨(mEOX)与伊立替康、5-氟尿嘧啶和亚叶酸钙(FOLFIRI)在晚期胃癌一线治疗中的疗效及不良反应.
方法: 将105例病理学诊断的进展期胃癌患者随机分为mEOX组及FOLFIRI组, mEOX组(n = 55)给予表柔比星50 mg/m2静推, d1; 奥沙利铂130 mg/m2静脉滴注, d1; 卡培他滨625 mg/m2, 2次/d, d1-14, 21 d为1周期, 至少完成2个周期. FOLFIRI组(n = 50)给予伊立替康180 mg/m2, 静脉滴注, d1; 亚叶酸钙400 mg/m2静脉滴入2 h, d1; 5-氟尿嘧啶注射液400 mg/m2静推, d1; 5-氟尿嘧啶1200 mg/m2, 持续22 h静脉滴注或泵入, d1-2, 每14 d为1个周期, 至少用4个周期. 进展后行二线单药化疗. 观察两组的疗效和不良反应.
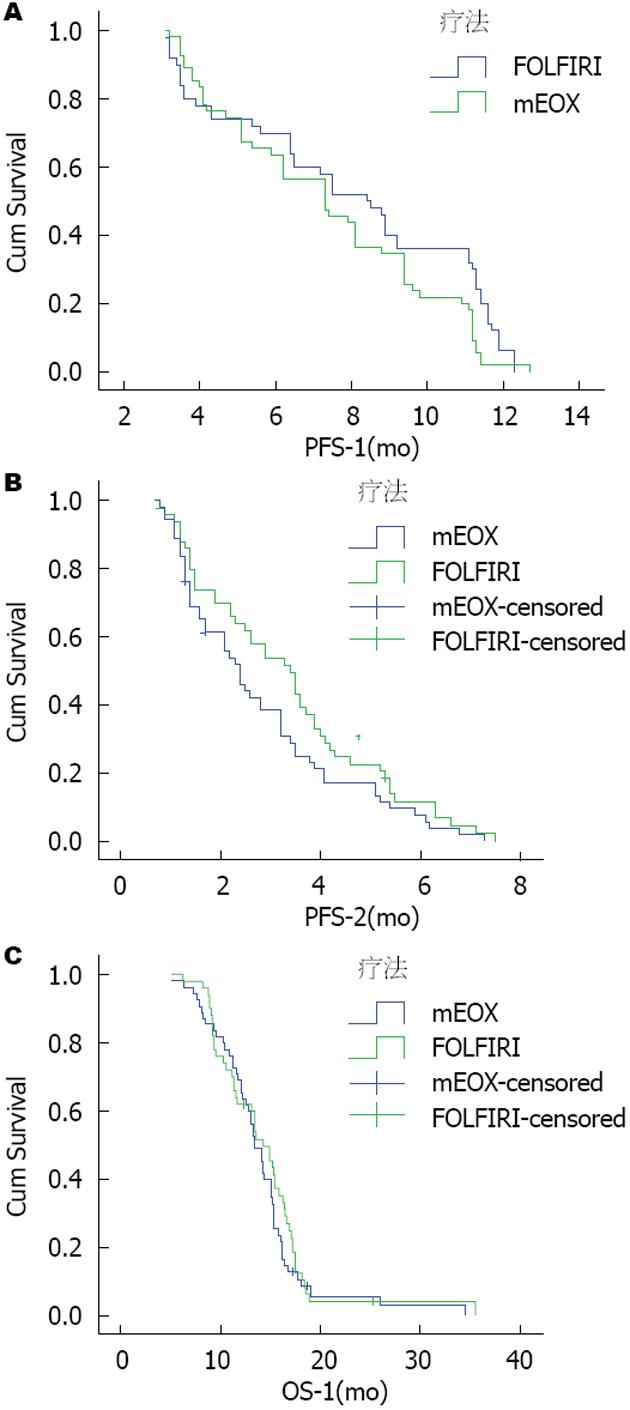
结果: mEOX组及FOLFIRI组客观有效率(objective response rate, ORR)分别为40.0%和48.0%, 差异无统计学意义(P = 0.409); mEOX组及FOLFIRI组一线化疗后的无进展生存期(progression-free survival, PFS)分别为7.3 mo和8.4 mo(P = 0.07), 进展后二线单药化疗中位PFS分别为2.4 mo和3.4 mo(P = 0.098), 总生存期(overall survival, OS)分别为13.5 mo和14.3 mo(P = 0.40), 无统计学差异. 风险比(risk ratio, HR)为0.810(95%CI: 0.501-1.163). 均小于1.25界值, 非劣效性检验成立. mEOX组Ⅲ-Ⅳ度粒细胞减少、血小板减少、贫血及腹泻发生率均明显低于FOLFIRI组, 差异有统计学意义(P<0.05), mEOX组因不良反应至化疗药物减量或延期使用的发生率也明显低于FOLFIRI组, 差异有统计学意义(P<0.05).
结论: mEOX方案方便易用安全有效, 可以成为局部晚期胃癌的标准方案, 值得进一步研究.
核心提示: 本研究中采用表柔比星、奥沙利铂和卡培他滨(mEOX)与伊立替康、5-氟尿嘧啶和亚叶酸钙(FOLFIRI)一线治疗晚期胃癌的疗效, 其中mEOX的客观有效率、无进展生存期及生存期少于FOLFIRI组, 但两组间比较无统计学差异. 在不良反应方面, mEOX组较FOLFIRI组出现更少的粒细胞减少、血小板减少、贫血及腹泻等, 且FOLFIRI组较mEOX组因不良反应至化疗药物减量或延期使用的患者更多, 证明mEOX组同FOLFIRI组一线化疗晚期胃癌患者疗效相当, 但FOLFIRI组伴随更高的血液毒性.
引文著录: 李建旺, 黄春珍, 元建华, 陈琼慧. EOX与FOLFIRI方案一线治疗晚期胃癌的疗效比较. 世界华人消化杂志 2016; 24(12): 1866-1873
Revised: March 24, 2016
Accepted: March 29, 2016
Published online: April 28, 2016
AIM: To compare the efficacy and toxicity of modified epirubicin, oxaliplatin, and capecitabine (EOX) and irinotecan, 5-fluorouracil, and leucovorin (FOLFIRI) regimens in metastatic gastric cancer patients.
METHODS: A total of 105 patients with advanced gastric carcinoma were randomly divided into either an EOX group (n = 55) or a FOLFIRI group (n = 50). The EOX group was given epirubicin 50 mg/m2 iv on day one, oxaliplatin 85 mg/m2 iv on day 1 and capecitabine at a twice-daily dose of 625 mg/m2 po for 2 wk, which was repeated every 3 wk. Efficacy was analyzed at least every 2 cycles along with adverse reactions. Patients in the FOLFIRI group received irinotecan 180 mg/m2 on day 1, leucovorin 400 mg/m2 as two-hour infusion and 5-fluorouracil 400 mg/m2 as a bolus, on day 1 and day 2 followed by 1200 mg/(m2•d) as 22 h continuous infusion regimen every 2 wk. Efficacy was analyzed at least every 4 cycles along with adverse reactions.
RESULTS: The objective response rates (ORR) in the modified EOX group and FOLFIRI group were similar (40.0% vs 48.0%, P = 0.409). The progression-free survival (PFS) rates in the first-line modified EOX group and FOLFIRI group were 7.3 mo and 8.4 mo (P = 0.07), respectively. The PFS rates in the second-line modified EOX group and FOLFIRI group were 2.4 mo and 3.4 mo (P = 0.098), respectively. The overall survival (OS) in the modified EOX group and FOLFIRI group was 13.5 mo and 14.3 mo (P = 0.40), respectively. The risk ratio (HR) of the modified EOX group to the FOLFIRI group was 0.810 (95%CI: 0.501-1.163) and less than 1.25, which suggests that non-inferiority was established. The incidence rates of grades III-IV neutropenia, thrombocytopenia, anemia and stomatitis in the modified EOX group were significantly lower than those in the FOLFIRI group (P < 0.05). The rates of dose reduction and dose delay in the modified EOX group were significantly lower than those in the FOLFIRI group (P < 0.001).
CONCLUSION: The modified EOX regimen is safe and feasible, and has the potential to become a standard regimen against advanced gastric cancer.
- Citation: Li JW, Huang CZ, Yuan JH, Chen QH. Comparison of efficacy of modified EOX and FOLFIRI regimens in treatment of metastatic gastric cancer. Shijie Huaren Xiaohua Zazhi 2016; 24(12): 1866-1873
- URL: https://www.wjgnet.com/1009-3079/full/v24/i12/1866.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i12.1866
胃癌在全世界恶性肿瘤致死原因中位居第3位, 近十年来, 尽管胃癌死亡率每年均有下降趋势, 但超过一半以上患者确诊时已处于中晚期[1], 手术是早期胃癌患者的主要治疗方式, 而晚期进展期胃癌患者往往选择系统化疗和姑息治疗[2]. 一些随机试验显示, 姑息化疗较最佳支持治疗更能提高晚期进展期胃癌患者的生存期[3,4], 但目前可供临床选择的方案仍十分有限. 一项Meta分析的结果显示, 姑息化疗(尤其是3药联合)能使晚期胃癌患者有效的延长生存期[5]. 一项随机试验显示, 表阿霉素、顺铂联合氟尿嘧啶(ECF)组较5-氟尿嘧啶、阿霉素和甲氨蝶啶一线治疗晚期食管胃连接部癌具有更好的无进展生存期(progression-free survival, PFS)和总生存期(overall survival, OS)[6]. REAL-2研究显示, 表阿霉素、奥沙利铂联合卡培他滨(EOX)对比ECF组治疗初治晚期食管胃连接部腺癌患者, 取得生存期更长. 表明卡培他滨替代氟尿嘧啶及奥沙利铂替代顺铂将疗效更好[7]. 法国的一项随机的Ⅲ期临床研究[8]显示, 氟尿嘧啶、亚叶酸钙、伊立替康联用(FOLFIRI)对比ECF耐受性好, 毒性较低, 美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)小组认为 FOLFIRI是一线治疗晚期胃癌患者可接受的选择. 另外, 一项随机对照Ⅲ期临床试验对既往均接受含氟尿嘧啶类及铂类化疗失败后的晚期胃癌患者, 进行最佳支持治疗与挽救性化疗(多西他赛每3 wk 1次或伊立替康每2 wk 1次)对照研究, 结果显示, 二线化疗患者能取得更好的OS[9]. 目前临床仍缺乏标准的一线化疗方案. 因此, 本研究主要目的在于比较一线mEOX和FOLFIRI方案对晚期胃癌患者的临床疗效.
105例患者均为2009-01/2014-06在海口市人民医院肿瘤科住院患者, 且均经病理明确诊断为胃腺癌, 具有临床可评价病灶, 所有患者中男69例, 女36例, 年龄32-70岁, 中位年龄为52岁, 17例患者接受过胃癌手术, 其中7例行姑息性全胃切除, 88例未行手术治疗. 105例患者中, 弥漫型腺癌30例, 肠型腺癌39例, 其他型腺癌36例. 所有患者有明确的观察指标, 可经CT或MRI检测病灶大小结果; 既往未接受过化疗或辅助治疗, 如曾使用过化疗方案中同类药物者停用化疗>6 mo; 肝肾功能、白细胞和血小板均正常, 无化疗禁忌证; ECOG评分≤2分; 没有第二原发肿瘤. 病变侵及一个脏器或部位者59例, 侵及两个及以上脏器或部位者46例, 其中肝转移36例, 肺转移16例, 腹膜后淋巴结转移41例, 锁骨上淋巴结19例, 盆腔转移13例. 105例患者随机分为A、B两组, 所有患者均签署化疗知情同意书, 其中A组为mEOX, B组为FOLFIRI组. 两组在年龄、性别、ECOG评分、原发肿瘤部位、病理特征等方面具均有可比性(表1). 注射用盐酸表柔比星, 辉瑞制药有限公司生产, 规格10 mg/支, 产品批号: 20100320; 奥沙利铂, 杭州赛诺菲生产, 规格: 50 mg/支, 批号: 0906087; 卡培他滨, 上海罗氏制药有限公司生产, 片剂, 规格为0.15 g, 生产批号: SH0216; 伊立替康, 齐鲁制药有限公司生产, 规格: 每支(瓶)0.1 g, 批号: B2E0903001; 亚叶酸钙, 山东罗欣药业股份有限公司生产, 规格: 每支(瓶)0.1 g, 批号: 0903209-2; 5-氟尿嘧啶注射液, 天津金耀氨基酸有限公司生产, 规格: 每支(瓶)0.25 g, 批号: 0902221; 多西他赛, 赛诺菲安万特生产, 规格: 20 mg/支, 批号: 100666-200401; 紫杉醇, 哈药集团生物工程有限公司生产, 规格: 5 mL:30 mg, 产品批号: 20100913.
| 临床特点 | mEOX(n = 55) | FOLFIRI(n = 50) | P值 |
| 年龄(岁) | 0.20 | ||
| <50 | 24(43.6) | 18(36.0) | |
| ≥50 | 31(56.4) | 32(64.0) | |
| 性别 | 0.74 | ||
| 男 | 35(63.6) | 34(68.0) | |
| 女 | 20(36.4) | 16(32.0) | |
| ZPS评分 | 0.68 | ||
| 0 | 4(7.3) | 5(10.0) | |
| 1 | 47(94.0) | 38(76.0) | |
| 2 | 4(7.3) | 7(14.0) | |
| 既往胃手术史 | 0.27 | ||
| 无 | 45(81.8) | 43(86.0) | |
| 有 | 10(18.2) | 7(14.0) | |
| CEA基线水平(ng/mL) | <0.01 | ||
| <50 | 41(74.5) | 12(24.0) | |
| ≥50 | 14(25.5) | 38(76.0) | |
| CA19-9基线水平(ng/mL) | 0.57 | ||
| <50 | 24(43.6) | 23(46.0) | |
| ≥50 | 31(56.4) | 27(54.0) | |
| 既往放疗史 | 0.27 | ||
| 无 | 46(83.6) | 42(84.0) | |
| 放化疗 | 9(16.4) | 7(14.0) | |
| 姑息放疗 | 0(0.0) | 1(2.0) | |
| 肿瘤初始部位 | 0.04 | ||
| 胃食管连接部 | 6(10.9) | 5(10.0) | |
| 胃 | 49(89.1) | 45(90.0) | |
| Ô发肿瘤病理特征 | 0.20 | ||
| 弥漫型腺癌 | 12(21.8) | 18(36.0) | |
| 肠型腺癌 | 22(40.0) | 17(34.0) | |
| 其他类型腺癌 | 21(38.2) | 15(30.0) | |
| 转移部位数 | 0.92 | ||
| 1 | 32(58.2) | 27(54.0) | |
| >2 | 23(41.8) | 23(46.0) | |
| 既往化疗史 | 0.11 | ||
| 无 | 47(85.5) | 43(86.0) | |
| 氟尿嘧啶类 | 4(7.3) | 4(8.0) | |
| 顺铂为基础 | 4(7.3) | 3(6.0) |
1.2.1 治疗: A组(EOX组)采用注射用盐酸表柔比星50 mg/m2静推, d1: 奥沙利铂130 mg/m2静脉滴注, d1; 卡培他滨625 mg/m2, 2次/d, d1-14, 餐后服用, 21 d为1周期. B组(FOLFIRI组)采用伊立替康180 mg/m2, 静脉滴注, d1; 亚叶酸钙400 mg/m2静脉滴入2 h, d1; 5-氟尿嘧啶注射液400 mg/m2静推, d1; 5-氟尿嘧啶1200 mg/m2, 持续22 h静脉滴注或泵入, d1-2, 每14 d为1个周期. 两组化疗前后常规予以止吐处理; 因腹泻为伊立替康的剂量限制性毒性, 一旦出现腹泻, 采用易蒙停每2 h口服对症处理腹泻症状. 全部患者均接受2周期以上的全身静脉化疗, 两组均治疗到疾病进展或出现无法耐受的不良反应. A组2个化疗周期结束后7 d临床评价疗效, B组3周期化疗结束后12 d评价疗效. 复查影像学评价疗效, 治疗后每周行血常规、肝肾功能检查. 化疗后复查经RECIST标准评价进展后, 体能状况好的患者继续进行了单药二线化疗, 均为与一线治疗无交叉耐药的化疗药物. 分别为: 多西他赛75 mg/m2, 持续静脉滴入1 h, d1; 21 d为1个周期. 两组化疗前1 d开始常规使用地塞米松7.5 mg, 口服, 2次/d, 连服3 d, 预防多西他赛引起的水钠储留. 伊立替康350 mg/m2, 静脉滴注, d1; 21 d为1个周期. 紫杉醇175 mg/m2, 静脉滴注, d1; 21 d为1个周期, 化疗后每2周期评价疗效.
1.2.2 评价标准: (1)治疗和疗效评估: 按照RICIST1.1实体瘤客观疗效评定标准进行评价, 分为完全缓解(complete remission, CR), 部分缓解(partial remission, PR)和稳定(stable disease, SD), 疾病进展(progressive disease, PD). 客观缓解率(objective response rate, ORR)为CR+PR, 疾病控制率(disease control rate, DCR) = CR+PR+SD. 体能状态(performance status scale, PS)评价按照美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)一般状况评分标准, 分为0-5分. PFS定义为从治疗开始至肿瘤客观进展或任何原因的死亡的时间. OS是指从治疗开始至死亡或末次随访的时间. 本研究中, PFS-1定义为从一线化疗开始至肿瘤客观进展或任何原因的死亡的时间, PFS-2定义为从二线治疗开始至肿瘤客观进展或任何原因的死亡的时间. 随访采取来院复查或电话询问方式, 随访直至患者死亡或2015-09-30; (2)不良反应评价: 根据NCICTC 3.0标准评价不良反应, 分为0-4级; 而神经系统毒性参照奥沙利铂专用Levi神经病变分级标准进行评价, 分为0-4级: 0级, 无反应; 1级, 感觉异常或感觉迟钝(遇冷引起), 7 d内完全消退; 2级, 感觉异常或感觉迟钝, 21 d内能完全消退; 3级, 感觉异常或感觉迟钝, 21 d内不能完全消退; 4级, 感觉异常或感觉迟钝, 伴有功能障碍.
统计学处理 意向性分析数据集(intention to treat, ITT)分析所有随机患者. 符合方案数据集(per-protocol population, PP)分析指将明显违犯方案(major protocol violations)的患者排除分析之外. 接受过化疗者都归入安全性分析. 非劣效性检验采用单侧可信区间法. 主要研究终点是PP分析, 以证明mEOX与FOLFIRI比较, 肿瘤疗效ORR的非劣效性. ORR非劣效性指mEOX与FOLFIRI治疗组之间的ORR差异的单侧95%可信区间的上限低于15%. 在α = 0.05的显著性水平下, 单侧Ⅰ型错误为5%, 设定非劣效界值δ为0.15, 确保80%效能验证mEOX与FOLFIRI的ORR非劣效性. 并行ITT分析研究结果. 采用COX回归分析PFS、OS; 双侧90%CI上限低于非劣效性所需界值(1.25)被证明非劣效性. 应用SPSS13.0软件进行数据分析处理, 计数资料比较采用χ2检验, 等级资料比较采用秩和检验. PFS采用Kaplan-Meier法, 生存时间比较采用Log-rank检验. 以mEOX与FOLFIRI对比的HR值95%CI<1.25为有统计学意义, 单侧检验. 其余均为双侧检验, 检验水准α = 0.05, 以P<0.05为差异有统计学意义.
本研究中位年龄52岁(32-70岁), 其中mEOX组51岁(30-71岁), FOLFIRI组52岁(31-72岁), 两组间无显著差异(P = 0.43). 共15例患者在辅助化疗±放疗后出现转移, 90例患者确诊胃癌时已处于进展期或远处转移. 两组患者中初始行放疗或辅助化疗治疗史比例无显著差异, 初始行手术切除史患者比例亦相似.
105例晚期胃癌患者经mEOX或FOLFIRI一线化疗, 其中mEOX组患者先期共完成中位5周期(3-7周期)mDCF方案化疗, 而FOLFIRI组共完成中位6周期(2-8周期)mDCF方案化疗. 在mEOX和FOLFIRI组中分别各完成一线化疗5.2周期(3-9周期)和4.7周期(2-8周期)(P = 0.48). PP分析的mEOX ORR不劣于FOLFIRI, mEOX为40.0%和FOLFIRI为48.0%(P = 0.409), 组间差异为8.0%; 单侧95%CI的上限为14.6%, 低于非劣效性所需的上限界值(15%). ITT分析的mEOX的ORR不劣于FOLFIRI; mEOX为48%和FOLFIRI为53%; 组间差异为5.0%; 单侧95%CI的上限为14.8%, 低于非劣效性所需的上限值(15%). 近期疗效情况如表2. mEOX和FOLFIRI两组间一线化疗后中位PFS分别为7.3 mo和8.4 mo, 两组间无统计学差异(P = 0.07)(图1A). 进展后行二线单药化疗中位PFS分别为2.4 mo和3.4 mo, FOLFIRI组略高于mEOX组(P = 0.098)(图1B). 两组间患者中位OS分别为13.5 mo和14.3 mo, 组间无统计学差异(P = 0.40)(图1C). 将分组作为协变量进行Cox回归分析, mEOX组相对FOLFIRI组HR = 0.810(95%CI: 0.501-1.163), 95%CI上限<1.25, 提示mEOX组疗效相对FOLFIRI组非劣效性成立.
| 近期疗效 | mEOX(n = 55) | FOLFIRI(n = 50) | P值 |
| 一线化疗疗效 | |||
| CR | 0(0.0) | 0(0.0) | |
| PR | 22(40.0) | 24(48.0) | |
| SD | 16(29.0) | 12(24.0) | |
| PD | 17(31.0) | 14(28.0) | |
| ORR | 22(40.0) | 24(48.0) | 0.409 |
| DCR | 38(69.0) | 36(72.0) | 0.744 |
| 二线化疗疗效 | |||
| CR | 0(0.0) | 0(0.0) | |
| PR | 12(21.8) | 9(18.0) | |
| SD | 10(18.2) | 15(30.0) | |
| PD | 33(60.0) | 26(52.0) | |
| ORR | 12(21.8) | 9(18.0) | 0.81 |
| DCR | 22(40.0) | 24(48.0) |
两组间最常见的血液不良反应均为中性粒减少和贫血, mEOX组较FOLFIRI组出现更少的中性粒减少、血小板减少和贫血等不良反应. FOLFIRI组较mEOX组转氨酶明显增高(P = 0.001), 腹泻明显增多(P = 0.003). 两组间血清肌酐变化水平无明显差异(P = 0.43), mEOX组与FOLFIRI组因不良反应致化疗药物减量使用患者分别为4例(7.3%)和36例(72.0%)(P<0.001). 而因不良反应致化疗时间耽搁的两组间患者分别为8例(14.5%)和26例(52.0%)(P<0.001)(表3).
| 不良反应 | mEOX(n = 55) | FOLFIRI(n = 50) | P值 |
| 血液不良反应 | |||
| 中性粒细胞减少 | <0.001 | ||
| Ⅰ-Ⅳ | 11(20.0) | 49(98.0) | |
| Ⅲ-Ⅳ | 3(5.5) | 13(26.0) | |
| 粒细胞减少性发热 | 1.0 | ||
| Ⅰ-Ⅳ | 3(5.5) | 3(6.0) | |
| Ⅲ-Ⅳ | 2(3.6) | 3(6.0) | |
| 贫血 | 0.02 | ||
| Ⅰ-Ⅳ | 24(43.6) | 34(68.0) | |
| Ⅲ-Ⅳ | 1(1.8) | 1(2.0) | |
| 血小板 | <0.001 | ||
| Ⅰ-Ⅳ | 3(5.5) | 46(92.0) | |
| Ⅲ-Ⅳ | 0(0.0) | 1(2.0) | |
| 非血液学不良反应 | |||
| 恶心/呕吐 | 0.82 | ||
| Ⅰ-Ⅳ | 12(21.8) | 10(20.0) | |
| Ⅲ-Ⅳ | 0(0.0) | 0(0.0) | |
| 腹泻 | 0.003 | ||
| Ⅰ-Ⅳ | 1(1.8) | 11(22.0) | |
| Ⅲ-Ⅳ | 0(0.0) | 1(2.0) | |
| 口腔炎 | 1.0 | ||
| Ⅰ-Ⅳ | 3(5.5) | 2(4.0) | |
| Ⅲ-Ⅳ | 0(0.0) | 0(0.0) | |
| 手足综合征 | 0.88 | ||
| Ⅰ-Ⅳ | 4(7.2) | 5(10.0) | |
| Ⅲ-Ⅳ | 1(0.0) | 2(4.0) | |
| 外周神经毒性 | 0.01 | ||
| Ⅰ-Ⅳ | 13(23.6) | 2(4.0) | |
| Ⅲ-Ⅳ | 1(1.8) | 1(2.0) |
胃癌大多确诊时已处于中晚期, 常已失去手术机会, 5年生存率不足20%, 是严重威胁我国人民身体健康的主要癌症之一, 化疗是治疗晚期进展期胃癌的重要手段之一[1]. 胃癌是化疗相对敏感的肿瘤, 研究[3]显示, 姑息化疗较最佳支持治疗更能提高晚期进展期胃癌患者的生存期. 随着近年来很多新药显示出对胃癌的良好抗癌活性, 包括奥沙利铂、紫杉醇、卡培他滨、替吉奥胶囊、伊立替康等这些药物一线治疗胃癌有效率为17%-30%, 可使生存期有所延长, 同时与传统药物联合使用可更好的提高疗效[10]. ECF、DCF和FOLFIRI 3药联合方案被欧洲肿瘤内科学会(European Society for Medical Oncology, ESMO)及NCCN指南作为晚期胃癌患者化疗获得1类证据推荐[11,12]. 但ECF方案引起的肾毒性、较严重的骨髓抑制及氟尿嘧啶的21 d持续静脉滴注使很多患者不能耐受, 依从性也较差. 奥沙利铂作为第三代铂类抗癌药物, 较顺铂细胞毒性更强而肾脏毒性大大降低, 且消化系反应轻微, 其对胃癌有良好治疗价值. 希罗达其抗肿瘤作用不亚于5-氟尿嘧啶,患者的依从性则较使用5-氟尿嘧啶明显提高[13]. 本研究将奥沙利铂替代顺铂, 以希罗达替代5-氟尿嘧啶, 组成EOX方案, 一方面基于药物的协同作用, 另一方面考虑药物的高效低毒的原则. 由此, 本研究主要目的在于比较改良EOX和FOLFIRI方案对晚期胃癌患者一线治疗的临床疗效, 并于进展后体能状况好的患者继续给予二线单药化疗, 评估PFS及OS. 本实验可望为临床选择晚期胃癌一线化疗方案提供有效的临床参考依据.
本研究中mEOX和FOLFIRI组一线化疗后ORR分别为40.0%和48.0%, 中位PFS分别为7.3 mo和8.4 mo, OS分别为13.5 mo和14.3 mo, 两组间均无统计学差异(P>0.05). REAL-2研究[7]中, EOX化疗组ORR为47.9%, 中位PFS为7.0 mo及OS为11.2 mo. 与本研究结果基本相似, 而本研究中mEOX组OS较REAL-2研究稍延长, 可能与本研究中患者均接受二线化疗有关. 而近来Guimbaud等[8]完成的随机Ⅲ期临床研究, 对比FOLFIRI与ECF作为一线治疗晚期胃癌或胃食管交界腺癌. 在此研究中, 416例患者(65%的患者胃腺癌, 33%有胃食管交界腺癌)随机接受FOLFIRI或ECF方案化疗. 平均随访31 mo, FOLFIRI对比ECX中位至治疗失败时间(time to treatment failure, TTF)大大延长, 分别为5.1 mo和4.2 mo, P = 0.008, PFS为5.3 mo和5.8 mo, P = 0.96, OS为9.5 mo和9.7 mo, P = 0.95, ORR为39.2%和37.8%, 均无显著差异. FOLFIRI对比ECF耐受性好, 毒性较低. 本研究组中FOLFIRI组PFS及OS均较该研究稍延长, 可能与该研究入组中近1/3患者为胃食管交接处腺癌具有相对更差预后相关. 本研究中mEOX组较FOLFIRI组出现更少的粒细胞减少、血小板减少、贫血及腹泻等不良反应. 而FOLFIRI组较mEOX组因不良反应至化疗药物减量或延期使用的患者更多(P<0.001). 这可能与本研究中使用卡培他滨替代氟尿嘧啶、奥沙利铂替代顺铂具有更低的不良反应有关. 本研究中与REAL-2研究[7]及Guimbaud等[8]的研究结果相似.
本研究中进展后行二线单药化疗mPFS分别为2.4 mo和3.4 mo, 两组间无统计学差异(P = 0.098). 在近期发表的TCOG GI-0801 Ⅲ期临床研究中, 伊立替康单药二线化疗既往一线使用S-1为基础化疗失败的晚期胃癌, 其中位PFS为2.8 mo[14]. 与本研究结果相似.
HER-2过表达常预示肿瘤侵袭性强、病理分级高及预后差[15]. 一项Ⅲ期试验ToGA研究证实, HER-2阳性的晚期胃癌患者联合赫赛丁治疗能获得PFS和OS提高. 但因本研究中多数患者HER-2未检测, 其在两组患者中分布情况未知, 由此, 在HER-2阳性的晚期胃癌患者一线化疗有效性无法评估. 此为本研究一项不足.
我们推测, mECX方案和FOLFIRI方案均可作为晚期胃癌患者的一线治疗方案, 两者具有相似的疗效, 但不良反应存在差异, mECX方案较FOLFIRI不良反应更少, 耐受性更好, 值得临床进一步推广使用.
2012年全球胃癌新发病例近1百万, 在全世界恶性肿瘤发病率位居第5位, 在癌症死亡原因中位居第3位, 胃癌近一半发生在东亚, 主要在我国, 且大多确诊时已处于中晚期, 常已失去手术机会, 同时早期胃癌患者术后2年内有一半以上出现转移, 5年生存率不足20%, 是严重威胁我国人民身体健康的主要癌症之一, 化疗是治疗晚期胃癌的重要手段之一.
郭强, 主任医师, 云南省第一人民医院
多年来, 晚期胃癌的治疗似乎进入"瓶颈"阶段期, 目前化疗仍然是晚期胃癌的主要治疗手段, 但尚无标准方案. 与最佳支持治疗相比, 化疗可延长患者中位生存期, 提高其生存质量. 近年来, 随着各种新型抗癌药物的出现, 化疗方案不断演进, 晚期胃癌的治疗有效率和生存期得到进一步提高, 如何选择高效低毒的化疗药物联合治疗是当前临床研究的热点. 同时, 随着胃癌分子生物学研究的不断深入, 针对人表皮生长因子受体-2、表皮生长因子受体、血管内皮生长因子的分子靶向治疗也成为胃癌综合治疗的热点.
有文献报道, 在联合化疗方案中, 卡培他滨较氟尿嘧啶、奥沙利铂较顺铂具有更好的疗效. 荟萃分析显示, 与氟尿嘧啶相比, 联合卡培他滨的化疗方案将延长患者生存期, 并提高客观反应率及生存率.
一项来自法国的临床3期研究对416例晚期胃癌和胃食管连接部癌患者给予FOLFIRI和ECF一线化疗, 结果显示, FOLFIRI组比较ECF组疗效相似, 但不良反应更低, 耐受性更好. 而本研究使用卡培他滨替代氟尿嘧啶、奥沙利铂替代顺铂的改良EOX方案, 相反却显示出较FOLFIRI疗效相当, 不良反应更轻, 患者耐受性更好.
本文推测, 3药联合mECX方案和FOLFIRI方案一线治疗晚期胃癌患者具有相似的较好疗效, 较单药及两药联合均可能略有生存优势, 且不良反应均能耐受. mEOX较FOLFIRI不良反应更低, 患者耐受性更好. 两组方案均值得临床进一步推广应用. 因本研究病例数相对较少, 且为单中心研究, 还有待进一步多中心大样本研究.
本文的实验设计是非劣效性研究, 实验假设的基础是改良的EOX方案从PFS及OS均不劣于指南中I类化疗方案FOLFIRI, 而且改良的EOX方案的毒性更小, 耐受性更好, 有一定的临床指导意义.
编辑: 郭鹏 电编:闫晋利
| 1. | Siegel R, Ma J, Zou Z, Jemal A. Cancer statistics, 2014. CA Cancer J Clin. 2014;64:9-29. [PubMed] [DOI] |
| 2. | Thuss-Patience PC, Kretzschmar A, Bichev D, Deist T, Hinke A, Breithaupt K, Dogan Y, Gebauer B, Schumacher G, Reichardt P. Survival advantage for irinotecan versus best supportive care as second-line chemotherapy in gastric cancer--a randomised phase III study of the Arbeitsgemeinschaft Internistische Onkologie (AIO). Eur J Cancer. 2011;47:2306-2314. [PubMed] [DOI] |
| 3. | Van Cutsem E, Moiseyenko VM, Tjulandin S, Majlis A, Constenla M, Boni C, Rodrigues A, Fodor M, Chao Y, Voznyi E. Phase III study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer: a report of the V325 Study Group. J Clin Oncol. 2006;24:4991-4997. [PubMed] [DOI] |
| 4. | Koizumi W, Narahara H, Hara T, Takagane A, Akiya T, Takagi M, Miyashita K, Nishizaki T, Kobayashi O, Takiyama W. S-1 plus cisplatin versus S-1 alone for first-line treatment of advanced gastric cancer (SPIRITS trial): a phase III trial. Lancet Oncol. 2008;9:215-221. [PubMed] [DOI] |
| 5. | Wagner AD, Grothe W, Haerting J, Kleber G, Grothey A, Fleig WE. Chemotherapy in advanced gastric cancer: a systematic review and meta-analysis based on aggregate data. J Clin Oncol. 2006;24:2903-2909. [PubMed] [DOI] |
| 6. | Webb A, Cunningham D, Scarffe JH, Harper P, Norman A, Joffe JK, Hughes M, Mansi J, Findlay M, Hill A. Randomized trial comparing epirubicin, cisplatin, and fluorouracil versus fluorouracil, doxorubicin, and methotrexate in advanced esophagogastric cancer. J Clin Oncol. 1997;15:261-267. [PubMed] |
| 7. | Cunningham D, Starling N, Rao S, Iveson T, Nicolson M, Coxon F, Middleton G, Daniel F, Oates J, Norman AR. Capecitabine and oxaliplatin for advanced esophagogastric cancer. N Engl J Med. 2008;358:36-46. [PubMed] [DOI] |
| 8. | Guimbaud R, Louvet C, Ries P, Ychou M, Maillard E, André T, Gornet JM, Aparicio T, Nguyen S, Azzedine A. Prospective, randomized, multicenter, phase III study of fluorouracil, leucovorin, and irinotecan versus epirubicin, cisplatin, and capecitabine in advanced gastric adenocarcinoma: a French intergroup (Fédération Francophone de Cancérologie Digestive, Fédération Nationale des Centres de Lutte Contre le Cancer, and Groupe Coopérateur Multidisciplinaire en Oncologie) study. J Clin Oncol. 2014;32:3520-3526. [PubMed] |
| 9. | Kang JH, Lee SI, Lim do H, Park KW, Oh SY, Kwon HC, Hwang IG, Lee SC, Nam E, Shin DB. Salvage chemotherapy for pretreated gastric cancer: a randomized phase III trial comparing chemotherapy plus best supportive care with best supportive care alone. J Clin Oncol. 2012;30:1513-1518. [PubMed] [DOI] |
| 10. | Pozzo C, Barone C. Is there an optimal chemotherapy regimen for the treatment of advanced gastric cancer that will provide a platform for the introduction of new biological agents? Oncologist. 2008;13:794-806. [PubMed] [DOI] |
| 11. | Waddell T, Verheij M, Allum W, Cunningham D, Cervantes A, Arnold D. Gastric cancer: ESMO-ESSO-ESTRO clinical practice guidelines for diagnosis, treatment and follow-up. Eur J Surg Oncol. 2014;40:584-591. [PubMed] [DOI] |
| 12. | Ajani JA, Bentrem DJ, Besh S, D'Amico TA, Das P, Denlinger C, Fakih MG, Fuchs CS, Gerdes H, Glasgow RE. Gastric cancer, version 2.2013: featured updates to the NCCN Guidelines. J Natl Compr Canc Netw. 2013;11:531-546. [PubMed] |
| 13. | Wu Y, Wei ZW, He YL, Schwarz RE, Smith DD, Xia GK, Zhang CH. Efficacy of adjuvant XELOX and FOLFOX6 chemotherapy after D2 dissection for gastric cancer. World J Gastroenterol. 2013;19:3309-3315. [PubMed] [DOI] |
| 15. | Bang YJ, Van Cutsem E, Feyereislova A, Chung HC, Shen L, Sawaki A, Lordick F, Ohtsu A, Omuro Y, Satoh T. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010;376:687-697. [PubMed] [DOI] |