修回日期: 2016-03-17
接受日期: 2016-03-22
在线出版日期: 2016-04-18
目的: 探讨代谢综合征(metabolic syndrome, MS)与小肠黏膜损伤的关系.
方法: 按入排标准回顾性收录自2011-08/2015-10于广东药学院附属第一医院住院行胶囊内镜检查者的临床资料. 比较MS组与对照组(无MS任一组分)患者小肠黏膜不同病变的发生率、Lewis评分、小肠损伤严重程度, MS不同组分与小肠黏膜损伤的情况以及胰岛素抵抗与小肠黏膜损伤的相关性.
结果: 收录343例患者的临床资料, 最终179例患者的资料可用于分析. 其中诊断为MS者34例, 对照组者145例. MS组小肠绒毛水肿发生率显著高于对照组(70.6% vs 33.1%, χ2 = 16.10, P<0.001), 但两组溃疡发生率则无统计学差异(8.8% vs 4.8%, P = 0.404). MS组Lewis评分也显著高于对照组(76.62分±81.55分 vs 43.59分±86.96分, t = -2.016, P<0.001). 高血糖患者Lewis评分比无高血糖患者高34.242分±17.263分, 结果有统计学意义(t = 1.984, P = 0.048). 此外, 胰岛素抵抗指数越高, 小肠Lewis评分越高(B = 8.173, t = 2.173, P = 0.032).
结论: MS可能为小肠黏膜损伤的危险因素, 而高血糖则可能是MS引起小肠黏膜损伤最重要的组分.
核心提示: 本文发现代谢综合征(metabolic syndrome, MS)可能为小肠黏膜损伤的危险因素, 而高血糖可能是MS引起小肠黏膜损伤最重要的组分. 此外, 胰岛素抵抗越严重, 小肠损伤越严重. 因此, 控制血糖及改善胰岛素抵抗或有助于MS患者小肠黏膜损伤的治疗.
引文著录: 钟豪杰, 吴礼浩, 陈羽, 陈美慧, 何兴祥. 代谢综合征与小肠黏膜损伤的相关性. 世界华人消化杂志 2016; 24(11): 1754-1759
Revised: March 17, 2016
Accepted: March 22, 2016
Published online: April 18, 2016
AIM: To investigate the relationship between metabolic syndrome and small intestinal mucosal injury.
METHODS: Medical data of inpatients who underwent capsule endoscopy at Guangdong Pharmaceutical University from August 2011 to October 2015 were analyzed retrospectively. Different types of mucosal injuries, Lewis score and degree of severity were compared between patients with metabolic syndrome and those without. The effect of different components of metabolic syndrome on small intestinal mucosal injury and the relation between insulin resistance and Lewis score were assessed.
RESULTS: Medical data of 179 patients could be used for analysis. Thirty-four patients with metabolic syndrome were included in a metabolic syndrome group, and 145 patients without metabolic syndrome were included in a control group. The prevalence of villous edema was significantly higher in the metabolic syndrome group (70.6% vs 33.1%, χ2 = 16.10, P < 0.001), but the incidence of ulcers showed no significant difference (8.8% vs 4.8%, P = 0.404). In the metabolic syndrome group, Lewis score was also significantly higher (76.62 ± 81.55 vs 43.59 ± 86.96, t = -2.016, P < 0.001). The Lewis score of patients with hyperglycemia was 34.242 ± 17.263, which was higher than that of patients without hyperglycemia (t = 1.984, P = 0.048). A higher homeostasis model assessment of insulin resistance value was associated with a higher Lewis score (B = 8.173, t = 2.173, P = 0.032).
CONCLUSION: Metabolic syndrome may be a risk factor for small intestinal mucosal injury. Hyperglycemia may be the most effective component of metabolic syndrome for inducing small intestinal mucosal injury.
- Citation: Zhong HJ, Wu LH, Chen Y, Chen MH, He XX. Metabolic syndrome is associated with more serious small intestinal mucosal injury. Shijie Huaren Xiaohua Zazhi 2016; 24(11): 1754-1759
- URL: https://www.wjgnet.com/1009-3079/full/v24/i11/1754.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i11.1754
代谢综合征(metabolic syndrome, MS)是一组以肥胖、高血糖、血脂异常以及高血压等为特点的临床症候群. 随着中国人群生活结构及生活方式的改变, 我国MS的患病率已由2002年的5.4%上升至2010年的21.3%[1]. MS不仅是心血管疾病及2型糖尿病的危险因素[2], 也是多种消化道疾病的危险因素[3,4]. 大量临床及基础研究提示MS及其组分可引起肠道微生态失衡[5]、血管病变[6]、血液高凝状态[7]、炎症因子释放[8]等病理生理学改变, 这些改变均可诱发肠黏膜炎症.
小肠疾病因发生率较低、诊断难度较大等原因未得到足够的重视. 但是, 小肠黏膜损伤可导致糜烂、溃疡、出血, 甚至穿孔等严重后果. 小肠黏膜损伤的危险因素, 如长期服用非甾体类药物、肝硬化并门脉高压等, 在国内外已被广泛报道[9,10]. 但是, MS与内镜下小肠黏膜损伤的关系仍未见报道. 因此, 我们使用胶囊内镜探讨MS与小肠黏膜损伤的关系.
患者的纳入标准: 自2011-08/2015-10于广东药学院附属第一医院因不明原因的消化道出血、腹痛、腹泻、消瘦等行胶囊内镜检查的住院患者. 排除标准: (1)被诊断为恶性肿瘤; (2)近期服用非甾体类药物; (3)克罗恩病; (4)胃肠道感染, 如急性胃肠炎、肠结核、肠道寄生虫等; (5)小肠梗阻及其他原发性小肠疾病; (6)严重心、肺、肝、肾疾病; (7)病历资料不齐全.
回顾性地收集患者性别、年龄、体质量指数(body mass index, BMI)、烟酒史、高血压病史、糖尿病病史、血糖、血脂、空腹胰岛素、幽门螺旋杆菌(Helicobacter pylori, H. pylori)感染情况及胶囊内镜结果等资料. 稳态模型胰岛素抵抗指数(homeostasis model assessment for insulin resistance, HOMA-IR)计算方式如下: HOMA-IR = 空腹血糖×空腹胰岛素/22.5[11].
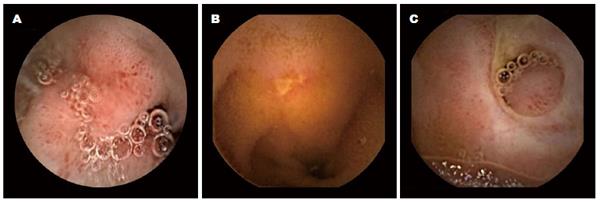
使用Lewis评分对小肠黏膜损伤进行评价. 小肠黏膜损伤主要指小肠黏膜的炎性改变, 包括绒毛水肿、溃疡及狭窄(图1)[12]. 依据胶囊内镜通过小肠的时间将小肠平均分为3段. 小肠黏膜损伤总分等于损伤最严重的肠段得分加狭窄得分, 并依据总分将小肠损伤分为不明显、轻度、中重度3个严重程度.
MS诊断依据2004年中华医学会的标准, 具体如下: (1)BMI≥25.0 kg/m2; (2)空腹血糖≥6.1 mmol/L和/或2 h PG≥7.8 mmol/L, 和/或已确诊为糖尿病并治疗者; (3)SBP/DBP≥140/90 mmHg, 和/或已确诊为高血压并治疗者; (4)空腹血甘油三酯≥1.7 mmol/L, 和/或空腹LDL-C<0.9 mmol/L(男)或<1.0 mmol/L(女); (5)具备以上4项组分成分中的3项或全部者[13].
统计学处理 使用SPSS19.0进行统计分析. 连续变量用mean±SD表示, 分类变量用频数(百分比)表示. 服从正态分布的两组均值的比较使用独立样本t检验, 不服从正态分布的两组连续变量的比较使用Mann-Whitney U检验. 两组二项分类的比较使用四格表卡方检验或Fisher确切概率法. MS各组分对小肠黏膜损伤的影响及胰岛素抵抗指数对小肠黏膜损伤的影响使用多元线性回归进行分析. P<0.05为差异有统计学意义.
纳入343例患者, 最终179例患者的资料可用于分析. 其中MS组(符合MS诊断标准者)34例, 对照组(无MS诊断标准中任一组分者)145例. 两组患者的一般资料如表1.
| 项目 | 对照组(n = 145) | MS组(n = 34) | P值 |
| 男性[n(%)] | 67(46.2) | 21(61.8) | 0.102 |
| 年龄(岁) | 51.57±13.87 | 68.68±13.063 | <0.001 |
| 幽门螺杆菌感染[n(%)] | 95(65.5) | 20(58.8) | 0.464 |
| 吸烟[n(%)] | 23(15.9) | 7(20.6) | 0.507 |
| 饮酒[n(%)] | 10(6.9) | 5(14.7) | 0.167 |
表2可见MS组小肠绒毛水肿发生率显著高于对照组(70.6% vs 33.1%, χ2 = 16.10, P<0.001), 小肠溃疡发生率也高于对照组, 但无统计学差异(8.8% vs 4.8%, P = 0.404). 纳入患者的小肠均未见明显狭窄. MS组小肠Lewis评分也显著高于对照组(76.62分±81.55分 vs 43.59分±86.96分, t = -2.016, P<0.001), 但两组患者的小肠损伤严重程度无统计学差异(P = 0.116).
| 项目 | 对照组(n = 145) | MS组(n = 34) | P值 |
| 小肠绒毛水肿[n(%)] | 48(33.1) | 24(70.6) | <0.001 |
| 小肠溃疡[n(%)] | 7(4.8) | 3(8.8) | 0.404 |
| Lewis评分(分) | 43.59±86.96 | 76.62±81.55 | <0.001 |
| 严重程度[n(%)] | 0.116 | ||
| 不明显 | 133(91.7) | 28(82.4) | |
| 轻度 | 12(8.3) | 6(17.6) |
使用多元线性回归分析MS各组分及年龄对小肠黏膜损伤的影响, 结果提示高血糖者小肠Lewis评分比无高血糖者高34.242分, 差异有统计学意义(t = 1.984, P = 0.048), 其他组分及年龄对小肠黏膜损伤的影响则无统计学意义(表3).
| 因素 | B | 标准误 | P值 |
| 年龄(岁) | 0.560 | 0.450 | 0.214 |
| 高血糖 | 34.242 | 17.263 | 0.048 |
| 高血压 | 5.189 | 14.376 | 0.718 |
| 血脂异常 | 13.339 | 13.069 | 0.308 |
| 肥胖 | -4.900 | 14.602 | 0.737 |
从病历资料中可计算得到111例患者的胰岛素抵抗指数. 使用多元线性回归分析胰岛素抵抗对小肠黏膜损伤的影响, 并对高血糖引起小肠黏膜损伤的影响进行校正. 结果提示胰岛素抵抗指数越高, 小肠Lewis评分越高(B = 8.173, t = 2.173, P = 0.032).
本研究发现MS患者小肠绒毛水肿发生率及小肠Lewis评分明显高于对照组, 提示MS可能为小肠黏膜损伤的危险因素. 而高血糖可能是MS引起小肠黏膜损伤最重要的组分.
近年的临床与基础研究提示MS可能通过以下机制引起小肠黏膜损伤: (1)MS及其组分通过引起肠道微生态失衡导致小肠黏膜损伤. Le Chatelier等[5]发现肥胖者肠道微生态紊乱, 表现为有助于抗炎的细菌, 如Akkermansia muciniphila含量减少, 而弯曲杆菌、志贺菌等致病菌含量则增加. 肠道菌群改变的同时, 对肠道黏膜屏障有持续保护作用及抗氧化作用的丁酸盐分泌也减少. 糖尿病患者肠道也发现类似改变[14]. 此外, 糖尿病可通过影响内源性大麻素系统及肠黏膜屏障的紧密连接蛋白等导致肠道通透性增强[15]. 同时, Sato等[16]发现糖尿病者血液中可检出肠道细菌, 并且其含量远高于对照组. 该结果提示糖尿病患者存在肠道菌群移位. MS患者肠道微生态失衡、肠道通透性改变, 引起肠道菌群移位、内毒素进入血液, 最终可导致小肠黏膜炎症及损伤; (2)MS及其组分通过引起血管病变、微循环障碍导致小肠黏膜损伤. MS患者脂联素浓度显著下降, 血管处于氧化应激状态, 最终可致血管损伤[17]. 同时, MS患者肾素-血管紧张素系统处于激活状态, 该状态引起血管紧张素Ⅱ浓度升高、血管壁炎症及动脉硬化[6]. 此外, MS患者通过脂肪细胞产生、释放细胞因子及脂肪因子, 扰乱凝血/抗凝系统、影响血小板功能, 导致血液处于高凝状态[18]. 血管损伤、动脉粥样硬化、血液高凝状态均可引起小肠微循环障碍, 最终发展为小肠黏膜损伤. 上述研究为MS及高血糖引起小肠黏膜损伤提供了一定的理论依据.
虽然MS患者有更高的小肠绒毛水肿发生率及Lewis评分, 但两组间小肠溃疡的发生率及损伤严重程度的比例并无统计学差异. 其可能的原因如下: (1)小肠的血管呈网状分布、交通支发达, 即使部分血管发生损伤或闭塞, 其交通支仍可进行代偿, 不至于在短期内引起小肠黏膜严重损伤; (2)糖尿病、高血压的血管病变多发生于发病10年以后[19]. 但本研究中MS患者糖尿病平均病史约为4.71年, 高血压病平均病史约为8.48年. 因此, 由微循环障碍引起的较严重的小肠黏膜损伤可能仍未出现; (3)较小的样本量及潜在风险因素的存在也可能对结果产生影响.
有趣的是, 我们发现胰岛素抵抗越严重的MS患者小肠Lewis评分越高. 有研究显示胰岛素抵抗的患者血循环中的连蛋白(zonulin)显著增加, 并由此导致肠黏膜通透性增加[20]. 如上所述, 肠黏膜通透性增加可通过菌群移位及内毒素入血引起肠道炎症. 该研究为本研究的结论提供了一定的理论依据.
考虑到H. pylori可引起上段小肠, 尤其是十二指肠的损伤, 因此我们对患者H. pylori感染情况也进行比较. 此外, 因患者年龄差异较显著, 可能对结果产生影响, 我们使用多元线性回归分析了年龄对小肠Lewis评分的影响. 但是, 本研究仍存在一定的局限性: (1)由于本研究样本量较小, 可能因此而未能揭示MS与小肠溃疡、小肠损伤严重程度的关系; (2)由于纳入的均为住院患者, 而住院患者的病情相对严重, 因此可能存在一定的选择偏倚; (3)肠道清洁度可直接影响小肠病变的检出率, 但本研究并未进行评价. 此外, 可能存在其他未知的混杂因素对结果产生影响. 因此, 该结论仍有待进一步被证实.
总之, MS可引起小肠黏膜损伤, 而高血糖则可能是MS引起小肠黏膜损伤最重要的组分. 因此, 当MS患者, 尤其是有高血糖的MS患者, 出现不明原因的腹痛、腹泻、大便潜血阳性等表现, 且行胃镜、结肠镜检查后未发现可解释病情的原因时, 建议使用胶囊内镜等检查明确是否存在小肠黏膜损伤. 此外, 控制血糖或有助于合并高血糖的MS患者小肠黏膜损伤的治疗.
随着人口老龄化及生活方式的改变, 代谢综合征(metabolic syndrome, MS)患病率不断上升. 除心血管疾病及2型糖尿病, MS还是消化道多种疾病的危险因素. 但MS与小肠黏膜损伤的研究相对较少, 且多侧重于基础研究.
邱成志, 教授, 主任医师, 福建医科大学附属第二医院普外科
基础研究提示MS可引起肠道微生态失衡、血管病变、血液高凝状态、炎症因子释放等病理生理学改变. 以上改变均可诱发肠黏膜的炎症及损伤. 但内镜下能否通过肉眼观察到明显的肠黏膜损伤则仍未见报道.
高血糖, 作为MS的组分之一, 可引起肠道中产丁酸盐细菌的减少及条件致病菌的增多, 导致肠道屏障功能受损及内毒素入血, 最终可诱发肠黏膜损伤.
MS与小肠黏膜损伤相关的研究多侧重于基础方面. 本研究使用胶囊内镜通过肉眼观察证实两者在临床上确实存在一定的相关性, 对临床实践具有一定的指导意义.
本文提示控制血糖或许有助于合并高血糖的MS患者小肠黏膜损伤的治疗. 此外, 运动、减肥等改善胰岛素抵抗的方式可能也有助于MS患者小肠黏膜损伤的治疗.
胰岛素抵抗指数: 是目前广泛应用于临床评价患者胰岛素抵抗水平的常用指标. 正常个体的胰岛素抵抗指数为1. 随着胰岛素抵抗水平的升高, 胰岛素抵抗指数将高于1.
随我国人口老龄化和经济发展, MS的患病率上升, 本文研究分析有助于临床医生认识MS患者的临床特点, 具有一定的实用性和重要意义, 从内镜方向研究发现MS的患者存在小肠黏膜损伤及其可能的机制, 有新颖性.
编辑: 于明茜 电编:都珍珍
| 1. | Xi B, He D, Hu Y, Zhou D. Prevalence of metabolic syndrome and its influencing factors among the Chinese adults: the China Health and Nutrition Survey in 2009. Prev Med. 2013;57:867-871. [PubMed] [DOI] |
| 2. | Kaur J. A comprehensive review on metabolic syndrome. Cardiol Res Pract. 2014;2014:943162. [PubMed] [DOI] |
| 3. | Lin Y, Ness-Jensen E, Hveem K, Lagergren J, Lu Y. Metabolic syndrome and esophageal and gastric cancer. Cancer Causes Control. 2015;26:1825-1834. [PubMed] [DOI] |
| 4. | Ishino K, Mutoh M, Totsuka Y, Nakagama H. Metabolic syndrome: a novel high-risk state for colorectal cancer. Cancer Lett. 2013;334:56-61. [PubMed] [DOI] |
| 5. | Le Chatelier E, Nielsen T, Qin J, Prifti E, Hildebrand F, Falony G, Almeida M, Arumugam M, Batto JM, Kennedy S. Richness of human gut microbiome correlates with metabolic markers. Nature. 2013;500:541-546. [PubMed] [DOI] |
| 6. | de Kloet AD, Krause EG, Woods SC. The renin angiotensin system and the metabolic syndrome. Physiol Behav. 2010;100:525-534. [PubMed] [DOI] |
| 7. | Kok MG, Meijers JC, Pinto-Sietsma SJ. Individuals with coronary artery disease at a young age and features of the metabolic syndrome have an increased prothrombotic potential. Thromb Haemost. 2014;111:458-464. [PubMed] [DOI] |
| 8. | Grundy SM, Cleeman JI, Daniels SR, Donato KA, Eckel RH, Franklin BA, Gordon DJ, Krauss RM, Savage PJ, Smith Jr SC. Diagnosis and management of the metabolic syndrome. An American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement. Executive summary. Cardiol Rev. 2005;13:322-327. [PubMed] [DOI] |
| 9. | Matsushita Y, Narahara Y, Fujimori S, Kanazawa H, Itokawa N, Fukuda T, Takahashi Y, Kondo C, Kidokoro H, Atsukawa M. Effects of transjugular intrahepatic portosystemic shunt on changes in the small bowel mucosa of cirrhotic patients with portal hypertension. J Gastroenterol. 2013;48:633-639. [PubMed] [DOI] |
| 10. | Caunedo-Alvarez A, Gómez-Rodríguez BJ, Romero-Vázquez J, Argüelles-Arias F, Romero-Castro R, García-Montes JM, Pellicer-Bautista FJ, Herrerías-Gutiérrez JM. Macroscopic small bowel mucosal injury caused by chronic nonsteroidal anti-inflammatory drugs (NSAID) use as assessed by capsule endoscopy. Rev Esp Enferm Dig. 2010;102:80-85. [PubMed] [DOI] |
| 11. | Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia. 1985;28:412-419. [PubMed] [DOI] |
| 12. | Gralnek IM, Defranchis R, Seidman E, Leighton JA, Legnani P, Lewis BS. Development of a capsule endoscopy scoring index for small bowel mucosal inflammatory change. Aliment Pharmacol Ther. 2008;27:146-154. [PubMed] [DOI] |
| 14. | Qin J, Li Y, Cai Z, Li S, Zhu J, Zhang F, Liang S, Zhang W, Guan Y, Shen D. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature. 2012;490:55-60. [PubMed] [DOI] |
| 15. | Horton F, Wright J, Smith L, Hinton PJ, Robertson MD. Increased intestinal permeability to oral chromium (51 Cr) -EDTA in human Type 2 diabetes. Diabet Med. 2014;31:559-563. [PubMed] [DOI] |
| 16. | Sato J, Kanazawa A, Ikeda F, Yoshihara T, Goto H, Abe H, Komiya K, Kawaguchi M, Shimizu T, Ogihara T. Gut dysbiosis and detection of "live gut bacteria" in blood of Japanese patients with type 2 diabetes. Diabetes Care. 2014;37:2343-2350. [PubMed] [DOI] |
| 17. | Basati G, Pourfarzam M, Movahedian A, Samsamshariat SZ, Sarrafzadegan N. Reduced plasma adiponectin levels relative to oxidized low density lipoprotein and nitric oxide in coronary artery disease patients. Clinics (Sao Paulo). 2011;66:1129-1135. [PubMed] |
| 18. | Russo I. The prothrombotic tendency in metabolic syndrome: focus on the potential mechanisms involved in impaired haemostasis and fibrinolytic balance. Scientifica (Cairo). 2012;2012:525374. [PubMed] [DOI] |
| 19. | Shen Y, Lu L, Ding FH, Sun Z, Zhang RY, Zhang Q, Yang ZK, Hu J, Chen QJ, Shen WF. Association of increased serum glycated albumin levels with low coronary collateralization in type 2 diabetic patients with stable angina and chronic total occlusion. Cardiovasc Diabetol. 2013;12:165. [PubMed] [DOI] |