修回日期: 2016-02-25
接受日期: 2016-03-08
在线出版日期: 2016-04-08
目的: 探讨以胸腺肽联合槐耳颗粒对肝移植术后肿瘤复发及Foxp3+调节性T细胞(Treg细胞)、白介素(interleukin, IL)-10、转化生长因子β(transforming growth factor-β, TGF-β)的表达.
方法: 从2011-01/2015-01在解放军第309医院接受肝移植的患者中搜集病例数共计42例患者的临床资料(均符合杭州标准), 包括肝细胞癌(肝癌)患者42例. 根据患者术后用药情况分为联合用药组19例, 槐耳颗粒组16例, 胸腺法新组7例. 术后各组根据个体差异调整免疫抑制剂的种类和剂量[他克莫司(FK506)+吗替麦考酚酯(MMF)+西罗莫司]. 1 mo后联合用药组采用以胸腺法新联合槐耳颗粒抗肿瘤药物治疗, 其他2组分别单用槐耳颗粒及胸腺法新. 观察肝癌患者肿瘤的复发时间及各组外周血中调节性T细胞(Treg细胞)、IL-10、TGF-β的表达情况. 每例患者的观察时间均为12 mo.
结果: 联合药物组的无瘤生存时间明显高于槐耳颗粒组及胸腺法新组(P<0.05); 术后第6个月联合用药组中Treg细胞和IL-10的表达明显高于胸腺法新组(P<0.05), 而联合药物组与胸腺法新组差异无统计学差异(P>0.05). 术后第12个月, 联合药物组Treg、TGF-β、IL-10的表达明显高于胸腺法新组及槐耳颗粒组(P<0.05).
结论: 胸腺法新联合槐耳颗粒抗肿瘤疗法可明显延长肝癌肝移植术后肿瘤的复发时间, 较单用胸腺法新或者槐耳颗粒有良好的临床效果, 术后定期监测Treg细胞、IL-10、TGF-β表达, 可作为肝癌肝移植术后肿瘤复发的辅助指标.
核心提示: 肝癌肝移植术后在服用免疫抑制剂的情况下联合应用胸腺法新和槐耳颗粒, 可明显延长肝癌肝移植术后肿瘤复发时间, 同时降低患者外周血中Treg细胞及白介素-10、转化生长因子β的表达水平, 为临床当中如何延长肿瘤复发提供新的思路.
引文著录: 索龙龙, 杜国盛, 周林, 宋继勇, 朱志东, 封立魁, 杨绍臻. 胸腺法新为基础的药物治疗对肝移植术后肿瘤复发及相关细胞因子的影响. 世界华人消化杂志 2016; 24(10): 1587-1592
Revised: February 25, 2016
Accepted: March 8, 2016
Published online: April 8, 2016
AIM: To explore the influence of thymosin α-1 combined with Huaier granule on tumor recurrence and expression of Foxp3+ regulatory T (Treg) cells, interleukin-10 (IL-10), and transforming growth factor-β (TGF-β) in patients after liver transplantation.
METHODS: Clinical data for 42 patients with terminal primary liver cancer who underwent liver transplantation at the 309th Hosptial of Chinese People's Liberation Army from January 2011 to January 2015 (all meeting the Hangzhou standard) were retrospectively analyzed. According to postoperative medication, the patients were divided into a combination group (19 cases), a Huaier granule group (16 cases) and a thymosin α-1 group (7 cases). During 1 mo after liver transplantation, according to the individual differences of patients, different doses and types of immunosuppressants including tacrolimus, mycophenolate and sirolimus were used. The combination group was additionally given Huaier granule and thymosin α-1 after 1 mo, and the other two groups were given Huaier granule and thymosin α-1, respectively. The time of tumor recurrence and the expression of Treg cells, IL-10 and TGF-β were observed. Each patients were followed for 24 mo.
RESULTS: The disease-free survival was significantly longer in the combination group than in the other two groups (P < 0.05). At the sixth month, the expression of Treg and IL-10 in the peripheral blood was significantly higher in the combination group than in the thymosin α-1 group (P < 0.05), but there was no significant difference between the Huaier granule group and combination group (P > 0.05). At the twelfth month, the expression of Treg cells, IL-10, and TGF-β in the peripheral blood was significantly higher in the combination group than in the other two groups (P < 0.05).
CONCLUSION: Thymosin α-1 based anti-tumor therapy can obviously prolong liver tumor recurrence after transplantation. Regular monitoring of expression of Treg cells, IL-10 and TGF-β can be used as an auxiliary method for monitoring tumor recurrence after liver transplantation.
- Citation: Suo LL, Du GS, Zhou L, Song JY, Zhu ZD, Feng LK, Yang SZ. Influence of thymosin α-1 based anti-tumor therapy on tumor recurrence and cytokine expression in patients after liver transplantation. Shijie Huaren Xiaohua Zazhi 2016; 24(10): 1587-1592
- URL: https://www.wjgnet.com/1009-3079/full/v24/i10/1587.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i10.1587
随着肝癌的发病率不断上升, 晚期肝癌患者行肝移植术是目前短期内最有效的治疗手段, 可明显延长患者的生命, 提高患者的生存质量. 然而, 术后肿瘤的复发仍是影响患者生存率的重要问题, 我们通过在临床中研究发现, 早期运用胸腺法新联合槐耳颗粒可明显延缓肿瘤的复发, 收到良好的效果. 本研究重点分析胸腺法新为基础的抗肿瘤疗法对肝移植术后肿瘤复发与机体外周血相关细胞因子的变化, 以供同行参考.
选取2011-01/2015-01因晚期肝癌在解放军第309医院行肝移植术且术后恢复良好的患者26例(均符合杭州标准), 根据用药情况分为联合用药组19例; 单用胸腺法新组7例; 单用槐耳颗粒组16例, 所有患者均知情同意. 其中男35例, 女7例, 平均年龄50.2岁±6.4岁. 肝癌患者的临床病例资料如表1.
| 项目 | 联合药物组(n = 19) | 槐耳颗粒组(n = 16) | 胸腺法新组(n = 7) | P值 |
| 男/女 | 15/4 | 14/2 | 6/1 | >0.05 |
| 年龄(岁) | 49.6±5.3 | 49.8±7.5 | 52.7±7.0 | >0.05 |
| 合并HBV | 18 | 14 | 6 | >0.05 |
| 手术时间(h) | 8.52±1.36 | 8.84±0.97 | 8.35±1.59 | >0.05 |
| 合并肝硬化 | 17 | 11 | 7 | >0.05 |
| 肿瘤分化程度 | >0.05 | |||
| Ⅰ | 5 | 4 | 2 | |
| Ⅱ | 6 | 5 | 2 | |
| Ⅲ | 5 | 5 | 1 | |
| Ⅳ | 3 | 5 | 2 | |
| ALT(IU/L) | 103.84±83.92 | 87.37±52.94 | 120.28±100.1 | >0.05 |
| AST(IU/L) | 82.37±47.26 | 83±50.72 | 99±74.28 | >0.05 |
| Child-pugh分级 | >0.05 | |||
| A | 11 | 9 | 5 | |
| B | 8 | 7 | 2 | |
| 肿瘤最大径(cm) | >0.05 | |||
| ≤5 | 4 | 5 | 3 | |
| 5-10 | 8 | 4 | 1 | |
| ≥10 | 7 | 7 | 3 | |
| 肿瘤类型 | >0.05 | |||
| 单发 | 11 | 8 | 4 | |
| 多发 | 8 | 8 | 3 | |
| AFP(μg/L) | >0.05 | |||
| ≤25 | 3 | 6 | 2 | |
| >25 | 16 | 10 | 5 |
42例患者均行原位肝移植术, 分别在术前2 h及术后第4天应用舒莱20 mg静滴预防器官移植急性排斥反应, 术中常规应用甲泼尼龙500 mg进行冲击. 移植术后各组根据个体差异调整免疫抑制剂的种类和剂量[他克莫司(FK506)+吗替麦考酚酯(MMF)+西罗莫司]. 根据各组患者的术后临床资料发现, 联合用药组待患者术后1 mo后, 皮下注射胸腺法新1.6 mg/d, 第12天后改为2次/wk, 持续应用2年; 冲服槐耳颗粒20 g/次, 3次/d. 其余2组术后按常规使用他克莫司、西罗莫司等抗排异药物, 而对照组在使用抗排异药物的基础上仅加用槐耳颗粒或者胸腺法新.
收集患者术前病历资料, 术后通过定期复查来确定患者有无复发, 收集患者外周血, 通过流式细胞技术及酶联免疫吸附试验法分别检测Treg细胞及白介素(interleukin, IL)-10、转化生长因子β(transforming growth factor-β, TGF-β)的表达情况, 记录患者肿瘤复发时间、转移部位, 其结果进行统计学分析.
统计学处理 实验数据采用SPSS17.0统计软件进行处理, 计量资料采用mean±SD表示, 组间比较采用t检验, 率的比较采用χ2检验. P<0.05表示差异有统计学意义.
根据患者术后随访资料发现, 3组均有患者先后复发, 各组患者的术后无瘤生存时间在5-24 mo, 术后对外周血检测各项指标的时间均超过12 mo, 各患者生存时间均超过12 mo.
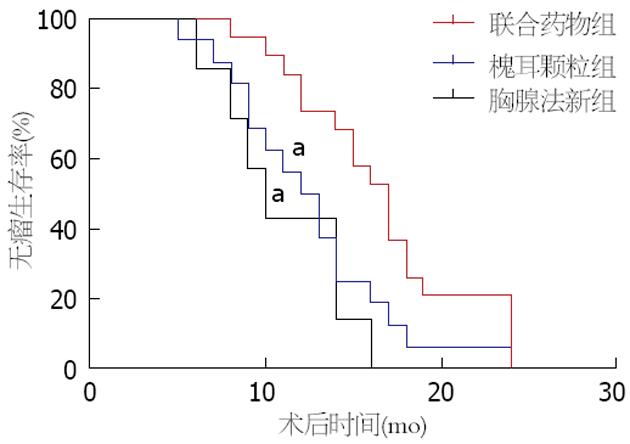
联合药物组、槐耳颗粒组、胸腺法新组3组术后无瘤生存期分别16.57 mo±4.9 mo、12.5 mo±4.7 mo、11 mo±3.69 mo, 联合药物组无瘤生存时间明显高于另外2组, 差异有统计学意义(P<0.05), 术后无瘤生存曲线如图1.
3组患者在术后第1月及第3月外周血中Treg、IL-10、TGF-β的表达虽有一定的差异, 但各组之间的差异均无统计学意义(P>0.05); 术后第6月, 联合药物组患者外周血中Treg、IL-10的表达均明显高于胸腺法新组(P<0.05), 而与槐耳颗粒组差异无统计学意义; 术后第12月, 联合药物组患者外周血中Treg、IL-10、TGF-β的表达水平明显高于胸腺法新组与槐耳颗粒组, 且差异有统计学意义(P<0.05), 其结果如表2.
| 指标 | 胸腺法新组(n = 7) | 槐耳颗粒组(n = 16) | 联合药物组(n = 19) |
| Treg(%) | |||
| 1 mo | 0.66±0.35 | 0.63±0.49 | 0.60±0.51 |
| 3 mo | 1.03±0.40 | 0.72±0.57 | 0.68±0.55 |
| 6 mo | 1.53±0.51 | 1.01±0.55 | 0.84±0.66a |
| 12 mo | 1.90±0.45 | 1.62±0.64 | 1.00±0.65ac |
| IL-10(ng/L) | |||
| 1 mo | 51.14±12.73 | 49.27±16.97 | 54.79±22.88 |
| 3 mo | 54.43±8.66 | 53.33±13.13 | 52.37±14.15 |
| 6 mo | 67.28±14.1 | 56.52±14.96 | 53.84±11.78a |
| 12 mo | 82.14±13.85 | 77.88±17.44 | 56.00±12.49ac |
| TGF-β(ng/L) | |||
| 1 mo | 25.49±10.65 | 23.54±16.88 | 22.97±17.85 |
| 3 mo | 27.35±7.45 | 24.17±12.64 | 25.13±13.69 |
| 6 mo | 43.21±11.53 | 33.54±12.89 | 28.50±12.76 |
| 12 mo | 46.78±8.28 | 40.48±6.81 | 28.50±10.52ac |
目前, 肝癌是较为常见的肿瘤之一, 其发病率一直居高不下, 且有不断上升的趋势. 在众多治疗晚期肝癌的方法之中, 肝脏移植取得了较为良好的效果, 而如何延缓及预防肝癌患者术后肿瘤复发, 是目前移植医生亟待解决的问题. 在肿瘤的发生发展过程中, 肿瘤免疫微环境中的各种免疫细胞和细胞因子水平起着非常重要的作用, 而Treg细胞及IL-10、TGF-β是目前研究的热点.
Treg细胞是一类具有控制体内自身免疫反应作用的T细胞亚群, 对机体的免疫调节起着重要作用, 研究还发现该细胞在肿瘤患者外周血中及肿瘤组织中高表达, 且表达的水平与患者的预后呈正相关[1]. TGF-β作为一种抑制免疫调控因子, 其生理功能主要是通过抑制T细胞及巨噬细胞的生长. L-10是一种来源于肿瘤细胞、Th2细胞和单核细胞的具有免疫调节作用的负向调控因子, 可与TGF-β共同作用来抑制一氧化氮的产生, 从而干扰巨噬细胞活化, 对肿瘤具有促进和抑制的双重作用[2-4]. 研究发现, 三者之间存在着相互的联系. 卢永刚等[5]通过实验研究发现, 在大肠癌患者区域转移性淋巴结中发现Treg细胞的表达明显高于正常淋巴结, 并且IL-10及TGF的表达水平也明显升高, 三者之间可能通过直接或间接共同作用抑制机体抗肿瘤免疫反应.
在肝癌微环境及患者外周血当中发现, Treg细胞与IL-10、TGF-β水平呈正相关, 且明显高于正常患者, 说明肝癌组织中的Treg细胞可能通过分泌IL-10及TGF-β, 二者通过相互作用, 可明显降低或抑制机体的免疫力, 使肿瘤逃避免疫监督, 从而促进肿瘤的生长和转移[6,7]. 刘阳等[8]通过对临床肝癌患者研究发现, 肝癌患者外周血中TGF-β、IL-10的表达明显高于肝硬化及健康组, 提示肝癌的发生发展与抑制性细胞因子TGF-β、IL-10存在着一定的相关性.
胸腺法新是一种免疫活性的多肽, 可促进机体T细胞增生、分化、成熟, 调节T淋巴细胞亚群比例, 还可诱导巨噬细胞、白介素、干扰素等因子的产生, 从而提高机体的免疫力. 在临床当中, 主要用于严重性感染等治疗[9-11]. 槐耳颗粒是一种由多糖蛋白及18种以上的氨基酸组成中药颗粒, 该药不仅能抑制肿瘤细胞生长, 诱导肿瘤细胞凋亡及多种细胞因子的产生, 还可提高机体的免疫力, 普遍用于肿瘤患者[12,13]. 研究[14]显示其主要通过抑制血管内皮细胞的生成, 进而达到抑制肿瘤组织中血管的生成的作用.
对于肝移植术后长期服用免疫抑制剂的患者, 我们研究团队首次将胸腺法新应用到肝癌移植术后的患者, 为本实验的创新点所在, 通过对患者术后肝功能研究分析发现, 患者应用胸腺法新联合槐耳颗粒并没有增加患者移植术后排异反应发生的风险[15], 并且还发现以联合胸腺肽为基础的抗肿瘤疗法, 可明显延长肿瘤复发的时间, 同时降低体内Treg细胞及IL-10、TGF-β的表达水平, 而Treg细胞及IL-10、TGF-β与肿瘤的发生发展也具有相关联系, 胸腺法新可能通过直接或间接作用协助槐耳颗粒改变体内Treg细胞及IL-10、TGF-β的表达, 从而对肿瘤产生更明显的抑制作用, 为肝癌患者肝移植术后的治疗提供新的治疗途径.
进一步对复发患者与无瘤患者对比研究发现, 肿瘤复发患者体内Treg细胞及IL-10、TGF-β的表达明显高于无瘤患者, 术后定期监测Treg细胞及IL-10、TGF-β的表达变化, 可作为肝癌肝移植术后肿瘤复发的预测指标, 对肝移植术后预防肿瘤复发具有重要的理论和临床意义. 本实验样本量有限, 有待进一步扩大样本, 延长观察时间, 进行多中心实验进一步验证胸腺法新联合槐耳颗粒对Treg细胞及IL-10、TGF-β作用的具体相关机制.
我国是肝癌大国, 晚期肝癌行肝移植术收到了良好的效果, 但面对术后肿瘤复发, 更好的延长患者生存时间, 是移植医生亟待解决的问题.
刘作金, 主任医师, 重庆医科大学附属第二医院肝胆外科; 李华, 教授, 中山大学器官移植研究所, 中山大学附属第三医院肝脏移植中心
肿瘤的发生与发展与机体的免疫调节变化有关, 而Treg细胞及调节性细胞因子与肿瘤发生发展密切相关, 如何改变Treg细胞及调节性T细胞的表达水平已成为目前研究的热点.
国内外学者对肝癌组织的病理研究发现显示Treg细胞与肿瘤的生长密切相关, 其表达水平影响着患者的预后, Treg细胞与白介素(interleukin, IL)-10、转化生长因子β(transforming growth factor-β, TGF-β)的表达具有相互作用.
本文通过采用酶联免疫吸附试验法对肝癌肝移植术后患者外周血中Treg细胞及TGF-β、IL-10的表达水平进行分析, 进一步探讨术后抗肿瘤药物对Treg细胞及TGF-β、IL-10表达水平的影响.
胸腺法新联合槐耳颗粒可明显降低患者外周血Treg细胞及TGF-β、IL-10的表达水平, 且可明显延长患者的无瘤生存时间, 为肝癌肝移植术后延长肿瘤复发时间提供依据.
胸腺法新: 一种免疫活性的多肽, 可促进机体T细胞增生、分化、成熟, 调节T淋巴细胞亚群比例, 从而提高机体的免疫力;
槐耳颗粒: 一种中药抗肿瘤药物, 对肿瘤生长有较好的抑制作用;
Treg细胞: 是一类控制体内自身免疫反应性的T细胞亚群, 与自身免疫性疾病的发生关系密切.
本文探讨了免疫调节药物胸腺肽联合中药在肝移植术后应用的意义, 结果及结论有一定的科学价值, 具有一定的参考意义.
编辑: 于明茜 电编:闫晋利
| 1. | Mittal S, Marshall NA, Duncan L, Culligan DJ, Barker RN, Vickers MA. Local and systemic induction of CD4+CD25+ regulatory T-cell population by non-Hodgkin lymphoma. Blood. 2008;111:5359-5370. [PubMed] [DOI] |
| 2. | Candido J, Hagemann T. Cancer-related inflammation. J Clin Immunol. 2013;33 Suppl 1:S79-S84. [PubMed] [DOI] |
| 3. | 周 林, 周 光炎, 路 丽明. IL-10的双向免疫调节作用. 细胞与分子免疫学杂志. 2012;28:1100-1106. |
| 4. | Zeng L, O'Connor C, Zhang J, Kaplan AM, Cohen DA. IL-10 promotes resistance to apoptosis and metastatic potential in lung tumor cell lines. Cytokine. 2010;49:294-302. [PubMed] [DOI] |
| 5. | 卢 永刚, 刘 凌云, 孙 秀娟, 何 沙, 吕 一. 大肠癌区域引流淋巴结中Treg细胞的变化及其与IL-10,TGF-β-1的关系. 中国普通外科学杂志. 2013;22:1302-1306. |
| 7. | 叶 韵斌, 彭 峰, 李 洁羽, 林 丽平, 郑 雄伟, 周 东, 力 超, 黎 巧连, 蔡 晓雯. 肝细胞肝癌组织浸润性淋巴细胞及其因子的表达. 细胞与分子免疫学杂志. 2011;27:1056-1060. |
| 8. | 刘 阳, 胡 梅, 喻 红波, 黎 健. 肝癌患者淋巴细胞HLA-G表达及血清TGF-β、IL-10水平研究. 武警后勤学院学报(医学版). 2014;23:468-470. |
| 9. | Garaci E. Thymosin alpha1: a historical overview. Ann N Y Acad Sci. 2007;1112:14-20. [PubMed] |
| 10. | Serafino A, Pica F, Andreola F, Gaziano R, Moroni N, Moroni G, Zonfrillo M, Pierimarchi P, Sinibaldi-Vallebona P, Garaci E. Thymosin α1 activates complement receptor-mediated phagocytosis in human monocyte-derived macrophages. J Innate Immun. 2014;6:72-88. [PubMed] [DOI] |
| 11. | Garaci E, Pica F, Serafino A, Balestrieri E, Matteucci C, Moroni G, Sorrentino R, Zonfrillo M, Pierimarchi P, Sinibaldi-Vallebona P. Thymosin α1 and cancer: action on immune effector and tumor target cells. Ann N Y Acad Sci. 2012;1269:26-33. [PubMed] [DOI] |
| 14. | Han Y, Zhang C. Macrophage migration inhibitory factor plays a pivotal role in hepatocellular carcinoma and may be a noninvasive imaging target. Med Hypotheses. 2010;75:530-532. [PubMed] [DOI] |
| 15. | 宋 继勇, 杜 国盛, 朱 志东, 郑 德华, 崔 洪涛, 封 立魁, 石 炳毅. 胸腺法新在肿瘤患者肝移植术后应用的安全性分析. 中华损伤与修复杂志(电子版). 2014;9:166-168. |