修回日期: 2016-02-29
接受日期: 2016-03-08
在线出版日期: 2016-04-08
目的: 研究脂肪肝与小肠黏膜病变的相关性.
方法: 选取广东药学院附属第一医院2011-08/2015-08曾行胶囊内镜且无癌症、小肠结核、克罗恩病、溃疡性结肠炎等肠道原发疾病及服用非甾体类药物的患者分为脂肪肝组和无肝病组(对照组), 收集相关临床资料和小肠黏膜病变资料, 将两组患者的发病率、发病类型、病灶分布进行分析比较.
结果: 纳入研究350例 脂肪肝组60例, 无肝病组290例, 脂肪肝组小肠黏膜病变的发病率及小肠黏膜病变的Lewis评分均显著高于对照组(75.0% vs 33.8%, P<0.001; 121.00分±178.51分 vs 61.08分±144.10分, P = 0.005). 脂肪肝患者小肠上、中、下三分之一肠段绒毛水肿的发生率为(7.1%、15.7%、4.3%, P< 0.001). 脂肪肝患者上、中、下三分之一肠段溃疡的发生率为(2.0%、2.6%、3.4%, P = 0.498). 肝脏无创NAFLD-FS评分与小肠黏膜病变评分呈正相关(r = 0.108, P = 0.043). 胰岛素抵抗指数与小肠黏膜病变评分呈正相关(r = 0.162, P = 0.034).
结论: 脂肪肝可引起小肠黏膜病变, 甘油三酯有可能是脂肪肝引起小肠黏膜病变的重要影响因素. 脂肪肝患者小肠黏膜病变好发于上、中1/3, 肝脏损害程度与小肠黏膜病变程度存在相关性.
核心提示: 本文主要发现小肠黏膜病变会出现在脂肪肝的患者中, 这与近几年来提出的"肝-肠轴"是一致的. 脂肪肝患者出现小肠黏膜病变主要以绒毛水肿为主, 且主要通过甘油三酯影响小肠黏膜发生损害. 脂肪肝的严重程度与小肠黏膜病变的程度呈正相关.
引文著录: 陈美慧, 袁瑜, 李兰, 钟豪杰, 何兴祥. 脂肪肝与小肠黏膜病变的相关性. 世界华人消化杂志 2016; 24(10): 1581-1586
Revised: February 29, 2016
Accepted: March 8, 2016
Published online: April 8, 2016
AIM: To assess the association between fatty liver and small intestinal mucosal lesions.
METHODS: After obtaining approval from the ethical review committee of the First Affiliated Hospital of Guangdong Pharmaceutical University, from August 2011 to August 2015, patients who were excluded as having cancer or primary intestinal disease and NSAID takers were divided into a fatty liver group (case group) and a group without liver disease (control group). Intestinal lesions were detected by capsule endoscopy, and the correlation of capsule endoscopy scoring index with fatty liver index was analyzed.
RESULTS: Of 350 individuals, 60 diagnosed with fatty liver by CT or B ultrasound were included in the case group, and 290 without liver diseases were included in the control group. The incidence of small bowel mucosal lesions and the Lewis score in the case group were significantly higher than those in the control group (75.0% vs 33.8%, P < 0.001; 121.00 ± 178.51 vs 61.08 ± 144.10, P = 0.005). In fatty liver patients, the incidence rates of small intestinal edema in the upper, middle and lower third were 7.1%, 15.7%, and 4.3% (P < 0.001), respectively, and the incidence rates of small intestinal ulcers were 2.0%, 2.6%, and 3.4% (P = 0.498), respectively. Liver noninvasive NAFLD-FS score was positively correlated with the small intestinal mucosa damage score (r = 0.108, P = 0.043). Insulin resistance index was positively correlated with small intestinal damage score (r = 0.162, P = 0.034).
CONCLUSION: Fatty liver disease may be related to the small intestine lesions, and triglycerides may be an important factor. Most lesions are located in the proximal or middle small bowel.
- Citation: Chen MH, Yuan Y, Li L, Zhong HJ, He XX. Association between fatty liver and small intestinal mucosal lesions. Shijie Huaren Xiaohua Zazhi 2016; 24(10): 1581-1586
- URL: https://www.wjgnet.com/1009-3079/full/v24/i10/1581.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i10.1581
近年来大量研究[1-3]发现许多疾病可导致小肠黏膜病变, 小肠黏膜病变可导致出血、慢性贫血、甚至穿孔. 小肠处于整个消化系统的中间位置难以观察, 但随着技术不断进步, 胶囊内镜的生产和在医疗行业的广泛推广, 使小肠病变在胶囊内镜下得以发现. 近几年来, 非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)发病率逐渐上升, 肥胖人群越来越多, 更甚者出现在儿童阶段, 所以引起了科研工作者的高度重视[4]. 1998年肝-肠轴概念[5]的提出, 关于肝-肠的研究逐渐成为热点. 有国外学者报导[6], NAFLD与小肠细菌过度生长(small bowel bacterial overgrowth, SIBO)具有密切的关系, NAFLD通过SIBO使得小肠黏膜通透性改变从而引起小肠黏膜病变. 然而, 用临床病例分析脂肪肝与小肠黏膜病变的相关性, 目前少有报道. 因此, 我们应用胶囊内镜观察小肠黏膜损害情况、NAFLD-FS评估脂肪肝, 然后分析二者之间的关系, 现报告如下.
回顾性纳入2011-08/2015-05曾于广东药学院附属第一医院行胶囊内镜的患者. 排除标准为: (1)既往诊断为恶性肿瘤; (2)肠道感染性疾病, 如肠结核、急性肠炎、寄生虫感染等; (3)炎症性肠病; (4)长期服用非甾体类抗炎药; (5)严重的心、肺、肾等疾病; (6)临床数据缺失; (7)小肠梗阻. 脂肪肝诊断标准为: 经CT、B超及实验室检查等临床确诊脂肪肝(包括酒精性和NAFLD)的患者.
1.2.1 资料收集: 收集被纳入患者的性别、年龄、有无高血压、糖尿病、吸烟、饮酒、有无幽门螺旋杆菌感染、体质量指数(body mass index, BMI)、生化血指标等基本资料.
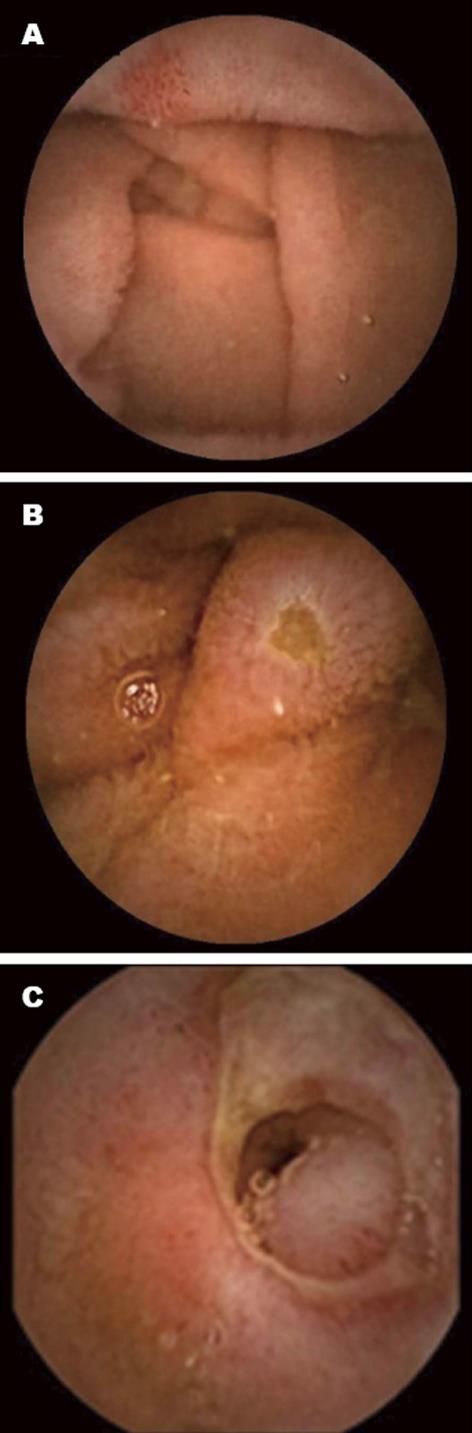
1.2.2 胶囊内镜检查的肠道准备: 入选的患者在医师的指导下接受胶囊内镜检查, 检查前2 d半流质饮食, 检查前1 d全流饮食, 和爽半包(68.575 g)溶于1 L水中晚上服用, 晨起五点继续将剩余半包(68.575 g)溶于1 L水中服用, 然后再服用1 L温水泻至清水便, 吞服胶囊前2 h用祛泡剂(卫朗)2支, 温水送服胶囊. 吞服胶囊后半小时内再次观察是否已经进入小肠, 如果已经进入小肠则2 h后患者允许食用干面包, 4 h后允许正常饮食; 传感器及记录设备9 h后被除去. 胶囊内镜选用PillCam SB1/SB2 Capsule(Given imaging, Israel), 图像用Rapid Access 7.0 software(RAPID 7.0)工作站(software and workstation from Given Imaging Ltd)进行分析. 由3位经验丰富的內镜医生阅片讨论并达成一致. 患者的临床信息及內镜医生的信息对记录员保密(图1).
1.2.3 相关评分量表: 胶囊内镜下小肠黏膜病变使用Lewis评分[7], 内容包括: (1)绒毛水肿: 有无, 病变范围(小段、长段、全长), 病变数目(单发、散在、弥漫); (2)黏膜溃疡: 数目(单个、数个、多发), 病变范围(小段、长段、全长), 病变大小(<1/4、1/4-1/2、>1/2); (3)狭窄: 数目(无、单个、多个), 病因(溃疡引起、非溃疡引起), 程度(胶囊能通过、不能通过). 根据胶囊内镜在小肠内的传输时间把小肠分上、中、下三段. 三段的得分分别为: 小肠上1/3总分 = 绒毛水肿得分(有无绒毛水肿得分×病变范围得分×数目得分)+溃疡得分(数目分值×病变范围得分×病变大小得分), 小肠中1/3、小肠后1/3均这样计算出各段的得分. 狭窄得分 = 数目得分×病因得分×程度得分. 三段得分与狭窄得分相加即为小肠黏膜病变总分. 脂肪肝患者选用肝脏无创NAFLD-FS评分[8]系统进行评价; 胰岛素抵抗指数 = 空腹胰岛素×空腹血糖/22.5.
统计学处理 采用SPSS19.0统计软件分析数据, 符合正态分布的计量资料, 采用mean±SD表示, 两组资料间比较采用t检验; 定性资料采用χ2检验, 采用多因素Logistic回归方程分析对小肠黏膜病变是否发生的影响因素, 检验标准为α = 0.05. 连续变量的相关关系采用Pearson相关分析. P<0.05为差异有统计学意义.
所有患者胶囊都顺利排出, 无体内滞留. 所有患者胶囊內镜检查完整, 根据回盲部影像判定患者胶囊内镜完成全小肠检查.
获得符合脂肪肝诊断标准患者60例为病例组, 无慢性肝病患者290例为对照组. 病例组60例中男30例(50%), 女30例(50%), 年龄30-87岁, 平均58.5岁±14.79岁, 对照组290例中男151例(52.1%), 女139例(47.9%), 年龄13-89岁, 平均57.16岁±15.71岁. 经χ2和t检验, 性别、年龄、吸烟、饮酒、有无幽门螺旋杆菌感染方面均无显著性差异(P>0.05)(表1).
| 项目 | 脂肪肝组(n = 60) | 无肝病组(n = 290) | P值 |
| 年龄(岁) | 58.5±14.79 | 57.16±15.71 | 0.544 |
| 性别(男/女) | 30/30 | 151/139 | 0.770 |
| 吸烟(有/无) | 6/54 | 51/239 | 0.180 |
| 饮酒(有/无) | 6/54 | 28/281 | 0.899 |
| 幽门螺杆菌(有/无) | 38/22 | 177/113 | 0.773 |
将脂肪肝组和无肝病组的小肠黏膜病变的发生率和小肠黏膜病变的严重程度进行分析比较, 结果脂肪肝组小肠黏膜病变的发生率显著高于对照组, 小肠黏膜病变的Lewis评分也显著高于对照组(表2).
| 类型 | 脂肪肝组 | 无肝病组 | χ2/t值 | P值 |
| 有小肠黏膜病变[n(%)] | 45(75.0) | 98(33.8) | 34.934 | P = 0.00<0.001 |
| 无小肠黏膜病变[n(%)] | 15(25.0) | 192(66.2) | ||
| 小肠黏膜病变Lewis评分(分) | 121.00±178.51 | 61.08±144.10 | -2.807 | P = 0.005 |
将脂肪肝组与无肝病组小肠黏膜病变不同病变类型发生率进行分析比较, 发现脂肪肝组与无肝病组小肠绒毛水肿发生率为71.7%、32.0%, 脂肪肝组与无肝病组小肠溃疡发病率为10.0%、6.6%, 绒毛水肿的发生率显著高于溃疡发生率.
脂肪肝患者小肠上、中、下三分之一肠段绒毛水肿的发生率为7.1%、15.7%、4.3%, 各段间绒毛水肿的发生率具有统计学差异(P<0.001). 脂肪肝患者上、中、下三分之一肠段溃疡的发生率为2.0%、2.6%、3.4%, 各段间溃疡的发生率无统计学差异(P = 0.498).
以有无小肠黏膜病变为因变量, 将可能影响小肠黏膜病变的因素作为自变量, 进行多因素非条件Logistic回归分析, 采用向前法逐步回归引入自变量, 进入模型标准为0.05, 剔除模型标准为0.10. 结果显示甘油三酯是小肠黏膜病变的主要因素(表3).
| 影响因素 | 赋值说明 | 回归系数 | Wald | P值 | 优势比 | 95%可信区间 |
| 胆固醇 | 按实际胆固醇赋值 | -0.114 | 1.163 | 0.281 | 0.892 | 0.725-1.098 |
| 甘油三酯 | 按实际甘油三酯赋值 | 0.549 | 12.549 | <0.001 | 1.732 | 1.278-2.347 |
| BMI | 按实际BMI赋值 | -0.003 | 0.099 | 0.753 | 0.997 | 0.976-1.018 |
| ALT | 按实际ALT赋值 | 0.010 | 0.353 | 0.552 | 1.010 | 0.978-1.042 |
| AST | 按实际AST赋值 | 0.011 | 0.090 | 0.764 | 1.011 | 0.941-1.086 |
将所有患者采用无创肝功能NAFLD-FS评分进行肝脏的损害评分并与小肠黏膜Lewis评分作比较, 两者进行Pearson相关分析, 结果显示NAFLD-FS评分与小肠黏膜病变评分间具有正相关(r = 0.108, P = 0.043).
共有170例患者的空腹胰岛素和空腹血糖指标, 将其胰岛素抵抗指数与小肠黏膜病变评分进行Pearson相关分析, 结果显示二者间存在正相关(r = 0.162, P = 0.034).
随着人口的老龄化、病毒性肝炎的有效防治以及生活习惯的改变, 高脂饮食、缺乏锻炼且酒精的滥用, 脂肪性肝病正成为我国常见的慢性肝病之一[9,10]. 大量研究发现, 脂肪肝患者肠道出现菌群失调、屏障破坏、动力减弱[11-13]. 而菌群失调、肠道通透性改变等可导致肠道黏膜水肿、糜烂, 甚至溃疡的发生.
本研究的胶囊内镜下主要病变类型如图一所示, 包括绒毛水肿、小肠溃疡、狭窄.结果显示脂肪肝患者小肠黏膜病变的发生率显著高于无肝病患者, 小肠黏膜病变的评分也具有明显差异, 提示脂肪肝与小肠黏膜病变密切相关. 大量研究报导, 除脂肪肝外其他类型的肝脏病变也可导致小肠黏膜损伤. Aoyama等[2]及Akyuz等[14]发现肝硬化及肝硬化合并门脉高压者小肠黏膜病变发生率显著高于对照组. 本研究显示脂肪肝患者绒毛水肿的发生比例远高于溃疡的发生比例, 可能是脂肪肝导致小肠黏膜病变的早期. 脂肪肝患者小肠黏膜病变好发于中1/3, 可能是空肠缺少丰富的血供, 当肠黏膜缺血缺氧、紧密连接性破坏、通透性增加时无法有足够的毛细血管分支进行代偿. 多因素Logistic回归分析提示甘油三酯是小肠黏膜病变的主要因素, 脂肪肝的形成也是由于肝脏脂质代谢异常, 甘油三酯的堆积形成, 也许通过护肝、调脂治疗可以保护肠道黏膜. 相关性分析发现肝脏无创NAFLD-FS评分与小肠黏膜病变严重度评分呈正相关, 提示肝脏损害程度越严重, 小肠黏膜病变越严重. 胰岛素抵抗指数与小肠黏膜病变评分间也存在正相关, 其原因可能是胰岛素抵抗参与脂肪变的发生并促进肝细胞损伤和炎症发展, 而肠道菌群又可促进胰岛素抵抗的发生, 进一步加重肝肠轴的恶性循环.
国外学者[11-13]发现脂肪肝患者肠道黏膜屏障破坏, 小肠黏膜紧密连接完整性受损、黏膜屏障通透性增加. 肠黏膜屏障受损后会导致内毒素等有害物质经门静脉进入肝脏, 进一步加重肝脏损害. Miele等[12]发现NAFLD患者发生SIBO的风险远高于健康人. SIBO通过减缓肠道动力, 加剧细菌的过度生长引起肠道菌群失调、菌群易位. 肠道菌群紊乱及肠黏膜屏障受损激活了肝固有免疫系统, 促进肝细胞炎症反应, 进一步形成"肝-肠"疾病的恶性循环. Vanni等[15]通过观察发现在先天性肥胖的ob/ob小鼠模型中, 存在肠黏膜屏障受损, 引发内毒素血症,并通过释放肿瘤坏死因子α(tumor necrosis factor α, TNF-α)导致NASH的发生. 在Zhu等[16]的研究中发现NASH患者与健康人相比较, NASH患者的肠道菌群中含有较多的产生内源性酒精的菌种, 血中乙醇浓度升高, 从而氧化应激可导致肝脏炎症.
本研究发现脂肪肝患者比无肝病患者小肠黏膜病变的发生率及严重程度高. 提示脂肪肝患者出现不明原因的腹痛或其他肠道症状时或者贫血等临床表现时, 应考虑有无小肠黏膜病变, 推荐进行胶囊内镜检查. 在治疗方面, 脂肪肝患者的护肝、调脂治疗也许有助于肠黏膜损伤的修复.
随着1998年"肝-肠轴"概念的提出, 人们越来越关注肝与肠的关系, 肝与肠从胚胎起源就存在密切的关系, 肠的大部分血液供应来源于门静脉, 因此肠内的毒性产物可通过门静脉回流入肝脏激活肝脏的固有免疫系统, 加重肝脏损害. 另外, 脂肪肝会引起肠内菌群易位, 从而导致小肠黏膜的损害.
沈薇, 教授, 重庆医科大学附属第二医院消化内科; 张炜, 副教授, 主任医师, 江苏大学附属医院消化科
目前大量文献报道肝硬化与小肠的关系, 但脂肪肝、肝炎与小肠的报道暂缺, 而关于肝炎、脂肪肝、肝硬化的肠道菌群的基础研究较多且引起了热议. 同时小肠是整个消化系统最难检测到的部分, 且小肠疾病的发病率较低, 一直未受到临床医生的关注. 胶囊内镜检查其诊断率可达55%, 特别是其无法到达的部位, 胶囊内镜有很好的使用价值. 目前需要解决的问题是需要进行临床研究, 对临床上肝病患者进行肠道保护治疗后肝病有否好转.
在日本发表的多篇文献中证实了肝硬化的患者出现严重的小肠黏膜病变如溃疡、绒毛水肿、红斑、静脉扩张、毛细血管扩张等, 且肝病严重程度分级与小肠黏膜病变呈正相关. 这与本文研究的脂肪肝的NAFLD-FS评分与小肠黏膜病变Lewis评分相一致.
本文与国外相类似的文章比较, 样本例数较大350例, 而且国内外暂时无关于脂肪肝与小肠黏膜病变的报道, 只有肝硬化与小肠黏膜病变的报道较多, 采用胶囊内镜技术研究小肠的损害比较新颖, 可靠对患者不具有伤害, 较为舒适.
本文提示脂肪肝患者出现不明原因的腹痛或其他肠道症状时或者贫血等临床表现时, 应考虑有无小肠黏膜病变, 推荐进行胶囊内镜检查. 在治疗方面, 脂肪肝患者的护肝、调脂治疗可能有助于肠黏膜损伤的修复,总结此文章在实际应用中的价值, 或对应用的指导、改进作用, 以及在将来应用中的前景.
小肠细菌过度生长: 主要指在小肠内正常的菌群如有益的双歧杆菌和毛螺旋菌减少减少, 而有害的细菌逐渐增多如致病性肠杆菌和链球菌增加, 这是在肝硬化患者的粪便微生物分析结果中发现的, 且已经证实了肝炎、脂肪肝、肝硬化的患者与正常人的肠道菌群有着明显的不同, 肝病患者的肠道菌群明显发生改变.
本文研究的内容重要且具有新颖性. 具有科学性、创新性和可读性, 能较好地反映我国脂肪肝临床和基础研究的先进水平.
编辑: 郭鹏 电编:闫晋利
| 1. | Muraki M, Fujiwara Y, Machida H, Okazaki H, Sogawa M, Yamagami H, Tanigawa T, Shiba M, Watanabe K, Tominaga K. Role of small intestinal bacterial overgrowth in severe small intestinal damage in chronic non-steroidal anti-inflammatory drug users. Scand J Gastroenterol. 2014;49:267-273. [PubMed] [DOI] |
| 2. | Aoyama T, Oka S, Aikata H, Nakano M, Watari I, Naeshiro N, Yoshida S, Tanaka S, Chayama K. Small bowel abnormalities in patients with compensated liver cirrhosis. Dig Dis Sci. 2013;58:1390-1396. [PubMed] [DOI] |
| 3. | Qin J, Li Y, Cai Z, Li S, Zhu J, Zhang F, Liang S, Zhang W, Guan Y, Shen D. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature. 2012;490:55-60. [PubMed] [DOI] |
| 4. | Vajro P, Paolella G, Fasano A. Microbiota and gut-liver axis: their influences on obesity and obesity-related liver disease. J Pediatr Gastroenterol Nutr. 2013;56:461-468. [PubMed] [DOI] |
| 5. | Marshall JC. The gut as a potential trigger of exercise-induced inflammatory responses. Can J Physiol Pharmacol. 1998;76:479-484. [PubMed] |
| 6. | Miele L, Marrone G, Lauritano C, Cefalo C, Gasbarrini A, Day C, Grieco A. Gut-liver axis and microbiota in NAFLD: insight pathophysiology for novel therapeutic target. Curr Pharm Des. 2013;19:5314-5324. [PubMed] |
| 7. | Gralnek IM, Defranchis R, Seidman E, Leighton JA, Legnani P, Lewis BS. Development of a capsule endoscopy scoring index for small bowel mucosal inflammatory change. Aliment Pharmacol Ther. 2008;27:146-154. [PubMed] |
| 8. | Angulo P, Hui JM, Marchesini G, Bugianesi E, George J, Farrell GC, Enders F, Saksena S, Burt AD, Bida JP. The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology. 2007;45:846-854. [PubMed] |
| 10. | Fan JG, Farrell GC. Epidemiology of non-alcoholic fatty liver disease in China. J Hepatol. 2009;50:204-210. [PubMed] [DOI] |
| 11. | Wang YC, Jin QM, Kong WZ, Chen J. Protective effect of salvianolic acid B on NASH rat liver through restoring intestinal mucosal barrier function. Int J Clin Exp Pathol. 2015;8:5203-5209. [PubMed] |
| 12. | Miele L, Valenza V, La Torre G, Montalto M, Cammarota G, Ricci R, Mascianà R, Forgione A, Gabrieli ML, Perotti G. Increased intestinal permeability and tight junction alterations in nonalcoholic fatty liver disease. Hepatology. 2009;49:1877-1887. [PubMed] [DOI] |
| 13. | Miele L, Beale G, Patman G, Nobili V, Leathart J, Grieco A, Abate M, Friedman SL, Narla G, Bugianesi E. The Kruppel-like factor 6 genotype is associated with fibrosis in nonalcoholic fatty liver disease. Gastroenterology. 2008;135:282-291.e1. [PubMed] [DOI] |
| 14. | Akyuz F, Pinarbasi B, Ermis F, Uyanikoglu A, Demir K, Ozdil S, Besisik F, Kaymakoglu S, Boztas G, Mungan Z. Is portal hypertensive enteropathy an important additional cause of blood loss in portal hypertensive patients? Scand J Gastroenterol. 2010;45:1497-1502. [PubMed] [DOI] |
| 15. | Vanni E, Bugianesi E. The gut-liver axis in nonalcoholic fatty liver disease: Another pathway to insulin resistance? Hepatology. 2009;49:1790-1792. [PubMed] [DOI] |
| 16. | Zhu L, Baker SS, Gill C, Liu W, Alkhouri R, Baker RD, Gill SR. Characterization of gut microbiomes in nonalcoholic steatohepatitis (NASH) patients: a connection between endogenous alcohol and NASH. Hepatology. 2013;57:601-609. [PubMed] [DOI] |