修回日期: 2015-01-22
接受日期: 2015-01-29
在线出版日期: 2015-03-28
目的: 讨论羽扇豆醇影响肝癌细胞株SMMC-7721增殖及促进其凋亡作用机制.
方法: 使用不同浓度(0、2、5、10、20 µg/mL)的羽扇豆醇在不同处理时间(24、36、48 h)下, 处理SMMC-7721细胞株后, 通过MTT法检测SMMC-7721细胞增殖情况; 对使用不同浓度的羽扇豆醇处理48 h后的SMMC-7721细胞, 利用流式细胞仪检测SMMC-7721细胞的细胞周期以及细胞凋亡情况, 还使用Western blot检测细胞细胞增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)、B淋巴细胞瘤-2(B-cell lymphoma-2, Bcl-2)基因及Bcl-2相关X蛋白(Bcl-2 associated X protein, Bax)蛋白的表达情况, 最后我们通过免疫组织化学的方式检测在裸鼠体内接种的SMMC-7721细胞瘤体的微血管密度(microvessel density, MVD)值, 检测羽扇豆醇对抑制肿瘤血管生成的作用.
结果: 相较于对照组, 通过不同浓度的羽扇豆醇处理后的SMMC-7721细胞增殖水平均受到不同程度的抑制, 而且既显示出量效关系又显示出时效关系; 受到羽扇豆醇体外诱导处理后的SMMC-7721细胞能够使G0/G1期受到阻滞, 甚至出现凋亡现象, SMMC-7721细胞的PCNA和Bcl-2蛋白表达情况下调, Bax蛋白的表达情况上调(P<0.05). 肿瘤瘤体MVD值下降(P<0.01).
结论: SMMC-7721细胞的增殖会因为羽扇豆醇的处理而受到抑制, 并且还会因为羽扇豆醇的处理而出现凋亡. 羽扇豆醇还可以抑制肿瘤瘤体血管生成.
核心提示: 羽扇豆醇对SMMC-7721细胞增殖具有抑制作用并能诱导该细胞凋亡. 本研究主要为研究羽扇豆醇对肿瘤细胞的抑制作用提供了思路, 我们的研究未见到文献报道.
引文著录: 兴伟, 宋巍, 徐志峰, 宋易华. 羽扇豆醇影响肝癌细胞株SMMC-7721增殖与凋亡的机制. 世界华人消化杂志 2015; 23(9): 1411-1419
Revised: January 22, 2015
Accepted: January 29, 2015
Published online: March 28, 2015
AIM: To investigate the effect of lupeol on the growth and apoptosis of hepatic carcinoma SMMC-7721 cells and explore the mechanism involved.
METHODS: After SMMC-7721 cells were treated by different concentrations of lupeol (0, 2, 5, 10, 20 µg/mL) for different durations (24, 36 or 48 h), cell proliferation was determined by MTT assay. The SMMC-7721 cells were also tested by flow cytometry after treatment with different concentrations of lupeol for 48 h. The expression of proliferating cell nuclear antigen (PCNA), B-cell lymphoma-2 (Bcl-2) and Bcl-2 associated X protein (Bax) in SMMC-7721 cells was tested by Western blot. Xenograft tumors of SMMC-7721 grown in nude mice were tested by immunohistochemistry to assess the microvessel density (MVD) and the effect of lupeol on angiogenesis.
RESULTS: Compared with the control group, the proliferation of SMMC-7721 cells was inhibited by lupeol in a time and concentration dependent manner. The cell cycle of SMMC-7721 cells was blocked at G0/G1 by lupeol. Lupeol also resulted in apoptosis. Lupeol up-regulated the expression of PCNA and Bcl-2, down-regulated the expression of Bax (P < 0.05), and decreased MVD (P < 0.01).
CONCLUSION: Lupeol can inhibit SMMC-7721 cell proliferation and induce cell apoptosis.
- Citation: Xing W, Song W, Xu ZF, Song YH. Effect of lupeol on proliferation and apoptosis of hepatic carcinoma SMMC-7721 cells. Shijie Huaren Xiaohua Zazhi 2015; 23(9): 1411-1419
- URL: https://www.wjgnet.com/1009-3079/full/v23/i9/1411.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i9.1411
肝癌是一种恶性程度高, 死亡率高的疾病, 由于其发病较为隐匿[1,2], 所以手术切除率较低, 而肝癌多对传统化疗和放疗耐受, 所以其治疗一直是临床研究的热点[3,4]. 羽扇豆醇是一种存在于水果蔬菜中的三萜类物质, 被我国传统医学应用多年. 以往的研究[5,6]已经证明其有抗炎、抗风湿的作用, 不仅如此他还被证实有原则性抑制人DNA拓扑异构酶Ⅱ的作用. 本文旨在研究羽扇豆醇影响肝癌细胞株SMMC-7721增殖及促进其凋亡作用机制.
肝癌细胞株选用中国科院上海细胞生物学研究所的SMMC-7721, 使用培养基为用含10%胎牛血清的RPMI 1640培养基并加入终浓度为1 mmol/L的氨基胍, 以抑制血清中的氨基氧化酶. RPMI 1640购自美国Gibco公司; 噻唑蓝(MTT)、胰蛋白酶(trypsin)、羽扇豆醇采用上海源叶生物公司产品; 细胞周期检测试剂盒选用Thermo公司产品; B淋巴细胞瘤-2(B-cell lymphoma-2, Bcl-2)基因抗体, Bcl-2相关X蛋白(Bcl-2 associated X protein, Bax)抗体和细胞增殖核抗原(proliferating cell nuclear antigen, PCNA)抗体(美国Santa Cruz公司); 二甲基亚砜(DMSO)选用天津市化学试剂厂产品.
1.2.1 检测羽扇豆醇对SMMC-7721细胞增殖的抑制作用: 检测羽扇豆醇对SMMC-7721细胞增殖的抑制作用使用MTT法检测. 取对数生长期的SMMC-7721细胞, 使用完全培养基调整为终浓度为1×105/mL的细胞悬液, 在96孔板中孵育, 每孔100 µL. 在细胞培养箱培养24 h后, 向各孔中加入羽扇豆醇, 并调整各孔羽扇豆醇终浓度分别为2、5、10、20 µg/mL, 阴性对照组则仅加入完全培养基. 每个实验组及阴性对照组均设5复孔, 加入羽扇豆醇或培养基后各孔细胞在细胞培养箱细胞培养, 分别培养24、36、48 h. 在实验结束前4 h每孔均加入MTT(5 mg/mL)10 µL, 再继续培养4 h. 然后弃去培养液, 各孔加入150 µL二甲基亚砜(DMSO), 充分震荡15 min, 使用酶标仪490 nm(参考波长620 nm)每孔光密度(OD)值进行测定, 并计算羽扇豆醇对每组细胞细胞的抑制率. 抑制率(%) = (1-实验组OD值/对照组OD值)×100%.
1.2.2 细胞周期分布情况及凋亡率的检测: 对SMMC-7721细胞用不同浓度(2、5、10、20 µg/mL)的羽扇豆醇共同培养48 h后, 收集细胞, 调整细胞浓度为1×106/mL的细胞悬液, 离心(1000 r/min×5 min). 弃去上清液, 用磷酸盐缓冲液(PBS)洗涤细胞2次, 使用4 ℃预冷的70%乙醇1.5 mL重悬细胞, 调整细胞浓度为1×106/mL的悬液待检. 细胞悬液在4 ℃过夜后检测. 加入0.5 mL浓度50 mg/L为碘化吡啶(PI)染液, 闭光条件下染色30 min, 然后用流式细胞仪检测. 实验重复进行3次. 根据得到的DNA组方图内各时相细胞分布情况, 计数处于各细胞周期的细胞所占百分比例, 计算细胞凋亡率.
1.2.3 Western blot: 使用被不同浓度(2、5、10、20 µg/mL)的羽扇豆醇处理48 h后的SMMC-7721细胞. 首先将细胞裂解30 min后, 在4 ℃、12000 g离心10 min, 提取上层清液中的细胞蛋白. 然后采用Lowry法定量测定蛋白浓度. 再配制10%的分离胶和5%的浓缩胶, 上样, 每孔加入50 µg待检蛋白. 在95 ℃条件下使蛋白变性10 min. 然后在12%聚丙烯酰胺-SDS凝胶电泳适当时间后, 蛋白转移至硝酸纤维素膜上, 使用5%脱脂奶粉封闭. 然后加入一抗、二抗, 分别在室温条件下孵育抗体2 h, 加入抗体后分别采用TBST缓冲液洗涤5次, 每次洗涤时间为10 min. 再检测硝酸纤维素膜上的抗原抗体复合物结合区带, 将样品放入暗盒中压片. 最后显影、定影、拍照. 该实验在相同实验条件下重复3次.
1.2.4 微血管密度(microvessel density, MVD)检测: 将处于对数生长期的SMMC-7721细胞用含有10%小牛血清的RPMI 1640培养基调整细胞浓度至1×107/mL后, 将0.2 mL细胞悬液接种于裸鼠左侧腋窝皮下. 将小鼠随机分为对照组、20、40和80 ng/g组. 每组小鼠从接种细胞悬液后第3天起每天接种相应药物共30 d. 对照组小鼠接种生理盐水1 mL, 实验组各组小鼠分别依据体质量接种相应计量的羽扇豆醇, 在停药1 wk后对小鼠脱颈处死并取出瘤块. 然后用甲醛固定瘤块, 切位3 µm切片, 石蜡脱水, 修复抗原, 在使用3%双氧水孵育10 min后, 加入兔抗人Ⅷ因子抗体1:150液, 4 ℃过夜, 再加入二抗, 室温孵育40 min, DAB显色3-5 min. 最后在显微镜低倍视野下选取癌巢间质血管丰富的视野, 在200倍视野下计数染为棕色的细胞及细胞从认为是血管, 计数操作由4人完成, 取4人计数平均值为所得MVD值.
统计学处理 采用SPSS13.0统计软件分析和处理数据. 所有数据结果以mean±SD表示, 实验组所得数据均数与对照组所得数据均数用LSD-t检验比较. P<0.05表示差异有统计学意义.
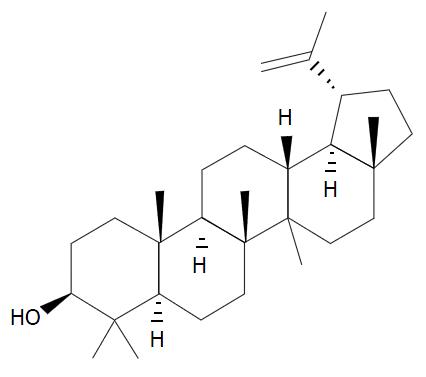
我们使用的羽扇豆醇分子结构式如图1所示. 实验结果具体数据如表1. 结果表明肝癌细胞SMMC-7721在受到不同浓度的羽扇豆醇作用不同时间后, 其生长及增殖受到明显的抑制, 通过分析我们可以发现, 羽扇豆醇对于肝癌细胞的抑制作用同时存在着时间依赖关系和剂量依赖关系. SMMC-7721细胞在受到2、5、10及20 µg/mL的羽扇豆醇处理24、48、72 h后分别与对照组比较差异有统计学意义(P<0.05).
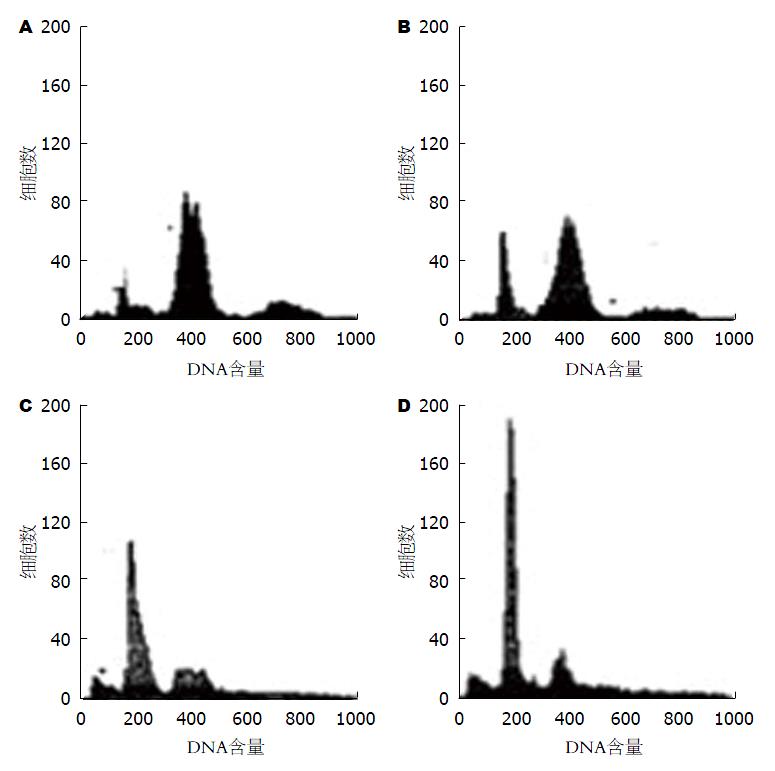
我们采用流式细胞仪检测在受到羽扇豆醇作用后细胞周期分布情况和细胞凋亡情况的变化. 具体实验数据如表2, 具体流式细胞分析图像如图2. 通过表2我们可以发现, 在受到不同浓度的羽扇豆醇作用48 h以后, SMMC-7721细胞处于G0/G1期细胞数量明显增多(P<0.01), 而处于G2/M和S期细胞数量明显减少(P<0.05), 细胞凋亡率明显增加(P<0.01).
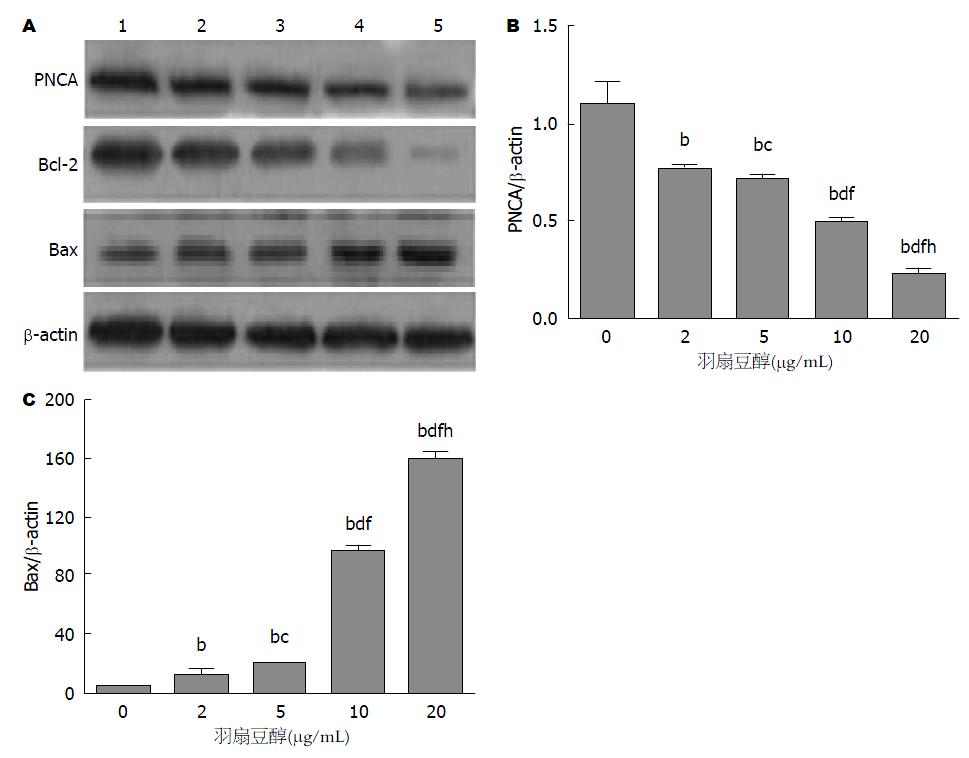
为检测SMMC-7721细胞在受到羽扇豆醇处理后PCNA、Bax及Bcl-2蛋白表达变化情况, 我们将接受不同浓度的羽扇豆醇(2、5、10、20 µg/mL)处理48 h后SMMC-7721细胞用免疫印迹方法进行检查(β-actin为内参). 检查结果如图3. 我们可以发现随着处理的羽扇豆醇浓度的增高, SMMC-7721细胞所表达的PCNA蛋白量明显下降, 呈现出较为明显的浓度依赖性. 同时我们可以发现Bcl-2蛋白也和PCNA蛋白存在着类似的情况. 与之相反的是Bax蛋白的情况却明显不同. 随着羽扇豆醇浓度的逐渐升高, Bax蛋白的表达量也呈现出逐渐增高的趋势, 也呈出浓度依赖性. 所以我们可以发现随着接受的羽扇豆醇浓度逐渐升高, SMMC-7721细胞所表达的Bax蛋白和Bcl-2蛋白Bax/Bcl-2的比例逐渐增高.
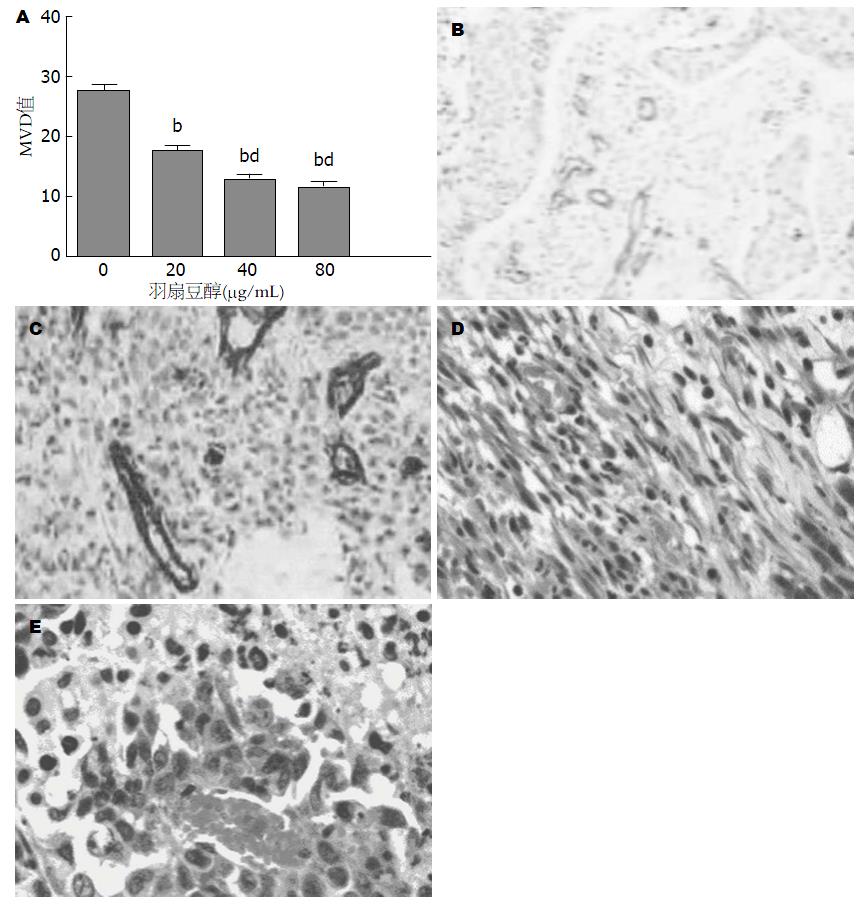
为检测小鼠体内瘤体在小鼠接受不同剂量羽扇豆醇处理后MVD值变化情况, 我们将接受不同剂量的羽扇豆醇处理后小鼠的瘤体通过免疫组织化学方法处理, 检测其瘤体内血管增殖情况, 检查结果如图4. 我们发现随着处理的羽扇豆醇剂量增加, 瘤体内MVD值逐渐降低, 呈现出剂量依赖关系.
肝癌是一种严重危害人类健康的疾病[7]. 目前, 通过手术治疗及通过介入化疗是临床用于治疗肝癌最主要的方法[8]. 不幸的是肝癌由于其生长速度较快, 发病初期较为隐匿的特性, 使得大部分患者在发现时已经处于完全, 难以通过手术治疗完全切除病灶. 所以化疗对于肿瘤患者显得意义重大, 但是由于如今化疗药物不良反应较大而患者一般情况较差难以承受化疗带来的严重不良反应, 所以找到一种新型的、不良反应较小的化疗药物显得意义重大.
目前认为肿瘤的发生是多因素共同作用的结果, 其发生是多基因在长时间共同作用的结果[9,10]. 肿瘤细胞中多种原癌基因及癌基因被激活, 表达其编码的相应蛋白质, 并影响其分化作用抑制其凋亡作用[11,12]. 肿瘤细胞表现出凋亡失衡的特点. 最后导致了肿瘤的发生[13]. 目前肿瘤治疗主要是瞄准选择性地诱导肿瘤细胞凋亡而又不损伤正常组织细胞, 而最新的研究[14]证明了将细胞死亡和细胞应激有机地结合起来可以引起肿瘤细胞的大量凋亡, 达到这一目的. 而现在肿瘤相关药物研究, 虽然选择的最初的靶点不一样, 但是最终途径都是通过诱导启动肿瘤细胞的凋亡程序.
羽扇豆醇是一种常见于植物中的天然三萜类物质, 具有生物活性, 可以阻滞细胞周期进程, 从而起到抗癌作用, 有研究发现其可以阻滞小鼠皮肤癌模型中p53基因和循环B基因, 同时还有实验证明该物质具有促进细胞凋亡的作用.
在我们的研究设计中, 肝癌细胞SMMC-7721使用的不同浓度的羽扇豆醇进行处理, 并且处理的时间还进行了区分, 最后通过MTT法检测发现了肿瘤细胞对于羽扇豆醇反应明显, 出现了生长增殖受到抑制的情况, 并且呈现出明显的时间依赖性和剂量依赖性, 具体如表1.
我们发现羽扇豆醇主要是通过阻滞肿瘤细胞的细胞周期进程来实现抑制肿瘤细胞生长和增殖的. 肿瘤细胞是一类细胞周期进程紊乱的细胞, 正常组织细胞的细胞周期都是按照G1-S-G2-M有序的进行的, 尤其是G1期, 他的长短是决定整个细胞周期的最关键因素. 恶性肿瘤细胞由于其细胞周期调控出现障碍, 出现了S期细胞异常增加, 从而出现了增殖异常的情况[15,16]. 目前的抗肿瘤药物大多是通过作用于某一个细胞周期的某种或某个靶点, 从而导致肿瘤细胞出现凋亡, 达到抑制其生长增殖的目的. 我们在实验中发现, 相对于阴性对照组, 经过羽扇豆醇处理后的肿瘤细胞处于S期的细胞所占比重明显减少. 并且还显示出随着羽扇豆醇药物浓度增加, 这一比例下降幅度随之增长的现象. 这充分地说明羽扇豆醇对于肿瘤细胞的细胞周期进程有着很大的影响, 他可以使S期细胞明显减少, 而相应的使G0/G1期细胞显著增多. 这说明羽扇豆醇可以有效地抑制肿瘤细胞有丝分裂信号, 而使肿瘤细胞无法进入S期进行DNA复制[17], 实现了诱导细胞凋亡的作用.
PCNA蛋白是一种细胞在增殖时才表达的核内蛋白. 他的表达情况已经被广泛用于评估细胞增殖状态[18]. 最近的研究[19-23]发现, 在多种肿瘤组织中PCNA高表达均预示着患者的转归不良. 我们在研究中发现, 随着受到羽扇豆醇处理浓度的升高, 在受到处理48 h的时候, 我们检测肿瘤细胞中的PCNA的蛋白表达量出现了较为明显的下降趋势, 并且还呈现出明显的剂量依赖性. 这表明羽扇豆醇极有可能是通过抑制肿瘤细胞中PCNA蛋白的表达来阻止肿瘤细胞的有丝分裂信号的, 从而达到阻滞肿瘤细胞细胞周期进程, 使之大量停留在G0/G1期. 同时我们还发现受到羽扇豆醇处理后的肿瘤细胞, 细胞凋亡率明显升高. 细胞凋亡是指在基因调控下出现的细胞自动死亡的现象. 他具有程序性、主动性, 是一种正常组织细胞固有的生物学过程[24]. 肿瘤细胞正是由于凋亡调控出现了异常, 才导致其出现了无序增殖的情况. 在细胞凋亡过程中, 线粒体的作用显得尤为重要[25]. Bcl-2正是一种在细胞的线粒体外膜上存在的原癌基因, 同时他还存在与细胞核和内质网上. 他发挥抗凋亡作用主要是靠抑制细胞色素C的表达, 而细胞色素C正是一种具有促进细胞凋亡的物质. 不仅如此, Bcl-2还能引起细胞核谷胱甘肽的积聚达到保护细胞的功能. 他的过度表达会引起细胞核核内氧化还原平衡改变, 降低了Caspase这种在细胞凋亡过程中起到关键作用基因的活性.
作为Bcl-2基因家族中的重要组成部分, Bax常以与Bcl-2形成二聚体的形式存在, 也在细胞凋亡的调节中扮演着关节角色. 与Bcl-2所起的作用不同, Bax主要起着促进细胞凋亡的作用[26,27]. 定位于胞浆中的Bax存在方式有两种, 一种是如上文所说的与Bcl-2形成二聚体; 第二种方式是与自身形成二聚体存在. 当细胞内的Bax增多, 胞浆中的Bax-Bax二聚体增加, 细胞凋亡的趋势更为显著. 反之, 则胞浆中的Bax-Bcl-2二聚体增多, 细胞的凋亡趋势则减弱. 因此胞浆中的Bax和Bcl-2比值对于细胞凋亡与否有着重要的提示作用. 我们在研究中发现, SMMC-7721细胞在接受不同浓度的羽扇豆醇作用48 h后, 肿瘤细胞中Bcl-2的表达出现下降而同时Bax表达则出现增高, 并且两者变化程度还随着羽扇豆醇浓度增加而显得更为明显, 从而导致了Bax/Bcl-2比值的逐渐增高(图3). 这提示羽扇豆醇在体外条件下抑制肿瘤细胞增殖的途径除了通过下调PCNA蛋白, 导致肿瘤细胞细胞周期进程出现变化, 大量细胞阻滞于G0/G1期以外, 还可以通过上调Bax表达, 下调Bcl-2表达, 导致Bax/Bcl-2比值增加, 来促进肿瘤细胞凋亡. 通过这两条通路共同作用来导致肿瘤细胞凋亡.
肿瘤生长与其促进血管增殖相关, 所以我们进行了MVD值检测, 发现随着处理羽扇豆醇剂量的增加, 瘤体内小血管数量减少, MVD值降低, 提示羽扇豆醇抑制肿瘤生长的作用可能与羽扇豆醇抑制瘤体内血管生长, 降低瘤体内养料供应有关.
我们发现羽扇豆醇即通过调节肿瘤细胞细胞周期进程, 抑制肿瘤细胞分裂, 阻止其增殖, 还通过促进肿瘤细胞凋亡, 抑制肿瘤细胞生存. 这两个方法是羽扇豆醇抑制肿瘤的主要机制. 同时, 羽扇豆醇还有抑制肿瘤血管增生的作用, 从而抑制瘤体养料供应, 影响肿瘤生长. 但是羽扇豆醇抑制肿瘤细胞生长增殖的这两个办法的具体分子学机制以及是否还存在其他机制, 还有待于我们的进一步研究.
羽扇豆醇是一种常见于植物中的天然三萜类物质, 具有生物活性, 可以阻滞细胞周期进程, 从而起到抗癌作用, 有研究发现其可以阻滞小鼠皮肤癌模型中p53基因和循环B基因, 同时还有实验证明该物质具有促进细胞凋亡的作用.
秦建民, 主任医师, 上海中医药大学附属普陀医院普外科
目前认为羽扇豆醇可能是通过抑制肿瘤细胞的拓扑异构酶来抑制肿瘤细胞生长及增殖的.
羽扇豆醇起促凋亡机制主要可以被归纳为以下几个方面: (1)羽扇豆醇可以抑制核因子-κB(nuclear factor-κB, NF-κB)的活性, 导致NF-κB依赖的抗凋亡蛋白比如B淋巴细胞瘤(B-cell lymphoma, Bcl)-xl, Bcl-2、X连锁的凋亡抑制因子(X linked inhibitor of apoptosis protein)等下调; (2)羽扇豆醇可以导致Fas诱导的相关死亡结构域(fas associated death domain)如白介素-1转换酶抑制蛋白, 从而导致细胞的凋亡; (3)下调凋亡抑制基因存活素(Survivin)、人端粒酶逆转录酶(human telomerase reverse transcriptase), 髓细胞白血病基因-1(myeloid cell leukemia-1)和血管内皮生长因子(vascular endothelial growth factor)基因的表达; (4)他还可导致线粒体的呼吸功能下降和下调跨膜电位; 除了上述的4种研究较多的机制以外还有人认为其起到诱导细胞凋亡的机制还可能与其对PI3K/Akt活性的抑制相关.
羽扇豆醇在体外条件下对SMMC-7721细胞增殖具有较强的抑制作用. 他可以抑制癌细胞进入S期从而使细胞周期停留在G0/G1期, 这可能与其能下调细胞增殖核抗原(proliferating cell nuclear antigen)蛋白的表达, 增大Bcl-2相关X蛋白(Bcl-2 associated X protein)/Bcl-2比值等作用相关. 但是其具体作用机制仍有待进一步研究.
羽扇豆醇还被发现在皮肤癌的治疗中起着非常重要的作用. 有研究显示其发挥作用的主要方法是促进肿瘤细胞凋亡和抑制肿瘤细胞增殖.
肿瘤的发生: 目前认为肿瘤的发生是多因素共同作用的结果, 其发生是多基因在长时间共同作用的结果. 肿瘤细胞中多种癌基因及原癌基因被激活, 表达其编码的相应蛋白质, 并影响其分化作用抑制其凋亡作用. 肿瘤细胞表现出凋亡失衡的特点. 最后导致了肿瘤的发生.
本研究采用分子生物学技术体内外观察羽扇豆醇对肝细胞癌增殖作用及其分子机制, 为研发新的抗肝细胞癌药物提供了一定的理论基础.
编辑: 韦元涛 电编:都珍珍
| 1. | Mukherjee AK, Basu S, Sarkar N, Ghosh AC. Advances in cancer therapy with plant based natural products. Curr Med Chem. 2001;8:1467-1486. [PubMed] |
| 2. | Bharti AC, Donato N, Aggarwal BB. Curcumin (diferuloylmethane) inhibits constitutive and IL-6-inducible STAT3 phosphorylation in human multiple myeloma cells. J Immunol. 2003;171:3863-3871. [PubMed] [DOI] |
| 3. | Molnár J, Gyémánt N, Tanaka M, Hohmann J, Bergmann-Leitner E, Molnár P, Deli J, Didiziapetris R, Ferreira MJ. Inhibition of multidrug resistance of cancer cells by natural diterpenes, triterpenes and carotenoids. Curr Pharm Des. 2006;12:287-311. [PubMed] [DOI] |
| 4. | Pisco L, Kordian M, Peseke K, Feist H, Michalik D, Estrada E, Carvalho J, Hamilton G, Rando D, Quincoces J. Synthesis of compounds with antiproliferative activity as analogues of prenylated natural products existing in Brazilian propolis. Eur J Med Chem. 2006;41:401-407. [PubMed] [DOI] |
| 5. | Shirataki Y, Kawase M, Sakagami H, Nakashima H, Tani S, Tanaka T, Sohara Y, Schelz Z, Molnar J, Motohashi N. Bioactivities of anastasia black (Russian sweet pepper). Anticancer Res. 2005;25:1991-1999. [PubMed] |
| 6. | Jackson KM, DeLeon M, Verret CR, Harris WB. Dibenzoylmethane induces cell cycle deregulation in human prostate cancer cells. Cancer Lett. 2002;178:161-165. [PubMed] [DOI] |
| 7. | Baráth Z, Radics R, Spengler G, Ocsovszki I, Kawase M, Motohashi N, Shirataki Y, Shah A, Molnár J. Multidrug resistance reversal by 3-formylchromones in human colon cancer and human mdr1 gene-transfected mouse lymphoma cells. In Vivo. 2006;20:645-649. [PubMed] |
| 8. | Nakano K, Nakayachi T, Yasumoto E, Morshed SR, Hashimoto K, Kikuchi H, Nishikawa H, Sugiyama K, Amano O, Kawase M. Induction of apoptosis by beta-diketones in human tumor cells. Anticancer Res. 2004;24:711-717. [PubMed] |
| 9. | Kawase M, Tanaka T, Kan H, Tani S, Nakashima H, Sakagami H. Biological activity of 3-formylchromones and related compounds. In Vivo. 2007;21:829-834. [PubMed] |
| 10. | Tanaka T, Kawase M, Tani S. Urease inhibitory activity of simple alpha,beta-unsaturated ketones. Life Sci. 2003;73:2985-2990. [PubMed] [DOI] |
| 11. | Xie SQ, Li Q, Zhang YH, Wang JH, Mei ZH, Zhao J, Wang CJ. NPC-16, a novel naphthalimide-polyamine conjugate, induced apoptosis and autophagy in human hepatoma HepG2 cells and Bel-7402 cells. Apoptosis. 2011;16:27-34. [PubMed] [DOI] |
| 12. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 15. | Jacks T, Weinberg RA. Cell-cycle control and its watchman. Nature. 1996;381:643-644. [PubMed] [DOI] |
| 16. | Minois N, Carmona-Gutierrez D, Madeo F. Polyamines in aging and disease. Aging (Albany NY). 2011;3:716-732. [PubMed] |
| 17. | Zhao CH, Chen XC, Jin JS, Zhu YG, Shi GB, Zeng YQ, Li YK, Peng X. [Effect of ginsenoside Rg1 on expression of p21, cyclin E and CDK2 in the process of cell senescence]. Yaoxue Xuebao. 2004;39:673-676. [PubMed] |
| 18. | De Marzo AM, Marchi VL, Yang ES, Veeraswamy R, Lin X, Nelson WG. Abnormal regulation of DNA methyltransferase expression during colorectal carcinogenesis. Cancer Res. 1999;59:3855-3860. [PubMed] |
| 19. | Belessi CJ, Parasi AS, Manioudaki HS, Laoutaris NP, Legakis NC, Peros GT, Androulakis GA. Prognostic impact of DNA ploidy pattern, S-phase fraction (SPF), and proliferating cell nuclear antigen (PCNA) in patients with primary gastric lymphoma. J Surg Oncol. 2003;82:247-255. [PubMed] [DOI] |
| 20. | Cappello F, Palma A, Martorana A, Rappa F, Cabibi D, Barresi E, Melloni D, Farina F, Aragona F. Biological aggressiveness evaluation in prostate carcinomas: immunohistochemical analysis of PCNA and p53 in a series of Gleason 6 (3+3) adenocarcinomas. Eur J Histochem. 2003;47:129-132. [PubMed] [DOI] |
| 21. | Grossi F, Loprevite M, Chiaramondia M, Ceppa P, Pera C, Ratto GB, Serrano J, Ferrara GB, Costa R, Boni L. Prognostic significance of K-ras, p53, bcl-2, PCNA, CD34 in radically resected non-small cell lung cancers. Eur J Cancer. 2003;39:1242-1250. [PubMed] [DOI] |
| 22. | Kato T, Kameoka S, Kimura T, Nishikawa T, Kobayashi M. C-erbB-2 and PCNA as prognostic indicators of long-term survival in breast cancer. Anticancer Res. 2002;22:1097-1103. [PubMed] |
| 23. | Dabrowski A, Szumiło J, Brajerski G, Wallner G. Proliferating nuclear antigen (PCNA) as a prognostic factor of squamous cell carcinoma of the oesophagus. Ann Univ Mariae Curie Sklodowska Med. 2001;56:59-67. [PubMed] |
| 24. | Karam JA, Lotan Y, Karakiewicz PI, Ashfaq R, Sagalowsky AI, Roehrborn CG, Shariat SF. Use of combined apoptosis biomarkers for prediction of bladder cancer recurrence and mortality after radical cystectomy. Lancet Oncol. 2007;8:128-136. [PubMed] [DOI] |
| 25. | Dudzik P, Dulińska-Litewka J, Wyszko E, Jędrychowska P, Opałka M, Barciszewski J, Laidler P. Effects of kinetin riboside on proliferation and proapoptotic activities in human normal and cancer cell lines. J Cell Biochem. 2011;112:2115-2124. [PubMed] [DOI] |
| 26. | Oltvai ZN, Milliman CL, Korsmeyer SJ. Bcl-2 heterodimerizes in vivo with a conserved homolog, Bax, that accelerates programmed cell death. Cell. 1993;74:609-619. [PubMed] [DOI] |
| 27. | Mantena SK, Baliga MS, Katiyar SK. Grape seed proanthocyanidins induce apoptosis and inhibit metastasis of highly metastatic breast carcinoma cells. Carcinogenesis. 2006;27:1682-1691. [PubMed] |