修回日期: 2015-01-06
接受日期: 2015-01-15
在线出版日期: 2015-03-08
目的: 探讨吗啡依赖胃肠损伤的多巴胺(dopamine, DA)能作用机制.
方法: 吗啡剂量递增皮下注射训练10 d, 建立大鼠吗啡条件性位置偏爱(conditioned place preference, CPP)模型, 生理盐水对照组(normal saline, NS)组和吗啡模型组(模型组)各取10只断头处死, 取胃和十二指肠黏膜, 荧光分光光度法检测其DA含量; 另再取10只, 采用Western blot检测其胃(胃贲门、胃体和幽门)和十二指肠组织多巴胺受体亚型2(dopamine D2 receptor, D2R)蛋白的表达. 两组计量资料比较采用t检验.
结果: 模型组大鼠胃、十二指肠DA含量(18.41 ng/g±0.62 ng/g、9.01 ng/g±2.37 ng/g)较NS组(32.01 ng/g±0.61 ng/g、17.31 ng/g±2.58 ng/g)显著减少(胃: t = 49.765, P = 0.000; 十二指肠: t = 7.485, P = 0.000); 而模型组胃贲门、胃体和十二指肠的D2R平均光密度值(0.67±0.05、0.53±0.08和0.61±0.07)较NS组(0.43±0.08、0.33±0.07和0.44±0.05)明显升高(胃贲门: t = 7.557, P = 0.001; 胃体: t = 6.859, P = 0.000; 十二指肠: t = 6.188, P = 0.001); 胃幽门变化差异无统计学意义(t = 0.84, P = 0.43).
结论: 吗啡依赖胃肠的损伤与胃肠DA系统的改变(递质和D2R受体)具有一定的相关性.
核心提示: 既往研究数据显示, 阿片类(海洛因、吗啡、鸦片等)依赖者脱(戒)毒期间上消化道疾病检出率明显增高, 而胃肠道多巴胺及其受体的改变与消化系统多种疾病的发生密切相关. 据此, 推测吗啡依赖胃肠损伤与胃肠多巴胺系统的改变具有一定的相关性.
引文著录: 徐靖宇, 白威峰, 涂平, 刘兴宇, 余守洋, 罗素元. 吗啡依赖大鼠胃肠多巴胺递质和D2受体的改变. 世界华人消化杂志 2015; 23(7): 1110-1114
Revised: January 6, 2015
Accepted: January 15, 2015
Published online: March 8, 2015
AIM: To investigate the mechanism of action of dopamine in gastrointestinal injury in morphine-dependent rats.
METHODS: A conditioned place preference (CPP) model was established by injecting rats with increasing doses of morphine. The rats were divided into two groups: a model group (M) and a saline group (N). Ten rats in each group were killed to detect the DA contents in the stomach and duodenum with a fluorescence spectrophotometer. The other 10 rats were used to test the expression levels of D2 receptor in the gastric cardia, body, pylorus and duodenum by Western blot.
RESULTS: The expression of DA in the stomach and duodenum was significantly lower in the model group than in the control group (18.41 ng/g ± 0.62 ng/g vs 32.01 ng/g ± 0.61 ng/g, 9.01 ng/g ± 2.37 ng/g vs 17.31 ng/g ± 2.58 ng/g, P < 0.01). The expression of D2R in the gastric cardia, gastric body and duodenum was significantly higher in the morphine dependent group than in the control group (0.67 ± 0.05 vs 0.43 ± 0.08, 0.53 ± 0.08 vs 0.33 ± 0.07, 0.61 ± 0.07 vs 0.44 ± 0.05, P < 0.01).
CONCLUSION: There is an obvious link between the pathological injury in gastrointestinal tissue and the DA system change in morphine-dependent rats.
- Citation: Xu JY, Bai WF, Tu P, Liu XY, Yu SY, Luo SY. Changes of dopamine content and D2 receptor expression in gastrointestinal tissues of morphine-dependent rats. Shijie Huaren Xiaohua Zazhi 2015; 23(7): 1110-1114
- URL: https://www.wjgnet.com/1009-3079/full/v23/i7/1110.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i7.1110
阿片类(鸦片、海洛因、吗啡等)滥用对人体的危害涉及机体的多个系统, 虽然神经系统首当其冲, 但消化系统的损害也相当严重及普遍, 阿片类依赖者脱(戒)毒期间上消化道疾病(胃及十二指肠炎症、出血、溃疡等)检出率明显增高[1], 溃疡性上消化道出血已成为吸毒者临床致死原因之一[2]. 因此, 非常有必要全面揭示阿片类依赖(包括躯体依赖和精神依赖)状态下消化系统损伤的机制, 但目前相关的研究主要集中在消化系统的细胞因子、神经肽以及个别胃肠激素等. 多巴胺(dopamine, DA)作为胃肠道的一种重要神经递质通过与其受体结合, 在消化系统多种功能中发挥着重要的作用[3], 同时胃肠多巴胺系统(递质和其受体)的改变亦与消化系疾病密切相关[4], 但目前在阿片类依赖消化系统损害中, 关于DA递质及其受体变化的研究尚未见文献报道. 本文通过观察吗啡诱导条件性位置偏爱(conditioned place preference, CPP)(一种精神依赖动物模型)大鼠胃和十二指肠DA递质和多巴胺受体亚型2(dopamine D2 receptor, D2R)的变化(说明: 选取D2R是因为已发现在吗啡依赖大鼠脑的多个部位有改变), 探讨吗啡依赖胃肠损伤的DA能作用机制, 旨在为阿片类依赖消化系统功能紊乱的临床治疗提供相应的依据.
8周龄♂SD大鼠(Sprague-Dawley rats, SD)(120-140 g), 购自第三军医大学实验动物中心, 许可证号: SCXK(渝)20007-0005. 盐酸吗啡注射液, 规格10 mg/mL, 沈阳第一制药厂, 批号: TD2006-0028; D2受体一抗(Chemicon公司). 荧光分光光度计(HITACHI公司); 条件性位置偏爱装置(上海吉量软件科技有限公司); 通用型电泳仪(Bio-Rad, USA); JY92-Ⅱ超声波细胞粉碎机(上海新芝生物技术研究所).
1.2.1 建立大鼠吗啡CPP模型: 大鼠在动物房适应性饲养1 wk后, 首先进行天然偏爱测试(d1-3): 打开CPP箱隔板, 将数十只大鼠放入其中每天自由穿梭15 min, 连续3 d, 每天记录大鼠在黑白箱中的时间, 剔除对白箱或黑箱有明显偏爱的大鼠, 确定大鼠自然偏爱黑箱, 故将白箱作为伴药箱. 取40只筛选合格的大鼠按随机数字表法分为2组, 即生理盐水对照组(NS组)和吗啡模型组(模型组), 每组20只. 条件训练(d4-13): 插上隔板使黑白箱分隔, 模型组大鼠采用吗啡剂量递增法颈背部皮下注射, 连续10 d(起始剂量为10 mg/kg, 至d13为100 mg/kg), 每天注射吗啡20 min后放入白箱训练40 min, NS组注射等量NS同法训练. 测试(d15): 在末次训练后48 h, 两组大鼠行CPP测试, 以确认吗啡CPP模型建立成功.
1.2.2 多巴胺递质含量检测: CPP测试确认模型建立成功后各组取10只大鼠麻醉剖腹, 首先肉眼观察两组大鼠胃和十二指肠出血情况后, 置冰盒取胃和十二指肠(近幽门1.5 cm长), 用生理盐水冲洗其内容物, 滤纸擦干, 再取胃和十二指肠黏膜组织, 称其质量, 采用荧光分光光度法测定[5]: 加入3 mL酸化正丁醇, 冰水中超声粉碎匀浆, 震荡5 min后离心5 min (3000 r/min); 取上清液2.5 mL, 加3 mL正庚烷、1.2 mL 0.1 mol/L盐酸, 震荡5 min后离心5 min(3000 r/min); 取水相0.5 mL, 加入1/15 moL/L, pH 7.2 PBS 1.7 mL、碘试剂0.1 mL, 再静置2 min; 加0.5 mL碱性亚硫酸钠, 再静置2 min; 加入0.6 mL的6 moL/L醋酸, 在沸水中2 min, 在冷水中冷却; 最后加入0.1 mL 45%磷酸并沸水浴15 min, 在荧光计上以325 nm激发, 在375 nm处测量荧光强度, 比照DA标准品, 计算各样品中DA的含量.
1.2.3 Western blot检测D2R的表达: 各组剩余之10只大鼠麻醉剖腹, 在冰盒上取其胃贲门、胃体和幽门各约0.5 cm2(每只大鼠所取部位相同)和十二指肠(近幽门1.0 cm长), 用生理盐水冲洗, 滤纸擦干, 按100:1加入SDS蛋白裂解液和蛋白质抑制剂的混合液, 超声粉碎, 4 ℃ 15000 r/min离心5 min, 取上清液, 用BCA法测定蛋白浓度. 蛋白标本以4:1加入5×上样缓冲液, 95 ℃灭活5 min. 行SDS-PAGE电泳, 转膜到PVDF膜上, 5%脱脂奶粉封闭1 h, 加一抗(1:1000)4 ℃过夜. 用TBST洗膜3次, 加二抗(1:2000)1 h, TBST洗膜3次. 加上ECL发光剂进行曝光, 显影. 应用Quantity One软件进行分析并检测其光密度值.
统计学处理 采用SPSS16.0统计软件对数据进行处理, 以mean±SD表示, 组间比较采用两独立样本t检验, P<0.05为差异有统计学意义.
如表1所示, 与NS对照组以及训练前比较, 训练后模型组大鼠在白箱停留时间明显延长(P<0.05), 表明吗啡CPP模型建立成功.
| 分组 | 训练前 | 训练后 | t值 | P值 |
| 生理盐水对照组 | 453±54 | 464±43 | ||
| 模型组 | 448±47 | 530±36 | 3.305 | 0.004 |
| t值 | 2.579 | |||
| P值 | 0.020 |
与生理盐水对照组比较, 模型组大鼠胃和十二指肠多巴胺递质含量显著减少(P<0.01)(表2).
| 分组 | 胃 | 十二指肠 |
| 生理盐水对照组 | 32.01±0.61 | 17.31±2.58 |
| 模型组 | 18.41±0.62 | 9.01±2.37 |
| t值 | 49.765 | 7.485 |
| P值 | 0.000 | 0.000 |
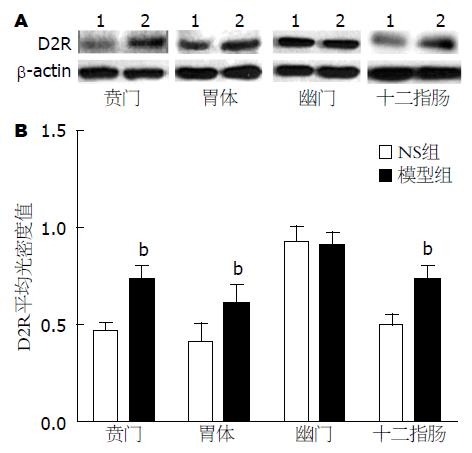
与生理盐水对照组比较, 模型组大鼠胃贲门、胃体和十二指肠D2R平均光密度值明显升高(P≤0.001), 说明表达量增多; 而胃幽门无改变(P>0.05)(表3, 图1).
| 分组 | 平均光密度值 | |||
| 贲门 | 胃体 | 幽门 | 十二指肠 | |
| 生理盐水对照组 | 0.43±0.08 | 0.33±0.07 | 0.85±0.06 | 0.44±0.05 |
| 模型组 | 0.67±0.05 | 0.53±0.08 | 0.83±0.09 | 0.61±0.07 |
| t值 | 7.557 | 6.859 | 0.840 | 6.188 |
| P值 | 0.001 | 0.000 | 0.430 | 0.001 |
自1965年Hankanson在胃黏膜中发现DA以来, 研究者们后续又在胃和十二指肠黏膜发现并证实是一种重要的胃肠道神经递质, 不仅如此, 胃肠道还存在有多巴胺受体(DR)[6], DA通过作用于DR, 在胃肠运动、胃肠胰分泌、胃肠黏膜保护、胃肠黏膜下血流调节等多方面发挥重要的生理功能. 病理情况下, 也参与胃肠道动力疾病、消化性溃疡、胰腺疾病及消化系肿瘤等的发生和发展. 本实验结果显示, 正常大鼠胃和十二指肠含有一定量的DA递质D2R, 与邓小英等[7,8]的报道一致, 但在吗啡精神依赖模型大鼠胃和十二指肠黏膜组织中的DA含量均减少; 而胃贲门、胃体和十二指肠组织中D2R的表达量上调, 再结合在模型组大鼠胃和十二指肠出血明显多于NS对照组的肉眼所见(模型组: 8/20只; NS对照组: 3/20只), 提示: 吗啡依赖胃肠的损伤与胃肠DA系统的改变(递质和D2R受体)具有一定的相关性.
正常胃肠道组织中阿片受体分布广泛[9], 他们对消化功能起着重要调节作用, 当长期大量摄取外源性阿片物质, 可使整个阿片肽系统功能受到抑制, 一旦外源阿片物质戒断(自然戒断、或用纳洛酮等竞争性的拮抗各类阿片受体), 而内源性阿片肽又不能及时补充, 则导致阿片肽系统效能降低, 从而出现胃肠功能紊乱, 明显的临床表现就是胃及十二指肠炎症、出血、溃疡等的发生较正常增加[10]. 本实验大鼠的取材时间是在末次吗啡训练后48 h(即吗啡停药自然戒断49 h左右), 此时间点正处于胃肠功能紊乱期间, 虽然临床是以胃及十二指肠炎症、出血、溃疡等病变呈现, 但其发生则涉及到诸多生理生化指标的异常改变, 而胃肠道DA系统就是其中之一. 因为对于胃和十二指肠出血或溃疡, 不管何种原因导致, 都表现为黏膜的完整性受到损害, 而胃肠黏膜完整性的维护又与黏液/碳酸氢盐屏障、黏膜屏障、黏膜血流量、细胞更新、前列腺素、胃黏膜保护作用因子(如生长抑素、表皮生长因子)等因素有关. 根据既往研究所证实, DA通过作用于胃肠道DR, 具有增加胃肠黏膜血液供应的作用[11]、能减少胃酸的分泌[12]、能刺激胃肠道前列腺素合成(前列腺素则具有确定的细胞保护作用, 特别是对胃肠黏膜)[13], 表明胃肠道DA系统对胃肠黏膜具有保护作用; 而且, 早年就有研究[14]发现, 多巴胺及其一系列类似物能防止大鼠实验性胃溃疡和十二指肠溃疡的产生, 而DR拮抗剂则能诱发大鼠产生胃溃疡和十二指肠溃疡; 十二指肠溃疡患者的十二指肠黏膜DA含量减少, 而受体结合部位却明显增加[15], 此则表明胃肠道DA递质减少及其受体表达量增多, 是胃肠损伤的因素之一. 因此, 在吗啡依赖(包括躯体依赖和精神依赖)胃肠损伤过程中, 胃肠道可呈现出DA递质减少, 以及D2R受体表达量上调的改变, 这也是在阿片类依赖消化系统损害机制研究中的首次发现. 本文从胃和十二指肠DA递质和受体调控角度所揭示的阿片类依赖消化系功能紊乱的机制, 可为阿片类依赖消化系损害的临床治疗用药提供新的思路, 这对于提高阿片类依赖患者的整体戒毒治疗水平, 降低复吸率具有一定的意义.
鉴于阿片类依赖胃肠道的损伤得不到及时纠正, 可影响阿片类依赖患者的整体戒毒治疗水平, 因此, 非常有必要全面揭示阿片类依赖(包括躯体依赖和精神依赖)状态下消化系统损伤的机制, 又特别因为溃疡性上消化道出血已成为吸毒者临床致死原因之一, 而多巴胺(dopamine, DA)作为胃肠道的一种重要神经递质通过与其受体结合, 在消化系统多种功能中发挥着重要的作用, 同时胃肠多巴胺系统(递质和其受体)的改变亦与消化系多种疾病如溃疡、出血等密切相关, 但目前在阿片类依赖消化系统损害中, 关于DA递质及其受体变化的研究尚未见文献报道.
吴灵飞, 教授, 主任医师, 汕头大学医学院附二院
阿片类依赖的机制及其治疗一直是国内外戒毒领域研究的重点和热点, 尤其是脱(戒)毒后复吸的原因和机制. 然而, 如何减轻阿片类戒断后精神依赖并防止复吸仍是目前亟待解决的难题, 吗啡作为临床常用的一种镇痛药, 虽然有相当的医疗价值, 但其成瘾性及其脱毒后的复吸阻碍了其在临床的广泛应用.
DA及其一系列类似物能防止大鼠实验性胃溃疡和十二指肠溃疡的产生, 而多巴胺受体拮抗剂则能诱发大鼠产生胃溃疡和十二指肠溃疡; 十二指肠溃疡患者的十二指肠黏膜DA含量减少, 而受体结合部位却明显增加.
本实验观察到正常大鼠胃和十二指肠含有一定量的DA递质和多巴胺受体亚型2(dopamine D2 receptor, D2R), 但在吗啡精神依赖模型大鼠胃和十二指肠黏膜组织中的DA含量均减少; 而胃贲门、胃体和十二指肠组织中D2R的表达量上调, 再结合在模型组大鼠胃和十二指肠出血明显多于NS对照组的肉眼所见, 提示吗啡依赖胃肠的损伤与胃肠DA系统的改变具有一定的相关性.
本文以胃和十二指肠DA递质及其D2受体为切入点, 从胃肠生化和受体角度所揭示的阿片类依赖消化系功能紊乱的机制, 为临床通过利用调控多巴胺系统功能紊乱所引起的消化系统功能异常提供了相应的理论依据. 并为其临床用药提供了新的思路.
DA作为胃肠道的一种重要神经递质通过与其受体结合, 在消化系统多种功能中发挥着重要的作用, 并与消化系统疾病密切相关. 探讨吗啡依赖胃肠损伤的DA能作用机制, 为阿片类依赖消化系统功能紊乱的临床治疗提供相应的依据, 有一定的应用价值. 本文总体研究内容清晰, 思路明确, 结果可信.
编辑: 郭鹏 电编: 都珍珍
| 1. | 张 文林, 叶 土生. 1115例海洛因依赖者脱毒期上消化道出血情况调查. 中国药物滥用防治杂志. 2000;6:20-22. |
| 2. | 杨 良. 海洛因的毒性及危害. 第1版. 北京: 中国医药科技出版社 1998; 107-108. |
| 3. | Mezey E, Eisenhofer G, Hansson S, Hunyady B, Hoffman BJ. Dopamine produced by the stomach may act as a paracrine/autocrine hormone in the rat. Neuroendocrinology. 1998;67:336-348. [PubMed] |
| 4. | Dive A, Foret F, Jamart J, Bulpa P, Installé E. Effect of dopamine on gastrointestinal motility during critical illness. Intensive Care Med. 2000;26:901-907. [PubMed] |
| 5. | 徐 叔云, 卞 如濂, 陈 修. 药理实验方法学. 第2版, 北京: 人民卫生出版社 2002; 459-464. |
| 9. | Holzer P. Opioid receptors in the gastrointestinal tract. Regul Pept. 2009;155:11-17. [PubMed] [DOI] |
| 10. | Thomas J. Opioid-induced bowel dysfunction. J Pain Symptom Manage. 2008;35:103-113. [PubMed] [DOI] |
| 11. | Kaise M, Echizen H, Ishizaki T. Dopaminergic control of gastric mucosal blood flow in humans. A study with endoscopic laser Doppler flowmetry coupled with gastric submucosal drug injection. Dig Dis Sci. 1993;38:1169-1174. [PubMed] |
| 12. | Costall B, Naylor RJ, Tan CC. A central site of dopamine agonist action to modify gastric secretion in the rat. Eur J Pharmacol. 1985;117:61-69. [PubMed] [DOI] |
| 13. | Nagahata Y, Urakawa T, Saitoh Y. Effect of dopamine on prostaglandin E2 content in gastric mucosa. Gastroenterol Jpn. 1990;25:681-684. [PubMed] |