修回日期: 2015-01-12
接受日期: 2015-01-15
在线出版日期: 2015-03-08
目的: 探讨交感神经递质去甲肾上腺素(norepinephrine, NE)对体外培养肝星状细胞(hepatic stellate cells, HSC)系表达瘦素以及瘦素受体的影响.
方法: 用不同浓度的NE作用于HSC, 分别于24、48及72 h收集细胞, 免疫组织化学方法检测活化HSC表达α-肌动蛋白(α-smooth muscle actin, α-SMA)情况; Western blot法检测其表达瘦素以及瘦素受体蛋白的影响; real-time PCR检测NE对HSC瘦素以及瘦素受体mRNA的影响.
结果: (1)免疫组织化学结果显示, 1、10、100 μmol/L浓度NE作用于HSC 24 h, α-SMA表达明显增加(14.1±4.4, 17.5±5.2, 19.8±4.1 vs 11.3±4.5; P<0.05); 提示NE可以活化HSC, 并促进HSC增殖. 10 μmol/L NE作用HSC 24、48、72 h后, α-SMA表达逐渐增强(17.5±5.2; 18.5±5.4; 19.2±6.2, P<0.05); 提示NE对HSC的促增殖作用具有时间依赖性; (2)Western blot结果显示, 1、10、100 μmol/L NE作用于HSC 24 h后, 瘦素蛋白表达明显高于对照组(1.54±0.08, 2.72±0.09, 2.84±0.18 vs 0.85±0.12, P<0.05); 瘦素受体蛋白表达亦明显高于对照组(1.57±0.18, 2.51±0.17, 2.89±0.19 vs 0.98±0.15, P<0.05); (3)Real-time PCR检测HSC瘦素以及瘦素受体mRNA的表达增加, 1、10、100 μmol/L NE作用于HSC 24 h后, 瘦素mRNA表达明显高于对照组(1.51±0.08, 2.58±0.09, 3.63±0.12 vs 1.00±0.07, P<0.05); 瘦素受体mRNA表达亦明显高于对照组(1.71±0.08, 2.87±0.10, 4.01±0.14 vs 1.00±0.08, P<0.05).
结论: 交感神经递质NE对体外活化的HSC瘦素以及瘦素受体的表达均有促进作用, 从而参与了肝纤维化的进程.
核心提示: 本研究首次检测了交感神经递质去甲肾上腺素(norepinephrine, NE)对肝星状细胞(hepatic stellate cells, HSC)瘦素以及瘦素受体表达的影响. 结果证实NE作用于HSC之后, 瘦素以及可溶性瘦素受体蛋白以及mRNA表达均明显增高, 提示NE确实介导了HSC瘦素以及瘦素受体的表达, 从而参与了肝纤维化的过程.
引文著录: 刘娜, 穆华, 梁传栋, 郑吉敏, 张建. 去甲肾上腺素对肝星状细胞表达瘦素以及瘦素受体的影响. 世界华人消化杂志 2015; 23(7): 1052-1058
Revised: January 12, 2015
Accepted: January 15, 2015
Published online: March 8, 2015
AIM: To investigate the effect of sympathetic neurotransmitter norepinephrine (NE) on the expression of leptin and leptin receptor in hepatic stellate cells (HSCs) in vitro.
METHODS: Different concentrations of NE were applied on HSCs for 24, 48 or 72 h. Immunohistochemical staining was used to detect the expression of α-smooth muscle actin (α-SMA) in activated HSCs. Western blot was used to detect the expression of leptin and soluble leptin receptor (sOB-R) proteins. Real-time PCR was used to examine the effect of NE on mRNA expression of leptin and sOB-R in HSCs.
RESULTS: Immunohistochemistry results showed that after 1, 10, or 100 μmol/L NE was used on HSCs, the expression of α-SMA increased significantly at 24 h (14.1 ± 4.4, 17.5 ± 5.2, 19.8 ± 4.1 vs 11.3 ± 4.5; P < 0.05), suggesting that NE could activate HSCs and promote their proliferation. When 10 μmol/L NE was applied for 24, 48 or 72 h, α-SMA expression gradually increased (17.5 ± 5.2; 18.5 ± 5.4; 19.2 ± 6.2, P < 0.05), indicating that NE induced HSC proliferation in a time-dependent manner. Western blot analysis showed that leptin protein expression was significantly higher in HSCs after treatment with 1, 10 and 100 μmol/L NE for 24 h compared with the control group (1.54 ± 0.08, 2.72 ± 0.09, 2.84 ± 0.18 vs 0.85 ± 0.12, P < 0.05); the expression of leptin receptor protein was also significantly higher than that in the control group (1.57 ± 0.18, 2.51 ± 0.17, 2.89 ± 0.19 vs 0.98 ± 0.15, P < 0.05). Real-time PCR was used to detect mRNA expression of leptin and leptin receptor, and the results showed that leptin mRNA expression was significantly higher than that in the control group (1.51 ± 0.08, 2.58 ± 0.09, 3.63 ± 0.12 vs 1.00 ± 0.07, P < 0.05); the expression of leptin receptor mRNA was also significantly higher than that in the control group (1.71 ± 0.08, 2.87 ± 0.10, 4.01 ± 0.14 vs 1.00 ± 0.08, P < 0.05).
CONCLUSION: The sympathetic neurotransmitter NE plays a role in the process of liver fibrosis possibly by promoting leptin and sOB-R expression in activated HSCs.
- Citation: Liu N, Mu H, Liang CD, Zheng JM, Zhang J. Effect of norepinephrine on expression of leptin and leptin receptor in hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2015; 23(7): 1052-1058
- URL: https://www.wjgnet.com/1009-3079/full/v23/i7/1052.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i7.1052
瘦素(leptin)是一种新型的脂肪因子, 已经被广泛认为参与了肝纤维化的进程[1]. 研究[2]发现在非酒精性脂肪肝患者中血清瘦素水平增高, 而瘦素是肝星状细胞(hepatic stellate cells, HSC)的强有力促有丝分裂因子, 并抑制HSC的细胞凋亡. 交感神经递质去甲肾上腺素(norepinephrine, NE)也能增加HSC数目, 并使其活化, 促进纤维化的形成. 瘦素对HSC的活化及促进纤维化的形成作用可能需要NE参与调节. 本文旨在探讨NE对活化HSC表达瘦素及其受体表达的影响, 为肝纤维化的临床治疗提供新的理论依据及治疗途径.
RPMI-1640培养基购自美国Gibco公司; 胎牛血清购自杭州四季青公司; α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)兔抗人单抗购自美国Abcam公司; β-actin兔抗人单抗购自北京博奥森公司; 兔抗人瘦素抗体、兔抗人瘦素受体抗体购自武汉博士德生物工程有限公司; ABC免疫组织化学试剂盒为Zymed公司产品; 逆转录反应体系、SYBR Green Real Master Mix、TRIzol试剂盒购自中国北京天根公司; PCR扩增用引物由上海生工生物工程技术服务有限公司合成; NE购自美国Sigma公司; 其他试剂为分析纯. 主要仪器有超净工作台、二氧化碳培养箱(Precision Co, 美国), 倒置相差显微镜(Olympus, 日本).
1.2.1 细胞系及细胞培养: 肝星状细胞系CFSC由美国Greenwel教授建系并惠赠, 其表型为活化的HSC, 从CCl4诱发的肝硬化大鼠中分离并通过培养使细胞自发获得永生性, 冷冻保存于液氮中. 将冷冻保存的肝星状细胞系复苏后接种于含10%胎牛血清、100 IU/mL青霉素、100 µg/mL链霉素和4 mmol/mL谷氨酰胺的RPMI-1640培养液中, 于37 ℃、50 mL/L CO2的培养箱内培养. 细胞随机分为4组: (1)空白对照组, 为单纯HSC培养; (2)低浓度NE组(1 μmol/L); (3)中浓度NE组(10 μmol/L); (4)高浓度NE组(100 μmol/L).
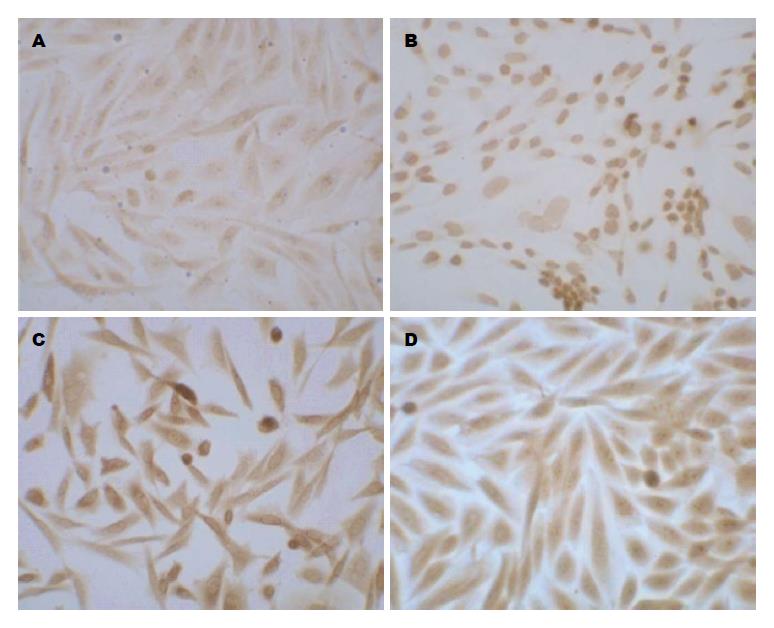
1.2.2 免疫组织化学法测定α-SMA表达情况: (1)细胞爬片: 取HSC细胞, 制成细胞悬液, 调整细胞密度为(1-5)×105/mL. 吸取细胞悬液500 μL, 分别接种于盖玻片上. 培养箱孵育4 h, 移去培养液, 对照组加1 mL培养液, 实验组分别加入1 mL含1、10、100 μmol/L NE的培养液, 培养箱内继续孵育; (2)免疫细胞化学染色: 40 g/L多聚甲醛固定30 min, PBS洗3遍, H2O2封闭10 min, PBS洗3遍, 山羊血清封闭(室温下1 h), 加入α-SMA一抗, 4 ℃冰箱过夜. 加ABC复合物, 室温下30 min, DAB显色, 苏木素复染, 中性树胶封固. 显微镜下观察α-SMA表达情况, 并于400倍镜下选取6个视野进行计分. 按照阳性细胞占所有细胞的比例计分, 0、<25%、25%-49%、50%-74%、≥75%分别为0、1、2、3、4 分. 着色强度计分: 细胞无着色, 0分; 浅黄色, 1分; 棕黄色, 2分; 棕褐色, 3分. 2项评分结果相加, 各组分别设置4个复孔.
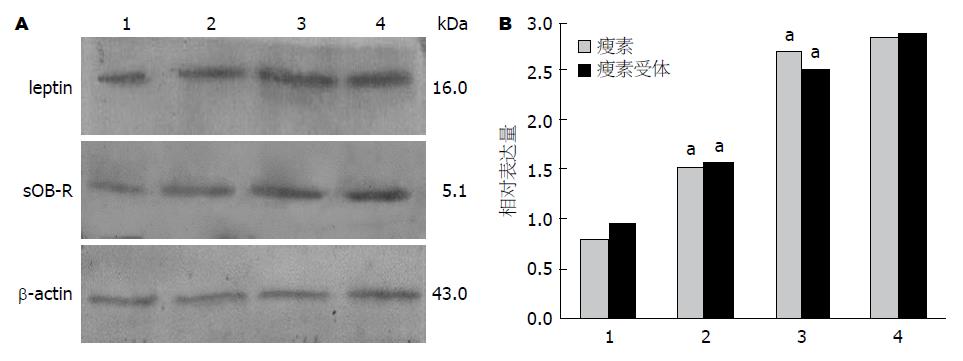
1.2.3 Western blot检测瘦素以及瘦素受体蛋白的变化: 取对数生长期细胞, 加1、10、100 μmol/L NE继续培养24、48及72 h后收集细胞, 提取细胞总蛋白, 考马斯亮蓝比色法测定蛋白含量. 以8%的SDS-PAGE凝胶作为分离胶电泳, 转膜, 封闭, 分别以兔抗人痩素抗体、兔抗人痩素受体抗体(1:200)和兔抗人β-actin多克隆抗体(1:200)作为第一抗体反应; 辣根过氧化物酶标记的山羊抗兔IgG(1:5000)作为第二抗体反应. 采用ECL发光剂, 进一步显影、定影, 结果以目的蛋白与β-actin的积分光密度值的比值表示. 密度扫描分析采用美国Kodak公司ID数码成像分析系统软件对Western印迹结果进行定量分析, 灰度值以积分光密度值(IOD)表示.
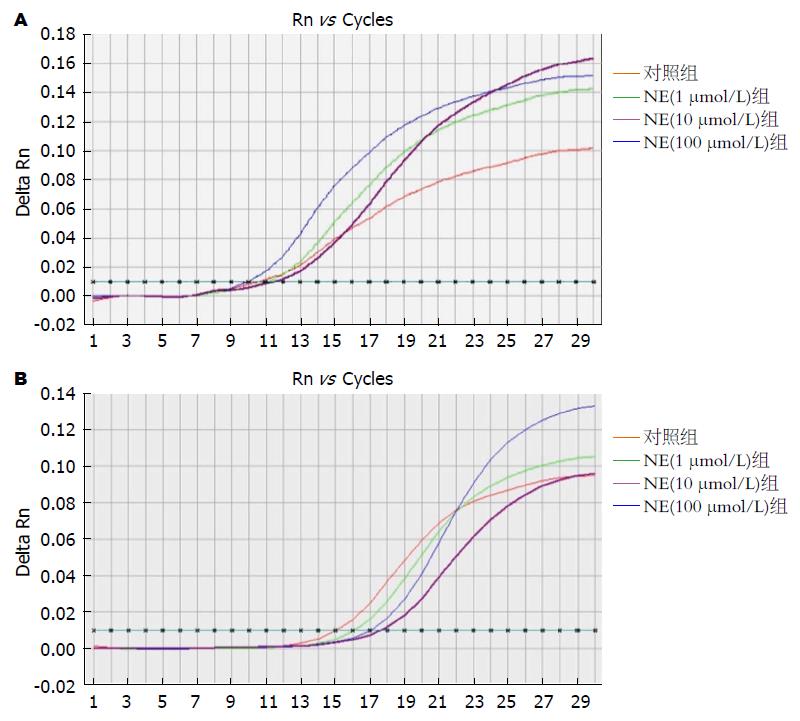
1.2.4 Real-time Q-PCR检测NE对HSC表达瘦素以及瘦素受体的影响: (1)采用TRIzoL试剂盒, 提取HSC总RNA, 逆转录合成cDNA; leptin、可溶性瘦素受体(soluble leptin receptor, sOB-R)及内参照甘油醛-3-磷酸脱氢酶(glyceraldehyde phosphate dehydrogenase, GAPDH)引物参照Genbank基因序列自行设计, 由北京赛百盛基因有限公司合成. 引物设计与合成如下: leptin(正义: 5'-CAATGACATTTCACACACGCAG-3', 反义: 5'-AGATGGAGGAGGTCTCGCAG-3', 扩增产物大小为204 bp). sOB-R(正义: 5'-GTGTCCTTCCTGACTCCGTAG-3', 反义: 5'-GTTATTCTCTGGAAAGACTGGCT-3', 扩增产物大小为119 bp). GAPDH(正义: 5'-TCCCTCAAGATTGTCAGCAA-3', 反义: 5'-AGATCCACAACGGATACATT-3', 扩增产物大小为259 bp); (2)在PE5700实时荧光定量PCR仪(美国ABI公司)上进行实时定量扩增. SYBR反应体系25 μL. 反应条件: 93 ℃ 5 min, 1个循环; 93 ℃ 45 s, 55 ℃ 1 min, 10个循环; 93 ℃ 30 s, 55 ℃ 45 s, 30个循环. 利用实时荧光定量PCR仪自带软件进行分析, 获得产物的Ct值. 采用相对定量2-△△Ct法比较leptin、sOB-R基因在各组中的表达差异, 即以对照组leptin、sOB-R mRNA表达量为标准, 各实验组leptin、sOB-R的表达量相对于对照组的变化用以下公式计算: △Ct实验组 = Ct目的基因-CtGAPDH, △Ct对照组 = Ct对照基因-CtGAPDH, △△Ct = △Ct实验组-△Ct对照组, 目的基因的相对表达量folds = 2-△△Ct计算瘦素、瘦素受体mRNA相对表达量.
统计学处理 受试样品数据以mean±SD表示. 用SPSS12.0软件进行统计分析, 多组间比较采用单因素方差分析(One-way ANOVA), 组间比较采用q检验. P<0.05为差异有统计学意义.
1、10、100 μmol/L浓度NE作用于HSC 24 h, α-SMA表达明显增加(14.1±4.4, 17.5±5.2, 19.8±4.1 vs 11.3±4.5; P<0.05); 提示NE可以活化HSC, 并促进HSC增殖. 10 μmol/L NE作用HSC 24、48、72 h后, α-SMA表达逐渐增强(17.5±5.2, 18.5±5.4, 19.2±6.2, P<0.05)(表1, 图1).
Western blot分析显示, 分别在大约16.0、5.1 kDa位置出现leptin、sOB-R特异性条带, 在43 kDa位置可见β-actin条带. 结果证实, 1、10、100 μmol/L NE作用于HSC 24 h后, 瘦素蛋白表达明显高于对照组(1.54±0.08, 2.72±0.09, 2.84±0.18 vs 0.85±0.12, F值为499.733, P<0.05); 瘦素受体蛋白表达亦明显高于对照组(1.57±0.18, 2.51±0.17, 2.89±0.19 vs 0.98±0.15, F值为196.334, P<0.05) (图2).
在实时荧光定量PCR过程中, 以荧光值和循环数作图, 自动得到mRNA水平扩增曲线, 可见各样品的重复性较好, 扩增效率基本一致. 应用相对定量2-△△Ct法比较leptin、sOB-R基因在各组HSC中的表达. 结果证实, 1、10、100 μmol/L NE作用于HSC 24 h后, 瘦素mRNA表达明显高于对照组(1.51±0.08, 2.58±0.09, 3.63±0.12 vs 1.00±0.07, F值为1394.213, P<0.05); 瘦素受体mRNA表达亦明显高于对照组(1.71±0.08, 2.87±0.10, 4.01±0.14 vs 1.00±0.08, F值为904.241, P<0.05)(表2, 图3).
瘦素是新发现的重要脂肪因子[3-5]. 近年来瘦素在非酒精性脂肪肝、丙型肝炎及肝硬化等慢性肝病中的作用已引起众多学者的关注[6-9]. 而HSC作为肝脏主要的纤维生成细胞, 在肝损伤时活化转变为肌纤维母细胞并导致多种胶原的表达和细胞外基质的过度堆积是肝纤维化的重要机制[10-12]. 研究[13-16]发现在非酒精性脂肪肝患者中血清瘦素水平增高, 而瘦素是HSC的强有力促有丝分裂因子, 并抑制HSC的细胞凋亡, 从而在肝病的进展中扮演了重要角色. Oben等[17]通过动物实验发现痩素缺陷性ob/ob大鼠形成肝损伤, 但HSC数目却减少, 如补充瘦素可增加HSC数目, 肝纤维化加重; 但对于对照大鼠注射同样剂量的瘦素却不能增加HSC数量, 说明依赖瘦素且与损伤关联的因素可使HSC增加[18]. 近年来, 交感神经系统与肝脏疾病的关系受到越来越多的关注[19]. 交感神经系统过度活化参与了肝脏损伤后修复和纤维化的调节[20,21]. 交感神经递质NE能增加HSC数目, 并使其活化, 从而促进纤维化的形成[22,23]. 表达低儿茶酚胺水平或低交感活性的痩素缺陷性ob/ob小鼠经研究显示可以产生肝纤维化抵抗, 当给予动物肝细胞毒性饮食, NE缺乏的大鼠不能出现活化HSC的积累, 纤维化形成过程减慢, 当给予补充促肾上腺素释放物质时, 这种现象消失, 认为NE直接作用于HSC, 以调节并削弱瘦素对HSC的活化作用[24]. 由此可见, 瘦素对HSC的活化及促进纤维化的形成作用可能需要NE参与调节[25]. 在我们的前期研究中发现, HSC可以合成和释放NE, 还表达α1、β1、β2等肾上腺素受体, HSC表达肾上腺素受体各亚型随着肝纤维化的进展而增加[26]. NE还可以抑制活化HSC的凋亡, 并促进其增殖[27,28]. 而瘦素对于HSC的作用是否需要NE的介导仍不明确. 本研究首次检测了交感神经递质NE对HSC瘦素以及瘦素受体表达的影响. 研究发现, NE作用于HSC之后, 瘦素以及可溶性瘦素受体蛋白以及mRNA表达均明显增高, 提示NE确实介导了HSC瘦素的表达, 从而参与了肝纤维化的过程.
瘦素是一种新型的脂肪因子, 已经被广泛认为参与了肝纤维化的进程. 瘦素可以促进肝星状细胞(hepatic stellate cells, HSC)有丝分裂, 并抑制其凋亡. 交感神经递质去甲肾上腺素(norepinephrine, NE)也能增加HSC数目, 促进纤维化的形成. 瘦素对HSC的活化及促进纤维化的形成作用可能需要NE参与调节.
李涛, 副主任医师, 北京大学人民医院肝胆外科
已经证实交感神经系统参与了肝纤维化的进展, 交感神经递质NE对于肝脏的主要纤维生成细胞HSC有促增殖作用, 并抑制其凋亡, 但具体机制仍不清楚, 对于瘦素以及瘦素受体的表达情况仍不明确.
交感神经递质NE能增加HSC数目,并使其活化, 促进纤维化的形成. 而表达低儿茶酚胺水平或低交感活性的瘦素缺陷性ob/ob小鼠可以产生肝纤维化抵抗, 认为NE可以直接作用于HSC, 以调节并削弱瘦素对HSC的活化作用.
本研究首次检测了交感神经递质NE对HSC瘦素以及瘦素受体表达的影响. 从而证实交感神经系统参与了肝纤维化的进程, 可以作为治疗肝纤维化的新靶点.
本研究发现, NE作用于HSC后, 瘦素以及可溶性瘦素受体表达均明显增高, 提示NE确实介导了HSC瘦素以及瘦素受体的表达, 参与了肝纤维化的过程. 从而为临床上肝纤维化的治疗提供新策略和新途径.
瘦素: 瘦素由肥胖基因编码, 主要由脂肪组织合成, 通过受体介导, 作用于靶组织, 抑制食欲并参与调节能量代谢、神经内分泌和免疫反应等; 可溶性瘦素受体: 是主要的瘦素结合蛋白, 影响游离瘦素指数, 调节瘦素的生物活性, 并参与瘦素的自分泌调节.
本研究结果可信, 具有一定的科学价值.
编辑: 郭鹏 电编: 都珍珍
| 1. | Yamamoto-Kataoka S, Ebihara K, Aizawa-Abe M, Nishio M, Kusakabe T, Yamamoto Y, Aotani D, Sakai T, Zhao M, Ebihara C. Leptin Improves Fatty Liver Independently of Insulin Sensitization and Appetite Suppression in Hepatocyte-Specific Pten-Deficient Mice with Insulin Hypersensitivity. Horm Metab Res. 2014; Nov 21. [Epub ahead of print]. [PubMed] |
| 2. | Mehta R, Birerdinc A, Wang L, Younoszai Z, Moazzez A, Elariny H, Goodman Z, Chandhoke V, Baranova A, Younossi ZM. Expression of energy metabolism related genes in the gastric tissue of obese individuals with non-alcoholic fatty liver disease. BMC Gastroenterol. 2014;14:72. [PubMed] [DOI] |
| 3. | Rachakonda V, Gabbert C, Raina A, Li H, Malik S, DeLany JP, Behari J. Stratification of risk of death in severe acute alcoholic hepatitis using a panel of adipokines and cytokines. Alcohol Clin Exp Res. 2014;38:2712-2721. [PubMed] [DOI] |
| 4. | Goldenberg D, Santos JL, Hodgson MI, Cortés VA. [Novel physiological and therapeutic implications of leptin]. Rev Med Chil. 2014;142:738-747. [PubMed] [DOI] |
| 5. | Paz-Filho G, Mastronardi CA, Licinio J. Leptin treatment: facts and expectations. Metabolism. 2015;64:146-156. [PubMed] [DOI] |
| 6. | Abenavoli L, Peta V. Role of Adipokines and Cytokines in Non-alcoholic Fatty Liver Disease. Rev Recent Clin Trials. 2014;9:134-140. [PubMed] |
| 7. | Polyzos SA, Kountouras J, Mantzoros CS. Leptin in nonalcoholic fatty liver disease: a narrative review. Metabolism. 2015;64:60-78. [PubMed] [DOI] |
| 8. | Wójcik K, Jabłonowska E, Omulecka A, Piekarska A. Insulin resistance, adipokine profile and hepatic expression of SOCS-3 gene in chronic hepatitis C. World J Gastroenterol. 2014;20:10449-10456. [PubMed] [DOI] |
| 9. | Liu Y, Brymora J, Zhang H, Smith B, Ramezani-Moghadam M, George J, Wang J. Leptin and acetaldehyde synergistically promotes αSMA expression in hepatic stellate cells by an interleukin 6-dependent mechanism. Alcohol Clin Exp Res. 2011;35:921-928. [PubMed] [DOI] |
| 10. | Oh S, Shida T, Sawai A, Maruyama T, Eguchi K, Isobe T, Okamoto Y, Someya N, Tanaka K, Arai E. Acceleration training for managing nonalcoholic fatty liver disease: a pilot study. Ther Clin Risk Manag. 2014;10:925-936. [PubMed] [DOI] |
| 11. | Zhou Q, Guan W, Qiao H, Cheng Y, Li Z, Zhai X, Zhou Y. GATA binding protein 2 mediates leptin inhibition of PPARγ1 expression in hepatic stellate cells and contributes to hepatic stellate cell activation. Biochim Biophys Acta. 2014;1842:2367-2377. [PubMed] [DOI] |
| 12. | Weiskirchen R, Tacke F. Cellular and molecular functions of hepatic stellate cells in inflammatory responses and liver immunology. Hepatobiliary Surg Nutr. 2014;3:344-363. [PubMed] [DOI] |
| 13. | Giby VG, Ajith TA. Role of adipokines and peroxisome proliferator-activated receptors in nonalcoholic fatty liver disease. World J Hepatol. 2014;6:570-579. [PubMed] [DOI] |
| 14. | Stojsavljević S, Gomerčić Palčić M, Virović Jukić L, Smirčić Duvnjak L, Duvnjak M. Adipokines and proinflammatory cytokines, the key mediators in the pathogenesis of nonalcoholic fatty liver disease. World J Gastroenterol. 2014;20:18070-18091. [PubMed] |
| 15. | Tang Y, Zheng S, Chen A. Curcumin eliminates leptin's effects on hepatic stellate cell activation via interrupting leptin signaling. Endocrinology. 2009;150:3011-3020. [PubMed] [DOI] |
| 16. | Choi SS, Syn WK, Karaca GF, Omenetti A, Moylan CA, Witek RP, Agboola KM, Jung Y, Michelotti GA, Diehl AM. Leptin promotes the myofibroblastic phenotype in hepatic stellate cells by activating the hedgehog pathway. J Biol Chem. 2010;285:36551-36560. [PubMed] [DOI] |
| 17. | Oben JA, Roskams T, Yang S, Lin H, Sinelli N, Torbenson M, Smedh U, Moran TH, Li Z, Huang J. Hepatic fibrogenesis requires sympathetic neurotransmitters. Gut. 2004;53:438-445. [PubMed] |
| 18. | Oben JA, Roskams T, Yang S, Lin H, Sinelli N, Li Z, Torbenson M, Thomas SA, Diehl AM. Norepinephrine induces hepatic fibrogenesis in leptin deficient ob/ob mice. Biochem Biophys Res Commun. 2003;308:284-292. [PubMed] |
| 19. | Bruinstroop E, Fliers E, Kalsbeek A. Hypothalamic control of hepatic lipid metabolism via the autonomic nervous system. Best Pract Res Clin Endocrinol Metab. 2014;28:673-684. [PubMed] [DOI] |
| 21. | Oben JA, Diehl AM. Sympathetic nervous system regulation of liver repair. Anat Rec A Discov Mol Cell Evol Biol. 2004;280:874-883. [PubMed] |
| 22. | Sigala B, McKee C, Soeda J, Pazienza V, Morgan M, Lin CI, Selden C, Vander Borght S, Mazzoccoli G, Roskams T. Sympathetic nervous system catecholamines and neuropeptide Y neurotransmitters are upregulated in human NAFLD and modulate the fibrogenic function of hepatic stellate cells. PLoS One. 2013;8:e72928. [PubMed] [DOI] |
| 23. | McKee C, Soeda J, Asilmaz E, Sigalla B, Morgan M, Sinelli N, Roskams T, Oben JA. Propranolol, a β-adrenoceptor antagonist, worsens liver injury in a model of non-alcoholic steatohepatitis. Biochem Biophys Res Commun. 2013;437:597-602. [PubMed] [DOI] |
| 24. | Mazzoccoli G, Vinciguerra M, Oben J, Tarquini R, De Cosmo S. Non-alcoholic fatty liver disease: the role of nuclear receptors and circadian rhythmicity. Liver Int. 2014;34:1133-1152. [PubMed] [DOI] |
| 25. | Wierzbicki AS, Oben J. Nonalcoholic fatty liver disease and lipids. Curr Opin Lipidol. 2012;23:345-352. [PubMed] [DOI] |
| 30. | Bartneck M, Warzecha KT, Tacke F. Therapeutic targeting of liver inflammation and fibrosis by nanomedicine. Hepatobiliary Surg Nutr. 2014;3:364-376. [PubMed] [DOI] |