修回日期: 2015-01-12
接受日期: 2015-01-16
在线出版日期: 2015-02-28
目的: 探讨不可切除的局部进展期胃癌术前口服替吉奥胶囊(gimeracil and oteracil porassium capsules, S-1)联合区域动脉灌注化疗栓塞的有效性及安全性.
方法: 回顾性分析郑州大学第一附属医院胃肠外科2010-01/2014-06收治的183例接受新辅助化疗后行手术切除的局部进展期胃癌患者的临床资料, 其中术前口服S-1联合区域动脉灌注化疗栓塞者90例(A组), 术前全身静脉化疗者93例(B组), A组与B组两组患者完成术前化疗后, 于3-4 wk内按照标准D2根治性手术操作要求进行手术. 比较两组术后组织病理学疗效、化疗不良反应发生率及术后并发症发生率.
结果: 两组术后标本的组织病理学评估均有效, A组和B组的疗效满意率分别为60%、43%, 差异有统计学意义(χ2 = 5.285, P<0.05); A组织化学疗不良反应(除外恶心反应)和术后吻合口瘘、肠梗阻、切口愈合不良、腹腔感染及肺部感染等并发症发生率均低于B组, 而恶心反应发生率高于B组; 两组均无新辅助化疗治疗相关死亡病例.
结论: 不可切除的局部进展期胃癌术前口服S-1联合区域动脉灌注化疗栓塞的疗效确切, 可降低化疗不良反应, 且不增加术后并发症的发生率.
核心提示: 口服替吉奥胶囊(gimeracil and oteracil porassium capsules)结合区域动脉灌注化疗栓塞的方案用于不可切除的进展期胃癌(advanced gastric cancer)术前新辅助化疗. 在全身给药的基础上强化局部治疗, 使给药区域更为准确, 利用化疗药物灌注栓塞肿瘤的滋养血管, 既提高了局部药物浓度, 又阻断了肿瘤血供, 取得了满意的临床疗效.
引文著录: 张玉坤, 郜永顺, 张云飞, 刘琪, 吴刚, 李文才, 李振乾. 不可切除的局部进展期胃癌术前口服S-1联合区域动脉灌注化疗栓塞的疗效评价. 世界华人消化杂志 2015; 23(6): 964-969
Revised: January 12, 2015
Accepted: January 16, 2015
Published online: February 28, 2015
AIM: To investigate the efficacy and safety of preoperative oral gimeracil and oteracil porassium capsules (S-1) chemotherapy combined with regional intra-arterial chemoembolization in the treatment of unresectable locally advanced gastric cancer.
METHODS: Clinical data for 183 patients with unresectable locally advanced gastric cancer who received operation after receiving neoadjuvant chemotherapy from January 2010 to June 2014 were retrospectively analyzed. Patients were divided into two groups: those who received preoperative oral S-1 chemotherapy plus regional intra-arterial chemoembolization (group A, n = 90) and those who received preoperative systemic chemotherapy (group B, n = 93). Radical resection was performed after 3 to 4 weeks for those who had resectable lesions.
RESULTS: The overall satisfactory rate was significantly higher (60%) in group A compared with 43% in group B (χ2 = 5.285, P < 0.05). The incidence rates of toxicities (except nausea) and postoperative complications such as anastomotic leakage, intestinal obstruction, poor wound healing, abdominal infection and pulmonary infection were all significantly lower in group A than in group B (P < 0.05 for all), while the incidence rate of nausea was significantly higher in group A than in group B (χ2 = 17.402, P < 0.01). There was no perioperative mortality related to neoadjuvant therapy in the two groups.
CONCLUSION: Preoperative oral S-1 chemotherapy combined with regional intra-arterial chemoembolization is associated with better efficacy, and fewer toxicities and postoperative complications in the treatment of unresectable locally advanced gastric cancer.
- Citation: Zhang YK, Gao YS, Zhang YF, Liu Q, Wu G, Li WC, Li ZQ. Preoperative oral S-1 plus regional intra-arterial chemoembolization for patients with unresectable locally advanced gastric cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(6): 964-969
- URL: https://www.wjgnet.com/1009-3079/full/v23/i6/964.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i6.964
胃癌是常见的恶性肿瘤, 据最新的统计, 我国每年新发胃癌的比例占世界的52.1%[1], 而且临床上早期胃癌所占比例较少, 绝大多数都是进展期胃癌(advanced gastric cancer, AGC). 在AGC中, 有相当一部分病例会因为局部浸润或转移严重而不可切除, 治疗效果很不理想. 怎样治疗不可切除的AGC, 如何进一步提高其治疗效果是经常需要面对的问题. 例如通过改变给药途径、增加肿瘤细胞对化疗药物敏感性等手段. 我们借鉴经验, 总结出口服替吉奥胶囊(gimeracil and oteracil porassium capsules, S-1)结合区域动脉灌注化疗栓塞的方案[2]用于不可切除的AGC的术前新辅助化疗.
选择郑州大学第一附属医院胃肠外科2010-01/2014-06收治的221例接受新辅助化疗的不可切除的局部进展期胃癌患者的临床资料, 剔除38例未行肿瘤切除手术者, 其余183例作为研究对象. 其中90例术前行口服S-1联合区域动脉灌注化疗栓塞(A组), 93例术前行全身静脉化疗(B组). 纳入标准: (1)患者同意参加本研究, 具有良好的依从性, 并签署化疗知情同意书; (2)年龄30-70岁, 性别不限; (3)组织病理学证实的胃腺癌、印戒细胞癌; (4)超声胃镜计算机断层扫描(computed tomography, CT)或磁共振成像(magnetic resonance imaging, MRI)等检查提示: 浸润深度为T3-T4且无远处转移, 至少2名外科医生认为不能行R0切除; (5)所有患者均未经过有效的抗肿瘤治疗. 排除标准: (1)对实验药物或对照药物过敏或过敏体质者; (2)妊娠或哺乳期妇女; (3)肝脏、肺、骨、脑转移以及腹腔以外淋巴结转移等远处转移; (4)同时患有其他恶性肿瘤; (5)有影响化疗不良反应评价的疾病. 本研究经郑州大学第一附属医院道德伦理委员会批准并经患者签署化疗知情同意书. 患者一般资料如表1.
1.2.1 治疗: A组方案: S-1 40 mg, Bid, P.O., d1-14, q3w×3周期; 奥沙利铂(oxaliplatin, OXA)100 mg/m2、表阿霉素(epirubicin, ADM)30 mg/m2, 第14天行区域动脉灌注化疗栓塞, 以Seldinger法经右侧股动脉插管, 超选择至肿瘤供血动脉, 根据肿瘤供血动脉迂曲、紊乱血管团的特点定位后, 将OXA 100 mg/m2、ADM 30 mg/m2各1/2分别溶解于5%葡萄糖注射液中, 泵入肿瘤滋养动脉, 然后将各自剩余1/2与40%碘化油乳化液共10 mL进行栓塞. 每间隔3 wk重复1次该方案. B组方案(mFOLFOX6): OXA 100 mg/m2, 静脉点滴2 h, 第1天; 亚叶酸钙(leucovorin, LV) 400 mg/m2, 静脉点滴2 h, 第1天; 氟尿嘧啶(5-fluorouracil, 5-Fu)2400 mg/m2, 静脉点滴46 h. 每间隔3 wk重复1次治疗方案. 每3 wk期新辅助治疗结束后复查CT, 按实体瘤的疗效评价标准(Response Evaluation Criteria in Solid Tumors, RECIST)(2009年1.1版)评价其疗效, 以完全缓解+部分缓解为治疗有效. 新辅助治疗结束3-4 wk进行手术治疗.
1.2.2 术后组织病理学评定: 按照胃癌化疗组织学疗效评定标准分0-Ⅲ级, Ⅰ级以上为治疗有效, Ⅱ级以上为疗效满意[1].
1.2.3 不良反应: 按美国国家癌症研究所(National Cancer Institute, NCI)通用不良反应术语标准v4.0分为1-5级, 低级反应时给予对症处理后继续原治疗方案, 严重反应时立即停止相关治疗.
1.2.4 术后并发症: 吻合口瘘、肠梗阻、切口愈合不良、腹腔感染、肺部感染等.
统计学处理 采用SPSS17.0进行统计分析, 连续性变量资料采用mean±SD表示, 应用Student's t检验; 对计数资料应用χ2检验. P<0.05为差异有统计学意义.
两组所有手术标本病理学评估均有效, A组和B组疗效满意率分别为60%、43%, 差异均有统计学意义(χ2 = 5.285, P<0.05)(表2).
| 分组 | n | 0级 | Ⅰ1级 | Ⅰ2级 | Ⅱ级 | Ⅲ级 |
| A组 | 90 | 0 | 10 | 26 | 45 | 9 |
| B组 | 93 | 0 | 21 | 32 | 35 | 5 |
| χ2值 | 5.285 | |||||
| P值 | 0.022 | |||||
A组不良反应均为低级反应(1、2级), 而B组出现较多的严重反应(3、4级), A组的不良反应发生率(除外恶心反应)均明显低于B组, 恶心反应高于B组, 两组均无治疗相关死亡病例, 其不良反应发生率相比差异有统计学意义(P<0.05)(表3).
| 不良反应 | A组 | B组 | χ2值 | P值 | ||||||||||
| 0 | 1 | 2 | 3 | 4 | 5 | 0 | 1 | 2 | 3 | 4 | 5 | |||
| 白细胞减少 | 34 | 39 | 17 | 0 | 0 | 0 | 14 | 26 | 30 | 21 | 2 | 0 | 34.6260 | <0.001 |
| 中性粒细胞减少 | 32 | 44 | 14 | 0 | 0 | 0 | 8 | 27 | 35 | 20 | 3 | 0 | 38.4930 | <0.001 |
| 贫血 | 80 | 8 | 2 | 0 | 0 | 0 | 70 | 11 | 6 | 4 | 2 | 0 | 8.7950 | 0.003 |
| 血小板减少 | 78 | 10 | 2 | 0 | 0 | 0 | 67 | 12 | 7 | 5 | 2 | 0 | 10.7290 | 0.001 |
| 恶心 | 4 | 71 | 15 | 0 | 0 | 0 | 8 | 35 | 43 | 0 | 0 | 0 | 17.4020 | <0.001 |
| 呕吐 | 80 | 9 | 1 | 0 | 0 | 0 | 60 | 13 | 10 | 8 | 2 | 0 | 19.9998 | <0.001 |
| 腹泻 | 84 | 6 | 0 | 0 | 0 | 0 | 71 | 7 | 8 | 5 | 2 | 0 | 14.2190 | <0.001 |
| 皮肤/黏膜 | 53 | 30 | 7 | 0 | 0 | 0 | 35 | 20 | 17 | 13 | 8 | 0 | 25.9140 | <0.001 |
| 疲惫 | 75 | 15 | 0 | 0 | 0 | 0 | 52 | 41 | 0 | 0 | 0 | 0 | 16.1920 | <0.001 |
| 感觉异常 | 80 | 10 | 0 | 0 | 0 | 0 | 7 | 65 | 21 | 0 | 0 | 0 | 122.5700 | <0.001 |
| 浅表静脉炎 | 79 | 11 | 0 | 0 | 0 | 0 | 8 | 56 | 29 | 0 | 0 | 0 | 117.1490 | <0.001 |
A组发生吻合口瘘、肠梗阻、切口愈合不良、腹腔感染、肺部感染等并发症的发生率均低于B组, 差异均有统计学意义(均P<0.05)(表4).
| 分组 | n | 吻合口瘘 | 肠梗阻 | 切口愈合不良 | 腹腔感染 | 肺部感染 |
| A组 | 90 | 2 | 2 | 3 | 2 | 3 |
| B组 | 93 | 12 | 10 | 13 | 9 | 14 |
| χ2值 | 7.836 | 5.432 | 6.496 | 4.500 | 7.456 | |
| P值 | 0.007 | 0.020 | 0.011 | 0.034 | 0.006 |
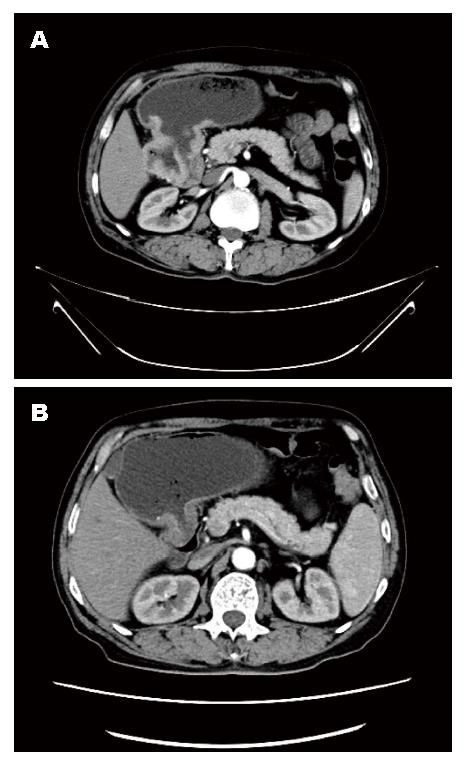
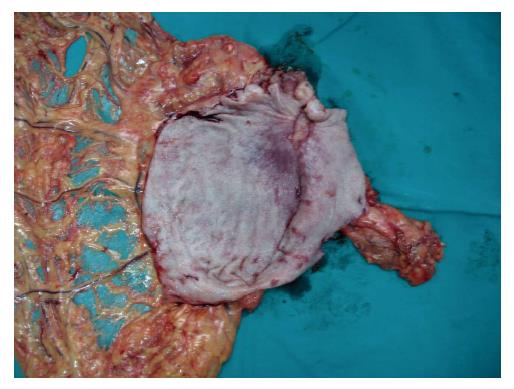
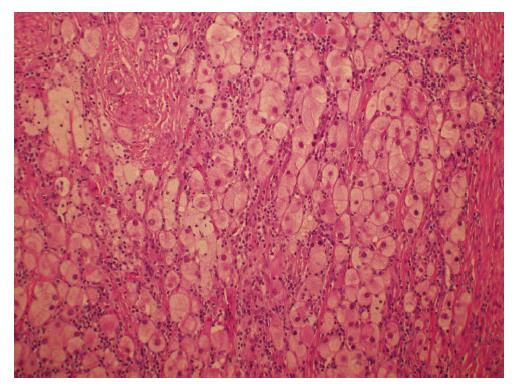
男, 63岁, 纳差6 mo余. 胃镜示: (胃)中分化腺癌, CT示: 胃窦占位, 结合临床考虑胃癌, 并胃周淋巴结肿大(图1A); 行3个周期A组方案治疗后, 复查CT显示原发肿瘤及转移淋巴结较前明细缩小(图1B). 遂行根治性远端胃大部切除术, 术后大体标本见局部给药范围内胃黏膜坏死, 瘢痕皱缩(图2). 术后病理检查示: (胃)溃疡, 胃壁内见较多淋巴细胞、浆细胞、组织细胞浸润, 并见较多成团分布的胞浆透亮的大细胞, 结合免疫组织化学, 考虑为退变的癌细胞(图3).
目前, 胃癌化疗的临床研究迅猛发展, 临床已广泛应用以各种药物优化组合后形成的联合用药方案, 虽使疗效得到一定程度的提高, 但近些年的临床研究也表明, 这些新药组成的联合用药方案对不可切除的AGC的疗效仍然有限[3,4]. 胃癌的治疗效果并不是与无限的扩大手术范围成正比的[5]. 相关研究结果表明胃癌领域应用分子靶向药物的机会还很渺茫[6-8]. 在对胃癌更理想的化疗药物问世以前, 医务人员迫切需要寻找到能够在现有化疗药物的基础上尽可能地提高新辅助化疗的有效率的方法, 例如通过改变给药途径、增加肿瘤细胞对化疗药物敏感性等手段. 我们借鉴经验, 总结出口服S-1结合区域动脉灌注化疗栓塞的方案用于不可切除的AGC术前新辅助化疗. 该研究与李国立教授等[9]的FLEEOX方案类似, 都是在全身给药的基础上强化局部治疗, 使给药区域更为准确, 局部药物浓度更高. 不同的是将全身给药途径由静脉给药改为口服, 并且在局部动脉灌注化疗中加入碘油栓塞, 以阻断肿瘤供血血管, 提高局部组织内药物浓度.
化疗药物大致分为细胞周期特异性药物和细胞周期非特异性药物[10], 前者如5-Fu, 给药时间是影响疗效的主要因素, ACTS-GC试验中证实了S-1在胃癌治疗中的价值, 而且具有口服方便, 患者易于接受的优点. 后者如OXA和ADM, 作用强、速度快, 浓度是影响其疗效的主要因素, 浓度增加后, 杀伤癌细胞的数量呈对数增加[11].
影响化疗能否继续进行的主要因素之一为化疗不良反应的严重程度. A组不良反应发生率(除恶心外)均低于B组, 主要原因可能是: 药物局部注射后经肝脏的"首过效应"后才进入体循环, 对全身的不良反应就相对较轻, 保证了临床应用的安全性[9,12]. 同时, 利用化疗药物栓塞肿瘤的滋养血管, 既提高了局部药物浓度, 又阻断了肿瘤血供, 虽然该研究在动脉给药中加用了ADM, 但是并未增加心血管等不良反应. 观察手术切除的大体标本可以发现, 动脉给药范围内的胃黏膜坏死, 出现瘢痕改变, 而给药范围以外的胃黏膜却是正常的. 虽然全身静脉给药也能通过肿瘤滋养血管进入肿瘤组织, 但不足之处也非常明显, 静脉给药可分布至全身, 对各组织器官均会产生影响, 从而产生不同程度的消化道、骨髓抑制等化疗不良反应, 而且达不到动脉给药的浓度.
目前, 不可切除的AGC最常用的新辅助化疗方案之一是mFOLFOX6[13], 但术前全身静脉化疗的不良反应与术后并发症均较高, 治疗效果不理想[14], 该研究表明口服S-1联合区域动脉灌注化疗栓塞治疗不可切除的AGC疗效确切, 可有效降低不良反应, 并且不增加术后并发症发生率, 有相关文献报道不可切除的AGC行术前动静脉结合可以提高胃癌患者的预后[15]. 目前, 临床上对不可切除的AGC还没能够给予足够的重视, 现今的治疗所能取得的疗效仍然无法满足临床上治疗不可切除胃癌的需要[16]. 本研究取得了满意的临床疗效, 但是, 本研究仅是单中心的研究, 只是初步的结果, 仍需进一步进行大量、深入的研究.
据最新统计, 我国每年新发胃癌的比例占世界的52.1%, 而且绝大多数都是进展期胃癌(advanced gastric cancer, AGC), 有相当一部分病例会因为浸润或转移严重而不可切除. 虽然目前很多临床试验证实了术前化疗能够改善可切除胃癌的预后, 但对不可切除的胃癌尚缺乏理想的治疗方法.
杜雅菊, 教授, 哈尔滨医科大学附属第二医院消化内科
术前新辅助化疗的作用已经得到广大临床医师的重视和认可, 但是怎样规范化治疗不可切除的局部进展期胃癌, 如何进一步提高其治疗效果、降低不良反应发生率及减少术后并发症是当今临床工作中迫切需要解决的问题.
动静脉结合给药的方法可以提高不可切除的局部进展期胃癌的手术切除率, 降低不良反应发生率及减少术后并发症, 提高患者的远期疗效, 越来越受到临床外科医师的重视和推广.
本研究将细胞周期特异性药物替吉奥胶囊(gimeracil and oteracil porassium capsules, S-1)和细胞周期非特异性药物[奥沙利铂(oxaliplatin, OXA)、表阿霉素(epirubicin, ADM)]通过口服及动脉给药, 在全身给药的基础上强化局部治疗, 使给药区域更为准确, 局部药物浓度更高, 并且在局部动脉灌注化疗中加入碘油栓塞, 以阻断肿瘤供血血管, 提高局部组织内药物浓度, 而且减轻对其他组织器官的影响. 以此达到提高临床疗效、降低不良反应发生率、减少术后并发症的效果.
通过对比不可切除的局部进展期胃癌术前口服S-1联合区域动脉灌注化疗栓塞与传统辅助化疗给药途径的组织病理学疗效、不良反应发生率、术后并发症发生率, 得出结论: 不可切除的局部进展期胃癌术前口服S-1联合区域动脉灌注化疗栓塞安全有效, 值得临床推广.
动脉灌注栓塞化疗: 通过动脉造影选择肿瘤供血动脉, 将化疗药物分别溶解, 部分泵入肿瘤供血动脉, 余化疗药物同碘化油乳液混合栓塞至肿瘤滋养动脉.
本文结合当今不可切除的局部进展期胃癌的治疗这一难点, 选题得当、设计合理、疗效满意, 是一项临床实用性较强的研究, 值得广大临床医师阅读与借鉴.
编辑: 韦元涛 电编: 闫晋利
| 1. | Chen W, Zheng R, Zhang S, Zhao P, Li G, Wu L, He J. Report of incidence and mortality in China cancer registries, 2009. Chin J Cancer Res. 2013;25:10-21. [PubMed] [DOI] |
| 2. | 郜 永顺, 钱 国武, 张 云飞, 吴 刚, 李 甸源, 李 文才, 赵 武干, 赵 阳阳. 局部进展期直肠癌术前全身静脉联合区域动脉灌注化疗栓塞的疗效评价. 世界华人消化杂志. 2013;21:367-372. |
| 3. | Koizumi W, Narahara H, Hara T, Takagane A, Akiya T, Takagi M, Miyashita K, Nishizaki T, Kobayashi O, Takiyama W. S-1 plus cisplatin versus S-1 alone for first-line treatment of advanced gastric cancer (SPIRITS trial): a phase III trial. Lancet Oncol. 2008;9:215-221. [PubMed] [DOI] |
| 4. | Cunningham D, Okines AF, Ashley S. Capecitabine and oxaliplatin for advanced esophagogastric cancer. N Engl J Med. 2010;362:858-859. [PubMed] [DOI] |
| 5. | Tsujinaka T, Sasako M, Yamamoto S, Sano T, Kurokawa Y, Nashimoto A, Kurita A, Katai H, Shimizu T, Furukawa H. Influence of overweight on surgical complications for gastric cancer: results from a randomized control trial comparing D2 and extended para-aortic D3 lymphadenectomy (JCOG9501). Ann Surg Oncol. 2007;14:355-361. [PubMed] [DOI] |
| 6. | Moehler M, Mueller A, Trarbach T, Lordick F, Seufferlein T, Kubicka S, Geissler M, Schwarz S, Galle PR, Kanzler S. Cetuximab with irinotecan, folinic acid and 5-fluorouracil as first-line treatment in advanced gastroesophageal cancer: a prospective multi-center biomarker-oriented phase II study. Ann Oncol. 2011;22:1358-1366. [PubMed] [DOI] |
| 7. | Wöll E, Greil R, Eisterer W, Bechter O, Fridrik MA, Grünberger B, Zabernigg A, Mayrbäurl B, Russ G, Dlaska M. Oxaliplatin, irinotecan and cetuximab in advanced gastric cancer. A multicenter phase II trial (Gastric-2) of the Arbeitsgemeinschaft Medikamentose Tumortherapie (AGMT). Anticancer Res. 2011;31:4439-4443. [PubMed] |
| 8. | Pinto C, Di Fabio F, Barone C, Siena S, Falcone A, Cascinu S, Rojas Llimpe FL, Stella G, Schinzari G, Artale S. Phase II study of cetuximab in combination with cisplatin and docetaxel in patients with untreated advanced gastric or gastro-oesophageal junction adenocarcinoma (DOCETUX study). Br J Cancer. 2009;101:1261-1268. [PubMed] [DOI] |
| 13. | Wainberg ZA, Lin LS, DiCarlo B, Dao KM, Patel R, Park DJ, Wang HJ, Elashoff R, Ryba N, Hecht JR. Phase II trial of modified FOLFOX6 and erlotinib in patients with metastatic or advanced adenocarcinoma of the oesophagus and gastro-oesophageal junction. Br J Cancer. 2011;105:760-765. [PubMed] [DOI] |
| 14. | Fujitani K, Ajani JA, Crane CH, Feig BW, Pisters PW, Janjan N, Walsh GL, Swisher SG, Vaporciyan AA, Rice D. Impact of induction chemotherapy and preoperative chemoradiotherapy on operative morbidity and mortality in patients with locoregional adenocarcinoma of the stomach or gastroesophageal junction. Ann Surg Oncol. 2007;14:2010-2017. [PubMed] [DOI] |
| 15. | Li GL, Liu K, Bao Y, Cao JM, Xu J, Wang XL, Wu B, Li JS. Retrospective analysis of 56 patients with advanced gastric cancer treated with combination of intravenous and intra-arterial intensified neoadjuvant chemotherapy. Chin Med J (Engl). 2012;125:780-785. [PubMed] [DOI] |