修回日期: 2014-12-28
接受日期: 2015-01-04
在线出版日期: 2015-02-28
目的: 探讨硫化氢(hydrogen sulfide, H2S)对肝纤维化大鼠肝细胞增殖、凋亡的调节作用以及P-p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase, p38MAPK)蛋白的表达的影响.
方法: 用四氯化碳诱导肝纤维化SD大鼠模型, 将提取的肝纤维化大鼠肝细胞分组: 对照组、H2S组(对照组基础上加H2S的供体NaHS至最适浓度)、SB组(对照组基础上加SB203580至最适浓度)、SB+H2S组(对照组基础上加NaHS、SB203580至最适浓度). MTT法检测NaHS及SB203580对肝纤维化大鼠肝细胞的增殖、增殖抑制率的影响; Annexin V-FITC/PI双染流式细胞术检测肝纤维化大鼠肝细胞凋亡率; Western blot技术检测P-p38MAPK蛋白在各组中的表达水平.
结果: 与对照组相比, 低浓度H2S(50 μmol/L)促进肝纤维化大鼠肝细胞增殖明显(P = 0.000), 对肝纤维化大鼠肝细胞凋亡无影响; SB203580可抑制肝纤维化大鼠肝细胞的增殖, 伴随药物浓度的升高细胞存活率降低(P = 0.000), 并诱导肝纤维化大鼠肝细胞凋亡(P = 0.000); P-p38MAPK蛋白在各组中均有表达, H2S组表达水平高于对照组(P = 0.000), SB组、SB+H2S组与对照组、H2S组相比, P-p38MAPK蛋白的表达量均减少(均P = 0.000).
结论: 低浓度H2S对肝纤维化大鼠肝细胞凋亡无诱导作用, 但能通过激活p38MAPK信号转导通路促进其细胞增殖.
核心提示: 肝细胞作为肝脏的主体细胞, 其增生不良是导致肝纤维化的重要机制之一. 本实验拟通过四氯化碳诱导肝纤维化的发生, 用提取的原代肝细胞研究硫化氢(hydrogen sulfide)对肝纤维化肝细胞增殖、凋亡的调节作用, 为肝纤维化的治疗提供理论基础.
引文著录: 郑娜娜, 岳雅伦, 郑勇, 刘浩, 张传峰, 陈卫刚. 硫化氢通过p38MAPK信号通路对肝纤维化大鼠肝细胞增殖、凋亡的影响. 世界华人消化杂志 2015; 23(6): 901-906
Revised: December 28, 2014
Accepted: January 4, 2015
Published online: February 28, 2015
AIM: To investigate the regulatory effect of hydrogen sulfide (H2S) on proliferation and apoptosis of hepatocytes from hepatic fibrosis rats and the underlying mechanism.
METHODS: Carbon tetrachloride was used to induce liver fibrosis in rats. Hepatocytes were isolated from the fibrotic liver rats and divided into a control group, an H2S group, an SB203580 group, and an SB203580 + H2S group. MTT assay was used to examine cell proliferation. Annexin V-FITC/PI double staining was used to detect apoptosis of hepatocytes. Western blot was used to measure P-p38MAPK protein expression.
RESULTS: Compared with the control group, H2S at 50 μmol/L promoted hepatocyte proliferation (P = 0.000), but had no significant impact on apoptosis of hepatocytes. SB203580 could inhibit hepatocyte proliferation in a dose-dependent manner (P =0.000), but induce cell apoptosis (P = 0.000). The expression of P-p38MAPK was detected in all four groups of cells. H2S up-regulated the expression of P-p38MAPK protein when compared to the control group (P = 0.000). The expression of P-p38MAPK was significantly lower in the SB203580 group and SB203580 + H2S group than in the control group and H2S group (P = 0.000).
CONCLUSION: H2S at 50 μmol/L has no apoptosis inducing effect on hepatocytes from hepatic fibrosis rats, but promotes hepatocyte proliferation possibly through activating the p38MAPK signal pathway.
- Citation: Zheng NN, Yue YL, Zheng Y, Liu H, Zhang CF, Chen WG. Hydrogen sulfide promotes proliferation of hepatocytes from hepatic fibrosis rats via p38MAPK signal pathway. Shijie Huaren Xiaohua Zazhi 2015; 23(6): 901-906
- URL: https://www.wjgnet.com/1009-3079/full/v23/i6/901.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i6.901
肝纤维化是肝组织进行损伤修复的一种病理过程. 肝细胞作为肝脏的主体细胞, 其增生不良是导致肝纤维化的重要机制之一. 硫化氢(hydrogen sulfide, H2S)是继NO、CO之后发现的第三种气体分子, 他具有多种生理功能[1-3], 本课题组前期研究结果显示, H2S具有延缓肝纤维化的作用, 并且证实当H2S缺乏时, 肝硬化大鼠肝细胞的凋亡增加, 进而促进肝纤维化发生[4]. 由此可见, 肝细胞在肝纤维化的发生中具有重要作用. p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase, p38MAPK)信号通路在细胞炎症、增殖、应激、凋亡等多种生理和病理过程中起着重要作用[5,6]. 因此, 本实验拟通过四氯化碳诱导肝纤维化的发生, MTT法、Annexin V-FITC/PI双染流式细胞术检测肝纤维化大鼠肝细胞增殖、凋亡情况, 并用Western blot技术检测肝纤维化大鼠肝细胞中P-p38MAPK蛋白的表达, 研究H2S对肝纤维化大鼠肝细胞增殖、凋亡的调节作用, 为肝纤维化的治疗提供理论基础.
30只SD大鼠, 为新疆医科大学动物实验中心提供的健康♀SD大鼠; 胰蛋白酶、胎牛血清(HyClone); 青霉素链霉素混合液、0.4%台盼蓝(Solarbio); WME培养基(Gibco); NaHS、地塞米松、胰岛素、MTT(Sigma); DMSO(BIOSHARP); Annexin V-FITC试剂盒(Biovision); SB203580(Merck); P-p38MAPK兔抗鼠单克隆一抗(Cell Signal Technology); HRP标记的山羊抗兔IgG(北京中杉金桥); 其余均为国产分析纯.
1.2.1 制备肝纤维化模型、提取肝纤维化大鼠肝细胞及活性鉴定: 复制肝纤维化大鼠模型参照本课题组前期实验经验[7,8]. 肝细胞分离参照文献[9-11], 最后加入含10%FBS、青霉素链霉素混合液、地塞米松、胰岛素的WME培养基(以下简称10%FBS的WME培养基), 重悬肝细胞. 取0.5 mL肝细胞悬液与0.4%台盼蓝1:1混合, 在倒置相差显微镜下检测细胞活力, 并用细胞计数板计数. 细胞活率>90%可用于后续实验.
1.2.2 肝纤维化大鼠肝细胞的培养及实验分组: 培养选用10%FBS的WME培养基, 37 ℃、50 mL/L CO2培养箱中培养, 4 h常规贴壁, 24-48 h换液1次, 2-3 d当细胞出现岛状连接时给予干预. 实验分组: 对照组给予10%FBS的WME培养基, H2S组给予NaHS至最适浓度, SB组给予SB203580至最适浓度, SB+H2S组给予NaHS、SB203580至最适浓度.
1.2.3 MTT法检测肝纤维化大鼠肝细胞增殖: 将新提取的肝细胞按2×104个/孔接种于96孔板, 当细胞出现大片岛状连接时, 用无血清WME培养基同步化处理12 h, H2S组将NaHS按照25、50、75、100、200 μmol/L浓度梯度给药, SB组分别按照12.5、25、50、100、200 μmol/L浓度梯度给药, 每组各设6个复孔. 在50 mL/L CO2培养箱中继续培养48 h后终止实验, 每孔加入5 g/L的MTT 20 μL, 培养箱中继续反应4 h, 吸出培养基, 每孔加入150 μL DMSO, 震荡混匀10 min. 利用酶标仪于波长490 nm处, 测定各孔吸光度(A)值, 计算两种药物对各组细胞的增殖率、增殖抑制率.
1.2.4 流式细胞技术检测肝纤维化大鼠肝细胞凋亡率: 将新提取的肝细胞按8×105个/孔接种至6孔板, 在细胞出现大片岛状连接时, 用无血清WME培养基同步化处理12 h, 按照实验分组分别加入相应浓度的NaHS和SB203580, 放入培养箱培养48 h后消化收集各孔细胞, 加入binding buffer和Annexin V-FITC/PI双染色剂, 4 ℃避光. 1 h内上机检测细胞凋亡率.
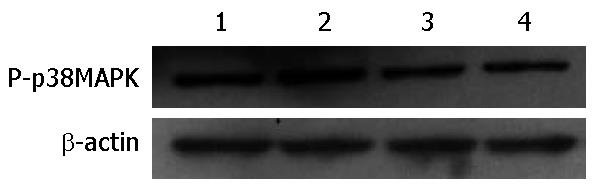
1.2.5 Western blot技术检测P-p38MAPK蛋白在肝纤维化大鼠肝细胞中的表达: 提取各实验组蛋白质, 紫外分光光度法测定蛋白浓度, 浓度配平后将蛋白煮沸变性处理. 经SDS-PAGE凝胶电泳分离, 半干转法将蛋白转至PVDF膜(电压23 V, P-p38MAPK、β-actin转43 min), 将膜置于封闭液(P-p38MAPK用含5%BSA的TBST缓冲液, β-actin用含5%脱脂奶粉的TBST缓冲液)室温封闭2 h, 分别加入兔抗鼠P-p38MAPK(1:1000)、鼠抗鼠β-actin(1:1000), 摇床缓慢摇动4 ℃孵育过夜. TBST洗脱一抗后加入辣根过氧化物酶标记的二抗(1:30000)室温孵育2 h, TBST洗脱二抗后ECL显色, 曝光. 用Gel-Proanalyzer分析软件进行灰度值分析, 以目的蛋白质条带与内参蛋白质条带的灰度值的比值表示目的蛋白质的相对表达水平.
统计学处理 使用SPSS17.0统计软件进行分析, 所有数据进行正态性及方差齐性检验, 实验数据用mean±SD表示, 组间比较采用单因素方差分析(ANOVA), 进一步组间两两比较采用LSD-t检验, P<0.05为差异有统计学意义.
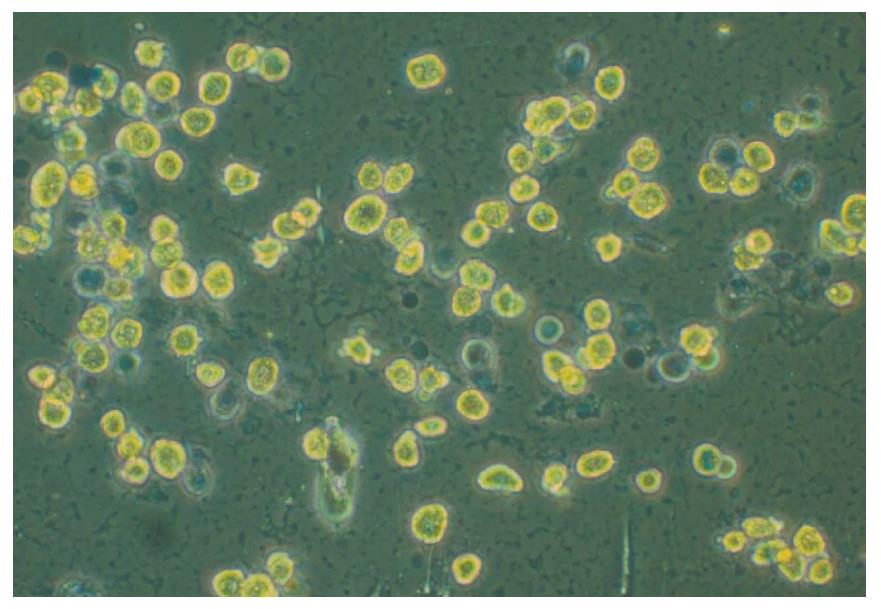
台盼蓝排斥试验结果显示(图1): 新提取的肝细胞呈圆形, 透亮, 有立体感, 细胞核清晰, 胞质内含有脂滴, 肝细胞活率>90%. 终计数, 平均每只肝纤维化SD大鼠获得(1-3)×107个肝细胞, 可满足后续实验.
经过不同干预处理肝细胞培养48 h后, 25、50 μmol/L NaSH促细胞增殖明显, 与对照组差异有统计学意义(分别P = 0.039、0.000), 50 μmol/L促细胞增殖率相对显著; 其余浓度NaSH(75、100、200 μmol/L)不促进细胞增殖, 与对照组差异无统计学意义. SB组(25、50、100、200 μmol/L)细胞的增殖均受到明显抑制(均P = 0.000), 细胞存活率(%)随SB203580的浓度增加而降低, 高浓度SB203580对细胞增殖抑制率较大, 选择25 μmol/L SB203580为最适浓度(表1).
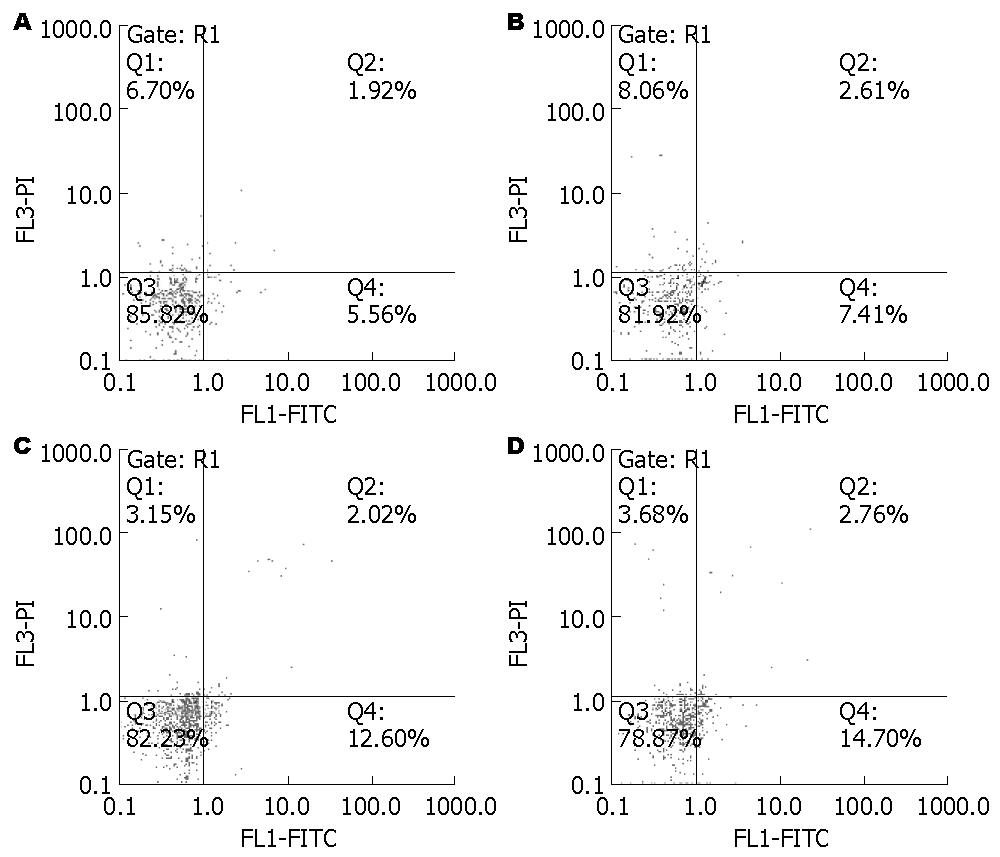
按照实验分组处理肝细胞48 h后, H2S组与对照组细胞凋亡率差异无统计学意义, SB组、SB+H2S组细胞凋亡率高于对照组(均P = 0.000)(表2, 图2).
目前, 抑制肝星状细胞激活和增生、诱导和促进肝星状细胞凋亡、增加肝脏细胞外基质降解的肝纤维化综合治疗学在临床上难以取得令人满意的疗效. 肝细胞占肝脏细胞总量的80%, 数量最多, 功能重要. 肝细胞在正常情况下很少分裂, 但在肝损伤时会表现强大的增殖和自我调控能力进行自身代偿调节[12]. 肝纤维化过程中, 肝细胞的反应性增殖能力受到延迟、减弱, 通过促进肝纤维化形成时期肝细胞的再生, 恢复正常的肝结构, 保持肝组织的完整性, 可延缓肝纤维化发展进程. 肝细胞在肝纤维化中的作用一直备受关注, 促进肝细胞增殖、抑制肝细胞凋亡成为肝纤维化治疗的热点[13-15].
H2S存在于人体多个系统, 近年研究[16-19]证实H2S在肝纤维化的发生发展过程中有着重要的保护性作用, 外源性H2S能够保护肝细胞, 减少肝细胞凋亡[20,21]. Ryazantseva等[22]发现低剂量NaHS可提高细胞生存率. MAPK与多种细胞的功能有关, p38MAPK通路是MAPK信号转导通路的重要组成部分, Liu等[23]研究结果表明p38MAPK信号通路介导小胶质细胞的增殖. Toutounchian等[24]证实抑制p38MAPK可以减少细胞的增殖. 徐霞等[25]研究证实在肝星状细胞中, H2S激活p38MAPK信号通路促进肝星状细胞的增殖, 且SB203580特异性阻断p38MAPK信号通路促进肝星状细胞的凋亡. 这些结果表明, 在细胞增殖、凋亡过程中, H2S、p38MAPK信号通路发挥着重要作用.
本研究将NaSH作用于提取的肝纤维化大鼠肝细胞, 结果显示, H2S促进肝纤维化大鼠肝细胞增殖, 且上调P-p38MAPK蛋白的表达, 但对肝纤维化大鼠肝细胞凋亡无影响. 磷酸化有活性的p38MAPK才能够上调某些转录因子的表达及其生物活性, 影响细胞的增殖、凋亡、分化和细胞因子的合成[26-28], 因此可以通过检测p38MAPK蛋白的磷酸化研究p38MAPK信号通路的变化. 对照组P-p38MAPK有表达, SB组比对照组P-p38MAPK表达量减少, 说明p38MAPK信号通路在肝纤维化大鼠肝细胞中有着一定的基础生物学作用. p38MAPK通路作为一种重要的信号通路, 可以被多种因子激活, 给予NaSH后P-p38MAPK蛋白表达增高, SB203580特异性阻断后, NaSH刺激的P-p38MAPK蛋白表达量明显减少, 我们推测在细胞水平H2S激活了p38MAPK信号通路, 增强了P-p38MAPK蛋白的表达. 本课题组前期实验中的肝细胞均为处于肝损伤时期的细胞, 并且本实验过程中均采用现提取的肝纤维化大鼠肝细胞, 与提取的正常大鼠肝细胞不相同[29], 从而保证体外培养的肝纤维化大鼠肝细胞短时间内有其在肝纤维化大鼠体内的状态及增殖水平, 当给予NaSH处理后, 细胞增殖比对照组明显. 本课题组前期研究结果表明H2S通过促进肝硬化大鼠肝组织内细胞的增殖, 对肝纤维化的发生发展起到保护作用[30]. 由此我们分析: H2S是通过激活p38MAPK信号转导通路促进肝组织内细胞即肝纤维化大鼠肝细胞增殖这一作用来达到其延缓肝纤维化的目的, 这一结论与我们的前期结果相吻合. 本实验中低浓度H2S对肝纤维化大鼠肝细胞凋亡率无影响, 课题组前期实验证明H2S能促进肝纤维化肝组织内肝细胞凋亡, 我们考虑是因为H2S到达活体细胞、离体细胞中的有效浓度不相同[31], 具体机制还尚未可知. SB203580阻断p38MAPK信号通路后, 肝纤维化大鼠肝细胞凋亡率增高, 这一作用可加速肝纤维化的进程.
总之, H2S激活p38MAPK信号通路促进肝纤维化肝细胞增殖, 延缓肝纤维化的发生发展, 这为治疗肝纤维化提供了一个新思路. H2S可以激活多条信号通路, p38MAPK信号通路也可以被多种因子激活, 二者作用机制非常复杂, 在今后的研究工作中, 我们将继续探讨H2S对肝纤维化肝细胞中p38MAPK信号通路的影响, 进一步揭示H2S保护肝纤维化的机制.
肝细胞在肝纤维化中的作用一直备受关注. 肝细胞作为肝脏的主体细胞, 其增生不良是导致肝纤维化的重要机制之一. 通过促进肝纤维化形成时期肝细胞的再生, 恢复正常的肝结构, 保持肝组织的完整性, 可延缓肝纤维化发展进程.
张小晋, 主任医师, 北京积水潭医院
硫化氢(hydrogen sulfide, H2S)存在于人体多个系统, 近年研究证实H2S在肝纤维化的发生发展过程中有着重要的保护性作用. p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase, p38MAPK)通路在MAPK信号通路中占重要地位, 是近年信号传导领域研究的热点之一.
H2S能通过激活肝组织、肝星状细胞中p38MAPK信号通路产生一系列生物学效应. 本实验通过p38MAPK特异性抑制剂SB203580的干预, 发现H2S同样能激活肝纤维化肝细胞中p38MAPK信号通路, 促进其增殖.
本实验中所用的肝细胞均为现提取的肝纤维化大鼠肝细胞, 保证体外培养的肝纤维化大鼠肝细胞短时间内有其在肝纤维化大鼠体内的状态及增殖水平, 能较真实的反映H2S对肝纤维化肝细胞中p38MAPK信号通路的影响.
H2S、p38MAPK在细胞炎症、增殖、应激、凋亡等多种生理和病理过程中起着重要作用, 目前肝纤维化综合治疗学在临床上难以取得令人满意的疗效, 只有在深入明确其具体机制后, 才能为临床应用提供指导依据. 本研究为肝纤维化的基础研究, 仅为肝纤维化研究提供进一步的理论基础.
硫化氢(H2S): 是存在于体内的第3种新型的内源性气体信号分子, 有着广泛的生物学效应. 近年研究证实其在肝纤维化的发生发展过程中起着重要的保护性作用. 对其进一步的研究, 将为肝纤维化及门脉高压的临床治疗提供新的方向; 丝裂原活化蛋白激酶(MAPK): 是脊椎动物体内广泛存在的一类丝氨酸/苏氨酸蛋白激酶. MAPKs是一种信号蛋白, 当机体受到各种外界刺激时会使外界应激信号通过信号转导、接替、放大、整合导致基因及生理改变而调控一系列细胞活动, p38MAPK是MAPKs家族中的成员之一, 其激活后所介导的信号转导主要与细胞的应激、损伤、增殖及凋亡有关.
本文是动物实验的基础研究, 论文课题立题较新颖, 方法合适, 结论可参考.
编辑: 韦元涛 电编: 闫晋利
| 1. | 杜 津. 硫化氢后处理对大鼠肝缺血再灌注损伤的保护作用. 天津: 天津医科大学 2012; . |
| 5. | Yoshinari D, Takeyoshi I, Kobayashi M, Koyama T, Iijima K, Ohwada S, Matsumoto K, Morishita Y. Effects of a p38 mitogen-activated protein kinase inhibitor as an additive to university of wisconsin solution on reperfusion injury in liver transplantation. Transplantation. 2001;72:22-27. [PubMed] [DOI] |
| 6. | Morel C, Ibarz G, Oiry C, Carnazzi E, Bergé G, Gagne D, Galleyrand JC, Martinez J. Cross-interactions of two p38 mitogen-activated protein (MAP) kinase inhibitors and two cholecystokinin (CCK) receptor antagonists with the CCK1 receptor and p38 MAP kinase. J Biol Chem. 2005;280:21384-21393. [PubMed] [DOI] |
| 7. | 杨 新疆, 齐 翠花, 郑 勇, 曹 玉文, 李 睿, 宋 丽秀, 赵 强, 陈 卫刚. SB203580对肝纤维化大鼠肝脏Ⅰ、Ⅲ型胶原蛋白表达的影响. 世界华人消化杂志. 2014;22:310-318. |
| 10. | Seglen PO. Preparation of isolated rat liver cells. Methods Cell Biol. 1976;13:29-83. [PubMed] [DOI] |
| 11. | Ma L, Tsatsos NG, Towle HC. Direct role of ChREBP.Mlx in regulating hepatic glucose-responsive genes. J Biol Chem. 2005;280:12019-12027. [PubMed] [DOI] |
| 12. | Kountouras J, Boura P, Lygidakis NJ. Liver regeneration after hepatectomy. Hepatogastroenterology. 2001;48:556-562. [PubMed] |
| 15. | 续 畅, 刘 泽洲, 李 志红, 李 健, 唐 炳华, 牛 建昭, 李 军祥. 槲芪散抗CCl4诱导大鼠肝纤维化的药效及对肝细胞增殖与凋亡的影响. 中西医结合肝病杂志. 2013;23:95-97. |
| 16. | 陈 卫刚, 郑 勇, 宋 丽秀, 刘 维国, 李 文娟, 刘 清华, 张 宁, 齐 翠花. 内源性H2S对大鼠实验性肝硬化门脉高压的影响. 世界华人消化杂志. 2011;19:467-471. |
| 17. | Zhang N, Zheng Y, Wang YL, Li R, Sun K, Chang XY, Chen WG, Zhao J, Li HA. Role of endogenous hydrogen sulfide in rats with hepatic cirrhosis at different stages. World Chin J Digestol. 2009;17:307-311. |
| 18. | 张 宁, 郑 勇, 王 于理, 李 睿, 孙 侃, 常 向云, 陈 卫刚, 赵 瑾, 李 洪安. 内源性硫化氢在不同时期大鼠肝硬化中的作用. 世界华人消化杂志. 2009;17:307-311. |
| 19. | 王 艳莎, 季 英磊, 吴 林琳, 刘 夷嫦, 谷 振勇. 延迟给予外源性硫化氢加剧脂多糖引起的大鼠肝细胞损伤. 南通大学学报(医学版). 2014;34:1-4. |
| 21. | Jha S, Calvert JW, Duranski MR, Ramachandran A, Lefer DJ. Hydrogen sulfide attenuates hepatic ischemia-reperfusion injury: role of antioxidant and antiapoptotic signaling. Am J Physiol Heart Circ Physiol. 2008;295:H801-H806. [PubMed] [DOI] |
| 22. | Ryazantseva NV, Novitsky VV, Starikova EG, Kleptsova LA, Jakushina VD, Kaigorodova EV. Role of hydrogen sulfide in the regulation of cell apoptosis. Bull Exp Biol Med. 2011;151:702-704. [PubMed] [DOI] |
| 23. | Liu Y, Zhao T, Yang Z, Li Q. CX3CR1 RNAi inhibits hypoxia-induced microglia activation via p38MAPK/PKC pathway. Int J Exp Pathol. 2014;95:153-157. [PubMed] [DOI] |
| 24. | Toutounchian JJ, Steinle JJ, Makena PS, Waters CM, Wilson MW, Haik BG, Miller DD, Yates CR. Modulation of radiation injury response in retinal endothelial cells by quinic acid derivative KZ-41 involves p38 MAPK. PLoS One. 2014;9:e100210. [PubMed] [DOI] |
| 26. | Karnoub AE, Dash AB, Vo AP, Sullivan A, Brooks MW, Bell GW, Richardson AL, Polyak K, Tubo R, Weinberg RA. Mesenchymal stem cells within tumour stroma promote breast cancer metastasis. Nature. 2007;449:557-563. [PubMed] |
| 30. | 阎 继攀, 郑 勇, 刘 浩, 李 睿, 张 宁, 齐 翠花, 宋 丽秀, 陈 卫刚. 实验性肝硬化大鼠肝组织中CSE和Ki-67的表达及其意义. 胃肠病学和肝病学杂志. 2012;21:232-235. |