修回日期: 2015-11-05
接受日期: 2015-11-17
在线出版日期: 2015-12-18
目的: 研究P38丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)通路在急性重症胰腺炎(severe acute pancreatitis, SAP)大鼠模型海马神经元中对诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)和前列腺素E2(prostaglandin E2, PGE2)的作用.
方法: 将60只SD大鼠随机分为对照组、SAP模型组(模型组)、抑制剂组(P38MAPK通路抑制剂SB203580). Nissl染色、免疫组织化学显色、免疫印迹法检测大鼠海马CA1区iNOS、PGE2和p-P38表达的变化; 应用透射电镜观察胰腺组织超微结构的变化.
结果: 与对照组相比, SAP模型组海马CA1区p-P38(20.4±2.2 vs 2.1±1.3)、iNOS(33.6±4.4 vs 3.7±0.4)、PGE2(34.7±4.0 vs 2.4±1.0)阳性神经元的数量显著增加(P<0.05); 给予SB203580后, 抑制剂组海马CA1区p-P38(12.8±0.7)、iNOS(14.4±4.9)、PGE2(18.3±0.5)阳性神经元的数量明显减少(P<0.05). 模型组胰腺细胞粗面内质网脱颗粒, 线粒体水肿扩张, 抑制剂组上述改变明显减轻.
结论: P38丝裂原活化蛋白激酶通路对SAP大鼠模型海马iNOS和PGE2表达可能起调控作用, 抑制该通路对SAP大鼠具有神经保护作用.
核心提示: P38丝裂原活化蛋白激酶通路对急性重症胰腺炎(severe acute pancreatitis, SAP)大鼠模型海马诱导型一氧化氮合酶和前列腺素E2的作用. 表达可能起调控作用, 抑制该通路对SAP大鼠具有神经保护作用.
引文著录: 蒙国光, 任大勇, 张宇新. P38MAPK通路对SAP大鼠模型海马神经元诱导型一氧化氮合酶和前列腺素E2表达的影响. 世界华人消化杂志 2015; 23(35): 5620-5627
Revised: November 5, 2015
Accepted: November 17, 2015
Published online: December 18, 2015
AIM: To investigate the effect of P38 mitogen-activated protein kinase (P38MAPK) pathway on the expression of inducible nitric oxide synthase (iNOS) and prostaglandin E2 (PGE2) in hippocampal neurons of rats with severe acute pancreatitis (SAP).
METHODS: Healthy male Sprague-Dawley rats were randomly divided into three groups: a control group, a model group, and an SB203580 (an inhibitor of P38MAPK pathway) group. The pathological changes in brain tissue were observed. By immunohistochemistry and Western blot, expression of iNOS and PGE2 and phosphorylation of P38MAPK were detected to observe the changes of positive cell numbers and the expression levels in the hippocampus.
RESULTS: Compared with the control group, the numbers of p-P38 (20.4 ± 2.2 vs 2.1 ± 1.3), iNOS (33.6 ± 4.4 vs 3.7 ± 0.4), and PGE2 (34.7 ± 4.0 vs 2.4 ± 1.0) immunoreactive cells increased markedly in the hippocampal CA1 region (P < 0.05). After treatment with SB203580, the numbers of p-P38 (12.8 ± 0.7), iNOS (14.4 ± 4.9), and PGE2 (18.3 ± 0.5) immunoreactive cells were reduced significantly as compared with the model group (P < 0.05). The inhibitor group had significantly improved pancreatic cell pathology compared to the SAP group, which had ultrastructural changes such as rough endoplasmic network degranulation and mitochondrial swelling expansion.
CONCLUSION: P38MAPK pathway regulates the expression of iNOS and PGE2 in the hippocampus, and inhibition of the pathway has a neuroprotective effect in rats with SAP.
- Citation: Meng GG, Ren DY, Zhang YX. P38 pathway regulates iNOS and PGE2 expression in hippocampal neurons in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2015; 23(35): 5620-5627
- URL: https://www.wjgnet.com/1009-3079/full/v23/i35/5620.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i35.5620
急性重症胰腺炎(severe acute pancreatitis, SAP)可引起多脏器功能损害, 其中中枢神系统功能障碍被称为脑损害[1-3]. 许多脑损害病例被报道, 但很难早期诊断, 致死率高, 并且发病机制不详. 炎症反应参与急性重症胰腺炎的病理生理过程, 许多炎症因子发挥重要作用, 其中包括诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)和前列腺素E2(prostaglandin E2, PGE2)[4-6]. 研究[7-9]认为在脑损害中, iNOS和PGE2参与并促进大脑神经元的变性丢失. 既往发现P38丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)通路调控炎症反应, 那么在SAP中P38MAPK通路与iNOS和PGE2的表达是否相关? 本研究通过观察SAP大鼠模型海马神经元中iNOS和PGE2的表达以及P38MAPK通路是否对其表达产生影响, 从而期望为治疗SAP脑损害提供新的途径.
5%牛磺胆酸钠(美国Sigma)公司; 兔抗人PGE2多克隆抗体(美国Cayman公司); 兔抗鼠p-P38多克隆抗体、兔抗人iNOS多克隆抗体(北京博奥森); 浓缩型免疫组织化学超敏UltraSensitive™ SP试剂盒(福州迈新); 恒冷箱切片机(Leica公司). 透射电镜(transmission electron microscope, TEM)由日本东芝公司提供.
1.2.1 动物分组和模型制备: 健康♂SD大鼠60只, 体质量290-320 g(北京维通利华实验动物技术有限公司, [SCXX(京)2007-2008], 自由进食及饮水, 室温25 ℃±2 ℃, 单笼喂养, 自然光照. 将大鼠随机分为对照组、模型组和抑制剂组, 每组20只. SAP模型组、抑制剂组: 参照Lankisch等[10]的方法经胰胆管向胰腺内注入5%牛磺胆酸钠(2 mg/kg)制备SAP大鼠模型, 抑制剂组在建模后10 min于大鼠尾静脉注射SB203580(10 mg/kg), 对照组大鼠在数次触动胰腺后关腹. 3组大鼠分别在建立模型成功后24 h处死大鼠并取材备检.
1.2.2 标本采集: 取材固定切片于造模后24 h, 每组随机选取10只大鼠, 取下腔静脉血测量淀粉酶, 然后经100 mL/L水合氯醛麻醉后, 40 g/L多聚甲醛经心灌流固定10 min后, 断头取脑及胰腺. 脑组织置于40 g/L多聚甲醛中固定24 h(4 ℃)后, 置于300 g/L蔗糖液中脱水至脑组织沉底. 取脑组织标本自视交叉后用恒冷箱切片机连续冠状切片(片厚10 μm), 贴附于载玻片上-20 ℃保存备用. 胰腺使用40 g/L多聚甲醛固定备用. 另随机选取5只大鼠, 脱颈法处死, 断头后于冰上快速分离海马低温匀浆, 离心后取上清, -80 ℃保存备用.
1.2.3 胰腺组织的病理学观察: 取胰腺组织1 mm3以25 g/L戊二醛4 ℃固定8 h, 梯度酒精脱水, 环氧树脂Epon812浸透, LKB-V型超薄切片机进行超薄切片(50-70 nm), 电镜下观察胰腺组织的超微结构的改变. 取脑组织切片, Nissl染色, 光镜下观察胰腺组织的病理学改变.
1.2.4 免疫组织化学染色: 取脑组织切片室温放置30 min后, 用PBS(pH 7.4±0.2)缓冲液洗涤后加入正常非免疫兔血清室温孵育10 min; 然后同一组织相邻切片分别加入兔抗鼠p-P38多克隆抗体(1:100)、兔抗人PGE2多克隆抗体(1:200)、兔抗人iNOS多克隆抗体(1:100), 4 ℃过夜; PBS洗涤后, 滴加生物素标记第二抗体室温孵育20 min; PBS洗涤, 加入生物素标记室温孵育20 min, DAB显色, 常规封片, 光镜下观察照相. 结果判定: 以神经元胞质中出现棕黄色颗粒或着色为棕黄判定为阳性结果, 免疫组织学阴性对照, 以PBS代替一抗.
1.2.5 免疫印迹: 每组提取30 μg样品, SDS-PAGE电泳, 电转膜, 加入封闭液室温下震荡2 h后, 然后分别加入兔抗人iNOS(1:400)、兔抗人PGE2(1:500)和兔抗鼠p-P38多克隆抗(1:100), 4 ℃孵育过夜. 室温孵育l h; PBS冲洗后, 再加入生物素标记的羊抗兔/小鼠IgG抗血清(1:200), 室温震荡孵育2 h, 然后与辣根过氧化物酶复合物室温下孵育0.5 h, DAB显色. 以β-actin作为内参, 将特异性蛋白条带扫描后,在同一条件下应用CMIAS真彩医学图像分析系统取测定条带平均光密度值.
统计学处理 选定海马CA1区所在区域, 采用CMIAS真彩色医学图像免疫组织化学自动分析系统进行阳性细胞计数. 各组每只动物的3张脑片数值相加后取平均值. 实验结果使用SPSS13.0统计软件进行统计处理. 分别采用单因素方差分析, q检验; 免疫印迹法统计分析同上. 以P<0.05为差异具有统计学意义.
模型组3只死亡, 存活率85%, 其余组均无死亡, 存活率100%. 对照组+抑制剂组存活率与模型组比较差异无统计学意义(P = 0.231).
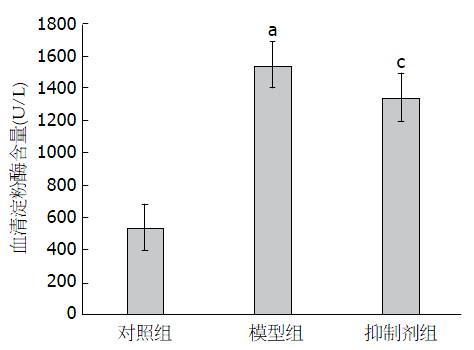
模型组及抑制剂组大鼠血清淀粉酶含量增高, 证明急性重症胰腺炎的诊断. 图1显示: 各组大鼠血清淀粉酶含量比较, 模型组血清淀粉酶含量明显高于其他两组. 与对照比较, 模型组血清淀粉酶含量明显增高(P<0.05). 与模型组比较, 抑制剂组血清淀粉酶含量显著降低(P<0.05).
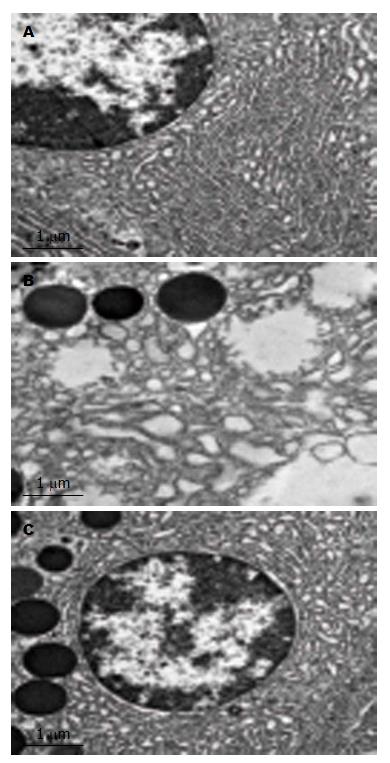
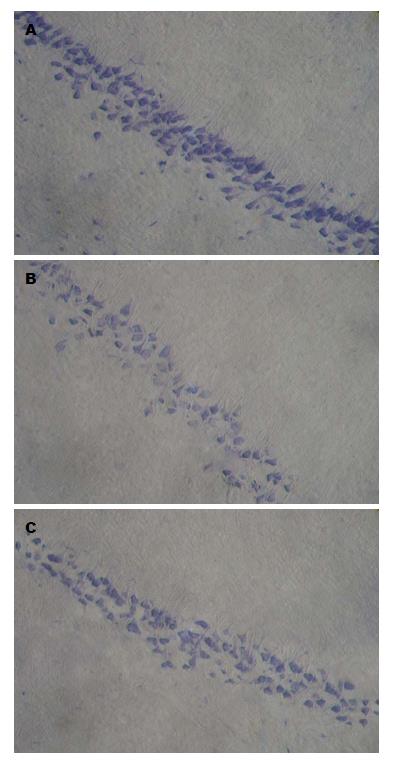
Nissl染色检测海马CA1区神经元的变性丢失: 与对照组比较, 模型组局部神经元缺失, 部分神经元出现核固缩, 核仁欠清晰, Nissl体减少或消失; 与模型组比较, 抑制剂组神经元胞核形态饱满, 核仁比较清晰, 仅发现散在神经元缺失或胞核固缩. 模型组透射电镜观察到粗面内质网脱颗粒, 线粒体水肿扩张、瘠断裂或消失等病理改变. 抑制剂组上述变化明显减轻(图2, 图3).
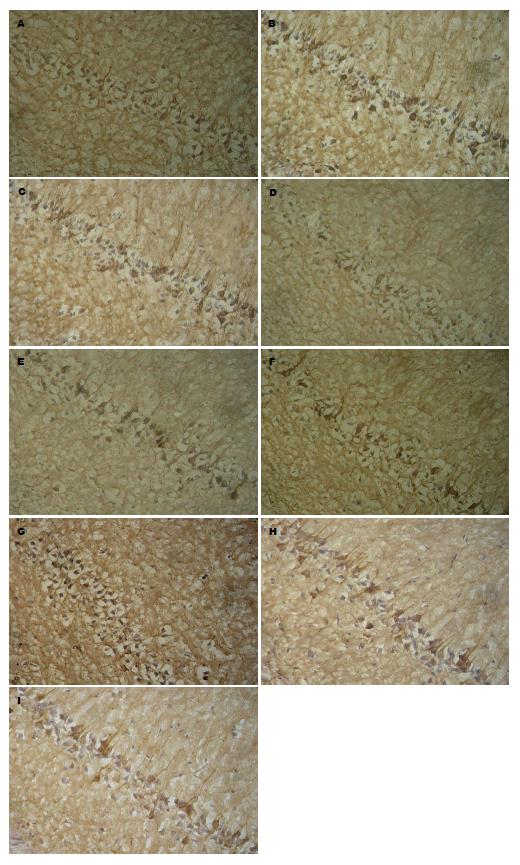
与对照组比较, 模型组海马CA1区可见p-P38、iNOS、PGE2阳性神经元明显增多, 胞质内颗粒状聚集物增多, 成棕黑色; 与模型比较, 抑制剂组阳性神经元较模型组有显著减少, 胞质内颗粒状聚集物减少, 染色较淡. 图像分析结果显示, 差异均有统计学意义(P<0.05, 表1, 图4).
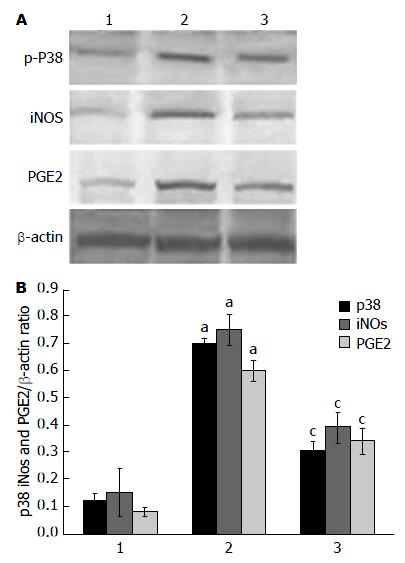
在预染蛋白标准约38、130和20 kDa处, 分别可见p-P38、iNOS和PGE2特异性蛋白条带. 图像分析结果显示: 与对照组相比, 模型组条带略宽, 着色最深, 蛋白水平明显上调, 与模型组比较, 抑制剂组条带着色变浅, 蛋白水平下调. 结果分析显示, 差异具有统计学意义(P<0.05, 图5).
SAP临床表现主要包括胰腺自身及胰周组织的坏死、脓肿或假性囊肿等局部并发症[11-13], 也可伴发胰外多脏器功能障碍[14,15], 其中脑损害是SAP病理生理过程中严重的并发症之一[16], 主要表现为神经精神症状, 但其致病机制不明确[16,17]. 本实验复制的SAP动物模型血清淀粉酶明显升高, 胰腺组织超微结构改变, 海马CA1区神经元缺失明显, 尼氏小体减少或消失, 以上结果说明动物模型符合实验要求[18].
研究发现在SAP脑损害发病机制中, 炎症因子能够引起脑细胞水肿、大脑间质的炎性损伤及神经髓鞘的破坏等[19-21], 说明炎症反应是SAP导致大脑神经元的变性丢失的重要诱发因素[20]. 为明确神经元丢失的原因, 我们通过实验观察炎症因子iNOS和PGE2的表达, 结果显示: 模型组海马CA1区神经元胞浆、轴突中iNOS、PGE2呈阳性反应, 且阳性神经元的数量明显高于对照组; 免疫印迹结果也证实模型组iNOS、PGE2蛋白的表达较对照组明显增高, 这表明SAP可引起大脑神经元的炎症反应, 而iNOS、PGE2的活化可能参与神经元的变性丢失. 文献报道[22-24], 在脑外伤动物模型中, 大脑内神经变性丢失的同时存在iNOS、PGE2的活化, 但是抑制iNOS、PGE2的表达, 能够减轻脑损害的作用.
神经系统疾病中炎症反应持续存在, 在其发展过程中P38MAPK通路发挥促炎作用, 磷酸化的P38能够介导炎症因子或炎性产物的表达和释放, 导致神经元的变性丢失[25,26]. Liu等[27]在胰腺炎动物模型的脊髓中发现磷酸化P38(p-P38MAPK)表达水平明显升高. 为了进一步研究p-P38在SPA脑损害中的作用, 我们观察发现: 与对照组相比, 海马CA1区局部神经元明显丢失, 剩余神经元胞质内p-P38呈阳性表达, 阳性神经元的数量增多, 并且免疫印迹结果也显示模型组p-P38蛋白的表达明显增高. 为研究p-P38与iNOS、PGE2在SAP脑损害中的相互作用关系, 我们观察了三者在海马CA1区的表达, 发现造模成功后24 h, 模型组p-P38、iNOS和PGE2表达明显升高. SB203580干预后, 我们通过对于Nissl染色的观察发现海马CA1区也出现神经元变性丢失的现象, 但较模型组比较程度有所减轻. 免疫组织化学结果显示p-P38表达明显被抑制, 同时iNOS和PGE2的表达也相应明显减少. 免疫印迹结果也支持这一现象. 实验结果提示: 在SAP大鼠中, P38MAPK通路受到激活, iNOS和PGE2的表达明显上调, 神经元丢失明显, 抑制该通路的过度激活, 可以下调iNOS和PGE2的过表达, 减轻神经元的损害程度. 有理由认为, P38MAPK通路对大脑神经元发挥毒性作用, 可能与激活iNOS和PGE2有关.
因此, 我们推断P38MAPK通路在SAP大鼠模型中对海马神经元的炎症反应起重要调控作用, 抑制P38MAPK通路的激活对于SAP大鼠脑损害可能起到一定的治疗作用.
急性重症胰腺炎(severe acute pancreatitis, SAP)是临床上比较常见的急腹症之一, 其脑损害的发生率以及病死率较高, 炎症反应是导致其发生的重要因素. 因此探讨SAP脑损害的发病机制、为寻找预防和治疗脑损害的途径提供理论基础.
王刚, 副研究员, 哈尔滨医科大学附属第一医院胰胆外科(普外二科)
炎症反应在急性重症胰腺炎脑损害的病理生理中起重要作用, 抑制炎症反应对于脑损害具有重要作用, P38丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)通路在炎症反应中起到重要作用, 其在SAP脑损害中神经元变性丢失中是否发挥作用很少见报道.
抑制P38MAPK通路对脑外伤中神经元损伤有很好的保护作用, 并且在减轻细胞变性丢失中发挥重要的作用. 少见P38MAPK通路在SAP脑损害中神经元的变性丢失的报道.
本文观察了P38MAPK通路对SAP脑损害神经元变性丢失及诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)和前列腺素E2(prostaglandin E2, PGE2)等炎症因子表达的影响, 探讨了P38MAPK通路对大脑神经元损害中的作用, 抑制P38MAPK通路对神经元的保护作用及其机制, 为SAP脑损害预防和治疗提供了实验依据.
本研究发现P38MAPK通路可通过上调iNOS和PGE2的表达, 加重神经元变性丢失, 抑制P38MAPK通路可减轻神经元的变性丢失, 这一发现为SAP脑损害防治提供新的靶点.
SAP脑损害: 是指SAP发病和治疗过程中出现的严重并发症之一, 主要表现为定向力障碍、意识模糊、烦躁、幻觉等精神、神经障碍.
本文通过研究iNOS和PGE2的表达, 观察大鼠海马神经元的变性丢失, 探讨P38MAPK通路对SAP大鼠模型海马神经元损害的影响, 以期为SAP的治疗提供新的思路, 具有一定的新颖性.
编辑: 于明茜 电编:都珍珍
| 1. | Zhang XP, Li ZJ, Zhang J. Inflammatory mediators and microcirculatory disturbance in acute pancreatitis. Hepatobiliary Pancreat Dis Int. 2009;8:351-357. [PubMed] [DOI] |
| 2. | Werner J, Feuerbach S, Uhl W, Büchler MW. Management of acute pancreatitis: from surgery to interventional intensive care. Gut. 2005;54:426-436. [PubMed] [DOI] |
| 3. | Zerem E, Imamović G, Sušić A, Haračić B. Step-up approach to infected necrotising pancreatitis: a 20-year experience of percutaneous drainage in a single centre. Dig Liver Dis. 2011;43:478-483. [PubMed] [DOI] |
| 4. | Hartman H, Wetterholm E, Thorlacius H, Regnér S. Histone deacetylase regulates trypsin activation, inflammation, and tissue damage in acute pancreatitis in mice. Dig Dis Sci. 2015;60:1284-1289. [PubMed] [DOI] |
| 5. | Chen GY, Dai RW, Luo H, Liu WH, Chen T, Lin N, Wang T, Luo GD, Tang LJ. Effect of percutaneous catheter drainage on pancreatic injury in rats with severe acute pancreatitis induced by sodium taurocholate. Pancreatology. 2015;15:71-77. [PubMed] [DOI] |
| 6. | Lee JH, An CS, Yun BS, Kang KS, Lee YA, Won SM, Gwag BJ, Cho SI, Hahm KB. Prevention effects of ND-07, a novel drug candidate with a potent antioxidative action and anti-inflammatory action, in animal models of severe acute pancreatitis. Eur J Pharmacol. 2012;687:28-38. [PubMed] [DOI] |
| 7. | Lei B, Mace B, Dawson HN, Warner DS, Laskowitz DT, James ML. Anti-inflammatory effects of progesterone in lipopolysaccharide-stimulated BV-2 microglia. PLoS One. 2014;9:e103969. [PubMed] [DOI] |
| 8. | Günther M, Davidsson J, Plantman S, Norgren S, Mathiesen T, Risling M. Neuroprotective effects of N-acetylcysteine amide on experimental focal penetrating brain injury in rats. J Clin Neurosci. 2015;22:1477-1483. [PubMed] [DOI] |
| 9. | Armstead WM, Riley J, Cines DB, Higazi AA. Combination therapy with glucagon and a novel plasminogen activator inhibitor-1-derived peptide enhances protection against impaired cerebrovasodilation during hypotension after traumatic brain injury through inhibition of ERK and JNK MAPK. Neurol Res. 2012;34:530-537. [PubMed] [DOI] |
| 10. | Lankisch PG, Ihse I. Bile-induced acute experimental pancreatitis. Scand J Gastroenterol. 1987;22:257-260. [PubMed] |
| 11. | Takeuchi H. [Pancreatic encephalopathy]. Ryoikibetsu Shokogun Shirizu. 2000;533-536. [PubMed] |
| 12. | Bakker OJ, van Santvoort H, Besselink MG, Boermeester MA, van Eijck C, Dejong K, van Goor H, Hofker S, Ahmed Ali U, Gooszen HG. Extrapancreatic necrosis without pancreatic parenchymal necrosis: a separate entity in necrotising pancreatitis? Gut. 2013;62:1475-1480. [PubMed] [DOI] |
| 13. | Banks PA, Bollen TL, Dervenis C, Gooszen HG, Johnson CD, Sarr MG, Tsiotos GG, Vege SS. Classification of acute pancreatitis--2012: revision of the Atlanta classification and definitions by international consensus. Gut. 2013;62:102-111. [PubMed] [DOI] |
| 14. | McKay CJ, Evans S, Sinclair M, Carter CR, Imrie CW. High early mortality rate from acute pancreatitis in Scotland, 1984-1995. Br J Surg. 1999;86:1302-1305. [PubMed] [DOI] |
| 15. | Banks PA, Freeman ML. Practice guidelines in acute pancreatitis. Am J Gastroenterol. 2006;101:2379-2400. [PubMed] |
| 16. | Jiang H, Li F, Liu S, Sun H, Cui Y, Wu Y. Acute pancreatitis affects the metabolism of catecholamine neurotransmitters in rats. Neuroscience. 2014;268:112-117. [PubMed] [DOI] |
| 17. | Ding X, Liu CA, Gong JP, Li SW. Pancreatic encephalopathy in 24 patients with severe acute pancreatitis. Hepatobiliary Pancreat Dis Int. 2004;3:608-611. [PubMed] |
| 18. | Oz HS, Lu Y, Vera-Portocarrero LP, Ge P, Silos-Santiago A, Westlund KN. Gene expression profiling and endothelin in acute experimental pancreatitis. World J Gastroenterol. 2012;18:4257-4269. [PubMed] [DOI] |
| 19. | Farkas G, Márton J, Nagy Z, Mándi Y, Takács T, Deli MA, Abrahám CS. Experimental acute pancreatitis results in increased blood-brain barrier permeability in the rat: a potential role for tumor necrosis factor and interleukin 6. Neurosci Lett. 1998;242:147-150. [PubMed] |
| 20. | Baek HS, Lee SJ. A case of posterior reversible encephalopathy syndrome associated with acute pancreatitis and chronic alcoholism. Gen Hosp Psychiatry. 2015;37:192.e3-192.e5. [PubMed] [DOI] |
| 21. | Shen FC, Hsieh CH, Huang CR, Lui CC, Tai WC, Chuang YC. Acute intermittent porphyria presenting as acute pancreatitis and posterior reversible encephalopathy syndrome. Acta Neurol Taiwan. 2008;17:177-183. [PubMed] |
| 22. | Stoica BA, Loane DJ, Zhao Z, Kabadi SV, Hanscom M, Byrnes KR, Faden AI. PARP-1 inhibition attenuates neuronal loss, microglia activation and neurological deficits after traumatic brain injury. J Neurotrauma. 2014;31:758-772. [PubMed] [DOI] |
| 23. | Cui QJ, Wang LY, Wei ZX, Qu WS. Continual naringin treatment benefits the recovery of traumatic brain injury in rats through reducing oxidative and inflammatory alterations. Neurochem Res. 2014;39:1254-1262. [PubMed] [DOI] |
| 24. | Fiebich BL, Akter S, Akundi RS. The two-hit hypothesis for neuroinflammation: role of exogenous ATP in modulating inflammation in the brain. Front Cell Neurosci. 2014;8:260. [PubMed] [DOI] |
| 25. | Lee JY, Kang SR, Yune TY. Fluoxetine prevents oligodendrocyte cell death by inhibiting microglia activation after spinal cord injury. J Neurotrauma. 2015;32:633-644. [PubMed] [DOI] |
| 26. | Vázquez de la Torre A, Junyent F, Folch J, Pelegrí C, Vilaplana J, Auladell C, Beas-Zarate C, Pallàs M, Verdaguer E, Camins A. PI3 k/akt inhibition induces apoptosis through p38 activation in neurons. Pharmacol Res. 2013;70:116-125. [PubMed] [DOI] |
| 27. | Liu PY, Lu CL, Wang CC, Lee IH, Hsieh JC, Chen CC, Lee HF, Lin HC, Chang FY, Lee SD. Spinal microglia initiate and maintain hyperalgesia in a rat model of chronic pancreatitis. Gastroenterology. 2012;142:165-173.e2. [PubMed] [DOI] |