修回日期: 2015-10-09
接受日期: 2015-10-12
在线出版日期: 2015-10-28
目的: 基于右半结肠癌(right-sided colon cancer, RSCC)和左半结肠癌(left-sided colon cancer, LSCC)2个亚群, 探索白介素8(interleukin 8, IL-8)基因在2组癌组织中的表达及其临床意义.
方法: 选择接受根治性手术切除的病理Ⅱ和Ⅲ期结肠癌患者80例, 以结肠脾曲为界, 分成RSCC组40例和LSCC组40例, 采集每个患者的癌组织及其自身配对正常结肠黏膜组织共80对. 应用实时定量PCR检测(real-time quantitative PCR, qRT-PCR)的方法检测IL-8基因mRNA在2组患者组织中的表达, 并分析其表达和临床病理变量的关系及其对各自预后的影响.
结果: 无论RSCC还是LSCC, IL-8基因mRNA在癌组织中的表达均显著高于自身正常结肠黏膜的表达(P<0.01); 然而, IL-8在RSCC中的表达明显高于LSCC, 经检验具有显著性. IL-8高表达患者与RSCC(65% vs 35%, P = 0.007), 较大肿瘤直径(5.2 cmvs 4.1 cm, P = 0.014), 和肿瘤浸润淋巴细胞(27.5% vs 10%, P = 0.045)显著相关; LSCC患者中IL-8高表达者的中位生存时间明显短于低表达者(37.0 mo vs 59.2 mo, P = 0.006), 而对RSCC患者的单独分析却发现IL-8高表达者的预后好于低表达者(63.8 mo vs 54.5 mo, P = 0.151). 多因素分析发现, T4结肠壁浸润(RR = 6.514, 95%CI: 1.209-35.102, P = 0.029)和脉管癌栓(RR = 6.272, 95%CI: 1.352-29.092, P = 0.019)是RSCC的独立预后因子; IL-8高表达(RR = 3.279, 95%CI: 0.973-11.051, P = 0.045)、T4结肠壁浸润(RR = 4.546, 95%CI: 1.335-15.481, P = 0.015)、淋巴结转移(RR = 5.918, 95%CI: 1.439-24.334, P = 0.014)和脉管癌栓(RR = 3.663, 95%CI: 1.089-12.320, P = 0.036)是LSCC的独立预后因子.
结论: IL-8基因在RSCC的表达明显高于LSCC, 且对两者具有不同的预后意义, 是LSCC不良的独立预后因子. 可见根据肿瘤部位的不同分析基因表达的临床意义是很有必要. RSCC和LSCC是具有复杂分子差异和不同致癌机制的两个潜在的结肠癌异质性群体.
核心提示: 本研究以探索结肠癌内部异质性为出发点, 从结肠癌不同亚群的角度对白介素8基因进行研究, 并发现其在右半结肠癌和左半结肠癌中的表达具有显著差异, 而且对二者具有不同的临床意义. 揭示了左右半结肠癌是2个具有复杂分子差异的群体.
引文著录: 许开宇, 李雨晨, 伍江平, 顾晋. 白介素8基因mRNA在左右半结肠癌组织中的差异表达及其临床意义. 世界华人消化杂志 2015; 23(30): 4822-4830
Revised: October 9, 2015
Accepted: October 12, 2015
Published online: October 28, 2015
AIM: To investigate the differential expression of interleukin 8 (IL-8) between left-sided and right-sided colon cancer and to analyze its clinical significance.
METHODS: Eighty patients who received radical resection for stage II or III colon cancer were involved, including 40 patients with left-sided colon cancer (LSCC) and 40 with right-sided colon cancer (RSCC). Paired cancer and normal colon mucosal specimens were collected from each patient. The gene expression of IL-8 was detected by real-time quantitative PCR. Subsequently, the relationship between IL-8 expression and clinicopathological variables as well as prognosis was analyzed.
RESULTS: The mRNA expression of IL-8 in colon cancer was significantly higher than that in normal colon mucosa (P < 0.01). IL-8 expression was significantly higher in RSCC than in LSCC (P = 0.004). High IL-8 expression was closely related with RSCC (65% vs 35%, P = 0.007), bigger tumor size (5.2 cm vs 4.1 cm, P = 0.014) and tumor infiltrating lymphocytes (27.5% vs 10%,P = 0.045). In patients with LSCC, the survival of patients with high IL-8 expression was significantly shorter than that in patients with low IL-8 expression (37.0 mo vs 59.2 mo, P = 0.006). However, among patients with RSCC, patients with high IL-8 expression tended to have a better prognosis than patients with low expression (63.8 mo vs 54.5 mo, P = 0.151). Multivariate analysis demonstrated that T4 infiltration (RR = 6.514, 95%CI: 1.209-35.102, P = 0.029) and lymphatic/vascular invasion (RR = 6.272, 95%CI: 1.352-29.092, P = 0.019) were independent prognostic factors of RSCC, and high IL-8 expression (RR = 3.279, 95%CI: 0.973-11.051, P = 0.045), T4 infiltration (RR = 4.546, 95%CI: 1.335-15.481, P = 0.015), lymph node metastasis (RR = 5.918, 95%CI: 1.439-24.334, P = 0.014) and lymphatic/vascular invasion (RR = 3.663, 95%CI: 1.089-12.320, P = 0.036) were independent prognostic factors of LSCC.
CONCLUSION: The gene expression of IL-8 is significantly different between RSCC and LSCC. High IL-8 expression has a different prognostic impact on RSCC and LSCC. RSCC and LSCC are two potentially heterogeneous groups with differences in molecular and carcinogenic mechanisms.
- Citation: Xu KY, Li YC, Wu JP, Gu J. Clinical significance of differential expression of interleukin 8 mRNA in left-sided and right-sided colon cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(30): 4822-4830
- URL: https://www.wjgnet.com/1009-3079/full/v23/i30/4822.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i30.4822
结直肠癌(colorectal cancer, CRC)是世界最常见的恶性肿瘤之一, 发病率在发达国家居第2位[1], 在中国城市居第3位[2]. 尽管治疗方法不断进展, 仍有近一半的患者最终死于复发和转移[3]. 把结直肠癌当作一个同质的整体, 仍然延用"One for All"的治疗模式, 远远不能满足当代肿瘤个体化治疗的要求, 因而探究结直肠癌内部所具有复杂异质性的亚型成为迫切需要. 早在1997年Distler等[4]就提出左半结肠癌(left-sided colon cancer, LSCC)和右半结肠癌(right-sided colon cancer, RSCC)是两个不同的肿瘤, 因为两者在胚胎发生, 基因改变和生物学特性诸多方面存在广泛的差异. 随着研究的深入, 越来越多的证据认为结直肠癌并不是遵循统一的致癌模式, 其内部至少存在3条致癌途径, 即染色体不稳定途径, 微卫星不稳定(microsatellite instability, MSI)途径和锯齿途径[5-7], 并且与肿瘤位置密切相关, 前者主要累及左半结肠, 后两者主要累及右半结肠. 由于致癌机制不同, 其内部存在许多差异表达的易感基因. 因此, 以结肠脾曲为界分成左半和右半结肠是研究结直肠疾病内部复杂异质性的重要途径. 遗憾的是, 至今许多有关结直肠癌的基础研究和临床试验仍然忽视基于这两个异质性亚群的评价.
白介素8(interleukin 8, IL-8)作为炎症趋化因子, 对肿瘤的进展起重要作用, 是强效的肿瘤生长因子和血管生成效应子[8]. 实验证明IL-8主要在CRC肿瘤细胞胞浆表达, 是结肠癌细胞的生长因子, 与结肠癌细胞迁移和侵袭能力相关[9-12]. IL-8表达与CRC的组织分级和转移相关[13]. 另一方面, IL-8还是宿主抗肿瘤免疫反应的重要调节剂, 他协同其他细胞因子促进树突状细胞向效应T细胞的抗原递呈, 并且调节辅助性T细胞中TH1细胞的激活, 从而促进免疫激活, 因而又具有抗肿瘤活性. 鉴于上述IL-8对结肠癌演变可能存在的相反作用, 临床上IL-8对CRC的预后影响尚不肯定. 这很可能与结肠癌内部的复杂异质性有关.
然而, 目前以结肠癌内部异质性出发, 从结肠癌不同亚群的角度对IL-8的研究报道较少. 本研究的目的着眼于探索IL-8在左、右半结肠这两个不同的结肠癌异质性群体中的表达及其对二者可能不同的临床意义.
选择接受根治性手术切除的结肠癌患者的80例, 以结肠脾曲为界, 包括RSCC组40例和LSCC组40例, 并符合下列条件: (1)散发性结肠癌; (2)术前未进行放射治疗, 化疗等各种形式的治疗; (3)接受结肠癌根治性手术切除, 术后切缘病理检查阴性; (4)术后病理检查确认为腺癌, AJCC分期为Ⅱ期和Ⅲ期; (5)有完整的临床、病理、随访资料. 组织标本离体后立即取自肿瘤腔面非坏死组织处, 并配对采集自身正常结肠黏膜组织(距肿瘤边缘5 cm以上), 迅速投入液氮中, 继而冻存于-80 ℃冰箱. 患者年龄范围29-82岁, 中位年龄57.9岁, 包括盲肠癌7例(8.8%), 升结肠癌14例(17.5%), 结肠肝曲癌14例(17.5%), 横结肠癌5例(6.3%), 结肠脾曲癌3例(3.8%), 降结肠癌6例(7.5%), 乙状结肠癌29例(36.3%), 直乙交界处癌2例(2.5%). 2组标本中, 各组的男/女比例和Ⅱ期/Ⅲ期比例均为20:20. 随访时间7-71 mo, 平均39.2 mo. 本研究均经患者书面知情同意和医院伦理委员会批准.
1.2.1 RNA提取: 冰冻组织标本100 mg在液氮下研磨匀浆化加入1 mL Trireagent(美国MRC公司)根据产品说明书用氯仿和异丙醇依次超速离心抽提, 总RNA用DEPC(美国Invitrogen产品)水溶解后, 用DnaseⅠ(美国Promega)去除RNA中的基因组DNA. 用1%琼脂糖凝胶电泳检测RNA条带, 并用分光光度计(美国Beckman公司)检测纯度和浓度.
1.2.2 实时定量PCR(real-time quantitative PCR, qRT-PCR)检测: 2 μg总RNA 70 ℃变性5 min, 然后在20 μL终反应体系中[Oligo(dT)180.5 μg, 1×第一链合成缓冲液, RNase酶抑制剂20 U, 10 mmol/L each dNTP, H Minus M-MuLV逆转录酶200 U, DEPC水](RevertAidTM H Minus First Strand cDNA Synthsis Kit, 美国MBI Fermentas公司)42 ℃逆转录1 h.
使用iCycler iQ qRT-PCR仪(美国BIO-RAD公司)进行Taqman探针法qRT-PCR扩增. 研究基因和内参基因(ACTB)引物及探针序列, PCR反应条件如表1(引物由北京奥科生物技术有限公司合成, 探针由北京赛百盛基因技术有限公司合成). 每个样品做2个平行反应, 平行反应Ct值肿瘤组织相差<0.5, 正常组织相差<1. 将各基因的PCR扩增产物倍比稀释成5个梯度相同条件下做qRT-PCR反应, 绘制相对标准曲线图, 根据直线的斜率求出各基因的扩增效率(E); 根据Ct值用扩增效率校正相对定量法计算出每个样品的基因表达; 最后PCR扩增产物测序验证.
| 基因 | 引物及Taqman探针序列(5'-3') | 反应条件 | ||
| T(℃) | 循环数 | 产物(bp) | ||
| IL-8 | F: GAGAGTGATTGAGAGTGGACCA | 59 | 43 | 143 |
| R: ATGAATTCTCAGCCCTCTTCAAAA | ||||
| Probe: TCTCCACAACCCTCTGCACCCAGT | ||||
| ACTB | F: GACTACCTCATGAAGATCCTCACC | 59 | 40 | 124 |
| R: CCATCTCTTGCTCGAAGTCCAG | ||||
| Probe: CGGCTACAGCTTCACCACCACGGC | ||||
qRT-PCR扩增结果用扩增效率校正相对定量法统计, 即将每个样品的Ct平均值代入qRT-PCR扩增效率校正的标准化表达公式[Q = 10K, K = (cttarget-B target)/slope target-(ctreference-B reference)/slope reference][14,15]. 其中, cttarget和ctreference分别为目的基因和内参基因ACTB的Ct值, B和slope分别为由相对标准曲线得出的目的基因和内参基因的截距和斜率. 此法校正了由于目的基因和内参基因扩增效率不同造成的基因表达量的计算误差.
统计学处理 应用SPSS19.0统计软件, 采用配对Wilcoxon和Mann-Whitney U非参数检验比较组间基因表达差异; 用Pearson χ2分析基因表达与临床病理参数的关系; 基因表达对生存的影响采用Kaplan-Meier生存分析法, 作Log-rank test检验; 用Cox proportion hazard model多因素分析患者的独立预后因子, 初步检验研究以P<0.1接受差异具有显著性, 其他统计结果均以P<0.05为差异具有统计学意义.
TRIzol法提取组织总RNA经1%琼脂糖凝胶电泳检测质量合格(图1), 紫外分光光度计检测RNA纯度在1.8-2.0之间. IL-8扩增产物测序后, 将结果与GeneBank中的核苷酸序列进行比对证实均为目的基因产物(图2).
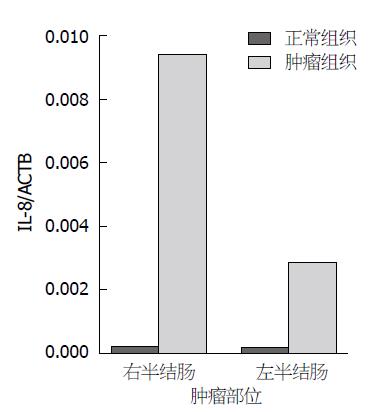
IL-8基因mRNA在结肠癌组织中的表达高于自身正常结肠黏膜的比例为92.5%; 从表2可以看出, 无论RSCC还是LSCC其mRNA在癌组织中的表达均显著高于自身正常黏膜(P<0.01); 相对于自身正常结肠黏膜, 对IL-8在癌组织中相对表达量(F)的统计显示, IL-8在RSCC中的表达明显高于LSCC, 差异具有显著性(表2, 图3).
| 分组 | QT±SD | QN±SD | F±SD | P1值 | P2值 |
| RSCC | 9.42×10-3±2.03×10-1 | 2.04×10-4±1.06×10-3 | 36.46±97.90 | <0.001 | 0.004 |
| LSCC | 2.86×10-3±1.61×10-2 | 1.94×10-4±9.67×10-3 | 18.98±22.29 | <0.001 |
本研究以结肠癌组织中本底标准化的基因表达量的中位数为界把所有患者分成基因高表达组和低表达组, 进行相关性分析发现, IL-8高表达患者在RSCC中的比例明显高于LSCC(65% vs 35%, P = 0.007), 肿瘤最大径也明显大于低表达患者(5.2 cm vs 4.1 cm, P = 0.014), 而且肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte, TIL)也较低表达患者更多见(27.5% vs 10.0%, P = 0.045); 另外, IL-8高表达与女性患者(P = 0.074)、隆起型肿瘤(P = 0.084)及发生异时性远处脏器转移(P = 0.172)具有非显著性正相关趋势(表3).
| 分组 | IL-8表达 | P值 | |
| 高表达 | 低表达 | ||
| 年龄(岁) | 57.5±11.9 | 58.3±10.3 | 0.734 |
| 性别 | 0.074 | ||
| 男 | 16 | 24 | |
| 女 | 24 | 16 | |
| 肿瘤部位 | 0.007 | ||
| RSCC | 26 | 14 | |
| LSCC | 14 | 26 | |
| 肿瘤最大径(cm) | 5.2±2.4 | 4.1±1.5 | 0.014 |
| 肿瘤大体形态 | 0.084 | ||
| 隆起型 | 15 | 8 | |
| 溃疡型 | 25 | 32 | |
| 肿瘤组织分级 | 0.588 | ||
| 高分化 | 5 | 5 | |
| 中分化 | 22 | 26 | |
| 低分化和未分化 | 13 | 9 | |
| 组织学类型 | 0.363 | ||
| 腺癌 | 32 | 35 | |
| 黏液腺癌 | 8 | 5 | |
| TIL | 0.045 | ||
| 无 | 29 | 36 | |
| 有 | 11 | 4 | |
| 肿瘤浸润深度 | 0.626 | ||
| T3 | 29 | 27 | |
| T4 | 11 | 13 | |
| 淋巴结转移 | 0.655 | ||
| 无 | 21 | 19 | |
| 有 | 19 | 21 | |
| LVI | 0.606 | ||
| 无 | 31 | 29 | |
| 有 | 9 | 11 | |
| 异时性远处脏器转移 | 0.172 | ||
| 无 | 29 | 34 | |
| 有 | 11 | 6 | |
| 癌相关死亡 | 0.302 | ||
| 存活 | 28 | 32 | |
| 死亡 | 12 | 8 | |
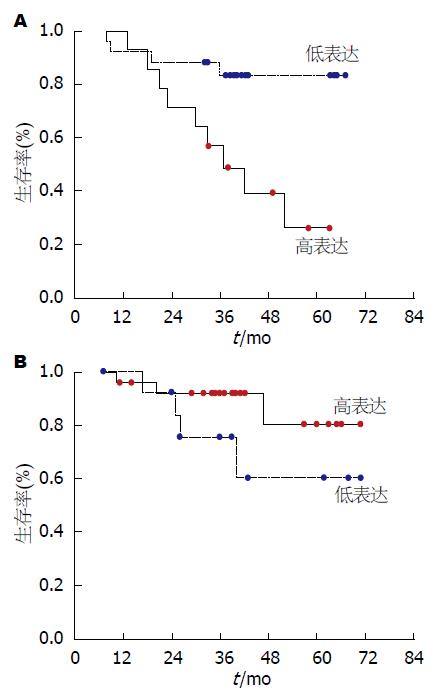
全组患者随访时间7-71 mo, 平均39.2 mo. 生存分析发现, 对于全体患者, IL-8高表达和低表达患者的生存时间无显著差异(55.1 mo vs 60.2 mo, P = 0.398); 但是分层分析发现, LSCC患者中IL-8高表达者的中位生存时间明显短于低表达者, 差异具有显著性(37.0 mo vs 59.2 mo, P = 0.006)(图4A); 而对RSCC患者显示出了与LSCC患者相反的趋势, 即IL-8的高表达者的预后具有好于低表达者的趋势, 尽管P值没有达到显著性(63.8 mo vs 54.5 mo, P = 0.151)(图4B).
把变量性别、年龄、组织分化程度、TIL、浸润深度、淋巴结转移、脉管癌栓、IL-8表达对RSCC和LSCC患者分别进行单变量分析, 将P<0.1的变量纳入Cox回归用倒推wald法进行多变量分析, 最后由P<0.05的变量构成Cox比例风险模型作为独立预后因子(表4). 结果显示, 对本研究患者群体肿瘤浸润深度(RR = 6.514, 95%CI: 1.209-35.102, P = 0.029)和脉管癌栓(RR = 6.272, 95%CI: 1.352-29.092, P = 0.019)是RSCC的独立预后因子; IL-8高表达(RR = 3.279, 95%CI: 0.973-11.051, P= 0.045)、淋巴结转移(RR = 5.918, 95%CI: 1.439-24.334, P = 0.014)和脉管癌栓(RR = 3.663, 95%CI: 1.089-12.320, P = 0.036)是LSCC的独立预后因子.
| 分组 | RSCC | LSCC | ||
| RR(95%CI) | P值 | RR(95%CI) | P值 | |
| 单因素分析 | ||||
| 性别(女) | 0.713(0.158-3.207) | 0.659 | 1.283(0.428-3.840) | 0.657 |
| 年龄(>65岁) | 1.174(0.227-0.060) | 0.848 | 1.227(0.411-3.664) | 0.714 |
| 组织分化(低分化) | 2.924(0.300-28.536) | 0.356 | 3.417(1.043-11.200) | 0.042 |
| TIL(+) | 0.320(0.037-2.745) | 0.299 | 0.858(0.111-6.634) | 0.884 |
| 穿透浆膜(T4) | 8.724(1.687-45.107) | 0.010 | 3.673(1.196-11.277) | 0.023 |
| 淋巴结转移(+) | 1.772(0.383-7.738) | 0.478 | 4.087(1.122-14.884) | 0.033 |
| LVI(+) | 9.333(2.011-43.314) | 0.004 | 5.311(1.723-16.367) | 0.004 |
| 高IL-8 | 0.350(0.078-1.568) | 0.170 | 4.587(1.408-14.940) | 0.011 |
| 多因素分析 | ||||
| 穿透浆膜(T4) | 6.514(1.209-35.102) | 0.029 | 4.546(1.335-15.481) | 0.015 |
| 淋巴结转移(+) | 6.272(1.352-29.092) | 0.019 | 3.663(1.089-12.320) | 0.036 |
| LVI(+) | 5.918(1.439-24.334) | 0.014 | ||
| 高IL-8 | 3.279(0.973-11.051) | 0.045 | ||
个体化治疗是肿瘤治疗的理想目标, 能在延长患者生存时间的同时降低医疗成本, 避免治疗给患者可能带来的不利因素. 患者之间不同的致癌机制是个体化治疗的分子基础, 这在CRC中尤为显著. 由于正常左、右半结肠之间从胚胎发生, 生理生化过程、正常黏膜的分子表达、致癌环境、致癌物代谢到致癌的分子机制等方面存在诸多差异, 即使是结肠癌和直肠癌之间也可能存在不同[16,17], 因此为了排除更多混杂因素的干扰, 本研究未包括直肠癌患者, 并且配对采集了80对结肠癌组织及其自身远端正常结肠黏膜组织, 分成左半和右半结肠癌组, 且组间性别和病理分期匹配. qRT-PCR的实验结果经过2次标准化处理校正了可能存在的PCR反应初始模板量和正常组织本底差异所致的偏畸.
本研究发现IL-8在LSCC和RSCC中均较正常结肠黏膜显著高表达, 其他的研究[18]从蛋白水平上也验证了这个表达模式. 然而本研究进一步还发现IL-8 mRNA在RSCC中的表达明显高于LSCC, 为后者的1.92倍(P = 0.004). 与临床病理因素相关分析发现, IL-8高表达与RSCC、TIL及较大的肿瘤直径显著相关, 和女性患者、隆起型肿瘤大体形态虽未及显著性, 但具有正相关趋势; 其中分析显示TIL、较大的肿瘤直径和隆起型肿瘤又均与RSCC显著相关; 目前已知MSI CRC也具有女性患者多见, 右半结肠聚集和富TIL等临床病理特点. 因而推测, IL-8在RSCC中的高表达与MSI途径的CRC可能密切相关. 有研究[19]通过将29例MSI CRC组织和104例微卫星稳定(microsatellite stability, MSS)CRC组织进行基因芯片的对比研究也证实, IL-8在MSI CRC中的表达较MSS CRC明显上调, 是MSS肿瘤的3.6倍. 此外, 在对RSCC患者的生存分析中发现IL-8高表达较低表达患者有预后较好的趋势, 分析这可能与IL-8在RSCC中发挥了抗肿瘤作用有关. 有研究发现[20]紫杉醇在治疗卵巢癌过程中可以诱导IL-8的表达, 转染了IL-8的卵巢癌细胞其增殖特性在体外观察并无改变, 然而将此IL-8表达上调的细胞注射动物后表现成瘤性缺失, 注射了IL-8中和抗体后可以逆转这种表型再现肿瘤生长. 相应的报道[21,22]在鼠结肠癌模型中, IL-8通过激活T淋巴细胞显现出高度的抗肿瘤性. 在MSI CRC中较MSS CRC明显上调的基因除了IL-8外还有许多其他介导宿主抗肿瘤免疫的基因, 如热休克蛋白HSP-70、HSP-110、促炎症因子IL-18、IL-15、IL-24、IL-7、细胞毒调节剂Granulysin、Granzyme A. 这些上调的因子协同促进宿主的抗肿瘤免疫应答, 最终通过MSI肿瘤中特征性存在的TIL效应T细胞发挥靶细胞杀伤作用. 而MSI-H肿瘤细胞自身可以释放移码突变性异常肽在体外可以激活细胞毒T细胞反应[23,24], 在活体内作为肿瘤特异性抗原激发宿主免疫应答. 鉴于IL-8高表达与右半结肠及TIL之间的显著相关性, 推测IL-8在RSCC中的高表达很可能是他在这部分肿瘤中抗肿瘤免疫反应的体现, 因而其对RSCC组患者的生存上体现出了预后较好的趋势. 接下来的研究, 我们将进一步明确IL-8与MSI CRC二者间的内在联系, 及其IL-8在MSI致癌途径下存在的调节与被调节机制.
与上述RSCC形成对照, 本研究发现IL-8高表达在LSCC显示了相反的临床意义, 即IL-8高表达是LSCC患者较差预后的指标. 而且发现IL-8高表达与异时性远处脏器转移有正相关趋势(P = 0.172). 这些可归因于前述的IL-8在肿瘤中具有的促细胞生长[10]和促血管生成的活性[25,26]. 近来研究[27]发现, IL-8在结肠癌中的促增殖和促迁移作用与金属蛋白酶依赖的对EGFR配体的剪切继而激活EGFR有关. 研究[13]发现IL-8在肝转移组织中的表达明显高于自身对应的原发癌组织, 表明IL-8与CRC肝转移有关. 对CRC患者血清检测的研究也发现IL-8明显高于正常对照, 而且与患者的临床分期, 结肠壁浸润和肝转移显著相关[28,29], 可以有助于对CRC患者的异时性肝转移风险进行预测; 其他研究也同样发现, IL-8高表达与肿瘤的浸润深度, Duke分期和较差预后显著相关[18,30], 这些均与本研究IL-8作为不良预后的独立预后因子相符.
从本研究可以看出结肠癌是一个具有复杂异质性的疾病, LSCC和RSCC是具有复杂分子差异的2个不同的结肠癌亚型, 因此无论在基础研究还是临床试验中把他作为一个同质性的整体进行分析势必会得出偏颇的结论. 根据肿瘤部位的不同对肿瘤标志物表达的临床意义进行分析是有必要的. 对不同异质性亚群的分子分类必将促进基于致癌途径特异性的结肠癌的个体化治疗.
"One for All"的治疗模式已经不适应当代肿瘤的个体化治疗要求. 尤其对于结直肠癌这样一个具有复杂异质性的疾病, 更不能当作一个同质的整体来对待. 越来越多的证据认为结直肠癌并不是遵循统一的致癌模式, 其内部至少存在3条致癌途径, 即染色体不稳定途径, 微卫星不稳定(microsatellite instability, MSI)途径和锯齿途径, 并且与肿瘤位置密切相关. 3者间必然存在复杂的分子差异.
肖秀英, 副主任医师, 上海交通大学医学院附属仁济医院; 顾国利, 副主任医师,中国人民解放军空军总医院普通外科
基于不同的致癌机制, 对结直肠癌的不同亚型进行分子分类, 并基于不同的分类指导肿瘤的个体化分子分期和分子靶向治疗, 以提高治疗的精准性, 避免临床上的过度治疗和治疗不足, 这是结直肠癌内部复杂异质性研究方面亟待解决的问题.
既往对白介素8(interleukin 8, IL-8)的研究都是基于结直肠癌的整体, 并发现其功能具有相反的生物学特性. 即一方面他是结直肠癌强效的生长因子和血管生成效应子, 与结肠癌细胞迁移和侵袭能力相关, 与结直肠癌的组织分级和转移相关. 另一方面, 他还是宿主抗肿瘤免疫反应的重要调节剂, 具有抗肿瘤活性. IL-8协同其他许多介导宿主抗肿瘤免疫的基因在MSI结肠癌中较微卫星稳定(microsatellite stability, MSS)结肠癌表达明显上调.
与既往的研究不同, 本文从结肠癌不同的亚群的角度对IL-8的表达及其与临床病理和预后的相关性进行研究, 证实了IL-8是左右半结肠癌间显著差异表达的分子, 并对二者的预后具有不同甚至相反的影响.
对肿瘤标志物的研究, 无论是基础还是临床领域, 把结肠癌作为一个同质性的整体进行分析势必会得出偏颇的结论. 根据肿瘤部位的不同对IL-8表达的临床意义进行分析是十分必要的.
MSI结直肠癌: 由于基因短重复序列发生移码突变所致的结直肠癌亚型, 约占散发型结直肠癌的5%-10%, 多累及右半结肠. 认为与错配修复基因MMR缺陷有关, 有遗传性家族史者是因MMR基因的胚系突变所致, 散发型者因MMR的CpG岛甲基化沉默所致. 目前发现该部分人群肿瘤突变抗原负荷高, 对肿瘤的免疫治疗较为敏感.
本研究就IL-8在左半和右半结肠中表达进行研究, 研究方法准确, 结果可靠. 对临床增进对结直肠癌生物学行为的认识具有一定的帮助.
编辑: 于明茜 电编:闫晋利
| 1. | Stewart BW, Kleihues P. Colorectal cancer. In: World Cancer Report. 2003; Available from: http://www.iarc.fr/en/publications/pdfs-online/wcr/2003/WorldCancerReport.pdf.. |
| 2. | 陈 万青. 2014年中国肿瘤登记年报. 北京: 全国肿瘤登记中心. 2014;. |
| 4. | Distler P, Holt PR. Are right- and left-sided colon neoplasms distinct tumors? Dig Dis. 1997;15:302-311. [PubMed] [DOI] |
| 5. | Mundade R, Imperiale TF, Prabhu L, Loehrer PJ, Lu T. Genetic pathways, prevention, and treatment of sporadic colorectal cancer. Oncoscience. 2014;1:400-406. [PubMed] [DOI] |
| 6. | Simons CC, Hughes LA, Smits KM, Khalid-de Bakker CA, de Bruïne AP, Carvalho B, Meijer GA, Schouten LJ, van den Brandt PA, Weijenberg MP. A novel classification of colorectal tumors based on microsatellite instability, the CpG island methylator phenotype and chromosomal instability: implications for prognosis. Ann Oncol. 2013;24:2048-2056. [PubMed] [DOI] |
| 7. | Arends MJ. Pathways of colorectal carcinogenesis. Appl Immunohistochem Mol Morphol. 2013;21:97-102. [PubMed] |
| 8. | Xie K. Interleukin-8 and human cancer biology. Cytokine Growth Factor Rev. 2001;12:375-391. [PubMed] [DOI] |
| 9. | Brew R, Southern SA, Flanagan BF, McDicken IW, Christmas SE. Detection of interleukin-8 mRNA and protein in human colorectal carcinoma cells. Eur J Cancer. 1996;32A:2142-2147. [PubMed] [DOI] |
| 10. | Brew R, Erikson JS, West DC, Kinsella AR, Slavin J, Christmas SE. Interleukin-8 as an autocrine growth factor for human colon carcinoma cells in vitro. Cytokine. 2000;12:78-85. [PubMed] [DOI] |
| 11. | Wilson AJ, Byron K, Gibson PR. Interleukin-8 stimulates the migration of human colonic epithelial cells in vitro. Clin Sci (Lond). 1999;97:385-390. [PubMed] [DOI] |
| 12. | Li A, Varney ML, Singh RK. Expression of interleukin 8 and its receptors in human colon carcinoma cells with different metastatic potentials. Clin Cancer Res. 2001;7:3298-3304. [PubMed] |
| 13. | Rubie C, Frick VO, Pfeil S, Wagner M, Kollmar O, Kopp B, Graber S, Rau BM, Schilling MK. Correlation of IL-8 with induction, progression and metastatic potential of colorectal cancer. World J Gastroenterol. 2007;13:4996-5002. [PubMed] |
| 14. | 张 驰宇, 徐 顺高, 黄 新祥. 一种新颖简便的荧光实时RT-PCR相对定量方法的建立. 生物化学与生物物理进展. 2005;32:883-887. |
| 15. | Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Res. 2001;29:e45. [PubMed] [DOI] |
| 16. | Kapiteijn E, Liefers GJ, Los LC, Kranenbarg EK, Hermans J, Tollenaar RA, Moriya Y, van de Velde CJ, van Krieken JH. Mechanisms of oncogenesis in colon versus rectal cancer. J Pathol. 2001;195:171-178. [PubMed] [DOI] |
| 17. | Konishi K, Fujii T, Boku N, Kato S, Koba I, Ohtsu A, Tajiri H, Ochiai A, Yoshida S. Clinicopathological differences between colonic and rectal carcinomas: are they based on the same mechanism of carcinogenesis? Gut. 1999;45:818-821. [PubMed] [DOI] |
| 18. | Baier PK, Eggstein S, Wolff-Vorbeck G, Baumgartner U, Hopt UT. Chemokines in human colorectal carcinoma. Anticancer Res. 2005;25:3581-3584. [PubMed] |
| 19. | Banerjea A, Ahmed S, Hands RE, Huang F, Han X, Shaw PM, Feakins R, Bustin SA, Dorudi S. Colorectal cancers with microsatellite instability display mRNA expression signatures characteristic of increased immunogenicity. Mol Cancer. 2004;3:21. [PubMed] [DOI] |
| 20. | Bleeker WA, Hayes VM, Karrenbeld A, Hofstra RM, Hermans J, Buys CC, Plukker JT. Impact of KRAS and TP53 mutations on survival in patients with left- and right-sided Dukes' C colon cancer. Am J Gastroenterol. 2000;95:2953-2957. [PubMed] [DOI] |
| 21. | Lejeune P, Reisser D, Onier N, Lagadec P, Lindley I, Jeannin JF. Interleukin-8 has antitumor effects in the rat which are not associated with polymorphonuclear leukocyte cytotoxicity. Cancer Immunol Immunother. 1994;38:167-170. [PubMed] [DOI] |
| 22. | Reisser D, Lejeune P, Lagadec P, Onier N, Dasilva C, Lindley I, Jeannin JF. Interleukin-8 antitumour effect is associated with a local infiltration but not with a systemic activation of T lymphocytes. Anticancer Res. 1994;14:977-979. [PubMed] |
| 23. | Saeterdal I, Gjertsen MK, Straten P, Eriksen JA, Gaudernack G. A TGF betaRII frameshift-mutation-derived CTL epitope recognised by HLA-A2-restricted CD8+ T cells. Cancer Immunol Immunother. 2001;50:469-476. [PubMed] [DOI] |
| 24. | Saeterdal I, Bjørheim J, Lislerud K, Gjertsen MK, Bukholm IK, Olsen OC, Nesland JM, Eriksen JA, Møller M, Lindblom A. Frameshift-mutation-derived peptides as tumor-specific antigens in inherited and spontaneous colorectal cancer. Proc Natl Acad Sci USA. 2001;98:13255-13260. [PubMed] [DOI] |
| 25. | Glebov OK, Rodriguez LM, Nakahara K, Jenkins J, Cliatt J, Humbyrd CJ, DeNobile J, Soballe P, Simon R, Wright G. Distinguishing right from left colon by the pattern of gene expression. Cancer Epidemiol Biomarkers Prev. 2003;12:755-762. [PubMed] |
| 26. | Li A, Varney ML, Valasek J, Godfrey M, Dave BJ, Singh RK. Autocrine role of interleukin-8 in induction of endothelial cell proliferation, survival, migration and MMP-2 production and angiogenesis. Angiogenesis. 2005;8:63-71. [PubMed] [DOI] |
| 27. | Itoh Y, Joh T, Tanida S, Sasaki M, Kataoka H, Itoh K, Oshima T, Ogasawara N, Togawa S, Wada T. IL-8 promotes cell proliferation and migration through metalloproteinase-cleavage proHB-EGF in human colon carcinoma cells. Cytokine. 2005;29:275-282. [PubMed] [DOI] |
| 28. | Kaminska J, Nowacki MP, Kowalska M, Rysinska A, Chwalinski M, Fuksiewicz M, Michalski W, Chechlinska M. Clinical significance of serum cytokine measurements in untreated colorectal cancer patients: soluble tumor necrosis factor receptor type I--an independent prognostic factor. Tumour Biol. 2005;26:186-194. [PubMed] [DOI] |
| 29. | Ueda T, Shimada E, Urakawa T. Serum levels of cytokines in patients with colorectal cancer: possible involvement of interleukin-6 and interleukin-8 in hematogenous metastasis. J Gastroenterol. 1994;29:423-429. [PubMed] [DOI] |
| 30. | Terada H, Urano T, Konno H. Association of interleukin-8 and plasminogen activator system in the progression of colorectal cancer. Eur Surg Res. 2005;37:166-172. [PubMed] [DOI] |