修回日期: 2015-09-21
接受日期: 2015-09-25
在线出版日期: 2015-10-28
目的: 预测分析Piezo1理化性质和结构等, 并检测其在肠道的表达.
方法: 利用Protparam程序预测Piezo1蛋白基本理化性质; 利用ProtComp Version 9.0分析亚细胞定位; 利用SOPMA程序预测其二级结构; 利用SWISS-MODEL服务器生成其三维模型. 利用免疫组织化学方法检测Piezo1在肠道组织的表达及定位, 以实时定量PCR检测(real-time quantitative PCR)检测Piezo1在不同肠段的表达量.
结果: Piezo1蛋白分子量为286.6453 kDa, 等电点pI = 7.27. Piezo1蛋白多次跨膜, 并有多个转录后蛋白修饰位点. Piezo1蛋白表达于肠道上皮与神经节, 其在结肠表达含量较回肠丰富(P<0.01).
结论: Piezo1在肠道表达丰富, 在肠上皮功能和肠道感觉调控方面的可能有关键作用.
核心提示: 本文利用生物信息学工具, 对Piezo1蛋白理化性质、分子结构、生物学功能进行预测分析, 并运用实验室方法检测其在肠道组织中的表达, 以期为进一步探讨Piezo1蛋白特性和功能、开发药物等提供理论依据, 为Piezo1蛋白在肠道功能和肠道疾病中的作用进行相关性的研究中奠定基础.
引文著录: 白涛, 钱伟, 张磊, 汪欢, 侯晓华, 宋军. Piezo1蛋白的生物信息学分析及其在肠道中的表达. 世界华人消化杂志 2015; 23(30): 4816-4821
Revised: September 21, 2015
Accepted: September 25, 2015
Published online: October 28, 2015
AIM: To predict and analyze the physical and chemical properties of Piezo1, and to detect its expression in the intestine.
METHODS: Physical and chemical properties of Piezo1 were predicted with Protparam. Subcellular location was analyzed with ProtComp Version 9.0. Protein secondary structure was predicted with SOPMA program. Three-dimensional model was created with SWISS-MODEL. Location of Piezo1 in the intestine was analyzed by immunohistochemical staining, and real-time quantitative PCR was performed to compare its expression in different segments of the intestine.
RESULTS: Piezo1 has a molecular weight of 286.6453 kDa, with an isoelectric point of 7.27. Piezo1 has many transmembrane domains and post-translational modification sites. Piezo1 was expressed in intestinal epithelial tissue and ganglion cells. Expression of Piezo1 in the colon was much more abundant than that in the small intestine (P < 0.01).
CONCLUSION: The intestine is rich in Piezo1. Piezo1 may play a key role in regulating the function of the intestinal epithelium and enteric nervous system.
- Citation: Bai T, Qian W, Zhang L, Wang H, Hou XH, Song J. Bioinformatics analysis of Piezo1 and detection of its expression in the gut. Shijie Huaren Xiaohua Zazhi 2015; 23(30): 4816-4821
- URL: https://www.wjgnet.com/1009-3079/full/v23/i30/4816.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i30.4816
Piezo1蛋白是2010年Coste等[1]发现并定义的机械门控离子通道蛋白, 其表达在物种间保守, 广泛存在于多个组织, 如肺、膀胱、皮肤、结肠等. 研究发现, Piezo1是拥有超过2000个氨基酸残基的多次跨膜离子通道蛋白, 是细胞膜感受机械刺激的关键蛋白之一. 当表达Piezo1蛋白的细胞感受机械刺激时, Piezo1即受到激活开放, 形成非选择性阳离子内流, 从而将机械刺激信号转化为生物电信号. Piezo1的发现是离子通道研究领域的里程碑. 本文利用生物信息学工具, 对Piezo1蛋白理化性质、分子结构、生物学功能进行预测分析, 并运用实验室方法检测其在肠道组织中的表达, 以期为进一步探讨Piezo1蛋白特性和功能、开发药物等提供理论依据, 为Piezo1蛋白在肠道功能和肠道疾病中的作用进行相关性的研究中奠定基础.
Piezo1蛋白的基因及其编码蛋白的GenBank登录号依次为KC602455与AGH27891. 免疫组织化学SP试剂盒购自武汉博士德公司; 多克隆抗体Piezo1购自Abcam公司; DAB显色液购自武汉博士德公司; TRIzol购自Gibco公司; 聚合酶链式反应(polymerase chain reaction, PCR)由上海英俊生物有限公司合成; 逆转录酶试剂盒购自TAKARA公司; NIH小鼠购自广东省实验动物中心.
1.2.1 生物信息学分析: 利用Protparam在线程序[2]预测Piezo1蛋白基本理化性质, 如分子量、等电点、平均疏水系数等; 利用ProtComp Version9.0在线工具分析亚细胞定位; 利用SOPMA在线程序[3]预测其二级结构; 利用SWISS-MODEL服务器[4]生成其三维模型, 并在PyMOL Version1.7.4中编辑.
1.2.2 免疫组织化学检测: 4%多聚甲醛固定组织标本24 h后, 石蜡包埋. 切片厚度为4 μm, 脱蜡水化后, 5%BSA 37 ℃封闭30 min, 一抗工作浓度为1:250, 4 ℃过夜. 二抗为生物素标记的羊抗兔IgG, DAB显色, 苏木素复染, 脱水封片. PBS缓冲液代替一抗做阴性对照.
1.2.3 不同肠道Piezo1 RNA的表达: 采用TRIzol提取组织RNA(步骤按照产品说明书), 运用逆转录试剂盒使RNA逆转录为cDNA, 应用SYBRGreen和实时定量PCR(real-time quantitative PCR, qRT-PCR)检测仪检测Piezo1的mRNA水平. 引物如下: β-actin: 上游5'-TGTTACCAACTGGGACGACA-3', 下游5'-CTGGGTCATCTTTTCACGGT-3'; Piezo1: 上游5'-TCATCATCCTTAACCACATGGTG-3', 下游5'-TGAAGACGATAGCTGTCATCCA-3'.
统计学处理 运用R2.11.1软件, 使用t检验方法进行统计分析, P<0.05为差异具有统计学意义.
通过Protparam预测Piezo1蛋白基本理化性质, 推测蛋白分子量为286.6453 kDa, 等电点pI = 7.27, 波长280 nm时摩尔消光系数为464620, 半衰期为30 h, 平均疏水性系数为0.078, 脂肪系数101.55. 不稳定参数为49.44, 属不稳定蛋白. Piezo1蛋白所含氨基酸残基数为2520, 其中碱性残基数目为248, 酸性残基数为249. 所含氨基酸组成如表1, 含亮氨酸和丙氨酸最多, 不含吡咯赖氨酸和硒半胱氨酸.
| 氨基酸 | 构成比(%) | 氨基酸 | 构成比(%) | 氨基酸 | 构成比(%) | 氨基酸 | 构成比(%) |
| Ala | 8.1 | Gln | 5.0 | Leu | 14.6 | Ser | 5.7 |
| Arg | 7.0 | Glu | 6.3 | Lys | 2.9 | Thr | 4.8 |
| Asn | 1.9 | Gly | 5.8 | Met | 2.1 | Trp | 2.4 |
| Asp | 3.6 | His | 2.2 | Phe | 5.1 | Tyr | 3.5 |
| Cys | 2.3 | Ile | 4.1 | Pro | 5.5 | Val | 7.1 |
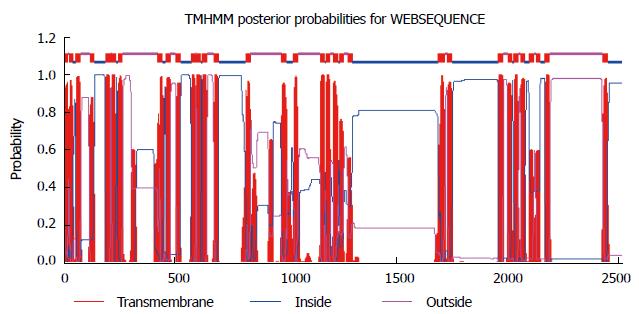
使用ProtComp Version9.0在线工具分析Piezo1蛋白亚细胞定位, 结果显示存在于细胞膜、高尔基体、内质网等生物膜结构中(图1). 使用MotifyScan进行翻译后修饰位点分析, 预测人Piezo1蛋白理论上存在1个酰胺化位点1922-1925, 8个N-糖基化位点(295-298、658-661、885-888、892-895、1095-1098、1222-1225、2293-2296、2330-2333), 2个cAMP-和cGMP-依赖性蛋白激酶磷酸化位点(1867-1870、1910-1913), 24个酪蛋白激酶Ⅱ磷酸化位点(96-99、108-111、306-309、374-377、378-381、552-555、567-570、676-679、709-712、758-761、1153-1156、1423-1426、1538-1541、1571-1574、1602-1605、1619-1622、1644-1647、1820-1823、1837-1840、1857-1860、1906-1909、1993-1996、2260-2263、2339-2342), 21个豆蔻酰化位点(169-174、253-258、474-479、505-510、762-767、918-923、995-1000、1008-1013、1058-1063、1475-1480、1608-1613、1620-1625、1640-1645、1668-1673、1775-1780、1832-1837、1853-1858、2090-2095、2271-2276、2393-2398、2441-2446), 21个蛋白激酶C磷酸化位点(56-58、179-181、241-243、328-330、455-457、500-502、1027-1029、1132-1134、1259-1261、1726-1728、1866-1868、1870-1872、1906-1908、1937-1939、2052-2054、2094-2096、2154-2156、2212-2214、2299-2301、2332-2334、2423-2425), 3个酪氨酸激酶磷酸化位点(1562-1569、1761-1768、2152-2158).
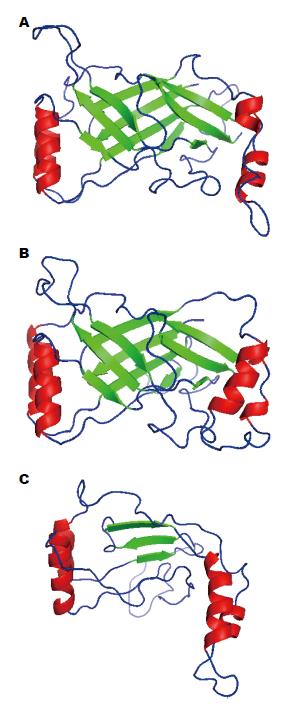
SOPMA在线程序分析结果显示, Piezo1蛋白含2520个氨基酸, 主要的结构元件为α螺旋(48.29%), 延伸链(14.88%), β转角(7.14%)和无规则卷曲(29.68%). 通过SWISS-MODEL服务器生成三维模型, 在PyMOL Version1.7.4中进行结构编辑, 生成Piezo1蛋白三维模型如图2.
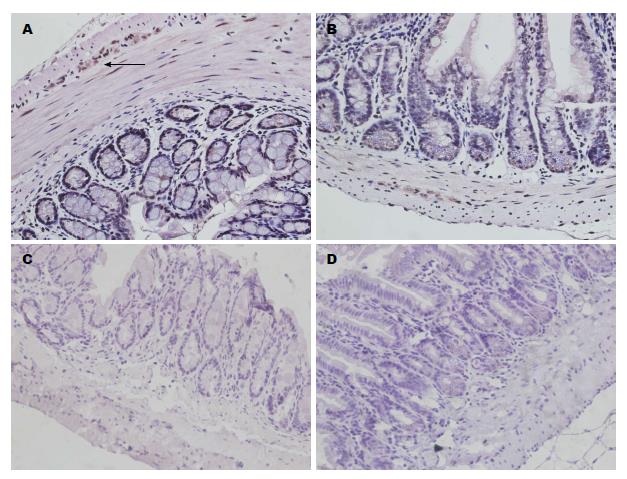
Piezo1蛋白在小鼠结肠组织中表达如图3A, 在小鼠回肠组织中表达如图3B, 阴性对照如图3C, D, 可见Piezo1蛋白在肠道表达丰富, 主要表达于上皮细胞与肠道神经节. 且同回肠组织比较, 小鼠结肠表达更丰富.
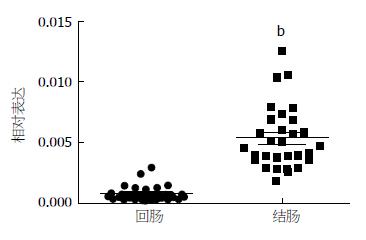
qRT-PCR检测小鼠不同肠段Piezo1基因表达情况, 结肠Piezo1表达较回肠明显丰富(P<0.01)(图4).
通过生物信息学分析发现, Piezo1是拥有超过2000氨基酸残基的多次跨膜通道蛋白, 主要定位于细胞膜系统. Piezo1蛋白具备多个修饰位点, 可能与通道活性和功能状态密切相关. 通过二级结构预测, 发现α螺旋在蛋白中占重要比例(48.29%), 符合跨膜蛋白的一般规律. 其中无规则卷曲(29.68%)和β转角(7.14%)占有较大比例, 提示可能存在抗原特性. 三种三级结构预测模型基本一致, 对于了解Piezo1蛋白空间结构具有重要意义. Coste等[1]发现Piezo1在肠道有表达, 其表达具体定位尚未见报道. 本研究证实, Piezo1主要表达于肠道上皮与肠神经节, 小鼠中证实, 结肠表达量较小肠明显丰富.
已有研究[1]表明, Piezo1为机械敏感性受体, 在感受机械刺激中发挥重要作用, 干预Piezo1蛋白能明显降低机械刺激引起的机械激活电流强度. Piezo1蛋白在果蝇感受伤害性机械刺激中起关键作用, 敲除Piezo1基因, 果蝇对伤害性机械刺激反应明显受损[5]. 此外, Piezo1在细胞形态、黏附、发育等方面至关重要: 机械力刺激是调节红细胞体积和形态的重要因素, 机械门控钙通道被预测为可能在红细胞功能调节中有至关重要的作用[6-11], 与此同时, 红细胞的衰老和状态也与钙离子的通透性相关[12-14], Piezo1的发现解释了红细胞形态功能调节与机械刺激的关系, 研究[15-19]发现, Piezo1的突变与遗传性干瘪红细胞增多症的红细胞病理现象息息相关[15], 参与红细胞体积和功能的调节[16,17]; Piezo1表达于泌尿道, 机械刺激后产生的钙离子内流和ATP释放, 是泌尿道感知尿流和压力的重要机制[18,19]; Piezo1的表达影响肿瘤细胞的黏附、迁移功能及相关通路的激活; 体内敲除Piezo1基因致使小鼠胚胎期死亡证实Piezo1参与发育和结构功能成熟, 结果证实血管发育受到限制, 内皮功能紊乱[20,21], 证实了Piezo1感受血流机械刺激从而发挥调节作用的生物学功能至关重要. 生物信息学分析提示, Piezo1蛋白具备离子通道功能的同时, 可能具备抗原特性, 与Yang等[22]试验研究相符, 在肿瘤细胞的黏附、迁移功能起到关键作用[23,24]. 而在肠道中, 关于Piezo1尚未有研究结果. 由于结肠内容物含水分较少并含较多微生物, 来源于肠腔的机械刺激和抗原刺激比小肠更复杂, 而Piezo1在结肠中表达较小肠丰富, 提示Piezo1在结肠上皮功能调控中可能有重要作用, 可感受肠腔内的机械刺激, 在肠道微环境稳态维持、内脏感觉等功能调控中发挥关键作用, 值得进一步研究. 另外, 内脏高敏感参与肠道疾病的症状发生[25-28], 肠神经系统是调控肠道感觉功能的重要机制[29,30], Piezo1在肠神经节的表达, 强烈提示其在肠道感觉功能调节中的重要作用, Piezo1可能是内脏感觉产生及调控的关键分子. Piezo1表达和功能的异常在肠易激综合征、溃疡性结肠炎等疾病中内脏高敏感性的发生有至关重要的作用. 同时, 可能参与肠道上皮损伤的完整性修复, 在肠上皮屏障功能中发挥关键调节作用.
本研究结果为深入探讨Piezo1蛋白在肠上皮功能和肠道感觉调控方面的作用提供理论依据, 为进一步研究Piezo1蛋白功能提供参考.
Piezo1蛋白是2010年Coste等发现并定义的机械门控离子通道蛋白, 其表达在物种间保守. 研究发现, Piezo1是细胞膜感受机械刺激的关键蛋白之一. Piezo1的发现是离子通道研究领域的里程碑.
高国全, 教授, 中山大学中山医学院生物化学教研室; 陆斌, 副教授, 中国人民解放军第二军医大学
Piezo1是新近发现的机械门控离子通道蛋白, 参与多种生物调控, 在各个器官广泛表达. Piezo1表达于肠神经系统, 可能在其参与内脏感觉功能调控中有重要意义.
自Piezo1被发现感知机械力以来, Piezo1被证实参与多种生物功能调节, 包括细胞形态、发育、迁移功能等, 既往的研究阐述了Piezo1在红细胞、口腔、泌尿道、肿瘤等领域的调节机制, 同时提出了更值得研究的问题.
本文以生物信息学方法分析了Piezo1的蛋白结构, 首次预测了活化位点, 并检测了其在肠道的分布, 为其在肠道的功能调节进一步研究奠定理论基础.
本研究结果为深入探讨Piezo1蛋白在肠上皮功能和肠道感觉调控方面的作用提供理论依据, 为进一步研究Piezo1蛋白功能提供参考.
文章通过生物信息学方法利用相关软件对Piezo1蛋白进行理化性质、分子机构、生物学功能进行预测, 并通过一些实验手段证明了该蛋白在肠道中的分布及表达情况, 为探讨此蛋白在疾病的发生发展中的作用以及进一步探讨该蛋白的生物功能、开发新药奠定了基础.
编辑: 于明茜 电编:闫晋利
| 1. | Coste B, Mathur J, Schmidt M, Earley TJ, Ranade S, Petrus MJ, Dubin AE, Patapoutian A. Piezo1 and Piezo2 are essential components of distinct mechanically activated cation channels. Science. 2010;330:55-60. [PubMed] [DOI] |
| 2. | 沈 通一, 张 明, 周 玉坤, 陈 红旗, 张 鹏, 杭 晓敏, 秦 环龙. 基于生物信息学的植物乳酸杆菌表层黏附蛋白的筛选及鉴定. 世界华人消化杂志. 2009;17:1626-1631. [DOI] |
| 3. | Geourjon C, Deléage G. SOPMA: significant improvements in protein secondary structure prediction by consensus prediction from multiple alignments. Comput Appl Biosci. 1995;11:681-684. [PubMed] |
| 4. | Arnold K, Bordoli L, Kopp J, Schwede T. The SWISS-MODEL workspace: a web-based environment for protein structure homology modelling. Bioinformatics. 2006;22:195-201. [PubMed] |
| 5. | Bagriantsev SN, Gracheva EO, Gallagher PG. Piezo proteins: regulators of mechanosensation and other cellular processes. J Biol Chem. 2014;289:31673-31681. [PubMed] [DOI] |
| 6. | Brain MC, Pihl C, Robertson L, Brown CB. Evidence for a mechanosensitive calcium influx into red cells. Blood Cells Mol Dis. 2004;32:349-352. [PubMed] |
| 7. | Johnson RM. Membrane stress increases cation permeability in red cells. Biophys J. 1994;67:1876-1881. [PubMed] |
| 8. | Ma YL, Rees DC, Gibson JS, Ellory JC. The conductance of red blood cells from sickle cell patients: ion selectivity and inhibitors. J Physiol. 2012;590:2095-2105. [PubMed] [DOI] |
| 9. | Vandorpe DH, Xu C, Shmukler BE, Otterbein LE, Trudel M, Sachs F, Gottlieb PA, Brugnara C, Alper SL. Hypoxia activates a Ca2+-permeable cation conductance sensitive to carbon monoxide and to GsMTx-4 in human and mouse sickle erythrocytes. PLoS One. 2010;5:e8732. [PubMed] [DOI] |
| 10. | Dyrda A, Cytlak U, Ciuraszkiewicz A, Lipinska A, Cueff A, Bouyer G, Egée S, Bennekou P, Lew VL, Thomas SL. Local membrane deformations activate Ca2+-dependent K+ and anionic currents in intact human red blood cells. PLoS One. 2010;5:e9447. [PubMed] [DOI] |
| 11. | Larsen FL, Katz S, Roufogalis BD, Brooks DE. Physiological shear stresses enhance the Ca2+ permeability of human erythrocytes. Nature. 1981;294:667-668. [PubMed] |
| 12. | Lew VL, Daw N, Perdomo D, Etzion Z, Bookchin RM, Tiffert T. Distribution of plasma membrane Ca2+ pump activity in normal human red blood cells. Blood. 2003;102:4206-4213. [PubMed] |
| 13. | Lew VL, Tiffert T. Is invasion efficiency in malaria controlled by pre-invasion events? Trends Parasitol. 2007;23:481-484. [PubMed] |
| 14. | Romero PJ, Romero EA. Differences in Ca2+ pumping activity between sub-populations of human red cells. Cell Calcium. 1997;21:353-358. [PubMed] |
| 15. | Gallagher PG. Disorders of red cell volume regulation. Curr Opin Hematol. 2013;20:201-207. [PubMed] [DOI] |
| 16. | Hua SZ, Gottlieb PA, Heo J, Sachs F. A mechanosensitive ion channel regulating cell volume. Am J Physiol Cell Physiol. 2010;298:C1424-C1430. [PubMed] [DOI] |
| 17. | Faucherre A, Kissa K, Nargeot J, Mangoni ME, Jopling C. Piezo1 plays a role in erythrocyte volume homeostasis. Haematologica. 2014;99:70-75. [PubMed] [DOI] |
| 18. | Peyronnet R, Martins JR, Duprat F, Demolombe S, Arhatte M, Jodar M, Tauc M, Duranton C, Paulais M, Teulon J. Piezo1-dependent stretch-activated channels are inhibited by Polycystin-2 in renal tubular epithelial cells. EMBO Rep. 2013;14:1143-1148. [PubMed] [DOI] |
| 19. | Miyamoto T, Mochizuki T, Nakagomi H, Kira S, Watanabe M, Takayama Y, Suzuki Y, Koizumi S, Takeda M, Tominaga M. Functional role for Piezo1 in stretch-evoked Ca2+ influx and ATP release in urothelial cell cultures. J Biol Chem. 2014;289:16565-16575. [PubMed] [DOI] |
| 20. | Li J, Hou B, Tumova S, Muraki K, Bruns A, Ludlow MJ, Sedo A, Hyman AJ, McKeown L, Young RS. Piezo1 integration of vascular architecture with physiological force. Nature. 2014;515:279-282. [PubMed] [DOI] |
| 21. | Ranade SS, Qiu Z, Woo SH, Hur SS, Murthy SE, Cahalan SM, Xu J, Mathur J, Bandell M, Coste B. Piezo1, a mechanically activated ion channel, is required for vascular development in mice. Proc Natl Acad Sci USA. 2014;111:10347-10352. [PubMed] [DOI] |
| 22. | Yang XN, Lu YP, Liu JJ, Huang JK, Liu YP, Xiao CX, Jazag A, Ren JL, Guleng B. Piezo1 is as a novel trefoil factor family 1 binding protein that promotes gastric cancer cell mobility in vitro. Dig Dis Sci. 2014;59:1428-1435. [PubMed] [DOI] |
| 23. | McHugh BJ, Murdoch A, Haslett C, Sethi T. Loss of the integrin-activating transmembrane protein Fam38A (Piezo1) promotes a switch to a reduced integrin-dependent mode of cell migration. PLoS One. 2012;7:e40346. [PubMed] [DOI] |
| 24. | McHugh BJ, Buttery R, Lad Y, Banks S, Haslett C, Sethi T. Integrin activation by Fam38A uses a novel mechanism of R-Ras targeting to the endoplasmic reticulum. J Cell Sci. 2010;123:51-61. [PubMed] [DOI] |
| 26. | Törnblom H, Van Oudenhove L, Tack J, Simrén M. Interaction between preprandial and postprandial rectal sensory and motor abnormalities in IBS. Gut. 2014;63:1441-1449. [PubMed] [DOI] |
| 27. | Liu L, Liu BN, Chen S, Wang M, Liu Y, Zhang YL, Yao SK. Visceral and somatic hypersensitivity, autonomic cardiovascular dysfunction and low-grade inflammation in a subset of irritable bowel syndrome patients. J Zhejiang Univ Sci B. 2014;15:907-914. [PubMed] [DOI] |
| 28. | Lowén MB, Mayer E, Tillisch K, Labus J, Naliboff B, Lundberg P, Thorell LH, Ström M, Engström M, Walter S. Deficient habituation to repeated rectal distensions in irritable bowel syndrome patients with visceral hypersensitivity. Neurogastroenterol Motil. 2015;27:646-655. [PubMed] [DOI] |
| 30. | Ibeakanma C, Ochoa-Cortes F, Miranda-Morales M, McDonald T, Spreadbury I, Cenac N, Cattaruzza F, Hurlbut D, Vanner S, Bunnett N. Brain-gut interactions increase peripheral nociceptive signaling in mice with postinfectious irritable bowel syndrome. Gastroenterology. 2011;141:2098-2108.e5. [PubMed] [DOI] |