修回日期: 2015-09-18
接受日期: 2015-09-25
在线出版日期: 2015-10-28
目的: 分析金雀异黄酮作用肝纤维化大鼠后, 肝组织中蛋白质的差异表达, 以探讨药物作用的关键蛋白.
方法: 将SD大鼠分为对照组、模型组和金雀异黄酮组, 除对照组外, 其余各组灌胃50% CCl4溶液连续15 wk, 于第9周开始以金雀异黄酮组进行给药治疗, 连续6 wk之后, 取大鼠肝组织, 提取蛋白质, 以同位素标记相对和绝对定量(isobaric tags for relative and absolute quantitation, iTRAQ)技术标记蛋白, 经质谱定量、鉴定蛋白质, 采用生物信息学分析蛋白质的功能; 以Western blot对有代表性的药物作用关键蛋白细胞色素C 4A2(Cyp4 A2)和载脂蛋白A1(apolipoprotein A-1, Apoa1)进行验证.
结果: 质谱共鉴定到585种蛋白质, 其中差异蛋白为63个, 含上调蛋白32个, 下调蛋白31个. 对这些差异表达蛋白进行功能分析, 发现参与信号传导、分子催化、分子绑定等过程, 差异表达蛋白之间存在紧密的相互作用. Western blot验证显示, 与模型组相比, 蛋白质相互作用的关键节点蛋白Cyp4 A2的表达明显降低, 而Apoa1的表达明显增加.
结论: 金雀异黄酮能通过调节肝组织中的多种蛋白质表达从而达到抗肝纤维化的效果, 其中对Cyp4 A2、Apoa1、膜联蛋白A2、二氢嘧啶脱氢酶等蛋白的调节可能是其抗肝纤维化作用的关键.
核心提示: 本研究以CCl4大鼠肝纤维化模型作为研究对象, 采用iTRAQ结合质谱分析的方法, 研究金雀异黄酮作用大鼠后肝组织中蛋白质的表达变化, 并采用Western blot验证药物作用的关键蛋白, 进一步从蛋白质组学水平揭示金雀异黄酮抗肝纤维化作用的关键蛋白及机制.
引文著录: 霍亚妮, 张学荣, 廖明. Cyp4 A2, Apoa1, ANXA2及DPYD为金雀异黄酮抗肝纤维化大鼠的关键蛋白. 世界华人消化杂志 2015; 23(30): 4808-4815
Revised: September 18, 2015
Accepted: September 25, 2015
Published online: October 28, 2015
AIM: To investigate the molecular mechanism of genistein in therapy of CCl4-induced liver fibrosis in rats by utilizing isobaric tags for relative and absolute quantitation (iTRAQ) coupled with liquid chromatography and electrospray ionization tandem mass spectrometry (LC-ESI-MS/MS).
METHODS: SD rats were randomly divided into a control group, a model group and a genistein therapy group. The rats of the model group and genistein therapy group were given intragastric administration of 50% CCl4 for 15 wk to induce liver fibrosis. Genistein therapy was started at the 9th week and lasted for 6 wk. Proteins differentially expressed in the tissue were identified by iTRAQ coupled with LC-ESI-MS/MS technology and analyzed with bioinformatics tools. The expression of representative differentia1 protein (Cyp4 A2 and A1) was validated by Western blot.
RESULTS: A total of 585 proteins were identified by MS, of which 63 were differentially expressed, including 32 up-regulated and 31 down-regulated ones. The differentially expressed proteins are involved in post-translational modification, transcription, recombination and signal transduction pathways. The tissue level of Cyp4 A2 decreased significantly in genistein therapy group compared with the model group, but Apoa1 showed a reverse trend.
CONCLUSION: Genistein can impact rat tissue protein expression. The antifibrotic effects of genistein may be due to regulation of protein expression.
- Citation: Huo YN, Zhang XR, Liao M. Cyp4 A2, Apoa1, ANXA2 and DPYD are involved in anti-fibrotic effects of genistein in rats. Shijie Huaren Xiaohua Zazhi 2015; 23(30): 4808-4815
- URL: https://www.wjgnet.com/1009-3079/full/v23/i30/4808.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i30.4808
金雀异黄酮为天然产物大豆的提取物, 有许多研究[1-5]发现其对肝癌、乳腺癌、鼻咽癌等多种肿瘤细胞具有较为好的抑制作用. 同位素相对和绝对定量(isobaric tags for relative and absolute quantitation, iTRAQ)标记联合质谱分析的蛋白质组学定量技术, 可同时定量和鉴定成百上千蛋白质, 是研究药物作用的关键蛋白及发现蛋白标志物的强有力工具[6,7]. 我们前期的研究显示金雀异黄酮具有明显的减轻大鼠的肝纤维化程度[8,9], 并采用iTRAQ标记结合液相-质谱联用技术分析了金雀异黄酮作用大鼠肝星状细胞后的差异表达蛋白[10]. 本研究以CCl4大鼠肝纤维化模型作为研究对象, 采用iTRAQ结合质谱分析的方法, 研究金雀异黄酮作用大鼠后肝组织中蛋白质的表达变化, 并采用Western blot验证药物作用的关键蛋白, 进一步从蛋白质组学水平揭示金雀异黄酮抗肝纤维化作用的关键蛋白及机制.
健康SD♂大鼠, 体质量220 g±30 g, 由广西医科大学实验动物中心提供, 合格证号: SCXK(桂)2014-0003; 金雀异黄酮购自Sigma公司; DMEM购自GIBICO公司; 蛋白提取及电泳分析所用的试剂RIPA裂解液、丙酮、过硫酸铵、TEMED、SDS、考马斯亮蓝等购自Thermo公司; iTRAQ Reagents-4plex Chemistry试剂盒、TEAB等主要质谱试剂购自美国Applied Biosystems公司. 电泳仪(美国BIO-RAD), 质谱仪(美国Applied Biosystems公司的5600型号).
1.2.1 动物处理: SD健康大鼠(60只)随机分为正常对照组、模型组和金雀异黄酮组, 每组20只. 除模型组和金雀异黄酮组大鼠于首次在背部皮下注射纯CCl4(5 mL/kg), 以后皮下注射40% CCl4溶液(2 mL/kg), 2次/wk, 共15 wk, 对照组普通饲养. 自注射CCl4之后的第9周, 金雀异黄酮组开始灌胃给金雀异黄酮(10 mg/kg, 1次/d), 至15 wk末处死大鼠留肝组织[8].
1.2.2 肝组织总蛋白的提取: 肝组织蛋白的提取方法详见文献[8]. 具体为: 对金雀异黄酮组和模型组大鼠的1 g肝组织进行剪碎, 转入玻璃匀浆管中加蛋白裂解液10 mL研磨均匀, 后30 s超声破碎; 接着在4 ℃以20000 g转速离心30 min,
取5 mL上清液与-20 ℃预冷丙酮以1:5混合均匀, 置于-20 ℃冰箱2 h, 以5000 g转速于4 ℃离心5 min; 弃上清液, 沉淀用iTRAQ试剂盒中自带的溶解液dissolution buffer(40 μL)和1%SDS(2 μL)充分混悬溶解, 然后在4 ℃ 25000 g转速离心20 min, 取上清液, 以Bradford方法对蛋白质含量进行测定, 以SDS-PAGE电泳分析提取到的蛋白质的质量.
1.2.3 蛋白质酶解和iTRAQ标记: 取以上肝组织蛋白100 μg, 置于EP管中, 加入还原剂2 μL, 混匀, 60 ℃反应1 h; 加入1 μL半胱氨酸封闭试剂, 室温下放置10 min. 分2次按蛋白:酶 = 20:1的比例加入Trypsin, 首次加入时酶解4 h(37 ℃), 再次加入酶解12 h(37 ℃). 然后对酶解产物进行真空冷冻干燥, 接着0.5 mol/L TEAB复溶酶解产物. 依照iTRAQ标记试剂盒程序进行肽段标记, 113标记模型组, 114标记用金雀异黄酮组, 置室温下2 h. 最后采用SymmetryC18柱对标记后的样品进行脱盐处理, 真空冷冻干燥, 4 ℃备用. 以上方法参考文献[10-13].
1.2.4 蛋白的液相分离: 将以上的2组标记肽段进行混合, 用200 μL缓冲液A液复溶, 然后进行液相分离. 液相分离条件: 第一维强阳离子柱分离: 缓冲液A液含10 mmol/L KH2PO4和25% ACN, pH 3; 缓冲液B液含10 mmol/L KH2PO4、500 mmol/L KCl和25%ACN, pH 3. 进行2次梯度洗脱, 每次进样100 μL, 214 nm/280 nm紫外检测波长, 200 μL/min流速. 线性梯度洗脱程序: 15-65 min, 0%-80%缓冲液B; 65-70 min, 80%-100%缓冲液B. 依据洗脱时间和峰形, 最终得到20个馏分, 用Symmetry C18柱对各馏分进行脱盐处理, 真空冷冻干燥备用. 以上方法参考文献[10-13].
1.2.5 蛋白质的质谱分析: 多肽的分析采用反相液-质联分析. 具体分析条件: 流动相A(甲酸:乙腈:水 = 0.1:2:98)流动相B(甲酸:乙腈:水 = 0.1:98:2), 进样量8.8 μL, 液相线性梯度洗脱程序为: 0-10 min, 进样; 10-12 min, 5%缓冲液B; 12-16 min, 5%-13%缓冲液B; 16-71 min, 13%-30%缓冲液B; 71-85 min, 30%-40%缓冲液B; 85-90 min, 40%-80%缓冲液B; 90-95 min, 80%缓冲液B; 5 min恢复柱料, 运行时间100 min. 质谱分析的技术参数: 一级质谱(MS)激光激发1250次, 在阳离子模式下用反射模式进行检测, 随后选择信噪比>50的母离子做二级质谱(MS/MS)分析, 每个样品点上最多选择25个母离子. 二级MS/MS激光激发2500次, 碰撞能量为2 kV, CID碰撞小室内的氮气压力维持在2.0×10-4 Pa, 以上方法参考文献[10-13].
1.2.6 蛋白质鉴定和定量: 质谱分析数据采用ProteinPilot3.0在Uniprot数据库中进行检索鉴定蛋白, 报告置信度在95%以上的蛋白质同时用m/z 113和114报告离子的峰面积积分进行相对定量分析, 以m/z 113为对照, 选择P<0.05的结果进行报告. 对有1个以上高置信度(不低于99%)唯一多肽匹配的蛋白不再进行人工确认, 对不含高置信度(不低于99%)唯一多肽匹配的蛋白, 用手工方法对MS/MS图谱碎片离子进行检查确认. 当差异倍数达到1.2倍以上或低于0.7倍, 且经统计检验其P<0.05时, 视为差异表达蛋白质.
1.2.7 生物信息学分析: iTRAQ鉴定分析到的肝组织差异表达蛋白的生物信息学分析: 采用GO分析数据库(http://www.geneontology.org/), 从分别从分子功能(molecularfunction, MF)、细胞成分(cellular component, CC)和生物学进程(biological process, BP)这3方面进行GO分析. 采用STRING10.0数据库构建肝组织差异表达蛋白相互作用网络图.
1.2.8 细胞色素C 4A2(Cyp4 A2)和载脂蛋白的Western blot验证: 取15 μg蛋白样品进行12%的SDS-PAGE蛋白电泳. 电泳条件: 80 V, 电泳20 min; 120 V, 电泳1 h. 电泳完毕后, 打开玻璃板, 按照预染标准的蛋白分子量Marker切取目的蛋白所在的胶条. 100 V冰内PVDF膜电转移1 h. 转膜完毕后, 5%的脱脂奶粉于37 ℃封闭1.5 h. 在封闭过的膜中加入一抗4 ℃过夜, 用TBST洗膜3次, 每次5 min. 洗膜后, 加入1:7000二抗荧光羊抗兔IgG, 37 ℃孵育1 h. TBST洗膜4次, 每次5 min后扫膜, 其中GAPDH为内参[14].
统计学处理 实验数据的结果用mean±SD进行表示, 组间比较采用单因素方差分析, 数据处理使用SPSS16软件, 以P<0.05时差异有统计学意义.
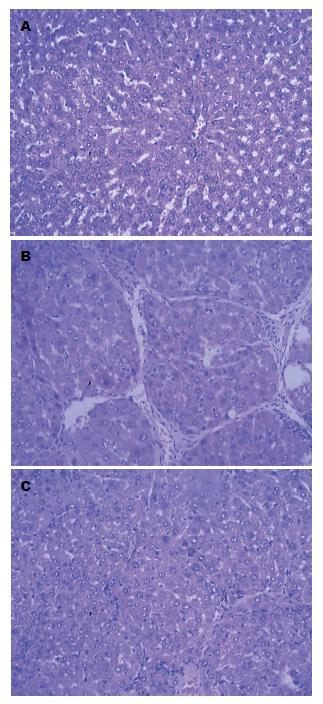
金雀异黄酮作用肝纤维化大鼠后, 采用HE染色观察肝组织病理变化, 正常组的肝脏小叶的结构整齐, 中央静脉及静脉窦状隙正常, 肝细胞排列整齐, 未见变性或硬化; 模型组的大鼠肝细胞现中度或高浊性肿大, 可见椭圆或圆形的大小不等的肝细胞结节构成的假小叶, 结节周围纤维组织增生、沉积. 金雀异黄酮治疗组大鼠的肝组织纤维程度有不同程度减轻, 肝小叶结构基本完整, 少量肝细胞轻度肿浊, 汇管区少量增生纤维组织且间隔变窄, 极少炎脂肪空泡(图1).
金雀异黄酮和模型组的肝组织蛋白经iTRAQ标记及质谱分析, 共鉴定到585种蛋白. 设定蛋白丰度差异达到>1.2倍(上调)或<0.7倍(下调), 且经统计检验其P<0.05的为差异蛋白, 与模型组相比, 金雀异黄酮组鉴定到的差异表达的蛋白质为63个, 含上调蛋白32个, 下调蛋白31个(表1).
| 序号 | 蛋白收录号 | 基因名称 | 蛋白质名称 | 114:113 |
| 1 | P04906 | GSTP1 | Glutathione S-transferase P | 2.331 |
| 2 | G3V786 | G3V786 | Protein Akr1b8 | 1.722 |
| 3 | Q5RJK5 | Q5RJK5 | Chromobox homolog 3 | 2.549 |
| 4 | Q5XFV4 | Q5XFV4 | Fabp4 protein | 1.852 |
| 5 | Q6B345 | S100a11 | Protein S100-A11 | 2.086 |
| 6 | P14480 | Fgb | Fibrinogen beta chain | 2.508 |
| 7 | D3ZY96 | D3ZY96 | Neutrophilic granule protein | 2.771 |
| 8 | P01048 | Map1 | T-kininogen 1 | 1.668 |
| 9 | P50116 | S100A9 | Protein S100-A9 | 1.254 |
| 10 | P02680 | Fgg | Fibrinogen gamma chain | 2.065 |
| 11 | Q63279 | Krt19 | Keratin, type I cytoskeletal 19 | 3.043 |
| 12 | D3ZC07 | D3ZC07 | Protein Pkn3 | 3.682 |
| 13 | M0R4B8 | M0R4B8 | Pyruvate kinase | 3.612 |
| 14 | Q05BA4 | Q05BA4 | Myadm protein | 1.538 |
| 15 | Q6PDW1 | Q6PDW1 | 40S ribosomal protein S12 | 1.508 |
| 16 | M0R9G2 | M0R9G2 | Protein L | 3.203 |
| 17 | P31977 | EZR | Ezrin | 3.015 |
| 18 | A0JPN2 | Slc39a4 | Zinc transporter ZIP4 | 2.079 |
| 19 | 6UPE1 | Etfdh | Electron transfer flavoprotein-ubiquinone | 2.968 |
| 20 | M0R9D5 | M0R9D5 | Protein Ahnak | 2.959 |
| 21 | D3ZQN7 | D3ZQN7 | Protein Lamb1 | 2.892 |
| 22 | B0BNA5 | COTL1 | Coactosin-like protein | 2.824 |
| 23 | P04639 | APOA1 | Apolipoprotein A-I | 2.689 |
| 24 | P68255 | Ywhaq | 14-3-3 protein theta | 1.672 |
| 25 | G3V6H9 | G3V6H9 | Nucleosome assembly protein 1-like 1 | 1.667 |
| 26 | Q9Z144 | Lgals2 | Galectin-2 | 2.651 |
| 27 | G3V9M6 | G3V9M6 | Fibrillin 1, isoform | 1.633 |
| 28 | P62890 | RPL30 | 60S ribosomal protein L30 | 2.625 |
| 29 | Q5U216 | DDX39A | ATP-dependent RNA helicase | 3.558 |
| 30 | Q5U2T9 | Q5U2T9 | FK506 binding protein 5 | 2.554 |
| 31 | Q56B11 | PELP1 | Proline, glutamic acid and leucine-rich protein 1 | 2.535 |
| 32 | G3V6C2 | G3V6C2 | Protein Hgd | 0.364 |
| 33 | Q5BK21 | Q5BK21 | Protein Tm7sf2 | 0.664 |
| 34 | P33273 | Cyp2c24 | Cytochrome P450 2C24 | 0.263 |
| 35 | A0A096MKG | Mnadk | NAD kinase 2, mitochondrial | 0.462 |
| 36 | Q5HZY2 | SAR1B | GTP-binding protein | 0.462 |
| 37 | P07150 | ANXA1 | Annexin A1 | 0.462 |
| 38 | Q920D2 | Dhfr | Dihydrofolate reductase | 0.462 |
| 39 | P20817 | Cyp 4a2 | Cytochrome P450 4A2 | 0.262 |
| 40 | Q66HK8 | Q66HK8 | Cytochrome P450 4F1 | 0.662 |
| 41 | Q7TP52 | CMBL | Carboxymethylenebutenolidase homolog | 0.661 |
| 42 | P97519 | HMGCL | Hydroxymethylglutaryl-CoA lyase | 0.359 |
| 43 | F1LZJ4 | F1LZJ4 | Hydroxypyruvate isomerase | 0.559 |
| 44 | M0RC77 | M0RC77 | Kynurenine formamidase | 0.558 |
| 45 | F1M0Q9 | F1M0Q9 | Protein Pm20d1 (Fragment) | 0.457 |
| 46 | M0RBL9 | M0RBL9 | Protein Vwa8 (Fragment) | 0.557 |
| 47 | Q5RJR8 | Lrrc59 | Leucine-rich repeat-containing protein 59 | 0.657 |
| 48 | P05544 | Serpina3l | Serine protease inhibitor A3L | 0.256 |
| 49 | P97524 | Slc27a2 | Very long-chain acyl-CoA synthetase | 0.156 |
| 50 | B0BNE5 | Esd | S-formylglutathione hydrolase | 0.155 |
| 51 | P41562 | Idh1 | Isocitrate dehydrogenase [NADP] cytoplasmic | 0.355 |
| 52 | M0R5Y9 | M0R5Y9 | Protein Zbtb8os | 0.354 |
| 53 | D4A5G8 | D4A5G8 | Pyruvate dehydrogenase E1 | 0.554 |
| 54 | D4AB01 | D4AB01 | Histidine triad nucleotide binding protein 2 | 0.453 |
| 55 | Q66HG4 | GALM | Aldose 1-epimerase | 0.453 |
| 56 | Q07936 | ANXA2 | Annexin A2 | 0.653 |
| 57 | D3ZTP0 | D3ZTP0 | Protein Aldh1l2 | 0.653 |
| 58 | D3ZF07 | D3ZF07 | Protein RGD1562402 | 0.452 |
| 59 | O89000 | DPYD | Dihydropyrimidine dehydrogenase [NADP(+)] | 0.652 |
| 60 | Q06884 | Q06884 | Cytochrome P450 3A1 | 0.552 |
| 61 | B5DFH4 | B5DFH4 | Papss2 protein | 0.252 |
| 62 | Q7TPA1 | Q7TPA1 | Ab1-114 | 0.251 |
| 63 | Q5BJZ3 | Q5BJZ3 | Nicotinamide nucleotide transhydrogenase | 0.151 |
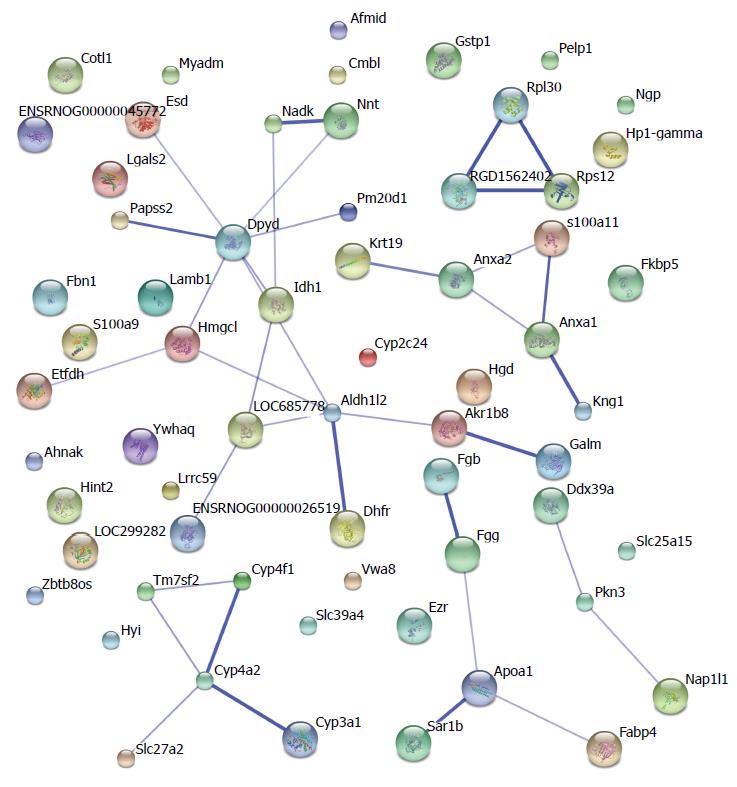
采用DAVID富集的GO分析对63个差异表达的蛋白进行功能分析, 发现这些蛋白参与的占比例较高的前3类细胞成分所占比例较高的前3类分别是胞外区(29.2%), 细胞内部分25%和细胞器Organelle 20.8%; 生物学进程(BP)是蛋白代谢进程(35.4%)、细胞生理过程(21.2%)和发育过程(7.1%); 分子功能所占比例较高的前3类分别是催化活性(41.2%)、分子绑定(26.5%)和结构分子活性(11.8%). STRING分析表明, 63个差异表达蛋白之间存在紧密的相互作用, 载脂蛋白A1(apolipoprotein A-1, Apoa1)、蛋白Cyp4 A2, 二氢嘧啶脱氢酶(dihydropyrimidine dehydrogenase, DPYD)、膜联蛋白A2(annexin A2 ANXA2)为相互作用关键节点蛋白(图2).
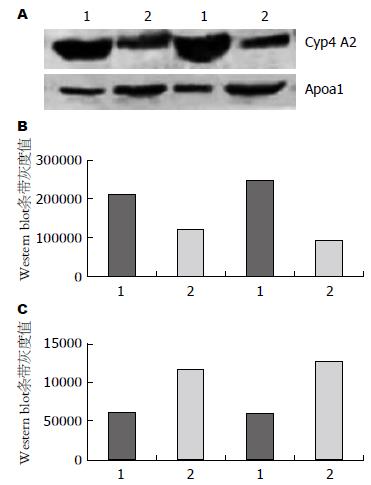
与模型组相比, 在金雀异黄酮组大鼠的肝组织中Cyp4 A2的表达明显降低, 而Apoa1的表达明显增加, 肝组织表达水平与iTRAQ检测结果一致(图3).
大豆类和大豆类植物性雌激素对人体健康的作用正在受到广泛关注[15]. 金雀异黄酮为豆科植物金雀花中天然存在的异黄酮类物质, 以通过天然存在的食物被人体摄入体内, 从而发挥其抗肿瘤效应, 其机制可能是通过对细胞周期、细胞凋亡、血管形成等的影响而发生效应[16]. 在前期的研究中, 项目组发现金雀异黄酮能明显抑制肝星状细胞的增殖, 调控细胞中Ⅰ型胶原等多个肝纤维化因子, 并对CCl4诱导的肝纤维化大鼠的肝脏起保护作用[8,9]. 为分析金雀异黄酮的抗肝纤维化机制, 课题组还研究了金雀异黄酮作用大鼠肝星状细胞后蛋白质的表达变化, 明确了一些参与金雀异黄酮抗肝纤维化过程的关键蛋白[10].
为进一步的深入探讨金雀异黄酮的抗肝纤维化的机制, 本研究以CCl4诱导的肝纤维化大鼠为模型, 采用iTRAQ技术结合质谱技术分析金雀异黄酮作用肝纤维化大鼠后, 肝组织蛋白质的表达变化. 经功能分析发现Apoa1、蛋白Cyp4 A2、ANXA2、DPYD在蛋白质的相互作用网络中处于功能网络交叉点, 这些蛋白可能在肝纤维化发生发展和药物抗肝纤维化作用过程中扮演重要角色, 并可能直接参与了金雀异黄酮的抗大鼠肝纤维化的过程.
Apoa1是肝脏合成用于转运胆固醇的一种蛋白. 肝纤维化时, Apoa1自肝脏细胞的释放受到细胞外基质中的胶原纤维阻碍, 且转录也减少, 被认为是诊断肝纤维化程度的指标之一[17], 通常在肝纤维化时表达显著降低[18]. 肝纤维化大鼠在金雀异黄酮治疗后, Apoa1的表达升高, 可能金雀异黄酮治疗后, 随着大鼠肝脏的纤维化程度减轻, Apoa1的表达恢复.
细胞色素P450酶是混合功能氧化酶系, 多表达于肝脏, 人体内约有75%的药物通过细胞色素P450代谢, 药物在体内的许多代谢动力学特征、不良反应等均与细胞色素P450有关. 研究[19]表明, 细胞色素P450酶系在人类肝脏中与药物代谢密切相关的主要有Cyp4 A2、Cyp4 A1等几种亚族, Cyp4 A2等酶家族往往在肝脏受到化学损伤代谢过程中高表达, 最近Yang等[19]在研究大鼠四氯化碳肝损伤中, 发现Cyp4 A2在肝脏组织中高表达, 但在水芹提取物治疗后, 肝损伤获得修复, Cyp4 A2蛋白的表达恢复到正常水平. 肝纤维化大鼠在金雀异黄酮治疗后, 与模型组相比, Cyp4 A2的表达明显下降, 有可能金雀异黄酮通过影响细胞色素P450酶系家族的表达, 达到抗肝纤维化的目的.
抗癌药物5-氟尿嘧啶(5-fluorouracil, 5-Fu)主要通过抑制胸苷酸合成酶发挥抗癌作用, 而二氢嘧啶脱氢酶主要在肝细胞合成, 是5-Fu体内代谢的一个起始酶和限速酶[20,21], 有研究发现3-ω多不饱和脂肪酸可能降低裸小鼠肝脏的双氢嘧啶脱氢酶(dihydropyrimidine dehydrogenase, DPD), 降低DPD的活性能提高肿瘤细胞对5-Fu的敏感性[22,23]. 在金雀异黄酮作用肝纤维化的大鼠后, DPD的表达降低, 是否金雀异黄酮影响肝纤维化类似5-Fu的抗癌作用, 通过降低DPD的活性, 提高抗肝纤维化作用, 这有待进一步的研究.
ANXA2是一种钙离子介导的磷脂结合特性的蛋白质, 属于膜联蛋白家族成员, 广泛分布于胞核、胞浆及细胞质膜外表面. ANXA2在细胞内参与膜形成、膜转运、胞吞、胞吐、细胞增殖、信号转导、分化及凋亡等一系列重要的生命过程. 大量研究[24-29]发现, 该蛋白质与肝纤维化密切相关. 随着纤维化程度的发展其水平而增高, 且与肝组织损伤和肝纤维化活动呈正相关. 有研究[30]发现经过鳖甲软肝片治疗后, 该蛋白质表达量下调. 在金雀异黄酮作用肝纤维化的大鼠后, ANXA2表达下降, 预示该药物可能通过减少ANXA2的表达量而有效地逆转肝纤维化进程.
金雀异黄酮为天然产物大豆的提取物, 有许多报道发现其对肝癌、乳腺癌、鼻咽癌等多种肿瘤细胞具有较为好的抑制作用. 同位素相对和绝对定量(isobaric tags for relative and absolute quantitation, iTRAQ)标记联合质谱分析的蛋白质组学定量技术, 可同时定量和鉴定成百上千蛋白质, 是研究药物作用的关键蛋白及发现蛋白标志物的强有力工具. 本实验中用CCl4制备大鼠肝纤维化模型已是较成熟技术, 可利用此模型进行实验研究.
庄林, 主任医师, 昆明市第三人民医院肝病科
分析金雀异黄酮作用肝纤维化大鼠后, 肝组织中蛋白质的差异表达, 以探讨药物作用的关键蛋白.
最近Yang等在研究大鼠CCl4肝损伤中, 发现细胞色素C 4A2(Cyp4 A2)在肝脏组织中高表达, 但在水芹提取物治疗后, 肝损伤获得修复, Cyp4 A2蛋白的表达恢复到正常水平. 肝纤维化大鼠在金雀异黄酮治疗后, 与模型组相比, Cyp4 A2的表达明显下降, 有可能金雀异黄酮通过影响细胞色素P450酶系家族的表达, 达到抗肝纤维化的目的.
本文通过动物模型观察金雀异黄酮作用肝纤维化大鼠后, 肝组织中蛋白质的差异表达, 以探讨药物作用的关键蛋白及发现蛋白标志物.
金雀异黄酮能通过调节肝组织中的多种蛋白质表达从而达到抗肝纤维化的效果, 其中对Cyp4 A2、载脂蛋白A1、膜联蛋白A2、二氢嘧啶脱氢酶等蛋白的调节可能是其抗肝纤维化作用的关键.
iTRAQ技术: 利用多种胺活性试剂对蛋白质水解的肽段进行标记, 再结合串联质谱对肽段进行标记精确的鉴别和定量.
本研究的科学性、创新性和可读性能较好地反映我国或国际胃肠病学临床和基础研究的先进水平. 该研究重要, 提供了有意义的信息, 内容较新颖. (1)肝纤维化是各种肝病共同的病理基础, 找到有效抗肝纤维化治疗的有效药物, 是有效控制肝脏疾病进展的重要方法; (2)有研究显示金雀异黄酮有抗肝纤维的作用.
编辑: 于明茜 电编:闫晋利
| 1. | Li Y, Ahmed F, Ali S, Philip PA, Kucuk O, Sarkar FH. Inactivation of nuclear factor kappaB by soy isoflavone genistein contributes to increased apoptosis induced by chemotherapeutic agents in human cancer cells. Cancer Res. 2005;65:6934-6942. [PubMed] [DOI] |
| 2. | Mohammad RM, Banerjee S, Li Y, Aboukameel A, Kucuk O, Sarkar FH. Cisplatin-induced antitumor activity is potentiated by the soy isoflavone genistein in BxPC-3 pancreatic tumor xenografts. Cancer. 2006;106:1260-1268. [PubMed] [DOI] |
| 5. | 阿依恒•曲库尔汗, 阿孜古丽•吐尔逊, 卢晓梅, 刘立中. Genistein对人鼻咽癌细胞系CNE抑制增殖和促进凋亡的研究. 中华耳鼻咽喉头颈外科杂志. 2007;42:783-785. |
| 7. | Bouchal P, Roumeliotis T, Hrstka R, Nenutil R, Vojtesek B, Garbis SD. Biomarker discovery in low-grade breast cancer using isobaric stable isotope tags and two-dimensional liquid chromatography-tandem mass spectrometry (iTRAQ-2DLC-MS/MS) based quantitative proteomic analysis. J Proteome Res. 2009;8:362-373. [PubMed] [DOI] |
| 15. | Tanabe M, Ieiri I, Nagata N, Inoue K, Ito S, Kanamori Y, Takahashi M, Kurata Y, Kigawa J, Higuchi S. Expression of P-glycoprotein in human placenta: relation to genetic polymorphism of the multidrug resistance (MDR)-1 gene. J Pharmacol Exp Ther. 2001;297:1137-1143. [PubMed] |
| 16. | Banerjee S, Li Y, Wang Z, Sarkar FH. Multi-targeted therapy of cancer by genistein. Cancer Lett. 2008;269:226-242. [PubMed] [DOI] |
| 17. | Imbert-Bismut F, Ratziu V, Pieroni L, Charlotte F, Benhamou Y, Poynard T. Biochemical markers of liver fibrosis in patients with hepatitis C virus infection: a prospective study. Lancet. 2001;357:1069-1075. [PubMed] |
| 18. | Poynard T, Munteanu M, Ngo Y, Torres M, Benhamou Y, Thabut D, Ratziu V. Diagnostic value of FibroTest with normal serum aminotransferases. Hepatology. 2006;43:374-375; author reply 375-376. [PubMed] |
| 19. | Yang SA, Jung YS, Lee SJ, Park SC, Kim MJ, Lee EJ, Byun HJ, Jhee KH, Lee SP. Hepatoprotective effects of fermented field water-dropwort (Oenanthe javanica) extract and its major constituents. Food Chem Toxicol. 2014;67:154-160. [PubMed] [DOI] |
| 20. | Fakih MG, Groman A, McMahon J, Wilding G, Muindi JR. A randomized phase II study of two doses of vorinostat in combination with 5-FU/LV in patients with refractory colorectal cancer. Cancer Chemother Pharmacol. 2012;69:743-751. [PubMed] [DOI] |
| 21. | Li XL, Wang CZ, Sun S, Mehendale SR, Du W, He TC, Yuan CS. American ginseng berry enhances chemopreventive effect of 5-FU on human colorectal cancer cells. Oncol Rep. 2009;22:943-952. [PubMed] |
| 22. | 吴 月琴, 白 文启, 李 灵敏, 郗 彦凤. 结直肠癌中5-氟尿嘧啶代谢酶的表达及临床意义. 临床与实验病理学杂志. 2015;31:619-623. |
| 24. | Seth D, Hogg PJ, Gorrell MD, McCaughan GW, Haber PS. Direct effects of alcohol on hepatic fibrinolytic balance: implications for alcoholic liver disease. J Hepatol. 2008;48:614-627. [PubMed] [DOI] |
| 25. | Abou-Agag LH, Tabengwa EM, Tresnak JA, Wheeler CG, Taylor KB, Booyse FM. Ethanol-induced increased surface-localized fibrinolytic activity in cultured human endothelial cells: kinetic analysis. Alcohol Clin Exp Res. 2001;25:351-361. [PubMed] |
| 26. | Tabengwa EM, Abou-Agag LH, Benza RL, Torres JA, Aikens ML, Booyse FM. Ethanol-induced up-regulation of candidate plasminogen receptor annexin II in cultured human endothelial cells. Alcohol Clin Exp Res. 2000;24:754-761. [PubMed] |
| 27. | Falcone DJ, Borth W, Khan KM, Hajjar KA. Plasminogen-mediated matrix invasion and degradation by macrophages is dependent on surface expression of annexin II. Blood. 2001;97:777-784. [PubMed] |
| 28. | Pluskota E, Soloviev DA, Bdeir K, Cines DB, Plow EF. Integrin alphaMbeta2 orchestrates and accelerates plasminogen activation and fibrinolysis by neutrophils. J Biol Chem. 2004;279:18063-18072. [PubMed] |
| 29. | Ling Q, Jacovina AT, Deora A, Febbraio M, Simantov R, Silverstein RL, Hempstead B, Mark WH, Hajjar KA. Annexin II regulates fibrin homeostasis and neoangiogenesis in vivo. J Clin Invest. 2004;113:38-48. [PubMed] |