修回日期: 2014-12-11
接受日期: 2014-12-18
在线出版日期: 2015-01-28
目的: 探讨一线应用奥沙利铂、氟尿嘧啶联合亚叶酸钙(FOLFOX)方案的晚期结直肠癌患者化疗引起的骨髓抑制(chemotherapy induced hematological toxicity, CIH)与预后的关系.
方法: 回顾性分析158例患者, 根据CTCAE 4.0标准将患者化疗引起的中性粒细胞减少(chemotherapy induced-neutropenia, CIN)分为: G0、G1、G2、G3-4组; 血小板减少分为: T0、T1组; 将血红蛋白(hemoglobin, Hb)减少分为贫血组(A1)和非贫血组(A0), 分析中性粒细胞减少、血小板减少以及贫血与预后的关系.
结果: CIN、血小板减少以及贫血是影响无进展生存期(progression-free survival, PFS)的独立预后因子. G1、G2、G3-4组较G0组进展风险降低27%、36%、29%( HR = 0.73, 95%CI: 0.286-0.891, (P = 0.018; HR = 0.64, 95%CI: 0.56-0.88, (P = 0.03; HR = 0.71, 95%CI: 0.44-0.85, P<0.003); 血小板减少患者较未出现血小板减少患者进展风险降低26%( HR = 0.74, 95%CI: 0.68-0.753, (P = 0.015); 非贫血患者较贫血患者进展风险降低18%(HR = 0.823, 95%CI: 0.609-0.921, (P = 0.03).
结论: 化疗过程中出现CIN、血小板降低与较好的预后相关. 监测并根据骨髓抑制程度及时调整化疗药物剂量, 纠正贫血将有助于改善预后.
核心提示: 在一线应用奥沙利铂、氟尿嘧啶联合亚叶酸钙(FOLFOX)方案化疗的晚期结直肠癌患者中, 出现中性粒细胞减少和血小板减少者无进展生存期(progression-free survival)有显著改善, 其中G2组获益更明显. 未出现化疗引起的骨髓抑制(chemotherapy induced hematological toxicity, CIH)者化疗药物可能未达到最佳有效剂量, 监测并根据CIH程度及时调整化疗剂量, 使化疗引起的中性粒细胞减少(chemotherapy induced-neutropenia)在早期达G2级或许有助于提高化疗疗效及改善预后, 积极纠正贫血与较好的预后亦相关.
引文著录: 陈杨, 王艳荣, 石燕, 韩全利, 陈丽, 吴志勇, 王浩, 戴广海. 晚期结直肠癌患者一线FOLFOX化疗引起的骨髓抑制与预后的关系. 世界华人消化杂志 2015; 23(3): 502-509
Revised: December 11, 2014
Accepted: December 18, 2014
Published online: January 28, 2015
AIM: To assess whether chemotherapy induced hematological toxicity is a marker of increased progression-free survival (PFS) in patients with advanced colorectal cancer receiving first-line FOLFOX chemotherapy.
METHODS: A retrospective analysis was performed of clinical data for 158 advanced colorectal cancer patients treated at Chinese PLA General Hospital. Patient and tumor characteristics and hematological toxicity (neutropenia, anemia, and thrombocytopenia) were recorded. The relationship between hematological toxicity and prognosis was analyzed.
RESULTS: Univariate analysis showed that compared with G0 neutropenia, G1/G2/G3-4 neutropenia reduced the risk of disease progression by 27%, 36%, and 29% (HR = 0.73, 95%CI: 0.286-0.891, (P = 0.018; HR = 0.64, 95%CI: 0.56-0.88, (P = 0.03; HR = 0.71, 95%CI: 0.44-0.85, P < 0.003), respectively. Thrombocytopenia reduced the risk of progression by 26% (HR = 0.74, 95%CI: 0.68-0.753, (P = 0.015). In contrast, anemia during chemotherapy was significantly associated with poorer PFS (HR = 0.823, 95%CI: 0.609-0.921, (P = 0.03).
CONCLUSION: These data suggest that occurrence of neutropenia or thrombocytopenia is associated with a better prognosis. Monitoring of neutropenia during chemotherapy and corresponding drug adjustment may contribute to favorable PFS.
- Citation: Chen Y, Wang YR, Shi Y, Han QL, Chen L, Wu ZY, Wang H, Dai GH. Relationship between chemotherapy induced hematological toxicity and prognosis in advanced colorectal cancer patients undergoing first-line FOLFOX chemotherapy. Shijie Huaren Xiaohua Zazhi 2015; 23(3): 502-509
- URL: https://www.wjgnet.com/1009-3079/full/v23/i3/502.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i3.502
结直肠癌发病率居全球第3位, 其死亡率呈逐年上升趋势[1]. 国内患者大部分确诊时已属晚期, 以化疗为主的综合治疗占重要地位. 化疗过程中出现的骨髓抑制, 在早期以中性粒细胞减少、血小板减少常见, 亦是多种化疗药物主要剂量限制性毒性; 在晚期常常出现贫血, 与失血、造血物质吸收障碍等相关. 贫血患者相对正常患者化疗有效率较低, 可能与贫血导致肿瘤微环境的改变, 从而引起放化疗抵抗以及延误了标准化疗有关[2]. 研究证实在多种实体肿瘤(如肺癌、乳腺癌、卵巢癌等)化疗引起的中性粒细胞减少(chemotherapy induced-neutropenia, CIN)、血小板减少往往预示着较好的预后[3-5]; 而贫血往往与较差的预后相关[6], 在结直肠癌中此类研究较少, 因此本研究拟探讨结直肠癌化疗引起的骨髓抑制(chemotherapy induced hematological toxicity, CIH)与预后的关系, 以期调整化疗药物剂量, 为临床提供指导.
选取2012-06/2013-08中国人民解放军总医院肿瘤科住院晚期结直肠癌患者158例作为研究对象. 所有病例经病理学诊断为结直肠癌, 按照TNM标准分期. 纳入标准: (1)具有客观病灶作为评价指标; (2)均为Ⅳ患者, 无手术指征; (3)年龄 ≤ 75岁; (4)治疗前卡氏体能状态(Karnofsky performance status, KPS)评分≥80分; (5)肝肾功能正常; (6)骨髓造血功能正常: 外周血白细胞总数>4×109/L, 粒细胞总数>2×109/L, 血小板计数>100×109/L, 血红蛋白(hemoglobin, Hb)>65 g/L; (7)预计生存期>3 mo. 排除标准: (1)既往肿瘤病史; (2)既往接受过化疗和放疗; (3)骨髓转移. 患者治疗2年内随访1次/3 mo, 以后随访1次/6 mo, 全组患者随访至2014-06-20建立完整的随访档案. 本组资料的随访率为96%.
1.2.1 治疗: 患者接受奥沙利铂、氟尿嘧啶(fluorouracil, Fu)联合亚叶酸钙(FOLFOX)方案化疗: 奥沙利铂85 mg/m2, d1; 左亚叶酸钙135 mg/m2, d1; 5-Fu 400 mg/m2滴斗, 2400 mg/m2泵入46 h, 14 d为1个周期, 3个周期后通过影像学评价疗效, 通过血液学以及症状评价不良反应. 出现Ⅲ-Ⅳ度中性粒细胞减少时使用粒细胞集落刺激因子治疗, 不预防性使用.
1.2.2 骨髓抑制评价以及疗效评价: 每个化疗周期的前1天, 以及化疗后第7、14天检验血常规. 骨髓抑制包括: 白细胞减少(中性粒细胞减少)、血小板减少以及Hb降低. 根据CTCAE 4.0的标准, 中性粒细胞减少分为G1级: 1.5×109-2.0×109, G2级: 1.0×109-1.5×109, G3级: 0.5×109-1.0×109, G4级:<0.5×109. 由此将患者分为G0组、G1组、G2组、G3-4组(包括G3和G4级中性粒细胞降低). 根据血小板水平分为T0正常组(血小板计数: 100×109-300×109)和T1减少组(血小板计数<100×109). 根据Hb水平分为A0正常组(Hb>120 g/L)和A1贫血组(Hb<120 g/L).
1.2.3 临床观察及评价指标: 按照世界卫生组织(World Health Organization, WHO)实体肿瘤近期客观疗效评定标准(RECIST 1.0)分为完全缓解(complete respond, CR)、部分缓解(partial respond, PR)、稳定(stable disease, SD)和进展(progressive disease, PD). 以CR+PR计算客观有效率(objective response rate, ORR), 以CR+PR+SD计算疾病控制率(disease control rate, DCR). 患者无进展生存(progression-free survival, PFS)定义为从化疗开始至疾病进展或死亡的时间间隔.
统计学处理 所有数据采用SPSS19.0统计学软件. Kaplan-Meier生存分析描绘生存曲线, 相关性检验用χ2检验, 单因素生存分析采用Log-rank检验. 多因素生存分析采用Cox比例风险回归模型. P<0.05为差异有统计学意义.
共纳入158例晚期结直肠癌患者, 中位年龄59岁(27-72岁). 其中肝转移89例, 均无骨髓转移. 所有患者均接受至少3周期FOLFOX方案化疗, 中位治疗周期6周期(表1).
| n | 贫血 | 中性粒细胞减少 | 血小板减少 | |||||||||
| Yes | No | P值 | G0 | G1 | G2 | G3-4 | P值 | Yes | No | P值 | ||
| n | 158 | 75 | 83 | 34 | 56 | 30 | 38 | 49 | 109 | |||
| 性别 | 0.230 | 0.540 | 0.320 | |||||||||
| 男 | 98 | 46 | 52 | 22 | 35 | 19 | 22 | 29 | 69 | |||
| 女 | 60 | 29 | 31 | 12 | 21 | 11 | 16 | 20 | 40 | |||
| 年龄(岁) | 0.560 | 0.380 | 0.460 | |||||||||
| ≤ 59 | 95 | 45 | 50 | 21 | 37 | 18 | 19 | 28 | 67 | |||
| >59 | 63 | 30 | 33 | 13 | 19 | 12 | 19 | 21 | 42 | |||
| 体表面积(m2) | 0.190 | 0.210 | 0.310 | |||||||||
| ≤ 1.79 | 80 | 38 | 42 | 18 | 30 | 16 | 20 | 26 | 54 | |||
| >1.79 | 78 | 35 | 43 | 16 | 26 | 14 | 18 | 23 | 55 | |||
| KPS评分 | 0.029 | 0.037 | 0.052 | |||||||||
| 90 | 133 | 65 | 68 | 30 | 48 | 26 | 29 | 40 | 93 | |||
| 80 | 25 | 10 | 15 | 4 | 8 | 4 | 9 | 9 | 16 | |||
| 组织分级 | 0.260 | 0.310 | 0.350 | |||||||||
| 高中分化 | 70 | 33 | 37 | 16 | 27 | 14 | 13 | 22 | 48 | |||
| 低分化 | 88 | 42 | 46 | 18 | 29 | 16 | 25 | 27 | 61 | |||
| 肝转移 | 0.320 | 0.410 | 0.520 | |||||||||
| 有 | 87 | 42 | 45 | 19 | 31 | 17 | 20 | 26 | 61 | |||
| 无 | 71 | 33 | 38 | 15 | 25 | 13 | 18 | 23 | 48 | |||
CIN特点: 158例患者中G0、G1、G2、G3-4组患者人数分别为34例(21%), 56例(36%), 30例(19%), 38例(24%). χ2检验显示CIN与年龄、性别、有无肝转移、组织学分级无显著相关(P>0.05), 与KPS评分具有相关性((P = 0.034).
血小板减少特点: 158例患者中出现血小板减少49例(31%), χ2检验显示血小板减少与年龄、性别、KPS评分、有无肝转移、组织学分级无显著相关性(P>0.05).
贫血特点: 158例患者中贫血的有75例(47%), χ2检验显示贫血与年龄、性别、有无肝转移、组织学分级无显著相关性(P>0.05), 与KPS评分具有相关性((P = 0.042).
2.2.1 单因素分析: 单因素分析显示: 性别、年龄、体表面积、病理分级、有无肝转移不是PFS的显著影响因子, 而KPS评分、骨髓抑制程度、贫血、血小板减少等因素是PFS的显著影响因子(P<0.05)(表2).
| 临床特征 | n(%) | Median PFS(95%CI) | χ2值 | P值 |
| 性别 | 0.231 | 0.681 | ||
| 男 | 98(62) | 5.1(3.9-7.2) | ||
| 女 | 60(38) | 5.3(4.2-6.8) | ||
| 年龄(岁) | 0.069 | 0.792 | ||
| ≤ 55 | 95(60) | 4.8(3.8-6.3) | ||
| >55 | 63(40) | 5.6(4.6-6.9) | ||
| 体表面积(m2) | 1.327 | 0.239 | ||
| ≤ 1.79 | 80(51) | 5.9(2.1-8.6) | ||
| >1.79 | 78(49) | 4.3(3.4-6.6) | ||
| KPS评分 | 9.630 | 0.039 | ||
| 80 | 25(16) | 4.7(3.3-6.1) | ||
| 90 | 133(84) | 5.3(3.5-7.9) | ||
| 组织分化 | 0.396 | 0.539 | ||
| 高中分化 | 70(44) | 5.8(4.2-8.6) | ||
| 低分化 | 88(56) | 4.9(4.1-6.9) | ||
| 肝转移 | 2.160 | 0.050 | ||
| 有 | 87(55) | 5.1(4.5-7.7) | ||
| 无 | 71(45) | 5.5(4.8-7.8) | ||
| CIN | 25.700 | 0.000 | ||
| G0 | 34(21) | 3.6(2.4-4.6) | ||
| G1 | 56(35) | 5.2(3.9-6.8) | ||
| G2 | 30(19) | 8.5(5.3-9.6) | ||
| G3-4 | 38(25) | 6.1(5.1-7.7) | ||
| 贫血 | 18.900 | 0.012 | ||
| 无 | 83(53) | 6.5(3.6-8.8) | ||
| 有 | 75(47) | 4.9(3.9-8.1) | ||
| 血小板减少 | 16.300 | 0.023 | ||
| 无 | 109(69) | 4.8(2.9-6.0) | ||
| 有 | 49(31) | 6.8(3.9-9.6) |
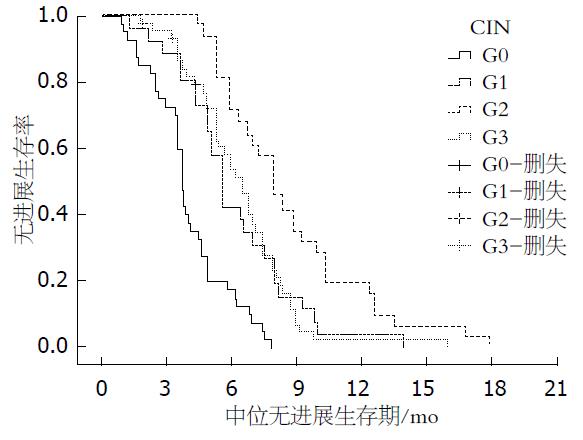
将不同CIN级别组内进行比较, 可见G1、G2、G3组的PFS与G0差异有统计学意义, G2、G3组均与G1差异有统计学意义, G2、G3组间PFS差异无统计学意义(表3).
| CIN | P值 |
| G0 vs G1 | 0.023 |
| G0 vs G2 | 0.008 |
| G0 vs G3 | 0.003 |
| G1 vs G2 | 0.016 |
| G1 vs G3 | 0.011 |
| G2 vs G3 | 0.127 |
2.2.2 Cox多因素分析: 经Cox多因素分析, CIN降低级别、贫血、血小板减少是PFS的独立影响因素. G1、G2、G3-4组较G0组进展风险降低27%、36%、29%(Hr = 0.73, 95%CI: 0.286-0.891, (P = 0.018; Hr = 0.64, 95%CI: 0.56-0.88, (P = 0.03; Hr = 0.71, 95%CI: 0.44-0.85, P<0.003); 血小板减少患者较未出现血小板减少患者进展风险降低26%(Hr = 0.74, 95%CI: 0.680-0.753, (P = 0.015); 非贫血患者较贫血患者进展风险降低18%(Hr = 0.823, 95%CI: 0.609-0.921, (P = 0.03)(表4).
| Ward | P值 | HR | 95%CI | |
| KPS评分 | ||||
| 80 vs 90 | 5.1 | 0.056 | 0.457 | 0.131-0.865 |
| CIN | ||||
| G1 vs G0 | 4.8 | 0.029 | 0.711 | 0.562-0.981 |
| G2 vs G0 | 13.7 | 0.001 | 0.633 | 0.443-0.882 |
| G3 vs G0 | 16.9 | 0.003 | 0.713 | 0.440-0.850 |
| 贫血 | ||||
| 有vs无 | 15.3 | 0.032 | 0.823 | 0.609-0.921 |
| 血小板减少 | ||||
| 有vs无 | 4.9 | 0.014 | 0.692 | 0.490-0.980 |
截止至随访终点2014-06, 患者中位随访时间为14.2 mo, 整体中位无进展生存时间(median progression survival, mPFS)为6.6 mo, 中位总生存时间(median overall survival, mOS)未达到.
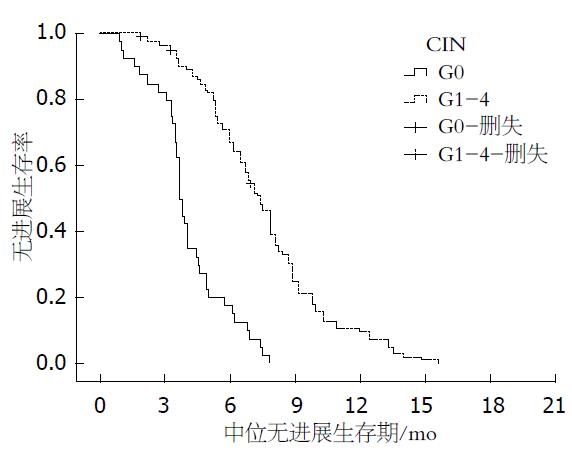
2.3.1 出现CIN患者和未出现CIN患者PFS对比: 158例患者中, 未出现CIN患者34例, 出现CIN者114例. 经Kaplan-Meier生存分析, 其中未出现CIN患者mPFS为3.6 mo对比出现CIN患者mPFS为7.2 mo(G0: 95%CI: 2.6-4.8 mo; G1-4: 95%CI: 5.7-8.3 mo, (P = 0.000). 生存曲线如图1所示, 出现CIN患者mPFS较未出现者明显延长.
2.3.2 出现CIN患者的各级别和未出现CIN患者PFS对比: G2组患者mPFS较G0和G1、G3-4组明显延长(8.5 mo vs 3.6 mo, (P = 0.003; 8.5 mo vs 5.2 mo, (P = 0.007; 8.5 mo vs 6.1 mo, (P = 0.023); G2较G3-4组未见明显差异(5.2 mo vs 6.1 mo, (P = 0.052). G1、G3/4组mPFS均较G0组显著延长(5.2 mo vs 3.6 mo, (P = 0.005; 6.1 mo vs 3.6 mo, (P = 0.000)(表2, 表3), 生存曲线如图2.
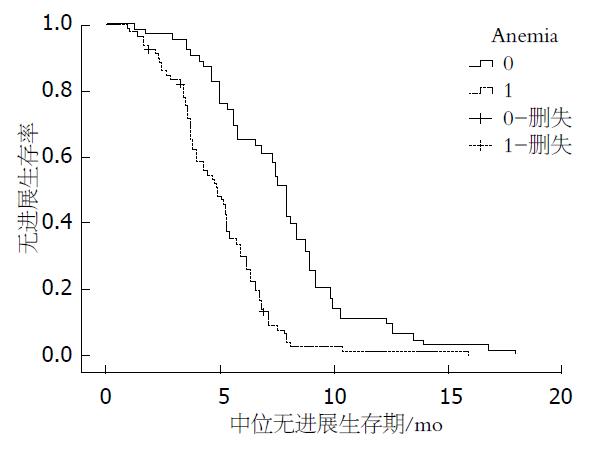
2.3.3 贫血组和非贫血组PFS对比: 出现贫血患者(A1)mPFS较正常患者(A0组)显著缩短(4.9 mo vs 6.5 mo, (P = 0.012)(图3).
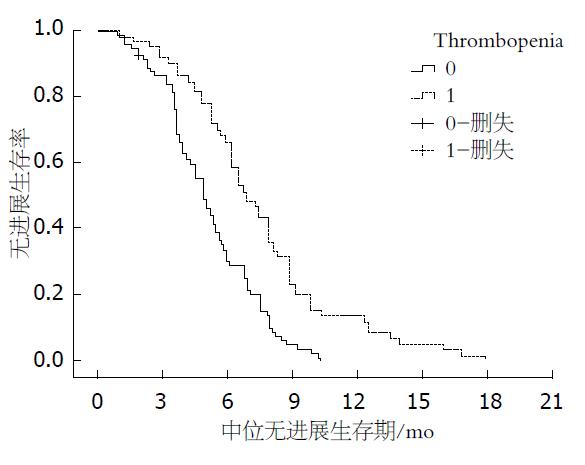
2.3.4 血小板减少与正常组PFS对比: 血小板减少患者(T1)mPFS较正常患者(T0组)延长(6.3 mo vs 4.5 mo, (P = 0.012)(图4).
158例患者中, CR 0例(0.0%), PR 65例(41.0%), SD 65例(41.0%), PD 28例(18.0%), RR 41.0%, DCR 82.0%. G1、2、3、4总体有效率高于G0组(76% vs 24%, (P = 0.018), 亚组分析提示在CIN降低级别中G2组ORR最高(56%, (P = 0.041); 未出现贫血患者ORR最高(45%, (P = 0.032); 出现血小板减少患者ORR最高(57%, (P = 0.004)(表5).
| ORR | P值 | DCR | P值 | |
| CIN | 0.041 | 0.0427 | ||
| G0 | 29(10/34) | 71(25/34) | ||
| G1 | 39(22/56) | 80(45/56) | ||
| G2 | 56(17/30) | 87(27/30) | ||
| G3 | 42(16/38) | 82(33/38) | ||
| 贫血 | 0.032 | 0.033 | ||
| 无(A0) | 45(37/83) | 90(75/83) | ||
| 有(A1) | 37(28/75) | 73(55/75) | ||
| 血小板减少 | 0.026 | 0.019 | ||
| 无(T0) | 34(37/109) | 79(86/109) | ||
| 有(T1) | 57(28/49) | 90(44/49) |
化疗过程中出现的骨髓抑制, 早期表现为中性粒细胞减少、血小板减少, 是多种化疗药物主要剂量限制性毒性. 晚期常常出现贫血, 消化系肿瘤中与失血、造血物质吸收障碍也有关系. 本研究中统一选取应用FOLFOX方案化疗的晚期结直肠癌患者, 均无手术指征, 其中位化疗周期为6周期, 研究骨髓抑制与预后的关系.
多项研究[7-9]证实在乳腺癌、肺癌(Di Maio等[9]的研究)治疗中, CIN、血小板减少与较好的预后相关. 近期Yamanaka等[10]在晚期胃癌中的研究也证实了此结论, 1055例患者中位总生存302 d, 其中G0级患者254 d(95%CI: 239-281 d), G1级355 d(95%CI: 309-415 d), G2级459 d(95%CI: 377-559 d)以及G3-4级患者480 d(95%CI: 380-552 d), 差异有统计学意义. 分析其原因, 化疗药物疗效与作用于细胞的有效药物剂量相关. 有效药物剂量不足导致疗效不佳, 目前仅通过体表面积来计算药物用量是不充分的[11], 个体肝脏、肾脏对药物代谢水平不同, 药物作用于细胞内部产生的代谢变化以及影响细胞基因转录表达的途径不同, 因而疗效有差异[12]. 目前临床治疗不足以检测每个患者的药物代谢过程, 因此将中性粒细胞减少、血小板减少作为一个药物代谢的间接监测指标. 有研究[13]表明, 药物反应与患者基因类型、DNA修复酶等相关. 个体全身细胞具有相同基因类型和相似的修复酶, 因此血液细胞和肿瘤细胞对于药物产生相似的药效学变化. 化疗过程中出现骨髓抑制或许间接提示有足够有效的化疗药物到达肿瘤细胞, 并产生杀伤作用. 未出现中性粒细胞减少患者, 可能于药物剂量不足相关[14,15].
目前也有一些学者[16,17]认为, 化疗所致的中性粒细胞减少、血小板减少等与肿瘤干细胞的杀伤存在相关性. 化疗所致的骨髓抑制可以一定程度上反映药物对肿瘤干细胞的杀伤作用, 从而影响患者的预后. 这一理论还需进一步的研究证实.
本研究中未出现CIN患者mPFS为3.6 mo对比出现CIN患者mPFS为7.2 mo(G0: 95%CI: 2.6-4.8 mo; G1-4: 95%CI: 5.7-8.3 mo, (P = 0.000), 出现CIN患者PFS显著延长; G2组患者mPFS较G0和G1、G3-4组明显延长(8.5 mo vs 3.6 mo, (P = 0.003; 8.5 mo vs 5.2 mo, (P = 0.007; 8.5 mo vs 6.1 mo, (P = 0.023); 血小板减少患者(T1)mPFS较正常患者(T0组)延长(6.3 mo vs 4.5 mo, (P = 0.012). 出现贫血患者(A1)mPFS较正常患者(A0组)显著缩短(4.9 mo vs 6.5 mo, (P = 0.012). 提示, 出现中性粒细胞减少以及血小板减少与较好的预后相关, 而贫血的出现预后较差.
患者化疗期间出现中性粒细胞减少, G2、G3-4级骨髓抑制都预示着更好的疗效和预后, 而G3-4级并没有表现出更好的效果, 可能于更高的感染、出血风险有关. 且常常需要降低药物剂量, 甚至停止治疗, 极大地影响了临床疗效[18]. 这和国际上结直肠癌相关研究结论具有一致性[19].
骨髓抑制的另一方面是贫血, 可引起肿瘤组织的贫血性乏氧, 从而影响放化疗的疗效, 降低生存, 因此Hb水平可能是影响结直肠癌患者的预后因素之一. Socinski等[20]对60项临床研究的回顾性分析发现, 肺癌伴贫血的患者中位死亡危险比可增加19%. 然而, 最近公布的JBR10研究显示基础Hb水平与生存期或无疾病进展期无统计学意义(分别为(P = 0.27和(P = 0.94)[21], 因此贫血对于预后的影响需进一步证实.
纠正贫血可以改善肿瘤患者的转归, 一项大型的荟萃分析证实了Hb水平和肿瘤患者生存期的相关性. Vansteenkiste等[22]对314例肺癌伴化疗相关性贫血研究显示促红细胞生成素治疗组的生存期长于对照组, 分别为46 wk和34 wk. 贫血可能缩短结直肠癌患者的生存时间, 为了深入明确贫血与结直肠癌患者预后的关系, 需要更进一步的研究证实.
由此可见, 化疗过程中出现中性粒细胞减少以及血小板减少往往预示着更好的预后和疗效, 而G2组和早期出现组预示着更大的获益. 通过CIN水平来调整药物剂量, 使现有的药物得到更合理更充分的应用, 使更多的患者得到有效治疗. 无论治愈性还是姑息性化疗, CIN都是值得关注的问题. 影响结直肠癌患者预后的因素较多, 本研究仅为回顾性研究, 研究病例数量亦有限, 仍需进一步的研究以明确骨髓抑制和纠正贫血对于结直肠癌患者预后的影响, 以期为临床带来更多指导意义.
一线应用FOLFOX方案化疗的晚期结直肠癌患者, 出现中性粒细胞减少和血小板减少者较不出现者PFS有显著改善, 其中G2组PFS获益更明显. CIN程度及血小板减少是影响PFS的独立预后因素. 提示, 未出现CIH者化疗药物可能未达到最佳有效剂量, 监测并根据CIH程度及时调整化疗剂量, 使CIN在早期达G2级或许有助于提高化疗疗效及改善预后, 积极纠正贫血与较好的预后亦相关.
从上世纪90年代开始, 多个临床研究报导在肺癌、乳腺癌、卵巢癌等化疗过程中出现的中性粒细胞减少、血小板减少与较好的预后相关; 而贫血患者往往预后较差.
陈其奎, 教授, 中山大学附属第二医院消化内科; 郑建勇, 副教授、副主任医师, 第四军医大学西京消化病医院消化外科
对于化疗过程中引起的骨髓抑制, 中性粒细胞减少程度有多种分级标准, 亦有报导根据中性粒减少出现时间分组, 各种分组标准有待进一步探讨. 与预后的关系当中, 出现骨髓抑制与较好的预后相关是毋庸置疑的, 但哪种级别或时间仍有待研究证实. 贫血在多种疾病中与较差的预后相关, 其机制有待探讨.
2005年Di Maio等发表在Lancet Oncol的研究, 搜集患者1000余例, 明确证实了中性粒细胞减少与较差预后相关.
本文将化疗引起的骨髓抑制(chemotherapy induced hematological toxicity, CIH)分三方面进行分析: 中性粒细胞减少、血小板减少以及血红蛋白降低, 分别研究其与预后的关系; 并将中性粒细胞减少分为4组, 详细比较4组之间的临床疗效与预后差异. 得出结论用于辅助临床用药.
监测并根据CIH程度及时调整化疗剂量, 使化疗引起的中性粒细胞减少(chemotherapy induced-neutropenia)在早期达G2级或许有助于提高化疗疗效, 使目前使用的化疗药物充分发挥作用, 治疗过程中积极纠正贫血也可为较好预后提供保证.
化疗引起的骨髓抑制(CIH): 指在化疗过程中由于药物不良反应引起的白细胞降低、血小板降低、贫血等现象.
文章结合临床, 为人们的想法"化疗反应越大, 效果越好"提供了依据, 也为进一步研究其机制提出了一定的方向.
编辑: 韦元涛 电编:都珍珍
| 1. | Guastadisegni C, Colafranceschi M, Ottini L, Dogliotti E. Microsatellite instability as a marker of prognosis and response to therapy: a meta-analysis of colorectal cancer survival data. Eur J Cancer. 2010;46:2788-2798. [PubMed] [DOI] |
| 2. | Gilreath JA, Stenehjem DD, Rodgers GM. Diagnosis and treatment of cancer-related anemia. Am J Hematol. 2014;89:203-212. [PubMed] [DOI] |
| 3. | Rambach L, Bertaut A, Vincent J, Lorgis V, Ladoire S, Ghiringhelli F. Prognostic value of chemotherapy-induced hematological toxicity in metastatic colorectal cancer patients. World J Gastroenterol. 2014;20:1565-1573. [PubMed] [DOI] |
| 4. | Han Y, Yu Z, Wen S, Zhang B, Cao X, Wang X. Prognostic value of chemotherapy-induced neutropenia in early-stage breast cancer. Breast Cancer Res Treat. 2012;131:483-490. [PubMed] [DOI] |
| 5. | Jang SH, Kim SY, Kim JH, Park S, Hwang YI, Kim DG, Jung KS. Timing of chemotherapy-induced neutropenia is a prognostic factor in patients with metastatic non-small-cell lung cancer: a retrospective analysis in gemcitabine-plus-platinum-treated patients. J Cancer Res Clin Oncol. 2013;139:409-417. [PubMed] [DOI] |
| 6. | Dubsky P, Sevelda P, Jakesz R, Hausmaninger H, Samonigg H, Seifert M, Denison U, Mlineritsch B, Steger G, Kwasny W. Anemia is a significant prognostic factor in local relapse-free survival of premenopausal primary breast cancer patients receiving adjuvant cyclophosphamide/methotrexate/5-fluorouracil chemotherapy. Clin Cancer Res. 2008;14:2082-2087. [PubMed] [DOI] |
| 7. | Poikonen P, Saarto T, Lundin J, Joensuu H, Blomqvist C. Leucocyte nadir as a marker for chemotherapy efficacy in node-positive breast cancer treated with adjuvant CMF. Br J Cancer. 1999;80:1763-1766. [PubMed] [DOI] |
| 8. | Cameron DA, Massie C, Kerr G, Leonard RC. Moderate neutropenia with adjuvant CMF confers improved survival in early breast cancer. Br J Cancer. 2003;89:1837-1842. [PubMed] [DOI] |
| 9. | Di Maio M, Gridelli C, Gallo C, Shepherd F, Piantedosi FV, Cigolari S, Manzione L, Illiano A, Barbera S, Robbiati SF. Chemotherapy-induced neutropenia and treatment efficacy in advanced non-small-cell lung cancer: a pooled analysis of three randomised trials. Lancet Oncol. 2005;6:669-677. [PubMed] [DOI] |
| 10. | Yamanaka T, Matsumoto S, Teramukai S, Ishiwata R, Nagai Y, Fukushima M. Predictive value of chemotherapy-induced neutropenia for the efficacy of oral fluoropyrimidine S-1 in advanced gastric carcinoma. Br J Cancer. 2007;97:37-42. [PubMed] [DOI] |
| 11. | Gurney H. How to calculate the dose of chemotherapy. Br J Cancer. 2002;86:1297-1302. [PubMed] [DOI] |
| 12. | Sawyer M, Ratain MJ. Body surface area as a determinant of pharmacokinetics and drug dosing. Invest New Drugs. 2001;19:171-177. [PubMed] [DOI] |
| 13. | Camps C, Sirera R, Iranzo V, Tarón M, Rosell R. Gene expression and polymorphisms of DNA repair enzymes: cancer susceptibility and response to chemotherapy. Clin Lung Cancer. 2007;8:369-375. [PubMed] [DOI] |
| 14. | Carus A, Gurney H, Gebski V, Harnett P, Hui R, Kefford R, Wilcken N, Ladekarl M, von der Maase H, Donskov F. Impact of baseline and nadir neutrophil index in non-small cell lung cancer and ovarian cancer patients: Assessment of chemotherapy for resolution of unfavourable neutrophilia. J Transl Med. 2013;11:189. [PubMed] [DOI] |
| 15. | Capitain O, Asevoaia A, Boisdron-Celle M, Poirier AL, Morel A, Gamelin E. Individual fluorouracil dose adjustment in FOLFOX based on pharmacokinetic follow-up compared with conventional body-area-surface dosing: a phase II, proof-of-concept study. Clin Colorectal Cancer. 2012;11:263-267. [PubMed] [DOI] |
| 16. | Abou Saleh M, Mafiana RN, Al Za'abi M, Vaishnav R, Al Kindi S, Al-Zakwani I. Epidemiology of chemotherapy-induced neutropenia at a tertiary university hospital in Oman. Int J Clin Pharm. 2013;35:1036-1039. [PubMed] [DOI] |
| 17. | Wicha MS, Liu S, Dontu G. Cancer stem cells: an old idea--a paradigm shift. Cancer Res. 2006;66:1883-1890; discussion 1895-1896;. [PubMed] [DOI] |
| 18. | Kaestner SA, Sewell GJ. Chemotherapy dosing part I: scientific basis for current practice and use of body surface area. Clin Oncol (R Coll Radiol). 2007;19:23-37. [PubMed] |
| 19. | Shitara K, Matsuo K, Takahari D, Yokota T, Shibata T, Ura T, Ito S, Sawaki A, Tajika M, Kawai H. Neutropenia as a prognostic factor in advanced gastric cancer patients undergoing second-line chemotherapy with weekly paclitaxel. Ann Oncol. 2010;21:2403-2409. [PubMed] [DOI] |
| 20. | Socinski MA, Zhang C, Herndon JE, Dillman RO, Clamon G, Vokes E, Akerley W, Crawford J, Perry MC, Seagren SL. Combined modality trials of the Cancer and Leukemia Group B in stage III non-small-cell lung cancer: analysis of factors influencing survival and toxicity. Ann Oncol. 2004;15:1033-1041. [PubMed] [DOI] |
| 21. | Waters JS, O'Brien ME, Ashley S. Management of anemia in patients receiving chemotherapy. J Clin Oncol. 2002;20:601-603. [PubMed] |
| 22. | Vansteenkiste J, Pirker R, Massuti B, Barata F, Font A, Fiegl M, Siena S, Gateley J, Tomita D, Colowick AB. Double-blind, placebo-controlled, randomized phase III trial of darbepoetin alfa in lung cancer patients receiving chemotherapy. J Natl Cancer Inst. 2002;94:1211-1220. [PubMed] |