修回日期: 2014-11-15
接受日期: 2014-12-05
在线出版日期: 2015-01-28
目的: 探讨伽玛刀(γ-刀)联合高强度超声聚焦刀(high-intensity focused ultrasound, HIFU)治疗局部晚期胰腺癌的安全性、有效性.
方法: 68例局部晚期胰腺癌患者随机分为2组: 其中33例为单纯放疗组(A组), 35例为先经γ-刀治疗后用HIFU治疗的联合组(B组). 患者治疗后l、2、3 mo行增强计算机断层扫描(computed tomography, CT)及糖链抗原199(carbohydrate antigen 199, CA199)复查, 以后为1次/3 mo, 共随访36 mo. 观察治疗后近期及远期疗效, 并进行生存曲线分析.
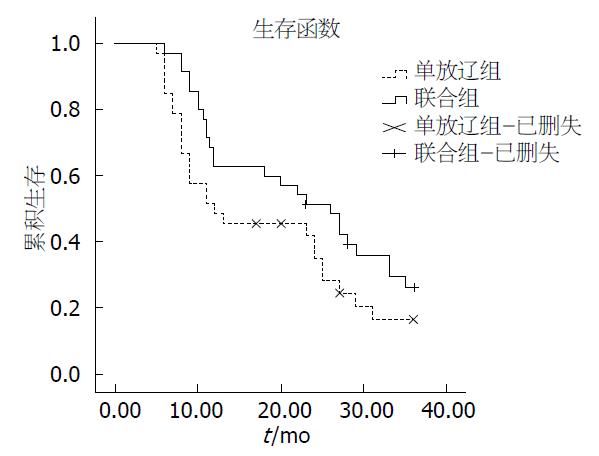
结果: A组临床受益率: B组临床受益率 = 87.88%: 94.29%(χ2 = 4.001, (P = 0.045<0.05), 2组中位生存时间为12.00 mo vs 26.00 mo, 平均生存时间A组为18.01 mo, B组为22.99 mo((P = 0.040<0.05). 2组68例患者中均按计划顺利完成, 无1例治疗后出现胰漏、皮肤灼伤、脏器穿孔及放射性肠炎等严重不良反应.
结论: γ-刀联合HIFU治疗是一种安全、有效治疗局部晚期胰腺癌的新方法.
核心提示: 本研究样本量较大, 伽玛刀联合高强度超声聚焦刀(high-intensity focused ultrasound)治疗方案新颖, 对局部晚期胰腺癌临床疗效较好, 具有一定应用价值及推广意义.
引文著录: 王磊, 李灵招, 单国用, 刘兴安, 杨文魁, 张松, 吴晓东. 伽玛刀联合HIFU治疗局部晚期胰腺癌的疗效. 世界华人消化杂志 2015; 23(3): 470-475
Revised: November 15, 2014
Accepted: December 5, 2014
Published online: January 28, 2015
AIM: To evaluate the safety and effectiveness of high-intensity focused ultrasound (HIFU) following gamma knife for treating locally advanced pancreatic cancer.
METHODS: Sixty-eight patients with locally advanced pancreatic cancer were randomly divided into two groups to receive either simple radiotherapy (group A; n = 33) or HIFU following gamma knife (group B; n = 35). The patients underwent contrast-enhanced computed tomography (CT) scans and CA199 tests 1, 2, 3 mo after treatment and every 3 mo thereafter during a total of 36 mo of follow-up. Short-term and long-term effects were observed after treatment, and survival curve analysis was performed.
RESULTS: The rate of clinical benefit response was significantly lower in group A than in group B (87.88% vs 94.29%, χ2 = 4.001, (P = 0.045 < 0.05); the median survival time was significantly shorter in group A than in group B (12.00 mo vs 26.00 mo, P < 0.05); the average survival time was significantly shorter in group A than in group B (18.01 mo vs 22.99 mo, (P = 0.040 < 0.05). All the patients in the two groups completed the treatment smoothly as planned, and no serious complications such as pancreatic leakage, skin burns, viscera perforation and radioactive enteritis occurred.
CONCLUSION: Gamma knife combined with HIFU therapy may be a safe and effective method for the treatment of locally advanced pancreatic cancer.
- Citation: Wang L, Li LZ, Shan GY, Liu XA, Yang WK, Zhang S, Wu XD. Gamma knife combined with high-intensity focused ultrasound for treatment of locally advanced pancreatic carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(3): 470-475
- URL: https://www.wjgnet.com/1009-3079/full/v23/i3/470.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i3.470
胰腺癌是消化系常见恶性肿瘤之一. 但由于其隐匿性及侵袭性的生物学特性, 就诊时仅有10%-20%患者可行根治性手术切除, 总体5年生存率仅1%-9%. 而胰腺癌中约40%为局部晚期胰腺癌[1], 其治疗方法较多, 但效果不尽如人意[2]. 随着胰腺癌放疗研究及微创技术的发展, 对于不能手术或拒绝手术胰腺癌患者, 趋向于采取放射治疗或微创治疗[高强度超声聚焦刀(high-intensity focused ultrasound, HIFU)、经导管动脉栓塞化疗术(transcatheter arterial chemoembolization, TACE)、经皮瘤内冰醋酸注射(percutaneous injections of acetic acid, PAI)、射频消融(radiofrequency ablation, RFA)]等治疗方法. 单纯放疗虽能改善预后并提高患者生存质量, 但其疗效与受照射的剂量高低密切相关[3]. 目前精确放疗技术使胰腺癌的局部控制率得以明显提高[4,5]. 而伽玛刀(γ-刀)治疗为精确的立体定向放射治疗之一, 加之非共面锥状旋转聚焦照射, 使得靶区剂量由外而内剂量越来越高, 而靶区外周边剂量明显下降. 而HIFU与放疗相比, 其高温的非选择性灭活能有效消融对放疗抗拒的乏血供、乏氧或处于S期肿瘤细胞. 因此, γ-刀联合HIFU治疗局部晚期胰腺癌可能具有协同增效作用, 可能是一种新的安全、有效治疗局部晚期胰腺癌的方法. 为此, 本研究初步临床观察γ-刀联合HIFU治疗局部晚期胰腺癌的疗效和不良反应, 旨在探讨γ-刀联合HIFU治疗局部晚期胰腺癌的安全性、有效性.
自2007-01/2011-07郑州人民医院放疗科收治的局部进展期胰腺癌患者共68例, 其中43例经计算机断层扫描(computed tomography, CT)引导下穿刺活检确诊, 其余25例患者均经增强CT或磁共振成像(magnetic resonance imaging, MRI)结合糖链抗原199(carbohydrate antigen 199, CA199)临床确诊. 其中男41例, 女27例. 平均年龄为50岁, 既往未曾行局部放疗及全身化疗, 卡氏评分(Karnofsky performance status, KPS)评分87分±2.4分. 随机分为2组, 其中33例为单纯放疗组(A组), 35例为先经γ-刀治疗后用HIFU治疗的联合组(B组). 两组病例之间差异无统计学意义. 研究对象入选标准: (1)确诊的局部晚期胰腺癌患者, 且患者无法行手术切除或拒绝手术切除; (2)胸、腹壁皮肤完好; (3)KPS评分≥80分, 且预计生存期>3 mo.
1.2.1 γ-刀治疗: 68例患者首先在郑州人民医院放疗科采用OUR-QGD型γ-刀全身治疗系统行立体定向放射治疗, 其主要步骤: (1)用真空垫制作体模; (2)在体模固定下按治疗体位平卧于立体定向体架上, 螺旋CT 3-5 mm层间距连续扫描, 扫描范围为自膈顶上5 cm至腰4椎体下缘. 并读取定位标尺记数值, 在患者体表与体模标记相应位置; (3)三维立体重建, 勾画临床靶体积和计划靶体积, 制定放射治疗计划及调整剂量分布, 开始实施治疗. 根据肿瘤位置、大小及患者一般情况等, 以50%-70%等剂量曲线包绕100%计划靶区(planning target volume, PTV), 剂量分割: 单次周边剂量: 3.0-4.5 Gy, 治疗次数8-12次, 总周边剂量36-50 Gy, 多数患者为先隔日照射后连续治疗. 危及器官受量为: 十二指肠在胰头癌患者30%左右, 胰体尾癌均<15%, 脊髓受量5%-20%.
1.2.2 HIFU治疗: 采用上海交通大学新地实业公司生产的HIFU-2001型超声聚焦肿瘤治疗系统在患者γ-刀治疗胰腺癌结束后30-60 min内行HIFU治疗. 患者取平卧位在清醒状态下进行治疗. 用机载彩超探头确定病灶大小、位置、形态、与邻近器官的关系, 确定治疗区域后即将B超定位探头从0度旋转到90度, 三维立体扫描病灶, 使用治疗计划系统分别在0度平面和90度平面勾画靶区. 计划包括: 病变治疗范围、治疗层数、层面面积、治疗点数. 然后在计算机自动控制下, HIFU焦点采用点点成线、线线成面、面面成体的积累方式在X、Y、Z轴3个方向上进行运动, 由深到浅治疗病变的各个层面, 直至覆盖整个治疗靶区. 治疗次数: 每例患者均行3-5次HIFU治疗, 隔日1次, 每次均在γ-刀治疗结束后30-60 min内进行. 治疗介质为脱气水, 输入电功率0.3-0.8 KW, 单元发射时间0.15-0.18 s, 间隔时间0.18-0.20 s, 每次点数50-60次, 步距、行距及层距分别为3、3、8 mm.
1.2.3 临床疗效观察及不良反应评价: 临床疗效评价标准: 按照世界卫生组织(World Health Organization, WHO)疗效评价标准, 将患者治疗疗效评价为: 所有已知病灶消失并保持最少4 wk为完全缓解(complete remission, CR), 肿瘤双径乘积之和减少50%以上维持4 wk为部分缓解(partial remission, PR), 缩小不足50%为无变化(no change, NC)或稳定(stable disease, SD), 肿瘤体积增大>25%或有新病灶出现为进展(progressive disease, PD).
临床受益反应(clinical benefit response, CBR): 依据1997年Burris等[5]制定的CBR标准对患者的疼痛强度[疼痛视觉评分(visual analog scale, VAS), 10分制]、镇痛药物消耗量、KPS评分和体质量变化综合评估. 凡符合下列一项指标(持续4 wk以上), 并无任何一项恶化者, 定义为临床受益: (1)疼痛强度减轻≥50%; (2)镇痛药物用量减少≥50%; (3)体力状况按KPS标准改善≥2分; (4)如疼痛程度及体力状况均稳定, 则体质量增加≥7%.
不良反应及并发症评价: 本研究的不良反应及并发症分级参照放射治疗肿瘤协作组(Radiation Therapy Oncology Group, RTOG)急性放射性损伤分级标准进行观察.
统计学处理 采用SPSS22.0软件进行统计学分析, 两组间样本客观有效率, 临床受益率以及并发症发生率等采用χ2检验, 对生存率比较采用Log-rank检验法. P<0.05为差异有统计学意义.
客观有效率: A组, 19/33 = 57.58%; B组, 28/35 = 80.00%; 差异有统计学意义(P<0.05). 临床受益率: A组, 29/33 = 87.88%; B组, 33/35 = 94.29%; 差异有统计学意义(P<0.05). 并发症: A组, 1/33 = 3.03%; B组, 2/35 = 5.72%; 差异无统计学意义(χ2 = 0.000, (P = 1.000). 并发症发生主要是胰漏、皮肤灼伤、脏器穿孔及放射性肠炎(表1, 表2). 急性毒性反应主要包括上消化道反应、肝肾毒性、白细胞减少、发热等(表3).
| 分组 | PR+CR | SD+PD | 客观有效率(%) | 临床受益率n(%) | χ2值 | P值 |
| A组 | 19 | 14 | 57.58 | 29(87.88) | 4.001 | 0.045 |
| B组 | 28 | 7 | 80.00 | 33(94.29) |
| 分组 | n | 疼痛强度减轻≥50% | 镇痛药用量减少≥50% | KPS评分改善≥2分 | 体质量增加≥7% |
| A组 | 33 | 22 | 24 | 19 | 22 |
| B组 | 35 | 30 | 28 | 29 | 32 |
| χ2值 | 3.425 | 0.499 | 5.229 | 6.370 | |
| P值 | 0.064 | 0.480 | 0.022 | 0.012 |
| 分组 | n | 上消化道反应 | 肝肾毒性 | 嗜中性白血球减少症 | 发热 |
| A组 | 33 | 28 | 7 | 25 | 10 |
| B组 | 35 | 20 | 3 | 8 | 5 |
| χ2值 | 6.280 | 1.273 | 19.029 | 2.535 | |
| P值 | 0.012 | 0.259 | 0.001 | 0.111 |
胰腺癌是常见的消化系恶性肿瘤之一, 其具有恶性程度高, 发展快, 病期短, 预后极差的特点. 根据美国肿瘤学会最新资料显示胰腺癌发病率与死亡率几乎相当, 发病率位居恶性肿瘤第10位, 死亡率在女性为第5位, 男性为第4位, 5年生存率仅为4%[6]. 胰腺癌位置深在, 周围肠道对射线耐受性差, 常规外照射剂量受到限制, 达不到肿瘤根治性放疗目的, 使肿瘤局部控制率低、复发率高[7]. 随着放疗技术发展, 一种利用立体定向等中心技术将大剂量高能γ-射线精确地一次或分次照射到设定靶区上的立体定向放疗(stereotactic radiotherapy, SRT)放疗技术, 已安全有效用于消化系肿瘤临床治疗[8]. 而体部γ-刀就是SRT技术一种, 他是中国具有自主知识产权的立体定向放射治疗设备, 可用于体部任何部位的肿瘤治疗. 与常规放疗相比, γ-刀采用多角度、多射野等方式大幅度提高了肿瘤靶区剂量, 而周边正常肠道组织剂量增加较少, 既减轻了正常小肠组织的损伤, 且高剂量照射又提高了肿瘤的局部控制率. 但是, γ-刀本身仍是一种放疗技术, 对血液灌注丰富、含氧丰富、细胞增殖活跃的肿瘤敏感性高. 在胰腺癌治疗中, 中央区域肿瘤血液灌注、含氧情况等均相对周边区域明显降低, 易产生放射耐受而残留. 因此, 寻找一种克服γ-刀不足的有效方法, 并与之联合, 可能会增加局部晚期胰腺癌的疗效.
而HIFU作为一种无创肿瘤热疗技术在胰腺癌治疗上的成功运用, 为单纯γ-刀治疗局部晚期胰腺癌效果不理想的患者带来了新希望. HIFU原理是利用高强度超声波在组织内的可穿透性和可聚焦性, 将高强度超声波聚集于肿瘤靶区, 形成一个焦域, 而该区域超声聚焦产生的生物学效应-瞬间高温, 使治疗区域温度骤升至65 ℃以上, 而使肿瘤组织发生凝固性坏死, 同时也能增强机体的免疫功能从而提高疗效[9]. 对于局部晚期胰腺癌周边血供丰富部分肿瘤, γ-刀因其含氧丰富不仅容易有效杀灭, 也能使其血管内皮损害引起血栓形成、血管闭塞, 有利于HIFU在该部分的热沉积, 而获得有效治疗. 同时, 热疗对处于S期的肿瘤细胞损伤作用明显, 而放疗对M期细胞敏感, 因此热疗可与放疗达成互补的作用[10,11]. 同时Sofuni等[12]的研究也表明HIFU在胰腺癌治疗中可有效控制肿瘤发展, 可成为联合治疗中一种不错选择. 因此, HIFU联合γ-刀具有协同增效作用, HIFU可能是一种能克服γ-刀不足的有效方法. 本研究结果显示, 联合治疗组80.00%肿瘤治疗有效率, 高于张丽萍等[13]研究报道, γ-刀治疗胰腺癌有效率67.60%, 提示二者联合治疗能有效杀灭局部晚期胰腺癌. 同时本研究在临床受益反应指标的比较中, 联合治疗组对单纯γ-刀治疗组对比在KPS评分改善及体质量增加方面有明显差异, 受益率高, 值得进一步临床推广.
γ-刀与HIFU联合治疗, 其联合应用顺序极为重要, 其直接影响疗效. HIFU治疗在杀灭肿瘤细胞同时, 可引起肿瘤组织的细小血管闭塞, 若HIFU治疗后行γ-刀, 会因为血管闭塞, 肿瘤血供少、乏氧, 降低放疗的效果. 且局部γ-刀治疗后阻断了肿瘤血供, 病变组织内血流量和血流速度均大幅下降, 有利于HIFU治疗时焦域区热能的累积, 并减少了HIFU治疗后热量散失. 因此, 先γ-刀后行HIFU才是合理的选择.
由于γ-刀和HIFU治疗均是体外非侵入性治疗方法, 其γ-线和超声波在治疗局部晚期胰腺癌时均须通过皮肤、肌肉等腹壁, 对周围组织肝脏及肠道等器官可能会出现放射性皮肤损害、肝肾毒性、发热等急性不良反应和并发症. 徐静等[14]研究消化系肿瘤报道, HIFU并发症中最常见的发热, 其发生率和严重程度与治疗时间、治疗范围相关. 本研究在发热、肝肾毒性方面两组统计无明显区别, 显示联合治疗后未增加发热及皮肤灼伤发生. 而且, 在急性毒性的上消化道反应、白细胞减低方面, 联合治疗组与单纯γ-刀治疗组对比差异有统计学意义, 联合组毒性反应更轻, 考虑可能与HIFU修复黏膜、改善免疫力有关. 在并发症胰漏、脏器穿孔及放射性肠炎等方面差异无统计学意义, 提示联合治疗组未增加其并发症发生风险.
本研究中单纯γ-刀治疗组有效率为57.58%, 低于周国中等[15]研究γ-刀治疗胰腺癌总有效率80.00%与我们联合治疗组有效率持平, 其可能原因是本研究病例数少及选取胰腺癌患者分期晚有关. 且其进一步研究发现γ-刀治疗可显著降低胰腺癌患者中CA199、血管内皮生长因子含量, 可能是γ-刀治疗胰腺癌潜在靶点, 值得进一步深入探讨.
因此, γ-刀联合HIFU不仅能有效治疗局部晚期胰腺癌, 也并未增加急性毒性反应及胰漏、皮肤灼伤、脏器穿孔及放射性肠炎等并发症的发生率, 提示该联合方案能安全、有效治疗局部晚期胰腺癌, 可能是其综合治疗的一种新方法. 由于本研究属于临床观察, 相关基础理论较少, 特别是与血清生化及血管生长因子之间关系, 尚需进一步深入研究.
胰腺癌是消化系恶性程度很高的肿瘤, 5年生存率不到5%, 且其发病率呈逐年增长趋势. 目前多学科、多中心联合的综合治疗已经在许多方面取得了一定的进展, 如何提高胰腺癌患者生存质量和生存期成为目前治疗的难点和重点. 目前常规放疗技术定位不准确, 对正常组织损伤大, 不良反应重, 疗效差. 而伽玛刀作为立体定向放疗技术, 可对病灶精确定位, 保护正常组织, 大大减少治疗期间不良反应, 我们将其联合高强度超声聚焦刀(high-intensity focused ultrasound, HIFU)方案治疗局部晚期胰腺癌, 评价其效果, 为局部晚期胰腺癌患者治疗提供新的方案.
肖恩华, 教授, 中南大学湘雅二医院放射教研室
对于局部晚期胰腺癌手术切除率低, 可手术切除者的5年生存率也不超过5%, 预后不佳. 而化疗由于易产生耐药性导致疗效不佳. 目前随着放疗及热疗设备及技术快速发展, 伽玛刀及HIFU在临床中应用越来越广泛, 且疗效尚可. 因此伽玛刀联合HIFU治疗局部晚期胰腺癌将成为一个重要治疗方案.
伽玛刀被广泛应用到晚期不能切除的恶性实体肿瘤. 有学者认为, 应用伽玛刀治疗胰腺癌可显著降低胰腺癌患者中糖链抗原199(carbohydrate antigen 199, CA199)、血管内皮生长因子含量, 从而提高有效率, 但还需要大样本支持. 国外学者研究表明HIFU在胰腺癌治疗中可有效控制肿瘤发展, 延长患者生存时间.
本研究采用伽玛刀联合HIFU治疗局部晚期胰腺癌, 充分发挥精确放疗及热疗的优势, 起到互相增敏的作用, 从而提高患者的有效率, 延长生存率, 改善患者的生活质量.
伽玛刀联合HIFU不仅能有效治疗局部晚期胰腺癌, 也并未增加急性毒性反应及并发症的发生率, 提示该联合方案能安全、有效治疗局部晚期胰腺癌, 可能是其综合治疗的一种新方法. 由于本研究属于临床观察, 相关基础理论较少, 特别是基因层面的一些变化, 尚需进一步深入研究.
HIFU: 高强度超声聚焦刀, 其原理是利用高强度超声波在组织内的可穿透性和可聚焦性, 将高强度超声波聚集于肿瘤靶区, 形成一个焦域, 而该区域超声聚焦产生的生物学效应-瞬间高温, 使治疗区域温度骤升至65 ℃以上, 而使肿瘤组织发生凝固性坏死, 从而达到治疗肿瘤的目的.
该研究在临床工作方面有一定创新, 对于局部晚期胰腺癌的治疗提出了一个新的治疗方案, 并取得了良好的疗效, 具有一定临床应用价值, 值得临床进一步探索.
编辑:韦元涛 电编:都珍珍
| 2. | Cooperman AM, Kini S, Snady H, Bruckner H, Chamberlain RS. Current surgical therapy for carcinoma of the pancreas. J Clin Gastroenterol. 2000;31:107-113. [PubMed] [DOI] |
| 5. | Burris HA, Moore MJ, Andersen J, Green MR, Rothenberg ML, Modiano MR, Cripps MC, Portenoy RK, Storniolo AM, Tarassoff P. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol. 1997;15:2403-2413. [PubMed] |
| 6. | Jemal A, Murray T, Ward E, Samuels A, Tiwari RC, Ghafoor A, Feuer EJ, Thun MJ. Cancer statistics, 2005. CA Cancer J Clin. 2005;55:10-30. [PubMed] [DOI] |
| 8. | Wulf J, Guckenberger M, Haedinger U, Oppitz U, Mueller G, Baier K, Flentje M. Stereotactic radiotherapy of primary liver cancer and hepatic metastases. Acta Oncol. 2006;45:838-847. [PubMed] [DOI] |
| 9. | Ashush H, Rozenszajn LA, Blass M, Barda-Saad M, Azimov D, Radnay J, Zipori D, Rosenschein U. Apoptosis induction of human myeloid leukemic cells by ultrasound exposure. Cancer Res. 2000;60:1014-1020. [PubMed] |
| 11. | Schlemmer M, Wendtner CM, Issels RD. Ifosfamide with regional hyperthermia in soft-tissue sarcomas. Oncology. 2003;65 Suppl 2:76-79. [PubMed] [DOI] |
| 12. | Sofuni A, Moriyasu F, Sano T, Yamada K, Itokawa F, Tsuchiya T, Tsuji S, Kurihara T, Ishii K, Itoi T. The current potential of high-intensity focused ultrasound for pancreatic carcinoma. J Hepatobiliary Pancreat Sci. 2011;18:295-303. [PubMed] [DOI] |