修回日期: 2014-11-27
接受日期: 2014-12-25
在线出版日期: 2015-01-28
目的: 探讨半相合基因来源肿瘤特异性树突状细胞活化的特异性细胞毒性T淋巴细胞(the special cytotoxic T lymphocytes activated by dendritic cells, DCs-CTLs)体外静脉注射荷瘤鼠后观察其抑瘤效果及其移植物抗宿主反应(graft-versus-host disease, GVHD)的程度.
方法: 将B16黑色素瘤体外种植于健康C57BL/6小鼠成功后, 全部在第10天给予60CO 7 Gy全身照射. 将荷瘤小鼠随机分为阴性对照、自体治疗及半相合治疗组, 分别于第10、17天给予小鼠自体红细胞、自体来源DCs-CTLs效应细胞、半相合鼠来源DCs-CTLs细胞经尾静脉注射治疗后, 行GVHD评分; 治疗后处死小鼠, 取脾脏、肾和皮肤行病理检查, 观察有无移植物抗宿主反应表现, 并绘制肿瘤生长曲线、计算抑瘤率.
结果: (1)3组GVHD反应评分结果: 阴性对照组与自体治疗组、半相合治疗组相比差异均有统计学意义(P<0.05); 自体治疗组与半相合治疗组之间比较无统计学意义, 分别取3组小鼠的脾脏、皮肤和肾脏行病理检查, 各组均未见明显移植物抗宿主反应的病理变化; (2)肿瘤生长曲线显示, 自体治疗组和半相合治疗组均能明显抑制肿瘤生长, 而阴性对照组对肿瘤的生长无明显抑制作用. 自体治疗组和半相合基因治疗组瘤质量均低于阴性对照组, 差异有统计学意义(P<0.05); 自体治疗组和半相合基因治疗组之间瘤质量对比差异无统计学意义(P>0.05); 自体治疗组和半相合治疗组抑瘤率对比差异无统计学意义(P>0.05).
结论: 自体治疗组及半相合基因治疗组均有明显抑瘤作用, 治疗后观察半相合基因治疗组未见明显移植物抗宿主反应.
核心提示: 半相合基因来源的特异性细胞毒性T淋巴细胞(the special cytotoxic T lymphocytes activated by dendritic cells)细胞未引起受体严重的移植物抗宿主反应, 且对于受体的恶性黑色素瘤细胞具有明显的抑制生长作用, 与自体来源的效应细胞相比抑瘤效果无明显统计学意义, 从而为免疫功能低下等特殊患者无法提取自身效应细胞来进行免疫治疗带来希望.
引文著录: 李冬斌, 司洪涛, 郑志刚, 茹丽娜, 许香梅, 徐晓云, 蔡建辉. 半相合基因DCs-CTL对小鼠黑色素瘤的抑制作用及GVHD反应. 世界华人消化杂志 2015; 23(3): 415-420
Revised: November 27, 2014
Accepted: December 25, 2014
Published online: January 28, 2015
AIM: To investigate the effect of haploidentical dentritic cell activated cytotoxic T lymphocytes (DC-CTCs) on melanoma growth in tumor-bearing mice and whether DC-CTCs induce significant graft-versus-host reaction (GVHD).
METHODS: Thirty healthy C57BL/6 mice were used for implantation of B16 melanoma. Tumor-bearing mice were randomly divided into a negative control group, an autologous DC-CTLs group and a haploidentical DC-CTLs group. All rats were irradiated with 7 Gy 60CO on day 10. The negative control group was intravenously given autologous erythrocytes via the tail vein on days 10 and 17; the autologous DC-CTLs group was given autologous DC-CTLs; and the haploidentical DC-CTLs group was given haploidentical DC-CTLs. After treatment, GVHD was assessed, and tumor growth curve was plotted to calculate tumor inhibition rate.
RESULTS: GVHD score differed significantly between the control group and autologous/haploidentical treatment groups (P < 0.05), while the two treatment showed no significant difference (P > 0.05). Pathological analysis of skin, spleen and kidney samples showed that there were no obvious pathological changes suggestive of GVHD in the three groups. Tumor growth curve analysis showed that tumor growth was significantly inhibited in the two treatment groups (P < 0.05), although no tumor growth inhibition was observed in the control group. Tumor growth inhibition was similar between the autologous treatment group and haploidentical treatment group.
CONCLUSION: Autologous and haploidentical DC-CTLs show significant anti-tumor effects, and haploidentical DC-CTLs do not cause significant GVHD.
- Citation: Li DB, Si HT, Zheng ZG, Ru LN, Xu XM, Xu XY, Cai JH. Adoptive transfer of haploidentical dentritic cell activated cytotoxic T lymphocytes inhibits melanoma growth but does not induce significant graft-versus-host reaction in tumor-bearing mice. Shijie Huaren Xiaohua Zazhi 2015; 23(3): 415-420
- URL: https://www.wjgnet.com/1009-3079/full/v23/i3/415.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i3.415
过继免疫治疗(adoptive immunotherapy)是肿瘤免疫治疗的一种重要方法, 取对肿瘤有免疫力的供者淋巴细胞或取患者自身的免疫细胞在体外活化、增殖后, 再输注患者体内, 使其在患者体内发挥抗肿瘤作用, 目前已成为肿瘤治疗中的有效的新方法[1-4], 并在肿瘤免疫治疗中发展迅速, 但同种异体来源的效应细胞的回输会引起严重的移植物抗宿主反应(graft-versus-host disease, GVHD), 甚至使患者死于严重的并发症, 故抽取的免疫细胞多为自体来源, 但在一些有凝血功能障碍、肝炎及体质虚弱等特殊患者中, 尚无有效的方法来提取其自身的单核细胞并进行体外培养, 从而形成效应细胞进行回输治疗, 近几年来, 半相合基因概念已在国外广泛应用与血液病的治疗[5], 并取得了令人鼓舞的效果, 说明半相合基因来源的效应细胞有避免引起严重GVHD反应并达到治疗效果的可能, 故在本实验中我们采用体外培养半相合基因鼠来源肿瘤特异性细胞毒性T淋巴细胞(the special cytotoxic T lymphocytes activated by dendritic cells, DCs-CTLs), 培养成功后回输荷瘤小鼠, 观察其回输后的GVHD的程度及其抑瘤效果, 拓展肿瘤免疫治疗效应细胞的来源, 为半相合基因来源DCs-CTLs治疗肿瘤提供实验依据.
半相合基因鼠CB6F1(健康♀小鼠C57BL/6与健康♂小鼠BALB/C杂交子一代), 20只, 饲养于河北医科大学实验动物中心(SPF级动物实验室), 实验室许可证号: SYXK(冀)2003-0028. 室内温度控制于24 ℃±l ℃, 保持相对湿度40%-60%, 24 h内12 h光照、12 h无光. 高压消毒笼具、水和垫料, 并且每3 d更换1次, 饲料用钴60灭菌. B16黑色素瘤细胞株购自中国科学院上海细胞库.
1.2.1 黑色素瘤细胞B16培养: 培养基为含10%胎牛血清的RPMI-1640完全培养基, 实验前常规培养及传代.
1.2.2 小鼠肿瘤模型建立: 取对数生长期的B16细胞, 调整浓度至1.8×106/mL, 皮下接种0.90×106个瘤细胞于C57BL/6小鼠肩、背部, 当肿瘤生长至3 mm×3 mm大小时, 判断其模型建立成功.
1.2.3 小鼠CB6F1和小鼠C57BL/6骨髓来源树突状细胞(dendritic cells, DCs)的培养: 采取颈椎脱位法处死小鼠后, 将其置于750 mL/L乙醇中浸泡3 min, 在无菌状态下取出两种小鼠的股骨和胫骨, 将其骨髓冲到无菌培养皿中, 收集培养皿中的骨髓细胞悬液, 于室温下静置4 min溶解红细胞后, 取RPMI-1640培养液洗涤细胞2遍后分装至培养瓶, 并加入完全培养基至5 mL, 再加入rmGM-CSF, 至终浓度25 ng/mL, rmIL-4终浓度至25 ng/mL. 将细胞培养板放入37 ℃, 含50 mL/L CO2的温箱中, 培养至第8天加入rmTNFα(20 ng/mL), 继续培养2 d后, 用吸管吹打后收集所有悬浮的小鼠来源树突状细胞.
1.2.4 DCs表型CD86、CD11c、CD80的检测: 取制备成功的小鼠的DCs悬液, 每管取出细胞数约3×107个, 加入小鼠CD32/16抗体封闭, 孵育后分别加入1 µg小鼠PE-CD80抗体、1 µg PE-CD86抗体和1 µg FITC-CD11c抗体, 经流式细胞仪检测鉴定DCs的纯度和成熟度.
1.2.5 C57BL/6及CB6F1小鼠DC细胞的黑色素瘤抗原负载: 在培养第9天的分别在每毫升C57BL/6小鼠及CB6F1小鼠DC培养基中加入3×106的细胞裂解物, 5 h后加入rmTNF-α, 将培养第9天后的细胞悬液作为负载肿瘤抗原的DCs(TL-DC).
1.2.6 制备肿瘤抗原特异性CTLs细胞: 流式细胞仪检测提取的C57BL/6小鼠及CB6F1小鼠的T淋巴细胞, 经CellQuest软件分析, 鉴定T细胞的纯度. 将CB6F1小鼠和C57BL/6小鼠来源TL-DCs及其相应的T淋巴细胞以1:20的比例混合, 用含rmIL-2(200 U/mL)的RPMI-1640完全培养基调整细胞数为106个/mL, 加入36孔板中, 每孔加至1 mL(约含T淋巴细胞2.5×106, TL-DCs 1.2×105), 置于细胞培养箱中培养, 隔天补充新鲜rmIL-2并半量换液; 至第7天收集细胞, 作为DCs-CTLs效应细胞. 同时以相同条件将T淋巴细胞与肿瘤细胞裂解物混合培养诱导对照CTLs, 取含rmIL-2(200 U/mL)的RPMl-l640完全培养基将细胞数调整为106个/mL, 加入36孔板中, 每孔加至1 mL(约含T淋巴细胞2.5×106, TL-DCs 1.2×105), 置于细胞培养箱中培养, 每2 d半量换液同时补充新鲜rmIL-2; 收集培养至第8天的细胞, 即为效应细胞DCs-CTLs, 同时以相同条件将T淋巴细胞与肿瘤细胞裂解物混合培养诱导对照CTLs.
1.2.7 特异性CTLs细胞的回输: 将30只荷瘤C57BL/6小鼠随机分为3组(对照组、自体治疗组、半相合治疗组), 在回输前每组均给予60Co 7 Gy剂量照射. 对照组、自体治疗组、半相合基因治疗组分别于第10、17天给予自体红细胞1.5×106/只, 自体来源DCs-CTLs效应细胞1.5×106/只, 半相合基因鼠来源的DCs-CTLs效应细胞1.5×106/只经鼠尾静脉回输.
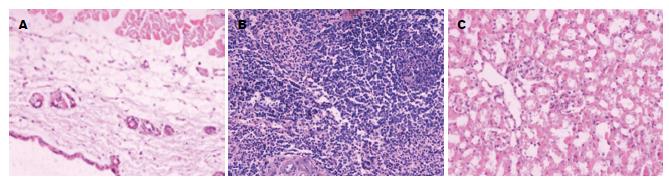
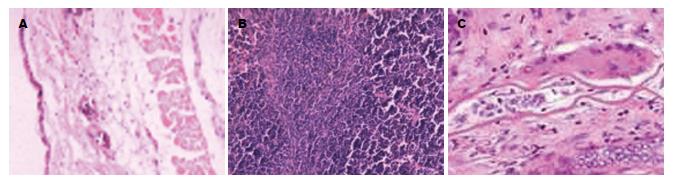
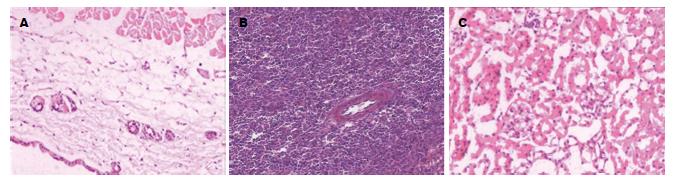
1.2.8 GVHD反应的病理检查及临床评分: 观察回输治疗后各组小鼠有无腹泻、精神萎靡、消瘦、弓背、皮肤溃疡和翘毛等表现, GVHD临床评分[6]依据回输治疗后各组小鼠的活动度是否减弱、体质量下降程度、皮毛改变、姿势及皮肤完整性等采用双人双盲评分, 每项0-2分, 总分10分. 实验结束后分别取各组小鼠皮肤、肾脏和脾脏用4%中性甲醛固定, 石蜡切片后行HE染色, 皮肤GVHD分级根据真皮浅层及小血管周围有无淋巴细胞浸润、表皮基底层细胞有无空泡变性; 脾脏GVHD分级根据脾小体、脾小梁是否消失, 组织结构有无破坏, 有无淋巴细胞浸润及纤维组织增生; 肾脏组织GVHD分级根据肾小球细胞增生程度、单核细胞及淋巴细胞浸润、肾间质中有无中性粒细胞来进行.
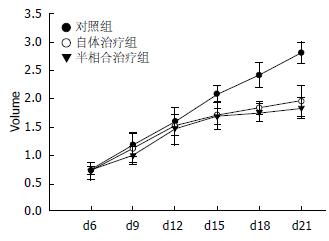
1.2.9 计算肿瘤的抑瘤率并绘制肿瘤生长曲线: 每隔4 d取游标卡尺测量瘤体的短径(a)和长径(b), 根据肿瘤体积计算公式: (V = a×b2/2)计算移植瘤体积, 绘制移植瘤生长曲线; 观察回输治疗4 wk后的瘤质量, 计算抑瘤率. 公式: (对照组瘤质量-实验组瘤质量)/对照组瘤质量×100%.
统计学处理 统计分析采用SPSS15.0统计软件, 多组正态数据间比较用单因素方差分析, 等级资料采用Radit秩和检验, 正态计量资料组间比较用t检验, 计数资料组间比较用χ2检验, P<0.05表示差异有统计学意义.
回输治疗后观察对照组小鼠出现体质量逐渐下降, 部分半相合基因治疗组小鼠出现弓背现象, 自体治疗组小鼠偶有精神差现象, 分别在回输后的第9、15、21天行GVHD临床评分(表1).
实验结束后称量各组小鼠瘤质量并计算各组小鼠的抑瘤率, 自体治疗组和半相合治疗组瘤质量均低于对照组(P<0.05), 自体治疗组和半相合基因治疗组之间瘤质量差异无统计学意义(P>0.05); 对照组与自体治疗组及半相合基因治疗组抑瘤率比较差异有统计学意义(P<0.05), 自体治疗组和半相合基因治疗组之间抑瘤率比较差异无统计学意义(P>0.05)(表2).
恶性黑色素瘤是一种临床上较为少见的恶性肿瘤, 多见于足跟、指趾等部位, 其发病率呈上升趋势, 可发生早期的转移, 有报道可见其可发生胃肠道转移[7,8], 易引起临床误诊, 故在临床上应引起重视.
DC是专职、有效的抗原递呈细胞, 也是目前已知的机体内抗原递呈能力最强的细胞, 其能有效地摄取、加工处理和递呈抗原, 成熟DC能有效激活初始型T细胞[8-11], 而T细胞具有高度的特异性的抗原识别和组织破坏作用, 可识别特异性肿瘤抗原, 故可应用于恶性肿瘤的治疗, 基于上述理论的过继免疫治疗在国内外广泛开展, 已取得明显效果, 在临床肿瘤患者中, 对于一些合并有肝炎、体质虚弱或骨髓瘤等无法提取自身的单核细胞来进行体外培养、并由此形成效应细胞的患者, 外源性效应细胞成为这些患者进行肿瘤免疫治疗的最可能的来源.
GVHD是免疫治疗的严重负反应, 其发生机理主要是由于供受者间的抗原不符, 供者T淋巴细胞识别受者同种异性抗原后活化增殖分化为效应性T淋巴细胞, 对受者免疫器官发动免疫攻击, 从而引起严重的后果. 半相合基因(haploidentical gene)已经在国内外广泛应用于血液病的治疗[12-15], 已有半相合异基因造血干细胞移植成功的报道, 证实了半相合基因来源效应细胞在血液病治疗领域的安全性及有效性, 但其在实体肿瘤治疗方面的报道较少, 由于异体来源MHC抗原不匹配, 以及由此引起的受体的严重的移植物抗宿主反应, 导致异体T细胞难以存活于移植体内的肿瘤组织从而发挥抗肿瘤作用, 为异体效应细胞治疗肿瘤带来了困难[10], 但在医疗实践中, 大多数患者在基因配型上可从直系亲属中找到具有半相合基因的供者, 如果能提取半相合基因来源的T淋巴细胞、体外培养并形成效应细胞后回输患者进行实体肿瘤免疫治疗并能够避免严重的GVHD反应, 则可极大地扩大效应细胞的来源, 为无法提取自身效应细胞的肿瘤患者提供一种新的治愈肿瘤的方法, 基于以上的理论及实验研究成果, 我们在本实验中将半相合基因鼠来源肿瘤特异性DCs-CTLs回输荷黑色素实体瘤小鼠体内, 研究半相合基因来源的效应细胞的抗肿瘤作用及其可能引起的受体的移植物抗宿主反应的严重程度, 结果表明自体治疗组和半相合基因治疗组小鼠治疗后一般状况可, 未见明显移植物抗宿主反应表现, 半相合治疗组及自体治疗组抑制肿瘤生长作用明显, 充分表明在体外的实验中半相合来源DCs-CTLs与自体来源DCs-CTLs治疗实体肿瘤的有效性相当, 未见引起明显的致命性的移植物抗宿主反应, 有研究指出应用高剂量的异体半相合基因供体淋巴细胞治疗会引起严重的不良反应, 从而影响其治疗效果, 本实验中我们未观察到明显的GVHD反应, 其主要原因有可能是小鼠骨髓中淋巴细胞含量较低, 或新分化成熟的供者的T淋巴细胞可能只识别肿瘤组织特异抗原, 不识别次要组织相容性抗原从而导致了异体半相合基因移植后未发生明显的GVHD反应, 总之, 半相合基因DCs-CTLs细胞使肿瘤免疫治疗的效应细胞的来源更加广泛, 为不能获取自体效应细胞的肿瘤患者带来了希望, 但是在下一步的研究中, 采用半相合基因来源的效应细胞进行免疫治疗的效应细胞的回输剂量仍需进一步摸索, 进一步明确GVHD的发病机制, 并可与多种抗肿瘤手段结合, 进一步增强其抗肿瘤效果, 在临床中确保其治疗的安全性、有效性、特异性, 仍是我们需要进一步解决的课题, 本实验研究为半相合基因治疗肿瘤的效果及安全性做了初步的探讨, 为临床应用提供理论依据.
过继免疫治疗是肿瘤免疫治疗的一种重要方法, 恶性黑色素瘤作为一种恶性肿瘤, 发病率有上升趋势, 并可见胃肠道转移, 半相合基因过继免疫治疗可拓宽免疫治疗效应细胞来源, 为免疫抑制等特殊患者治疗肿瘤带来希望.
李小荣, 教授, 中南大学湘雅三医院普外二科
半相合基因来源的效应细胞在白血病领域的治疗已取得明显进展, 在实体肿瘤的免疫治疗中也取得了令人鼓舞的进展, 但半相合基因等异源基因效应细胞可引起严重的移植物抗宿主反应(graft-versus-host disease, GVHD)反应是导致异源基因治疗的瓶颈问题, 有实验研究表明有半相合基因来源的效应细胞引起的GVHD反应是可控并不致引起致命影响, 且治疗效果于自体来源的效应细胞疗效相当, 也有实验研究发现GVHD反应对治疗个体有明显不良反应, 如何进一步研究半相合基因来源的效应细胞引起的GVHD反应的严重程度并预防其不良反应是目前亟待研究的问题.
Pandha等应用过继免疫治疗对于泌尿系统的肿瘤细胞的生长取得了明显的抑制效果, Jester等应用半相合基因用于白血病患者的治疗取得了良好的效果.
通过提取半相合基因来源的效应细胞来对小鼠的黑色素瘤进行过继免疫治疗, 与自体来源的效应细胞相比抑瘤效果相当, 未引起严重的移植物抗宿主反应, 增加肿瘤免疫治疗的效应细胞来源.
半相合基因来源的效应细胞未引起宿主的明显的GVHD反应, 对于异体来源的效应细胞用于肿瘤的免疫治疗提供理论依据.
GVHD: 是免疫治疗的严重负反应, 其发生机理主要是由于供受者间的抗原不符, 供者T淋巴细胞识别受者同种异性抗原后活化增殖分化为效应性T淋巴细胞, 对受者免疫器官发动免疫攻击, 从而引起严重的后果.
该文研究半相合基因特异性细胞毒性T淋巴细胞对小鼠黑色素瘤的影响及GVHD反应, 为黑色素瘤的研究提供一定的理论意义.
编辑:郭鹏 电编:都珍珍
| 1. | Barbuto JA, Ensina LF, Neves AR, Bergami-Santos P, Leite KR, Marques R, Costa F, Martins SC, Camara-Lopes LH, Buzaid AC. Dendritic cell-tumor cell hybrid vaccination for metastatic cancer. Cancer Immunol Immunother. 2004;53:1111-1118. [PubMed] |
| 2. | Pandha HS, John RJ, Hutchinson J, James N, Whelan M, Corbishley C, Dalgleish AG. Dendritic cell immunotherapy for urological cancers using cryopreserved allogeneic tumour lysate-pulsed cells: a phase I/II study. BJU Int. 2004;94:412-418. [PubMed] [DOI] |
| 3. | Hersey P, Halliday GM, Farrelly ML, DeSilva C, Lett M, Menzies SW. Phase I/II study of treatment with matured dendritic cells with or without low dose IL-2 in patients with disseminated melanoma. Cancer Immunol Immunother. 2008;57:1039-1051. [PubMed] |
| 4. | Cooke KR, Kobzik L, Martin TR, Brewer J, Delmonte J, Crawford JM, Ferrara JL. An experimental model of idiopathic pneumonia syndrome after bone marrow transplantation: I. The roles of minor H antigens and endotoxin. Blood. 1996;88:3230-3239. [PubMed] |
| 5. | Burmeister T, Molkentin M, Meyer C, Lachmann N, Schwartz S, Friedrichs B, Beyer J, Blau IW, Lohm G, Tietze-Bürger C. Molecular monitoring of minimal residual disease in two patients with MLL-rearranged acute myeloid leukemia and haploidentical transplantation after relapse. Exp Hematol Oncol. 2012;1:6. [PubMed] [DOI] |
| 6. | Yu JS, Liu G, Ying H, Yong WH, Black KL, Wheeler CJ. Vaccination with tumor lysate-pulsed dendritic cells elicits antigen-specific, cytotoxic T-cells in patients with malignant glioma. Cancer Res. 2004;64:4973-4979. [PubMed] [DOI] |
| 9. | Hershberger PA, He H, McCarthy SA. In vitro thymocyte maturation is associated with reduced cellular susceptibility to Fas-mediated apoptosis. Cell Immunol. 1998;185:134-145. [PubMed] [DOI] |
| 10. | 郭 建巍, 蔡 美英. TH细胞的活化与树突状细胞. 国外医学: 免疫学分册. 2002;25:13-16. |
| 11. | Viney JL. Dendritic cell subsets: the ultimate T cell differentiation decision makers? Gut. 1999;45:640-641. [PubMed] [DOI] |
| 12. | Hao S, Yuan J, Xu S, Munegowda MA, Deng Y, Gordon J, Xing Z, Xiang J. Antigen specificity acquisition of adoptive CD4+ regulatory T cells via acquired peptide-MHC class I complexes. J Immunol. 2008;181:2428-2437. [PubMed] |
| 13. | Jester S, Larsson J, Eklund EA, Papadopoulou D, Månsson JE, Békássy AN, Turkiewicz D, Toporski J, Øra I. Haploidentical stem cell transplantation in two children with mucopolysaccharidosis VI: clinical and biochemical outcome. Orphanet J Rare Dis. 2013;8:134. [PubMed] [DOI] |
| 14. | Xu PF, Duan LN, Luo Y, Wang Z, Lu CR, Xiang PD, Lei YY. [Treatment of leukemia with immunized donor cell infusion after nonmyeloablative haploidentical bone marrow transplantation]. Zhongguo Shi Yan Xue Ye Xue Za Zhi. 2013;21:711-715. [PubMed] [DOI] |