修回日期: 2014-10-30
接受日期: 2014-12-08
在线出版日期: 2015-01-28
目的: 探究原花青素(proanthocyanidins, PA)对肠缺血再灌注(ischemia-reperfusion, I/R)损伤大鼠肠道运动功能的影响及可能的机制.
方法: 28只SD大鼠随机分为假手术组(A组), 肠I/R组(B组), 原花青素低剂量组(C组), 原花青素高剂量组(D组), 每组7只. C组给予原花青素[100 mg/(kg·d)]、D组给予原花青素[200 mg/(kg·d)]预处理, 其余两组灌胃等量生理盐水, 连续给药5 d. 夹闭肠系膜上动脉(superior mesenteric artery, SMA)1 h后再灌注4 h建立肠I/R损伤大鼠模型, 取回肠组织测定平滑肌收缩力、制备肠组织匀浆测定髓过氧化物酶(myeloperoxidse, MPO)活性, 腹主动脉取血离心测定血清肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)含量.
结果: 肠I/R后肠道平滑肌收缩力频率、振幅和活力, 较A明显减弱(P<0.01), D组平滑肌的振幅为0.37 g, 较B组显著升高(P<0.05), C和D组肠道平滑肌收缩力的活力, 较B组有升高趋势; 肠I/R后血清TNF-α含量达178.03 pg/mL, 较A组明显升高(P<0.05), 给予原花青素预处理后血清TNF-α含量为108.97 pg/mL和98.71 pg/mL, 与B组相比显著降低(P<0.05), 并且C、D组肠组织匀浆MPO活性较B组呈降低的趋势.
结论: 原花青素可能通过减少血清TNF-α含量和降低肠组织MPO活性来减轻肠I/R损伤, 保护肠道平滑肌运动功能.
核心提示: 原花青素可以减少血清肿瘤坏死因子-α(tumor necrosis factor α)含量和降低肠组织髓过氧化物酶(myeloperoxidse)活性, 减轻缺血肠段的炎症反应, 进而减轻对Cajal间质细胞(interstitial cells of Cajal)的损伤, 这是改善肠道的运动功能和减轻肠缺血再灌注损伤的又一个亮点.
引文著录: 罗兰, 宋强, 李禹呈, 杨拯, 陈勇, 唐丽娟, 李欣芮, 杨悦璠, 杨森, 严洁, 黄倩. 原花青素对肠缺血再灌注大鼠平滑肌运动功能的保护作用. 世界华人消化杂志 2015; 23(3): 409-414
Revised: October 30, 2014
Accepted: December 8, 2014
Published online: January 28, 2015
AIM: To investigate the protective effects of proanthocyanidins (PA) on intestinal smooth muscle contractility in rats with ischemia-reperfusion (I/R) and explore the possible mechanism.
METHODS: Twenty-eight male SD rats were randomly divided into four groups (n = 7 for each group): A (sham group), B (I/R group), C (100 mg/kg PA group) and D (200 mg/kg PA group). Groups C and D were pretreated with 100 and 200 mg/(kg·d) PA for 5 days, group D was administrated 200 mg/(kg·d) PA, and the other two groups were administrated equal volume of physiological saline for the same duration. Intestinal I/R injury was induced by occlusion of the superior mesenteric artery (SMA) for 1 h and followed by a period of reperfusion for 4 h. Following reperfusion, the abdominal cavity was opened and segments of the ileum were quickly resected and equally separated into two parts to determine ileal smooth muscle contractility and tissue myeloperoxidse (MPO). Additionally, blood samples were collected to detect serum tumor necrosis factor-α (TNF-α).
RESULTS: The frequency, amplitude and vitality of intestinal smooth muscle contractility in group B were significantly decreased compared with group A (P < 0.01). Pretreatment with 200 mg/kg PA caused a significant increase in ileal smooth muscle contractility amplitude compared with group B (P < 0.05). Besides, both C and D groups showed an increasing trend in conparison with group B in the vitality of intestinal smooth muscle contractility. After I/R induction, the level of serum TNF-α was increased significantly (P < 0.05). Pretreatment with PA at 100 and 200 mg/kg significantly decreased the levels of serum TNF-α compared with group B (P < 0.05). Intestinal tissue MPO activity also showed a decreasing trend.
CONCLUSION: PA may reduce serum TNF-α levels and MPO activity and promote intestinal motility in rats with intestinal I/R injury.
- Citation: Luo L, Song Q, Li YC, Yang Z, Chen Y, Tang LJ, Li XR, Yang YF, Yang S, Yan J, Huang Q. Protective effects of proanthocyanidins on intestinal smooth muscle contractility in rats with intestinal ischemia-reperfusion injury. Shijie Huaren Xiaohua Zazhi 2015; 23(3): 409-414
- URL: https://www.wjgnet.com/1009-3079/full/v23/i3/409.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i3.409
缺血再灌注(ischemia-reperfusion, I/R)损伤是指发生缺血后的组织器官在恢复血供后机体损伤反而加重的现象[1,2]. 严重外伤、大面积烧伤、小肠移植、机械性肠梗阻等病理过程中均存在不同程度的I/R损伤[3-5]. 而各种原因引起的肠I/R损伤会使肠道平滑肌收缩力减弱, 并且常导致黏膜屏障受损、细菌移位等严重后果, 甚至引起多脏器功能衰竭综合征(multiple organdies function syndrome, MODS)[6]. 由于内脏器官中肠道是对缺血性损伤最为敏感的器官, 并且肠系膜再灌注损伤与多器官功能的衰竭有关[7]. 研究[8,9]发现, 肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和白介素6(interleukin-6, IL-6)等可参与全身炎症反应并导致多器官功能障碍的发生. 而肠道作为细胞因子产生器官, 是肠I/R时TNF-α等细胞因子产生的来源[10], 并且TNF-α核心作用是促进中性粒细胞的黏附和浸润, 在介导炎症反应中起重要作用. 此外, 髓过氧化物酶(myeloperoxidse, MPO)主要存在于中性粒细胞的嗜天青颗粒中, 由活化的中性粒细胞产生, 是评价中性粒细胞在组织中浸润程度的可靠指标之一.
原花青素是一类多酚类化合物的总称, 属于生物类黄酮, 具有强大的抗氧化、抗炎作用. 学者发现原花青素能明显减轻心肌[11]、肾[12]等组织I/R损伤的程度, 其强大的生物学活性和药理作用有益于人类健康. 但是有关原花青素减轻肠I/R损伤的报告确很少. 因此本研究探讨了原花青素对肠I/R损伤后肠道可能的保护作用及机制, 旨在为减轻肠I/R损伤寻找一种新途径和提供理论依据.
MPO ELISA试剂盒(武汉基因美生物技术有限公司, 批号201305)、TNF-α ELISA试剂盒(武汉基因美生物技术有限公司, 批号201305); 原花青素(四川省维克奇生物科技有限公司, 批号120406, 纯度UV≥95); 戊巴比妥钠(北京化学试剂公司); TGL•16G台式离心机(上海安亭科学仪器厂); 680酶标仪、洗板机(BIO-RAD, USA).
1.2.1 动物分组: 28只成年的清洁级♂SD大鼠, 体质量为200 g±20 g, 由四川省医学科学院•四川省人民医院实验动物研究所提供, 许可证号: SCXK(川)2013-15. 随机分为4组: 假手术组(A组)、肠I/R组(B组)、原花青素低剂量组(C组)、原花青素高剂量组(D组), 每组7只.
1.2.2 动物日常护理和预处理措施: 实验大鼠置于清洁鼠笼中单独喂养, 给予充足饲料, 自由饮水. 每天观察记录大鼠精神状况, 若大鼠出现异常表现则及时记录. C组每只大鼠每天灌胃原花青素100 mg/kg, D组每只大鼠每天灌胃原花青素200 mg/kg, A组和B组大鼠每天灌胃等量生理盐水, 连续灌胃5 d, 最后1次灌胃为造模前2 h.
1.2.3 肠I/R动物模型制备: 大鼠在造模前12 h开始禁食, 自由饮水. 称质量后腹腔注射1.5%戊巴比妥钠麻醉, 腹正中备皮消毒, 作2 cm左右切口打开腹腔, 分离并暴露肠系膜上动脉, 用无损伤动脉夹夹闭肠B组、C组和D组大鼠的SMA根部至其邻近动脉变白[13], 复制缺血模型. 将沾有温生理盐水的纱布覆盖于切口上以防细菌感染, 放置到温暖环境. 1 h后经切口进入腹腔, 取出动脉夹, 逐层缝合切口关闭腹腔, 恢复血供4 h, 手术严格遵循无菌原则, A组进行同样操作但不夹闭肠系膜上动脉.
1.2.4 制备肠组织匀浆及血清: 各组大鼠麻醉成功后, 分别于恢复血供后的4 h, 打开腹腔, 取距回盲部2 cm处的回肠段2 cm, 漂洗去除肠内容物, 剪除肠系膜, 滤纸吸干, 称质量, 放入50 mL的小烧杯中, 量取生理盐水, 其体积为肠组织重量的9倍, 取生理盐水总量的2/3加入烧杯中, 用眼科剪剪碎组织(在冰水浴中进行), 将剪碎的组织倒入玻璃匀浆管中, 再将剩余的1/3生理盐水冲洗残留在烧杯中的碎组织块, 一起倒入匀浆管中进行匀浆, 左手持匀浆管将下端插入盛有冰水混合物的器皿中, 右手将捣杆垂直插入套管中, 上下转动研磨数十次(6-8 min), 充分研碎, 使组织匀浆化, 将制备好的10%匀浆用普通离心机3500 r/min离心15 min, 取上清液, 存于-80 ℃冰箱. 分离腹主动脉取血3 mL, 在室温下静置30 min, 3500 r/min, 离心15 min后, 收集血清, -80 ℃条件下保存备用.
1.2.5 平滑肌收缩力的测定: 剪取距回盲部位向上4 cm处的回肠2 cm, 去除肠内容物后, 固定于装有台式液的恒温37 ℃平滑肌槽内, 另一端连接张力换能器, 打开生物机能实验系统BL-410E测定回肠平滑肌收缩活动, 待出现类似正余弦的稳定波形后开始记录, 灵敏度选择: 扫描速度设为1.00 s/div, 电增益为2 mV, 时间常数3 s, 高频滤波10 Hz, 连续记录30 min. 同时持续向平滑肌斜槽中通入每秒产一个气泡的空气, 并及时更换台式液. 回肠平滑肌收缩活力 = 回肠收缩频率×回肠收缩振幅.
1.2.6 检测血清TNF-α含量、MPO活性: 采用ELISA法检测血清中TNF-α含量和匀浆MPO的活力, 按试剂盒说明操作, 用酶标仪在450 nm波长下测定光密度(A)值(450 nm), 根据标准曲线计算样品中TNF-α含量、MPO活力.
统计学处理 实验数据均使用SPSS17.0统计软件包分析处理, 结果用mean±SD表示, 各组均数比较采用单因素方差分析(one-way ANOVA), 选择Levene方法进行方差齐性检验, 符合方差齐性要求采Student-Newman-Keuls法(SNK)对数据进行组间比较, 检验水准取α = 0.05, 当P<0.05为差异具有统计学意义.
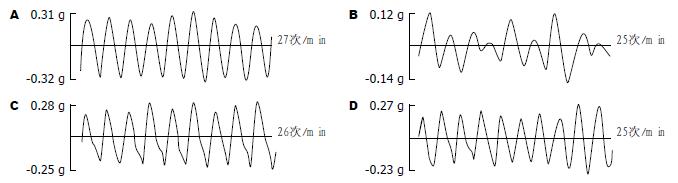
与A组比较, B组大鼠肠收缩活力值降低(P<0.01), 主要表现为频率减慢、振幅减小. 与B组比较, C组和D组平滑肌大鼠收缩力活力值差异均无统计学意义, 但D组振幅显著增强(P<0.05), 且趋于A组(P<0.01)(表1). A组回肠平滑肌收缩波形整齐稳定, 呈类似正余弦波形; B组波形频率较低, 振幅较弱, 且呈不规则状; C组和D组波形较稳定规则, 波峰波谷明显, 振幅较宽大(图1).
再灌注4 h后, B组血清TNF-α的含量升高, 且与A组相比差异具有统计学意义(P<0.01). 给予原花青素预处理后, C组和D组大鼠血清TNF-α的含量与B相比均显著降低(P<0.05), 且D组更趋近A组(表2).
| 分组 | 血清TNF-α(pg/mL) | 匀浆MPO (U/L) |
| A组 | 91.22±45.13 | 12.40±1.62 |
| B组 | 178.03±35.76b | 14.52±3.19 |
| C组 | 108.97±84.26c | 11.63±3.88 |
| D组 | 98.71±28.08c | 12.74±2.74 |
肠I/R后, 肠组织匀浆中MPO的活性与A组相比有明显升高的趋势, 但差异无统计学意义, 给予原花青素预处理后, 肠组织中MPO的活性较B组有明显下降的趋势, 但差异无统计学意义(表2).
原花青素属于生物类黄酮, 具有大的活性酚羟基, 因此有较强的清除各种活性氧自由基的能力. 葡萄籽原花青素在体内的清除自由基的能力是维生素C的20倍、维生素E的50倍[14], 因此原花青素具有强大的抗氧化功能. 此外, 原花青素可通过降低由炎性介质引起的毛细血管通透性的增高, 使毛细血管的脆性和张力减小, 保护毛细血管内的物质转运, 从而发挥抗炎作用. 研究[15]发现, 原花青素的抗炎作用可能与其清除自由基能力有关.
TNF-α主要来自单核/巨噬细胞以及T淋巴细胞, 而大量的巨噬细胞存在于小肠黏膜的固有层, 其可在内毒素、病毒和其他细胞因子的刺激下由不同的细胞分泌, 是促炎症因子连锁反应中的一个关键性介质[16], 而且TNF-α能刺激内皮细胞生成白介素等细胞活性因子和炎性介质, 对血管内皮细胞能产生直接不良反应, 进而损伤血管内皮, 增高毛细血管通透性, 血浆蛋白液渗入组织间隙使机体发生毛细血管通透性综合症, 并诱导黏附分子的活化、表达, 使血小板等黏附于内皮, 引起血管内凝血而加重组织器官的损伤[17]. 此外, 研究[18]表明炎症反应时大量的中性粒细胞活化. 而外界刺激可导致中性粒细胞聚集合成释放MPO并贮存于嗜天青颗粒内, 因此MPO的活力可作为中性粒细胞标志物是定量反应白细胞浸润的可靠指标[19]. 在肠I/R过程中常伴随氧自由基ROS等对各种组织细胞的损伤, 使细胞结构和功能受到破坏, 甚至导致细胞凋亡, 而中性粒细胞是ROS的主要来源[18]. 研究[20]显示, 原花青素能有效的清除氧自由基ROS. 而且本实验研究发现, 肠I/R后血清TNF-α含量明显增高, 肠组织MPO活性大幅提高, 说明再灌注后4 h后有炎性反应的发生. 而原花青素预处理后, 血清TNF-α含量显著降低, 肠组织MPO活性呈下降趋势, 尤其是原花青素高剂量组, 表明原花青素对减轻肠I/R后炎性反应有一定作用.
Shimojima等[21]发现, 肠I/R后肠道平滑肌的Cajal间质细胞减少, 使回肠收缩频率和振幅都有一定程度的减弱, 表现为肠蠕动功能障碍. Cheng等[22]报道, 在正常的循环中肠蠕动是一种自主的节律性运动, 与神经、激素和其他因素相关. 胃肠运动主要由交感、副交感神经系统、肠神经系统和Cajal间质细胞组成的肠神经细胞网络发挥平衡和协调作用[23]. 当肠神经系统受损后, 会阻碍胃肠道慢波基础上产生的动作电位, 从而抑制肠道平滑肌的收缩运动[24,25]. 而且肠道自主节律性运动的维持依赖Cajal间质细胞, 他是胃肠道的起搏细胞和兴奋传导细胞[26]. 如果肠I/R后的炎症反应导致Cajal间质细胞损伤, 可表现为收缩力异常, 进而导致肠道蠕动功能的障碍. 本实验结果显示, 手术后肠I/R组大鼠平滑肌收缩力的频率, 振幅, 活力值较假手术组都有明显的减低, 而与肠I/R组相比, 原花青素高剂量组回肠平滑肌收缩力的振幅显著增加. 说明肠I/R后的炎症反应可能损伤了Cajal间质细胞, 而经高剂量的原花青素预处理后收缩力的功能有了明显的改善, 因此说明原花青素可能通过减轻I/R后炎症反应保护Cajal间质细胞, 进而保护肠道运动功能.
原花青素的药用价值已经得到社会广泛的关注, 已经证实[27]有抗氧化、抗炎、抗凋亡、防癌、保护心血管等多种药用理化特性, 我们的实验结果也发现原花青素预处理能降低血清TNF-α含量和肠组织MPO活性, 减轻肠I/R后炎性反应进而改善肠道平滑肌收缩功能. 此外原花青素还具有多靶点的特性, 他能减轻肠I/R后的肺脏、肝脏和肾脏的氧化损伤[7], 因此原花青素保护肠道运动功能是否与其抗氧化、抗凋亡的作用有关以及其具体的给药剂量还有待后续深入研究.
目前国内外对缺血再灌注损伤后肠道平滑肌的运动功能研究较少, 而正常的肠道运动功能是维持人体正常生理功能的重要因素, 有研究显示肠缺血再灌注产生的肿瘤坏死因子-α(tumor necrosis factor, TNF-α)和髓过氧化物酶(myeloperoxidse, MPO)等炎症因子是造成肠道运动功能减弱的主要因素, 所以减轻肠缺血再灌注后的炎症反应是保护肠运动功能的主要途径之一.
孙星, 副教授, 副主任医师, 上海交通大学附属第一人民医院普外科
对于肠I/R损伤后肠道运动功能障碍的机制研究尚少, 减少炎症因子的含量已成为治疗的重点. 已经有文献提示肠缺血再灌注损伤后TNF-α的含量升高及MPO的活性增强这一现象, 这为治疗肠缺血再灌注损伤后胃肠运动功能障碍提供新思路.
有学者已经提示原花青素可以减少肠缺血再灌注后氧自由基的产生来保护肠道运动功能, 之后有学者研究显示也可通过调节炎症因子来实现, 对于其改善肠道平滑肌运动功能的具体机制尚未见报道.
本研究通过实验性研究原花青素对肠缺血再灌注损伤后TNF-α含量和MPO活性的影响, 并阐明其通过减少TNF-α含量和降低MPO活性实现, 是既往未曾报道过的. 本研究中直接检测血清中TNF-α含量、肠组织中MPO活性改变及肠道平滑肌运动功能的宏观指标(慢波和收缩力), 更直接、更科学的反映肠运动功能改变.
本研究方法中关于TNF-α含量和MPO活性变化程度, 是今后肠缺血再灌注损伤研究应借鉴的, 抑制肠缺血再灌注后的炎症反应是今后临床治疗的又一方向.
原花青素具有清除自由基、抗氧化作用, 具有减轻I/RI理论基础, 目前尚无原花青素减轻肠道IRI的研究. 本实验设计严密, 思路清晰, 通过回肠平滑肌收缩力、MPO活性、TNF-α的含量来判断IRI的程度, 具有较好的学术价值.
编辑:郭鹏 电编:都珍珍
| 1. | Yildiz Y, Serter M, Ek RO, Ergin K, Cecen S, Demir EM, Yenisey C. Protective effects of caffeic acid phenethyl ester on intestinal ischemia-reperfusion injury. Dig Dis Sci. 2009;54:738-744. [PubMed] [DOI] |
| 2. | Mallick IH, Yang W, Winslet MC, Seifalian AM. Ischemia-reperfusion injury of the intestine and protective strategies against injury. Dig Dis Sci. 2004;49:1359-1377. [PubMed] |
| 3. | Patai AV, Molnár B, Tulassay Z, Sipos F. Serrated pathway: alternative route to colorectal cancer. World J Gastroenterol. 2013;19:607-615. [PubMed] [DOI] |
| 4. | Kassahun WT, Schulz T, Richter O, Hauss J. Unchanged high mortality rates from acute occlusive intestinal ischemia: six year review. Langenbecks Arch Surg. 2008;393:163-171. [PubMed] [DOI] |
| 5. | Pierro A, Eaton S. Intestinal ischemia reperfusion injury and multisystem organ failure. Semin Pediatr Surg. 2004;13:11-17. [PubMed] |
| 6. | Sparkes BL, Slone EE, Roth M, Welti R, Fleming SD. Intestinal lipid alterations occur prior to antibody-induced prostaglandin E2 production in a mouse model of ischemia/reperfusion. Biochim Biophys Acta. 2010;1801:517-525. [PubMed] [DOI] |
| 7. | Sizlan A, Guven A, Uysal B, Yanarates O, Atim A, Oztas E, Cosar A, Korkmaz A. Proanthocyanidin protects intestine and remote organs against mesenteric ischemia/reperfusion injury. World J Surg. 2009;33:1384-1391. [PubMed] [DOI] |
| 9. | 张 树平, 胡 涛, 栾 海云, 李 庆忠, 李 淑翠, 刘 金苹. 肠缺血再灌注大鼠肺及血液白细胞介素6、白细胞介素8和肿瘤坏死因子α变化与辅酶Q10的干预. 中国组织工程研究与临床康复. 2007;11:5429-5431. |
| 10. | Yao Y, Yu Y, Wu Y, Shi Z, Sheng Z. The role of gut as a cytokine-generating organ in remote organ dysfunction after intestinal ischemia and reperfusion. Chin Med J (Engl). 1998;111:514-518. [PubMed] |
| 11. | Guler A, Sahin MA, Yucel O, Yokusoglu M, Gamsizkan M, Ozal E, Demirkilic U, Arslan M. Proanthocyanidin prevents myocardial ischemic injury in adult rats. Med Sci Monit. 2011;17:BR326-BR331. [PubMed] |
| 12. | Wei R, Ding R, Wang Y, Tang L. Grape seed proanthocyanidin extract reduces renal ischemia/reperfusion injuries in rats. Am J Med Sci. 2012;343:452-457. [PubMed] [DOI] |
| 13. | Zhang T, Wang Y, Ban R, Tong L, Qiao H, Lao H, Zhao H, Jiang X, Sun X, Zhang F. Oral administration of lactoferrin attenuates intestinal ischemia-reperfusion injury in rats. Eur Surg Res. 2012;49:99-106. [PubMed] [DOI] |
| 14. | Bagchi D, Bagchi M, Stohs SJ, Das DK, Ray SD, Kuszynski CA, Joshi SS, Pruess HG. Free radicals and grape seed proanthocyanidin extract: importance in human health and disease prevention. Toxicology. 2000;148:187-197. [PubMed] |
| 15. | Dongmo AB, Kamanyi A, Anchang MS, Chungag-Anye Nkeh B, Njamen D, Nguelefack TB, Nole T, Wagner H. Anti-inflammatory and analgesic properties of the stem bark extracts of Erythrophleum suaveolens (Caesalpiniaceae), Guillemin & amp; Perrottet. J Ethnopharmacol. 2001;77:137-141. [PubMed] |
| 17. | Yamamoto S, Tanabe M, Wakabayashi G, Shimazu M, Matsumoto K, Kitajima M. The role of tumor necrosis factor-alpha and interleukin-1beta in ischemia-reperfusion injury of the rat small intestine. J Surg Res. 2001;99:134-141. [PubMed] |
| 18. | Pergel A, Kanter M, Yucel AF, Aydin I, Erboga M, Guzel A. Anti-inflammatory and antioxidant effects of infliximab in a rat model of intestinal ischemia/reperfusion injury. Toxicol Ind Health. 2012;28:923-932. [PubMed] [DOI] |
| 20. | 谢 少华, 杨 拯, 龚 都, 张 尧, 余 婷, 高 建华, 杨 海燕, 李 晓, 马 延仃, 张 晓. 原花青素对脊髓损伤大鼠运动功能的影响. 中国康复理论与实践. 2012;18:831-833. |
| 21. | Shimojima N, Nakaki T, Morikawa Y, Hoshino K, Ozaki H, Hori M, Kitajima M. Interstitial cells of Cajal in dysmotility in intestinal ischemia and reperfusion injury in rats. J Surg Res. 2006;135:255-261. [PubMed] |
| 22. | Cheng W, Lui VC, Chen QM, Tam PK. Enteric nervous system, interstitial cells of cajal, and smooth muscle vacuolization in segmental dilatation of jejunum. J Pediatr Surg. 2001;36:930-935. [PubMed] |
| 23. | Jessen KR, Mirsky R. Glial cells in the enteric nervous system contain glial fibrillary acidic protein. Nature. 1980;286:736-737. [PubMed] |
| 24. | Ward SM, McLaren GJ, Sanders KM. Interstitial cells of Cajal in the deep muscular plexus mediate enteric motor neurotransmission in the mouse small intestine. J Physiol. 2006;573:147-159. [PubMed] |
| 25. | Ward SM, Beckett EA, Wang X, Baker F, Khoyi M, Sanders KM. Interstitial cells of Cajal mediate cholinergic neurotransmission from enteric motor neurons. J Neurosci. 2000;20:1393-1403. [PubMed] |
| 26. | Abdo H, Derkinderen P, Gomes P, Chevalier J, Aubert P, Masson D, Galmiche JP, Vanden Berghe P, Neunlist M, Lardeux B. Enteric glial cells protect neurons from oxidative stress in part via reduced glutathione. FASEB J. 2010;24:1082-1094. [PubMed] [DOI] |
| 27. | Xu Z, Du P, Meiser P, Jacob C. Proanthocyanidins: oligomeric structures with unique biochemical properties and great therapeutic promise. Nat Prod Commun. 2012;7:381-388. [PubMed] |