修回日期: 2015-08-18
接受日期: 2015-08-31
在线出版日期: 2015-10-08
目的: 构建乙型肝炎病毒X基因(hepatitis B virus x, HBx)慢病毒表达载体, 建立稳定表达HBx蛋白的人正常肝细胞系Chang liver-HBx.
方法: 应用聚合酶链式反应(polymerase chain reaction, PCR)方法从质粒中扩增HBx基因, 并克隆到慢病毒pEB-3xflag-GP-Puro载体上, 经PCR、酶切和测序鉴定正确后经慢病毒包装感染人肝细胞Chang liver, 再用嘌呤霉素筛选出稳定表达HBx蛋白的细胞株, 最后用免疫荧光和Western blot技术检测HBx蛋白的表达.
结果: 酶切鉴定和基因测序证实HBx基因成功克隆到慢病毒表达载体上, 重组慢病毒经包装纯化后获得滴度为1×108 TU/mL, 用包装好的重组慢病毒感染人肝细胞Chang liver, 经嘌呤霉素筛选获得单克隆细胞株Chang liver-HBx, 利用免疫荧光和Western blot技术检测发现细胞株Chang liver-HBx可稳定表达HBx蛋白.
结论: 成功构建了HBx的重组慢病毒表达载体, 获得了稳定表达HBx的Chang liver细胞系Chang liver-HBx, 为进一步研究HBx诱导正常肝细胞恶性转化提供细胞模型.
核心提示: 乙型肝炎病毒X(hepatitis B virus x, HBx)是诱导肝细胞恶性转化的关键分子. 研究发现HBx能激活生长信号, 或抑制P53的转录调节功能, 促进肝细胞的恶性转化. 本研究成功构建pEB-GFP-HBx载体, 并成功转染Chang Liver细胞, 为研究HBx诱导肝细胞恶性转化建立了细胞模型.
引文著录: 鲁琰, 朱明月, 张雪儿, 李伟, 董栩, 陈栘, 林波, 郭峻莉, 李孟森. 慢病毒-HBx表达载体的构建及其在人正常肝细胞系Chang liver的稳定表达. 世界华人消化杂志 2015; 23(28): 4482-4489
Revised: August 18, 2015
Accepted: August 31, 2015
Published online: October 8, 2015
AIM: To construct a lentiviral expression vector carrying the hepatitis B virus x (HBx) gene and to test its expression in the human Chang liver cell line.
METHODS: The HBx gene was amplified from plasmid pcDNA3.1-HBx by PCR. The purified HBx gene fragment was inserted into the pEB-3xflag-GP-Puro lentiviral vector, and the inserted fragment was identified by PCR, restriction endonuclease digestion and DNA sequencing. The recombinant vector was then transfected into Chang liver cells. Puromycin was applied to screen stable cell clones, and the expression of HBx in Chang liver cells was examined by immunofluorescence and Western blot.
RESULTS: Restriction enzyme digestion and DNA sequencing showed that the HBx gene had been successfully subcloned into the pEB-3xflag-GP-Puro vector. The titer of purified recombinant lentivirus was 1 × 108 TU/mL. HBx was produced after transfection with the recombinant lentivirus vector and screening with puromycin. Stable expression of HBx protein was present in Chang liver-HBx cells.
CONCLUSION: The Chang liver-HBx cell line that can stably express the HBx gene has been successfully generated; this model cell may be applied to study the role of HBx in the malignant transformation of liver cells.
- Citation: Lu Y, Zhu MY, Zhang XE, Li W, Dong X, Chen Y, Lin B, Guo JL, Li MS. Construction of a lentiviral expression vector of HBx and its stable expression in human Chang liver cell line. Shijie Huaren Xiaohua Zazhi 2015; 23(28): 4482-4489
- URL: https://www.wjgnet.com/1009-3079/full/v23/i28/4482.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i28.4482
乙型肝炎病毒(hepatitis B virus, HBV)的慢性感染是促进原发性肝癌(hepatocellular carcinoma, HCC)形成的主要诱因, 其相关性高达80%[1]. HBV是嗜肝DNA病毒科中正类嗜肝DNA病毒属的一员, 基因组全长约3.2 kb, 有4个开放阅读框架, 即包膜(S)、核心(C)、多聚酶(P)、X基因区[2]. 由X基因编码的HBx蛋白由154个氨基酸残基组成, 分子量约为17.5 kDa. 目前, 大部分研究[3]表明HBx蛋白可以在慢性肝炎患者体内产生, HBx本身不能直接与双链DNA结合, 而是通过蛋白质与蛋白质之间的相互作用来行使功能[4,5]. 肝癌的基本特征是肝细胞的调节紊乱, 造成调节细胞生长因子和诱导细胞死亡因素之间的失衡. 近年来, 越来越多的证据表明HBx可以与肝细胞核内外的大量蛋白质分子发生作用[6,7], 来调节肝细胞的增殖和凋亡, 造成肝细胞的调节紊乱和增殖异常, 最终导致肝细胞的恶性转化和浸润转移. 但是, HBx蛋白的生物学特性与原发性肝癌发生的具体关系目前尚不清楚. 所以构建稳定表达HBx蛋白的细胞模型显得非常必要, 本研究尝试构建HBx的慢病毒表达载体, 并将载体转染到人正常肝细胞Chang liver中筛选出稳定表达HBx的细胞株, 这将为进一步研究HBx的生物学功能和致病机制提供细胞模型.
人肝细胞Chang liver购自中国科学院上海细胞库; 限制性内切酶、DNA连接酶、DNA marker均购自Takara公司; PCR产物纯化试剂盒、质粒抽提试剂盒购自上海生工生物技术有限公司; 慢病毒表达系统由广州辉骏生物技术有限公司提供; DMEM培养基、胰酶消化液购自Gibico公司; 胎牛血清购自北京四季青生物技术有限公司; 嘌呤霉素购自Sigma公司; 特异性鼠抗人HBx抗体购自美国Abcam公司; β-actin抗体和马抗小鼠的IgG抗体购自美国Santa Cruz公司.
1.2.1 HBx基因的获取: 从质粒pcDNA3.1-HBx(本实验室保存)中扩增HBx基因, 上游引物为5'-GATTCTAGAATGGCTGCTAGGCTGTGCTG-3', 内含XbaⅠ酶切位点; 下游引物为5'-GAGGAATTCGGCAGAGGTGAAAAAGTTGCATGG-3', 内含EcoRⅠ酶切位点.
1.2.2 重组质粒的构建和鉴定: 上述PCR扩增的目的基因片段和慢病毒载体pEB-3xflag-GP-Puro经限制性内切酶XbaⅠ、EcoRⅠ双酶切过夜后, 用T4连接酶16 ℃连接过夜, 连接产物转化到感受态细胞大肠杆菌XL1- BLUE, 用含有氨苄青霉素的LB平板筛选出阳性克隆, 扩大培养后提取质粒, 进行PCR扩增和酶切鉴定, 将上述两种方法鉴定正确的质粒送中美泰和生物技术有限公司(中国广州)测序.
1.2.3 慢病毒包装和滴度测定: 预先准备生长汇合度为70%-80%的293T细胞, 次日将连接载体pEB-GFP-HBx与转染试剂Fitran混合, 转染293T细胞, 并用DMEM培养基培养. 在转染后48 h和72 h分别收集上清, 3000 r/min 4 ℃离心10 min, 取上清用0.45 μm微孔滤器过滤. 并用5×PEG8000溶液浓缩慢病毒颗粒.
以每孔1×104个细胞的浓度将293T细胞铺入96孔板, 24 h后将浓缩后的慢病毒按梯度稀释, 依次加入细胞培养孔中. 培养96 h后观察荧光表达情况, 数出最大稀释倍数孔中含有荧光细胞的个数; 病毒原液的滴度值(TU/mL) = 荧光细胞个数/稀释后的病毒实际体积.
1.2.4 重组慢病毒转染正常人肝脏Chang liver细胞系并筛选稳定表达株: 按照常规方法培养正常人肝脏Chang liver细胞, 并在转染前用胰酶消化液处理细胞重新传入细胞培养瓶中; 24 h后向细胞中加入200 μL重组慢病毒颗粒. 感染4 h后更换培养液, 并用不含目的基因的空载体作为对照.
在感染96 h后在荧光显微镜下观察到绿色荧光, 加入终浓度为10 μg/mL的嘌呤霉素, 筛选稳定表达的细胞株. 挑取嘌呤霉素抗性的单细胞克隆于96孔板、24孔板、6孔板逐级扩大培养, 经过14 d后建立稳定表达HBx的Chang liver细胞系.
1.2.5 免疫荧光检测HBx基因的表达: 盖玻片经清洗灭菌后放置于6孔板中, 将稳定转染HBx基因的Chang liver细胞株(命名为Chang liver-HBx细胞)加入6孔板中, 每孔2×104个细胞. 24 h后用4%的多聚甲醛固定细胞30 min, PBS清洗3次后加入5%的BSA封闭液封闭1 h, 在盖玻片上滴加HBx抗体(1:200稀释, Abcam, USA)4 ℃过夜. 次日, 将盖玻片在PBS中清洗3次, 将其放在载玻片上滴加Alexa Fluor-594标记的荧光二抗(1:200稀释, Abcam, USA), 37 ℃避光杂交1 h. 用PBS清洗3次后封片. 用激光共聚焦显微镜观察标记结果并拍照.
1.2.6 Western blot技术检测HBx蛋白: 分别收集稳定转染HBx基因的Chang liver-HBx细胞、转染空载体的Chang liver-EGFP细胞以及野生型细胞Chang liver, 提取细胞总蛋白并用Bradford法进行蛋白定量. 根据蛋白浓度每孔上样50 μg蛋白, 用15%的SDS-PAGE凝胶电泳, 转膜, 加入特异性鼠抗人HBx抗体(1:1000稀释, Abcam, USA)和β-actin抗体(1:1000稀释, Santa Cruz, USA)一抗4 ℃杂交过夜. 再用辣根过氧化物酶标记的二抗37 ℃杂交2 h. 应用发光显影法检测HBx和内参β-actin的表达.
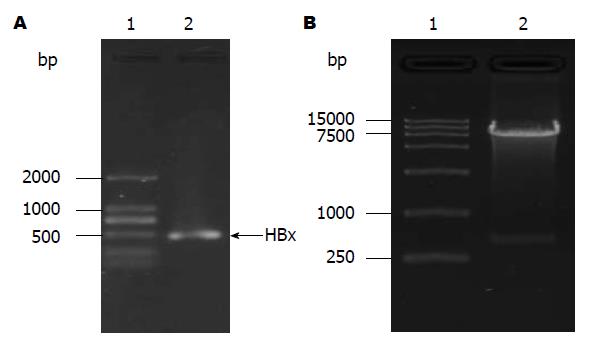
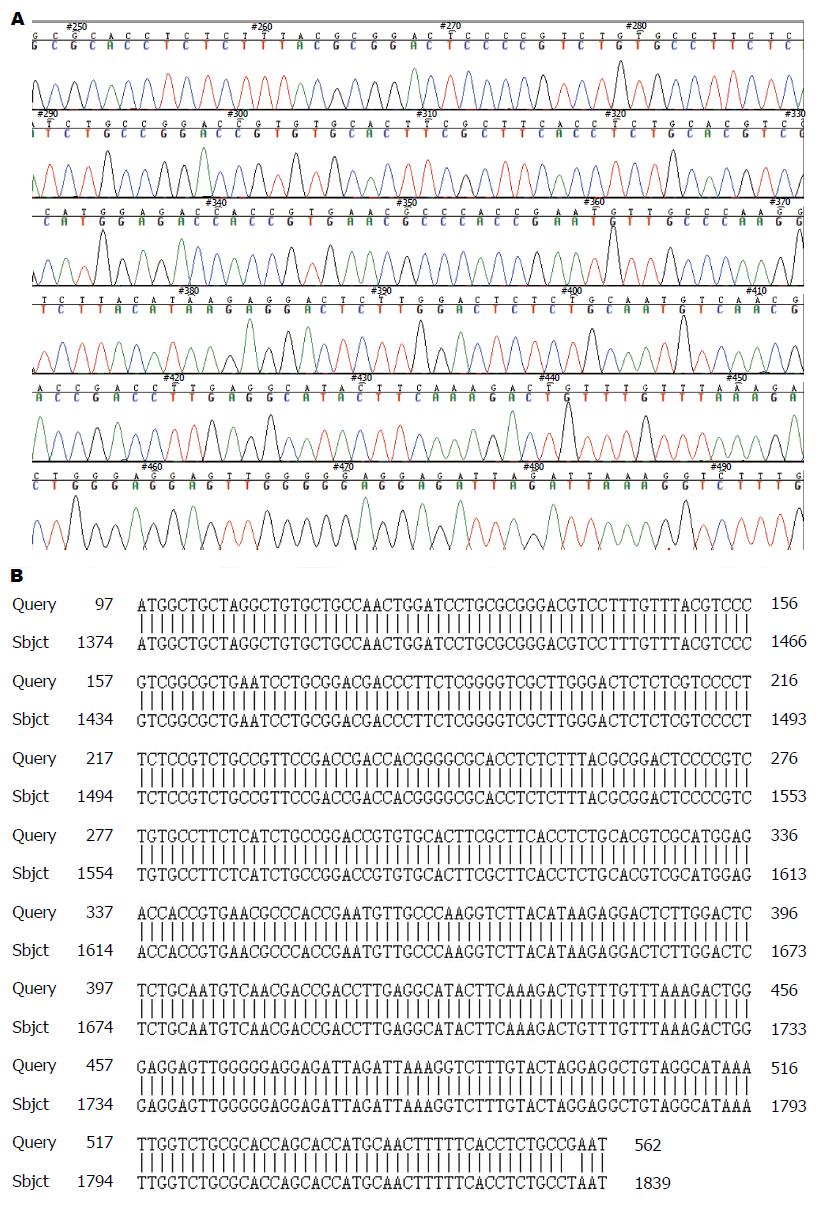
设计引物从质粒pcDNA3.1-HBx中扩增HBx基因, PCR扩增产物经琼脂糖凝胶电泳可见特异性扩增条带, 大小490 bp, 与预期的HBx基因长度相符, 如箭头所示(图1A). PCR扩增的HBx基因连接到慢病毒载体后转化感受态细胞, 经抗生素筛选得到的单克隆菌落并进行扩大培养. 运用质粒提取试剂盒提取质粒后进行双酶切鉴定, 结果在预期位置观察到特异性条带(图1B). 阳性克隆通过测序, GenBank数据库比对, 与目标序列一致(图2). 证明慢病毒载体pEB-GFP-HBx构建成功, 大量包装后得到慢病毒滴度为1×108 T U/mL.
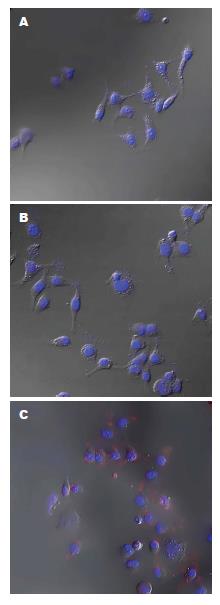
将构建的慢病毒载体pEB-GFP-HBx和阴性对照载体pEB-GFP转染Chang liver细胞, 在转染后的96 h在倒置荧光显微镜下观察到部分细胞中有绿色荧光蛋白表达(图3A, B). 加入嘌呤霉素24 h后部分细胞开始死亡(图3C, D). 筛选14 d后单克隆细胞株中几乎每个细胞都表达绿色荧光(图3E, F).
运用免疫荧光技术在共聚焦显微镜下观察, 发现稳定转染了慢病毒载体的细胞株呈现HBx阳性, 同时HBx蛋白主要位于胞浆, 红色所显示的是HBx的表达和在细胞存在的位置(图4). 野生型Chang liver细胞和转染了空载体的细胞株未见HBx表达. Western blot的实验结果同样证实HBx稳转细胞株中有HBx表达(图5).
肝癌是世界上常见的五大恶性肿瘤之一, 在癌症死亡率中居第3位, 目前肝癌的发病率在全球范围内呈上升趋势[8,9]. 据统计, 每年死于肝病的人为30万左右, 其中约有11万人死于肝癌[10]. 肝癌具有多血管、恶性程度高、生长速度快、转移范围广和复发率高等特点, 给临床治疗带来了非常大的困难.
慢性HBV感染是肝癌发病的主要原因[11,12], 尽管肝癌发生的确切机制尚不清楚, 但已有证据表明HBx蛋白在肝癌的发病过程中发挥了重要作用[13-15]. HBx基因是HBV基因组中的一个多功能反式激活因子, 是HBV重要的功能基因, 他在肝癌细胞中的整合率高达70%左右[16,17]. HBx基因是HBV感染、复制、发病和可能致癌的重要基因, 其表达的蛋白质是一种具有多种功能的病毒调节因子, 在慢性HBV感染的过程中起到举足轻重的作用. HBx蛋白可作为反式作用因子激活多种信号转到途径, 如磷脂酰肌醇激酶(phosphatidylinositol 3 kinase)、肾素-血管紧张素系统(renin-angiotensinsystem)、丝裂原活化蛋白激酶(mitogen-activated protein kinase)、肉瘤基因(sarcoma gene, src)、核因子-κB(nuclear factor-κB)[18-22]等, HBx还能通过抑制p53的转录活性促进甲胎蛋白(alpha fetoprotein)的表达[23,24], 从而影响细胞增殖、凋亡和周期、参与肝细胞的恶性转化和癌变. 但是, 对于其具体的作用机制目前还不十分明确. 因此, 进一步研究HBx的功能及在肝癌细胞中的作用, 将有助于理解HBV影响肝癌发生发展的机制, 为HBV相关性肝癌的预防和治疗提供线索.
随着分子生物学的发展, 应用基因转导技术研究HBx对肝细胞的恶性生物学行为的影响成为可能. 在既往研究报道中[25,26], 已有许多成功建立长期稳定表达HBx的肝癌细胞株但这些研究大都利用脂质体转染的方法, 然后进行稳定表达株的细胞筛选. 这种方法虽然操作简单, 但是筛选时阳性率较低, 难以获得长期稳定表达的细胞株. 在本研究中我们首先构建HBx的慢病毒表达载体, 然后利用慢病毒载体稳定转染Chang liver细胞, 构建HBx的稳转细胞系Chang liver-HBx. 经检测发现在转染慢病毒载体后, 在筛选的第14天便可筛选获得稳定表达株, 效率远高于脂质体筛选的方法. 筛选出的稳定表达株在2 mo后均有较高的表达水平, 说明我们获得了稳定表达HBx的肝细胞系Chang liver-HBx. 实现HBx分子在正常肝细胞Chang liver中的稳定性表达, 为后续研究HBx在细胞增殖、凋亡、肿瘤细胞恶性转化、肿瘤细胞耐药等方面提供一个细胞模型, 同时慢病毒表达系统是目前基因治疗的主要手段[27], 本研究利用慢病毒载体在正常肝细胞Chang liver中稳定表达HBx的方法, 能够建立稳定表达HBx的模型细胞, 为研究HBx在肝细胞内发挥的作用打下基础, 同时该技术的建立或许能够为将来研究肝癌的基因治疗提供借鉴和指导.
乙型肝炎病毒(hepatitis B virus, HBV)感染是导致肝癌发生的重要原因, HBV主要通过乙型肝炎病毒X蛋白(hepatitis B virus x, HBx)发挥促进肝细胞恶性转化的作用. 但是HBx如何诱导肝细胞恶性转化, 目前并不完全清楚. 所以建立携带表达HBx的载体的正常细胞系, 是研究HBx诱导肝细胞恶性转化的有利工具. 正常肝细胞转染表达HBx的载体后, 不仅能观察对肝细胞恶性相关基因的表达, 而且也能研究HBx诱导肝细胞恶性转化过程中的基因表达的时序性, 对预警HBV相关肝癌的发生具有重要的学术价值.
高国全, 教授, 中山大学中山医学院生物化学教研室; 高英堂, 研究员, 天津市第三中心医院
研究HBx诱导肝癌发生的机制是防治肝癌的热点和重点问题. 尽管研究已经发现HBV通过HBx的作用促进肝细胞恶性转化, 但是HBx通过怎样的机制促进肝细胞恶性转化, 目前并不清楚, 如何预警HBV相关肝癌发生是亟待解决的问题.
大量研究已经证明HBx是HBV感染后促进肝癌发生的关键因子, HBx通过优先诱导甲胎蛋白(alpha fetoprotein, AFP)表达激活磷脂酰肌醇3激酶/蛋白激酶B(phosphatidylinositol 3 kinase/protein kinase B)信号途径诱导肝细胞恶性转化, HBx也能通过抑制p53的转化活性促进AFP的表达, 导致肝细胞的恶性生长. 这些研究结果提示, HBx诱导肝细胞恶性转化可能通过激活AFP基因的表达, 显示HBx诱导AFP表达在肝细胞的恶性转化过程中发挥重要的作用.
本文对成功构建慢病毒-HBx表达载体及其在人正常肝细胞系Chang Liver的表达做了详细的阐述, 从载体构建、转染效果、序列测定以及载体的表达等系统观察pEB-GFP-HBx载体构建的准确性, 表达的稳定性等, 有利于后续研究HBx诱导肝细胞恶性转化的机制.
本文成功构建能在人正常肝细胞表达的HBx载体, 不仅能建立在正常肝细胞表达HBx分子的细胞模型, 而且也能为进一步研究HBx促进肝细胞恶性转化的机制打下坚实的基础.
嘌呤霉素筛选: 构建的慢病毒表达HBx的载体中, 含有抗嘌呤霉素作用的靶基因, 用嘌呤霉素作用于细胞后, 含有表达载体的细胞能存活下来, 而没有转染表达载体的细胞会凋亡, 通过筛选可获得稳定表达HBx的细胞系.
本研究通过构建HBx的慢病毒表达载体并转染Chang liver细胞, 采用免疫荧光和Western blot技术验证HBx蛋白表达, 最终获得稳定表达HBx的Chang liver细胞系, 为进一步研究HBx诱导正常肝细胞恶性转化提供了一个较好的研究工具或模型, 具有一定的研究价值.
编辑: 于明茜 电编:闫晋利
| 1. | Jain S, Singhal S, Lee P, Xu R. Molecular genetics of hepatocellular neoplasia. Am J Transl Res. 2010;2:105-118. [PubMed] |
| 2. | Lee YI, Hwang JM, Im JH, Lee YI, Kim NS, Kim DG, Yu DY, Moon HB, Park SK. Human hepatitis B virus-X protein alters mitochondrial function and physiology in human liver cells. J Biol Chem. 2004;279:15460-15471. [PubMed] [DOI] |
| 3. | Henkler F, Hoare J, Waseem N, Goldin RD, McGarvey MJ, Koshy R, King IA. Intracellular localization of the hepatitis B virus HBx protein. J Gen Virol. 2001;82:871-882. [PubMed] |
| 4. | Deroubaix A, Osseman Q, Cassany A, Bégu D, Ragues J, Kassab S, Lainé S, Kann M. Expression of viral polymerase and phosphorylation of core protein determine core and capsid localization of the human hepatitis B virus. J Gen Virol. 2015;96:183-195. [PubMed] [DOI] |
| 5. | Yano M, Ohkoshi S, Aoki YH, Takahashi H, Kurita S, Yamazaki K, Suzuki K, Yamagiwa S, Sanpei A, Fujimaki S. Hepatitis B virus X induces cell proliferation in the hepatocarcinogenesis via up-regulation of cytoplasmic p21 expression. Liver Int. 2013;33:1218-1229. [PubMed] [DOI] |
| 6. | Zhang Z, Torii N, Furusaka A, Malayaman N, Hu Z, Liang TJ. Structural and functional characterization of interaction between hepatitis B virus X protein and the proteasome complex. J Biol Chem. 2000;275:15157-15165. [PubMed] [DOI] |
| 7. | Huang WC, Chen WS, Chen YJ, Wang LY, Hsu SC, Chen CC, Hung MC. Hepatitis B virus X protein induces IKKα nuclear translocation via Akt-dependent phosphorylation to promote the motility of hepatocarcinoma cells. J Cell Physiol. 2012;227:1446-1454. [PubMed] [DOI] |
| 8. | Sherman M. Hepatocellular carcinoma: epidemiology, surveillance, and diagnosis. Semin Liver Dis. 2010;30:3-16. [PubMed] [DOI] |
| 9. | Yu SJ, Kim YJ. Hepatitis B viral load affects prognosis of hepatocellular carcinoma. World J Gastroenterol. 2014;20:12039-12044. [PubMed] [DOI] |
| 10. | Lee JH, Han KH, Lee JM, Park JH, Kim HS. Impact of hepatitis B virus (HBV) x gene mutations on hepatocellular carcinoma development in chronic HBV infection. Clin Vaccine Immunol. 2011;18:914-921. [PubMed] [DOI] |
| 11. | Neuveut C, Wei Y, Buendia MA. Mechanisms of HBV-related hepatocarcinogenesis. J Hepatol. 2010;52:594-604. [PubMed] [DOI] |
| 12. | Liu CJ, Kao JH. Hepatitis B virus-related hepatocellular carcinoma: epidemiology and pathogenic role of viral factors. J Chin Med Assoc. 2007;70:141-145. [PubMed] [DOI] |
| 13. | Zhang X, Zhang H, Ye L. Effects of hepatitis B virus X protein on the development of liver cancer. J Lab Clin Med. 2006;147:58-66. [PubMed] [DOI] |
| 14. | Sun Q, Wang Y, Zhang Y, Liu F, Cheng X, Hou N, Zhao X, Yang X. Expression profiling reveals dysregulation of cellular cytoskeletal genes in HBx-induced hepatocarcinogenesis. Cancer Biol Ther. 2007;6:668-674. [PubMed] [DOI] |
| 15. | Yang SL, Pan XL, Xiong ZF, Wei B, Yao HY. The influence of hepatitis Bvirus X protein on the clock genes in liver cells and its significance. Chinese-German J Clin Oncol. 2011;10:468-471. [DOI] |
| 16. | Feitelson MA, Lee J. Hepatitis B virus integration, fragile sites, and hepatocarcinogenesis. Cancer Lett. 2007;252:157-170. [PubMed] [DOI] |
| 17. | Block TM, Mehta AS, Fimmel CJ, Jordan R. Molecular viral oncology of hepatocellular carcinoma. Oncogene. 2003;22:5093-5107. [PubMed] [DOI] |
| 18. | Arbuthnot P, Capovilla A, Kew M. Putative role of hepatitis B virus X protein in hepatocarcinogenesis: effects on apoptosis, DNA repair, mitogen-activated protein kinase and JAK/STAT pathways. J Gastroenterol Hepatol. 2000;15:357-368. [PubMed] [DOI] |
| 19. | Zhu M, Guo J, Li W, Lu Y, Fu S, Xie X, Xia H, Dong X, Chen Y, Quan M. Hepatitis B virus X protein induces expression of alpha-fetoprotein and activates PI3K/mTOR signaling pathway in liver cells. Oncotarget. 2015;6:12196-12208. [PubMed] |
| 20. | Li M, Zhu M, Li W, Lu Y, Xie X, Wu Y, Zheng S. Alpha-fetoprotein receptor as an early indicator of HBx-driven hepatocarcinogenesis and its applications in tracing cancer cell metastasis. Cancer Lett. 2013;330:170-180. [PubMed] [DOI] |
| 21. | Ye H, Zhang C, Wang BJ, Tan XH, Zhang WP, Teng Y, Yang X. Synergistic function of Kras mutation and HBx in initiation and progression of hepatocellular carcinoma in mice. Oncogene. 2014;33:5133-5138. [PubMed] [DOI] |
| 22. | Zhu M, Guo J, Li W, Xia H, Lu Y, Dong X, Chen Y, Xie X, Fu S, Li M. HBx induced AFP receptor expressed to activate PI3K/AKT signal to promote expression of Src in liver cells and hepatoma cells. BMC Cancer. 2015;15:362. [PubMed] [DOI] |
| 23. | Ogden SK, Lee KC, Barton MC. Hepatitis B viral transactivator HBx alleviates p53-mediated repression of alpha-fetoprotein gene expression. J Biol Chem. 2000;275:27806-27814. [PubMed] [DOI] |
| 24. | Arima T, Nakao K, Nakata K, Ishikawa H, Ichikawa T, Hamasaki K, Ishii N, Eguchi K. Transactivation of human alpha-fetoprotein gene by X-gene product of hepatitis B virus in human hepatoma cells. Int J Mol Med. 2002;9:397-400. [PubMed] |
| 25. | Fiedler N, Quant E, Fink L, Sun J, Schuster R, Gerlich WH, Schaefer S. Differential effects on apoptosis induction in hepatocyte lines by stable expression of hepatitis B virus X protein. World J Gastroenterol. 2006;12:4673-4682. [PubMed] [DOI] |
| 26. | Misra KP, Mukherji A, Kumar V. The conserved amino-terminal region (amino acids 1-20) of the hepatitis B virus X protein shows a transrepression function. Virus Res. 2004;105:157-165. [PubMed] |
| 27. | Liu KC, Lin BS, Gao AD, Ma HY, Zhao M, Zhang R, Yan HH, Yi XF, Lin SJ, Que JW. Integrase-deficient lentivirus: opportunities and challenges for human gene therapy. Curr Gene Ther. 2014;14:352-364. [PubMed] |