修回日期: 2015-07-28
接受日期: 2015-08-06
在线出版日期: 2015-09-08
目的: 从结肠、海马及下丘脑中促肾上腺皮质激素释放因子(corticotropin releasing factor, CRF)和CRF受体1(CRF receptor 1, CRFR1)角度探讨健脾化湿颗粒改善腹泻型肠易激综合征(diarrhea-predominant irritable bowel syndrome, D-IBS)模型大鼠结肠运动和内脏敏感性的作用机制.
方法: 采用番泻叶灌胃结合束缚应激法建立D-IBS大鼠模型, 应用健脾化湿颗粒进行干预, 采用酶联免疫法(ELISA)检测大鼠结肠中CRF含量, 采用免疫组织化学法检测结肠中CRFR1及海马、下丘脑中CRF, CRFR1阳性表达, 采用RT-PCR法检测结肠、海马中CRF mRNA和CRFR1 mRNA的表达水平.
结果: 与正常组相比, 模型组结肠中CRF含量(67.1±3.8 vs 36.0±3.0), 海马、下丘脑中CRF阳性表达(0.23±0.02 vs 0.09±0.01, 0.17±0.02 vs 0.09±0.01)明显升高(P<0.01); 结肠、海马、下丘脑中CRFR1阳性表达(0.17±0.01 vs 0.03±0.01, 0.20±0.02 vs 0.09±0.01, 0.19±0.02 vs 0.07±0.01)明显升高(P<0.01); 结肠、海马中CRF mRNA和CRFR1 mRNA的表达(结肠: 0.89±0.04 vs 0.09±0.01, 1.09±0.09 vs 0.21± 0.04; 海马: 0.56±0.01 vs 0.15±0.05, 1.26±0.14 vs 0.23±0.06)显著升高(P<0.01). 与模型组相比, 各治疗组结肠、海马中CRF(51.0±3.4, 54.6±4.1, 45.1±4.7, 43.3±3.9 vs 67.1±3.8; 0.18±0.02, 0.19±0.02, 0.15±0.02, 0.11±0.01 vs 0.23±0.02)显著下降(P<0.01), 阳性对照组、中、高剂量组下丘脑中CRF(0.15±0.02, 0.13±0.01, 0.12±0.01 vs 0.17±0.02)下降显著(P<0.05, P<0.01); 阳性对照组、中、高剂量组结肠、海马、下丘脑中CRFR1表达(结肠: 0.10±0.01, 0.08±0.01, 0.05±0.01 vs 0.17±0.01; 海马: 0.16±0.01, 0.14±0.02, 0.13±0.01 vs 0.20±0.02; 下丘脑: 0.15±0.02, 0.13±0.01, 0.11±0.01 vs 0.19±0.02)下降显著(P<0.05, P<0.01); 结肠中CRF mRNA表达(0.63±0.04, 0.76±0.06, 0.32±0.06, 0.13±0.03 vs 0.89±0.04)及中、高剂量组海马中CRF mRNA表达(0.76±0.11, 0.67±0.10 vs 1.09±0.09)显著降低(P<0.01); 阳性对照组、中、高剂量组结肠中CRFR1 mRNA表达(0.47±0.03, 0.40±0.06, 0.24±0.06 vs 0.56±0.01)及中、高剂量组海马中CRFR1 mRNA表达(0.62±0.06, 0.60±0.07 vs 1.26±0.14)显著降低(P<0.05, P<0.01).
结论: 健脾化湿颗粒可能通过下调结肠、海马及下丘脑中CRF、CRFR1 表达来改善D-IBS模型大鼠结肠运动和内脏敏感性.
核心提示: 本文在前期验证健脾化湿颗粒可改善腹泻型肠易激综合征模型大鼠结肠运动及内脏敏感性的基础上, 从脑-肠轴的促肾上腺皮质激素释放因子(corticotropin releasing factor, CRF)及其受体角度探讨其可能的作用机制, 证实健脾化湿颗粒治疗腹泻型肠易激综合征的作用机制与其调节中枢及结肠CRF及其受体的表达相关.
引文著录: 王迎寒, 刘玉玲, 杜海燕, 靳继伟, 胡楠, 于海龙, 陈光晖, 赵素微, 张晓峰. 健脾化湿颗粒对D-IBS模型大鼠脑-肠轴中CRF和CRFR1的影响. 世界华人消化杂志 2015; 23(25): 4075-4083
Revised: July 28, 2015
Accepted: August 6, 2015
Published online: September 8, 2015
AIM: To evaluate the effect of Jianpi Huashi granule on corticotropin releasing factor (CRF) and corticotropin releasing factor receptor 1 (CRFR1) expression in the colon, hippocampus and hypothalamus of rats with diarrhea-predominant irritable bowel syndrome (D-IBS).
METHODS: A rat model of D-IBS was established by intragastric administration of Sennae decoction combined with restraint stress. Rats were divided into several groups. Jianpi Huashi granule was given to rats in Jianpi Huashi groups, pinaverium bromide tablets to rats in the positive group and water to the other groups. ELISA was used to detect the content of CRF in the colon. Immunohistochemistry assay was used to detect the expression of CRFR1 in the colon, hippocampus, and hypothalamus, and CRF in the hippocampus and hypothalamus. RT-PCR was used to detect the expression of CRF and CRFR1 mRNAs in the colon and hippocampus.
RESULTS: In the D-IBS model group, the content of CRF in the colon (67.1 ± 3.8 vs 36.0 ± 3.0) and the expression of CRF in the hippocampus and hypothalamus (0.23 ± 0.02 vs 0.09 ± 0.01, 0.17 ± 0.02 vs 0.09 ± 0.01) were increased significantly compared to the normal group (P < 0.01 for all). The expression of CRFR1 in the colon, hippocampus and hypothalamus was also increased significantly (0.17 ± 0.01 vs 0.03 ± 0.01, 0.20 ± 0.02 vs 0.09 ± 0.01, 0.19 ± 0.02 vs 0.07 ± 0.01, P < 0.01 for all). The expression of CRF and CRFR1 mRNAs in the colon and hippocampus was significantly increased in the model group compared to the normal group (0.89 ± 0.04 vs 0.09 ± 0.01, 1.09 ± 0.09 vs 0.21 ± 0.04, 0.56 ± 0.01 vs 0.15 ± 0.05, 1.26 ± 0.14 vs 0.23 ± 0.06, P < 0.01 for all). After treatment, the expression of CRF in the colon and hippocampus in all treatment groups was significantly decreased (51.0 ± 3.4, 54.6 ± 4.1, 45.1 ± 4.7, 43.3 ± 3.9 vs 67.1 ± 3.8; 0.18 ± 0.02, 0.19 ± 0.02, 0.15 ± 0.02, 0.11 ± 0.01 vs 0.23 ± 0.02, P < 0.01 for all), and the expression of CRF in the positive control group, medium- and high-dose Jianpi Huashi granule groups in the hypothalamus was significantly decreased (0.15 ± 0.02, 0.13 ± 0.01, 0.12 ± 0.01 vs 0.17 ± 0.02, P < 0.05 or P < 0.01). The expression of CRFR1 in the colon, hippocampus and hypothalamus in the positive control group, medium- and high-dose Jianpi Huashi granule groups was significantly reduced (0.10 ± 0.01, 0.08 ± 0.01, 0.05 ± 0.01 vs 0.17 ± 0.01, 0.16 ± 0.01, 0.14 ± 0.02, 0.13 ± 0.01 vs 0.20 ± 0.02, 0.15 ± 0.02, 0.13 ± 0.01, 0.11 ± 0.01 vs 0.19 ± 0.02, P < 0.05 or P < 0.01). The expression of CRF mRNA in the colon in all treatment groups was significantly reduced (0.63 ± 0.04, 0.76 ± 0.06, 0.32 ± 0.06, 0.13 ± 0.03 vs 0.89 ± 0.04, P < 0.01 for all), while the expression of CRF mRNA in the hippocampus in the medium- and high-dose Jianpi Huashi granule groups was significantly decreased (0.76 ± 0.11, 0.67 ± 0.10 vs 1.09 ± 0.09, P < 0.01 for all). The expression of CRFR1 mRNA in the colon in the positive control group, medium- and high-dose Jianpi Huashi granule groups was significantly reduced (0.47 ± 0.03, 0.40 ± 0.06, 0.24 ± 0.06 vs 0.56 ± 0.01, P < 0.05 or P < 0.01), while the expression of CRFR1 mRNA in the hippocampus in the medium- and high-dose Jianpi Huashi granule groups was significantly decreased (0.62 ± 0.06, 0.60 ± 0.07 vs 1.26 ± 0.14, P < 0.01 for all).
CONCLUSION: Jianpi Huashi granule regulates colonic motility and visceral sensitivity in rats with D-IBS possibly by modulating the expression of CRF and CRFR1 in the colon, hippocampus and hypothalamus.
- Citation: Wang YH, Liu YL, Du HY, Jin JW, Hu N, Yu HL, Chen GH, Zhao SW, Zhang XF. Influence of Jianpi Huashi granule on CRF and CRFR1 expression in the brain-gut axis of rats with diarrhea-predominant irritable bowel syndrome. Shijie Huaren Xiaohua Zazhi 2015; 23(25): 4075-4083
- URL: https://www.wjgnet.com/1009-3079/full/v23/i25/4075.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i25.4075
肠易激综合征(irritable bowel syndrome, IBS)是临床常见的消化系统疾病, 其病位在结肠, 根据其症状表现不同, 可以分为腹泻型、便秘型、腹泻-便秘交替型[1]. 腹泻型肠易激综合征(diarrhea-predominant irritable bowel syndrome, D-IBS)以腹痛、腹泻为主, 患者常伴有心烦、焦虑、抑郁等神经功能失调症状. 迄今为止, D-IBS病因及发病机制尚不清楚, 无法用单一的生理病理机制来解释其复杂的症状. 近年来随着神经胃肠病学的发展, 研究[2]认为D-IBS与脑-肠轴功能紊乱有关, 并试图从脑-肠互动的角度, 把不同因素整合起来从更深层次揭示D-IBS的病因及发病机制. 脑-肠轴功能的实现依赖于各种脑-肠肽及其受体的正常表达, 如果表达异常, 则产生一系列临床症状. 目前关于脑肠轴中枢部分的研究多以参与感觉、内脏活动的调节及情绪、行为、学习和记忆等关系密切的边缘系统为主, 包括: 前额叶、下丘脑、海马、扣带回等. 前期实验[3,4]证实, 健脾化湿颗粒可改善采用灌服番泻叶联合束缚应激方法建立的D-IBS模型大鼠结肠运动和内脏敏感性, 且对D-IBS模型大鼠中枢c-fos、前额叶皮质促肾上腺皮质激素释放因子(corticotropin releasing factor, CRF)、结肠5-羟色胺(5-hydroxytryptamine, 5-HT)等表达有调节作用. 本实验继续从结肠、海马、下丘脑中CRF和CRF受体1(CRF receptor 1, CRFR1)角度来研究其作用机制.
♂SD大鼠72只, 体质量250 g±20 g, SPF级, 购自北京华阜康生物科技股份有限公司, 许可证号: SCXK(京)2009-0004. 饲养于承德医学院屏障环境动物实验室, 实验前1 wk动物以适应实验环境. 番泻叶(安国市昌达中药材饮片有限公司, 批号: 1009002)捡择后置于沸水中浸泡25 min, 双层纱布过滤, 滤液减压浓缩成生药含量为0.3 g/mL. 健脾化湿颗粒(承德医学院中药研究所制备). 得舒特(法国苏威特公司, 批号: 627414). Excelsior™ ES自动组织脱水机(美国Thermo Scientific司); Histocentre 3™组织包埋机(美国Thermo Scientific公司); RM2125型常规轮转石蜡切片机(德国Leica公司); TK-218型恒温摊片烤片机(湖北泰维医疗科技有限责任公司); BH-2型显微镜及摄像装置(日本Olympus公司); Multiskan MK 3酶标仪(Thermo Labsystems); DU800紫外可见分光光度计(美国CKMAN COULTER公司); SORVALL Biofuge fresco冷冻离心机(德国Kendro Labrotary公司); DYY-6B型稳压稳流电泳仪(北京市六一仪器厂); 美国Biorad icycler PCR仪(icycler); CRF酶联免疫分析试剂盒(上海酶联生物科技有限公司); 兔抗鼠CRF抗体(北京博奥森生物技术有限公司); 兔抗鼠CRFR1抗体(北京博奥森生物技术有限公司); SP免疫组织化学试剂盒(北京四正柏生物技术有限公司); TaKaRa RNA PCR Kit(大连宝生物工程有限公司), CRF、CRFR1、β-actin引物合成(上海英潍捷基贸易有限公司); DNA Marker(北京天根生化科技有限公司); 6×DNA电泳loading buffer(北京天根生化科技有限公司).
1.2.1 实验分组: ♂SD大鼠72只, 随机分成六组, 每组12只, 分别为正常组、模型组、阳性对照组、健脾化湿颗粒低、中、高剂量组.
1.2.2 动物模型的制备与处理: 参照文献[5]的方法, 实验前禁食不禁水, 除正常组其余各组大鼠前14 d均予以番泻叶煎剂(0.3 g生药/mL)灌胃; 后14 d在灌服完番泻叶煎剂后用透明胶带束缚大鼠前上肢, 胸部及肩部持续2 h. 束缚2 h后模型组予以生理盐水灌胃; 健脾化湿颗粒(低、中、高)剂量组予以健脾化湿颗粒(0.25、0.50、1.00 g/mL)剂量灌胃; 阳性对照组予以得舒特(3 mg/mL)灌胃; 正常组全程只予以生理盐水灌胃. 且各溶液灌胃量均为10 mL/kg.
1.2.3 标本采集与预处理: 药物干预14 d后, 各组大鼠均以腹腔注射10%水合氯醛麻醉处死, 迅速取结肠组织, 置于冰冷的生理盐水中, 沿纵轴剪开肠管, 冲洗干净肠内溶物, 用滤纸吸干水后, 部分用多聚甲醛固定用于免疫组织化学检测; 部分置于-80 ℃冰箱里冷冻保存, 用于酶联免疫检测; 其余部分装入用DEPC水处理过的冻存管中即刻投入液氮中保存, 用作RT-PCR检测.
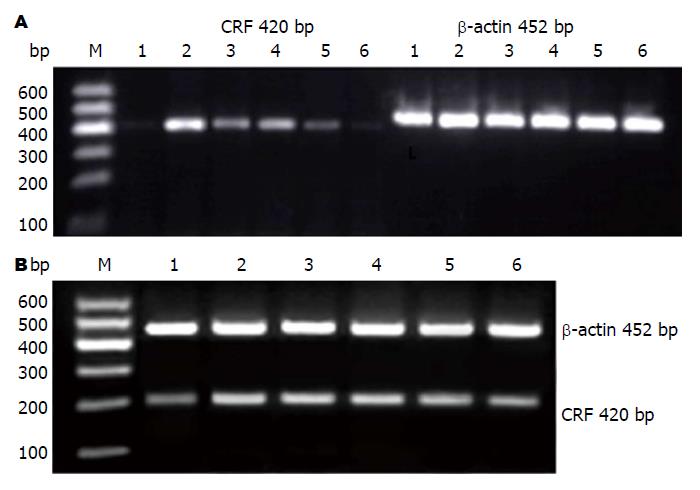
1.2.4 指标检测: (1)结肠中CRF含量检测: 取储存于-80 ℃冰箱的结肠组织约60 mg, 加PBS[9 mL/(g•组织)], 研磨后离心, 取上清, 用ELISA试剂盒检测结肠中CRF水平; (2)结肠、海马及下丘脑中CRF、CRFR1表达的检测: 取经多聚甲醛固定的结肠, 石蜡包埋后切片进行免疫组织化学法染色. 操作步骤严格按照SP免疫组织化学试剂盒说明书进行, DAB显色, 其中PBS作为阴性对照. 以胞浆中出现棕黄色反应物为阳性反应, 阴性对照无棕黄色的反应物. 采用Image-pro plus(IPP)图像分析软件对CRF、CRFR1的表达进行半定量分析. 每例随机选取6个400×视野的平均光密度值(IOD/Area)值(以每张图片中阳性区域的光密度总和除以阳性区域的面积总和得出的平均光密度为结果, 每张免疫组织化学片子随机取6个不重叠的视野进行拍照后, 通过Image-pro plus软件进行计算, 所得平均光密度值小数点后有7位以上的数字, 在统计时通过四舍五入的方法, 保留两位小数)作为该例的测量值. 该值越大则染色越强; (3)RT-PCR法检测结肠及海马中CRF和CRFR1 mRNA表达: 称取80-100 mg超低温冷冻的结肠组织样品, 用TRIzol一步法提取总RNA并测定浓度, 取总量为2 μg的RNA进行反转录, 体系为20 μL, 反转录条件如下: 30 ℃ 10 min, 42 ℃ 30 min, 99 ℃ 5 min, 5 ℃ 5 min. 在PCR仪中进行扩增, 反应体系为20 μL, 反应条件如下: 94 ℃预变性2 min, 94 ℃变性30 s, 56 ℃退火30 s, 72 ℃延伸45 s, 共30循环. CRF引物: 上游引物: 5'-CTCACAGCAACAGGAAACTGAT-3', 下游引物: 5'-TAGCCACCCCTCAAGAATGAAT-3'(扩增长度420 bp); CRFR1引物: 上游引物: 5'-CCGCTACAATACCACAAACAA-3', 下游引物: 5'-GCCGCAGAAAGAGGACAAAGG-3'(扩增长度206 bp); β-actin引物: 上游引物: 5'-GAGAGGGAAATCGTGCGTGAC-3', 下游引物: 5'-CATCTGCTGGAAGGTGGACA-3'(扩增长度452 bp), 实验重复3次, 以β-actin作为内参. 取5 μL PCR反应产物于2%琼脂糖凝胶上进行电泳, 电压120 V, 用紫外透射仪观察并摄取图像. 用Quantity One 4.6.2凝胶定量分析软件进行半定量分析, 测定图像光密度值. 各目的基因的光密度与β-actin条带光密度的比值作为mRNA表达水平参数.
统计学处理 采用SPSS17.0统计软件进行数据分析, 计量资料以mean±SD表示, 各组间差异均采用单因素方差分析中两两比较. 若方差齐则采用LSD检验, 若方差不齐采用 Dunnett's T3检验, 以P<0.05为差异具有统计学意义.
由表1可知, 与正常组比较, 模型组大鼠结肠CRF水平显著升高(P<0.01); 与模型组比较, 各治疗组大鼠CRF水平均显著降低(P<0.01); 与阳性对照组比较, 低、中、高剂量组均有显著差异(P<0.05, P<0.01).
| 分组 | 剂量 | CRF | CRFR1 | ||||
| 结肠(ng/L) | 海马 | 下丘脑 | 结肠 | 海马 | 下丘脑 | ||
| 正常组 | - | 36.0±3.0 | 0.09±0.01 | 0.09±0.01 | 0.03±0.01 | 0.09±0.01 | 0.07±0.01 |
| 模型组 | - | 67.1±3.8b | 0.23±0.02b | 0.17±0.02b | 0.17±0.01b | 0.20±0.02b | 0.19±0.02b |
| 阳性药组 | 得舒特(3 mg/mL) | 51.0±3.4d | 0.18±0.02d | 0.15±0.02c | 0.10±0.01d | 0.16±0.01c | 0.15±0.02c |
| 低剂量组 | 2.50 g/mL | 54.6±4.1de | 0.19±0.02d | 0.16±0.01 | 0.16±0.02f | 0.18±0.02 | 0.17±0.02 |
| 中剂量组 | 5.00 g/mL | 45.1±4.7de | 0.15±0.02de | 0.13±0.01de | 0.08±0.01de | 0.14±0.02de | 0.13±0.01de |
| 高剂量组 | 10.00 g/mL | 43.3±3.9df | 0.11±0.01df | 0.12±0.01df | 0.05±0.01df | 0.13±0.01de | 0.11±0.01de |
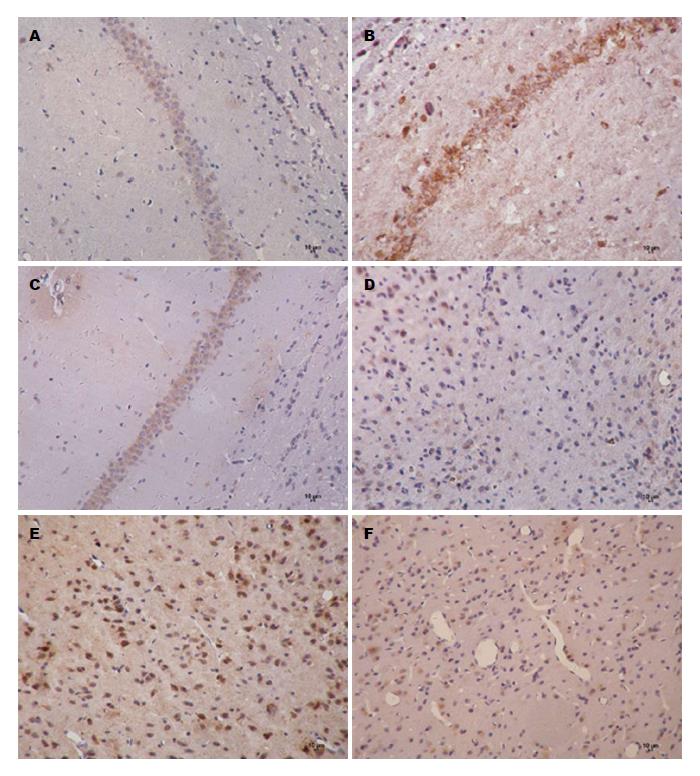
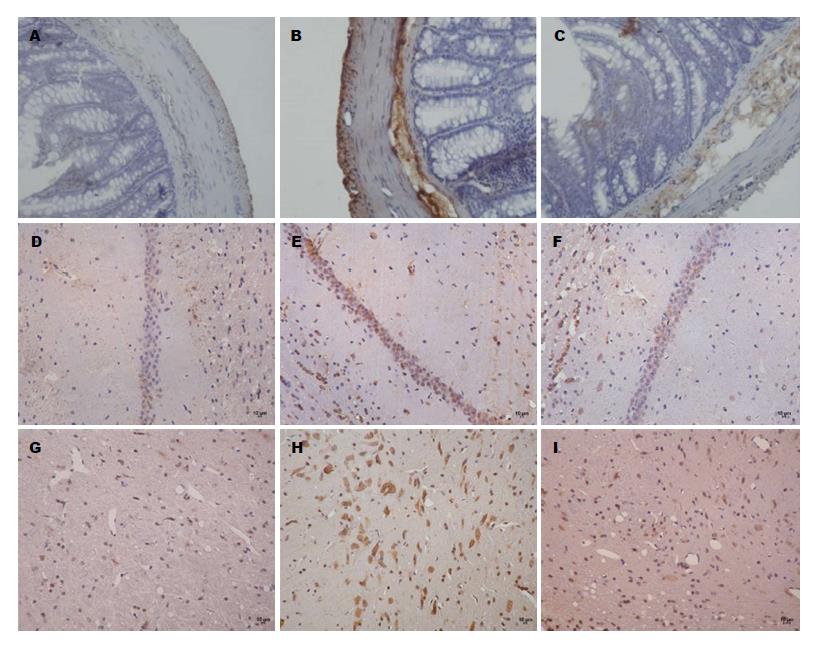
由表1, 图1可知, 与正常组比较, 模型组大鼠海马及下丘脑中CRF阳性表达量明显增多(P<0.01); 与模型组比较, 各治疗组海马中CRF表达显著下降(P<0.01), 下丘脑中CRF表达有不同程度下降, 阳性对照组及中、高剂组有显著差异(P<0.05, P<0.01); 与阳性对照组比较, 中、高剂量组大鼠海马及下丘脑中CRF阳性表达差异有统计学意义(P<0.05, P<0.01).
由表1, 图2可知, 与正常组比较, 模型组大鼠结肠、海马及下丘脑中CRFR1阳性表达明显增多(P<0.01). 与模型组比较, 各治疗组大鼠结肠、海马及下丘脑中CRFR1阳性表达有不同程度的下降, 阳性对照组、中、高剂量组差异显著(P<0.05, P<0.01). 与阳性对照组比较, 低、中、高剂量组大鼠结肠中CRFR1阳性细胞表达差异有统计学意义(P<0.05, P<0.01); 中、高剂量组海马及下丘脑中CRFR1阳性表达差异显著(P<0.05).
由表2, 图3可知, 与正常组比较, 模型组大鼠结肠及海马中CRF、CRFR1 mRNA水平显著升高(P<0.01); 与模型组比较, 各治疗组大鼠结肠中CRF mRNA水平均显著降低(P<0.01), 中、高剂量组海马中CRF、CRFR1 mRNA水平均显著降低(P<0.01); 与阳性对照组比较, 结肠中CRF mRNA差异显著(P<0.05, P<0.01); 中、高剂量组海马中CRF mRNA有显著差异(P<0.01). 阳性对照组及中、高剂量组结肠中CRFR1 mRNA水平降低显著(P<0.05, P<0.01). 与阳性对照组比较, 高剂量组结肠CRFR1 mRNA水平及中、高剂量组海马CRFR1 mRNA水平显著降低(P<0.01).
| 分组 | 剂量 | CRF mRNA | CRFR1 mRNA | ||
| 结肠 | 海马 | 结肠 | 海马 | ||
| 正常组 | - | 0.09±0.01 | 0.21±0.04 | 0.15±0.05 | 0.23±0.06 |
| 模型组 | - | 0.89±0.04b | 1.09±0.09b | 0.56±0.01b | 1.26±0.14b |
| 阳性药组 | 得舒特(3 mg/mL) | 0.63±0.04d | 0.93±0.11 | 0.47±0.03c | 1.14±0.11 |
| 低剂量组 | 2.50 g/mL | 0.76±0.06de | 0.97±0.11 | 0.51±0.03 | 1.10±0.11 |
| 中剂量组 | 5.00 g/mL | 0.32±0.06df | 0.76±0.11df | 0.40±0.06d | 0.62±0.06df |
| 高剂量组 | 10.00 g/mL | 0.13±0.03df | 0.67±0.10df | 0.24±0.06df | 0.60±0.07df |
D-IBS作为临床常见的消化系统疾病, 在治疗上以药物治疗为主要手段, 目前临床上西医多采用对症治疗, 主要包括胃肠解痉药、止泻药、肠道动力感觉调节药、抗抑郁药等. 虽然这些药物对症状的缓解虽在短期内有一定的疗效, 但远期效果欠佳, 停药后易复发. 中医学在治疗上标本兼治, 临床效果良好, 且不良反应小. 针对本病脾虚、肝郁、湿盛的病机, 遣方用药, 以炙黄芪益脾气、升清阳, 益智仁温补脾肾、固涩止泻, 二者共为君药; 炒白术、茯苓助黄芪健脾益气, 兼能化湿, 为健脾培土之重臣; 砂仁化湿行气、温中止泻, 乌药温肾散寒、行气止痛, 既助益智仁温肾止泻, 又通畅湿邪所阻之气机; 四者为臣药; 陈皮理气燥湿, 炒白芍柔肝调气, 防风香燥胜湿, 炙甘草健脾益气, 调和诸药, 四者共为佐使; 诸药紧密配合, 共奏理气健脾、化湿止泻之奇效, 使D-IBS患者腹痛、腹泻症状得到改善.
CRF是一种重要的神经内分泌肽, 广泛分布在体内, 主要分布在中枢神经系统(centralnervoussystem, CNS)中与应激相关的重要区域, 在外周器官亦有分布, 如胃肠道、肾上腺、脾等器官. CRF肽家族有CRF配体(CRF、Ucn1、Ucn2等)和CRF受体(CRFR1、CRF-R2), 该家族的主要功能是调动机体各系统来应答应激刺激[6]. 各类应激因素可以刺激下丘脑和其他脑区释放CRF、CRF及其相关肽都能引起与应激状态相似的胃肠蠕动改变, 如结肠蠕动加快, 传输时间缩短, 结肠黏膜对离子、大分子物质通透性的增高, 离子、水分、前列腺素和黏液分泌的增加, 腹泻发生频率增加等[7]. Bravo等[8]研究表明, CRF是导致IBS发病的关键因素, 在应激过程中, 下丘脑释放的CRF参与调节对心理刺激的行为反应和内脏反应, 且CRF的释放增加可产生焦虑, 从而使得应激、焦虑和内脏感觉异常. CRF是一种介导下丘脑-垂体-肾上腺皮质轴对应激反应的关键调节肽, 在脑-肠互动中起了重要的作用, 通过影响胃肠道运动、肠道感染和内脏高敏感等参与IBS的发病[9]. IBS患者的结肠动力异常可能是由于CRF依赖性机制和/或肥大细胞脱颗粒, 释放各种神经递质, 而导致结肠动力异常和内脏敏感性增高. CRF通过与CRFR1受体结合参与应激诱导的结肠高度运动、水样腹泻和结肠扩张的敏感性[10]. CRFR2受体反应能够抑制胃排空和缓解结肠扩张引起的内脏感觉异常[11]. 动物实验[12]表明, CRF能够诱导大小鼠反复排便, 应用CRF拮抗剂可有效阻断. 研究[13]表明, CRF、Ucn1、CRFR1在急性应激、慢性应激、急慢性联合应激IBS模型大鼠的结肠中的表达均较正常组显著升高, 说明其表达与应激引起的IBS结肠功能改变相关. 大多数D-IBS患者结肠呈高敏感状态, 其结肠感受器异常兴奋引起下丘脑室旁核和蓝斑的CRF神经兴奋, 而CRF神经兴奋能导致精神行为变化、结肠运动加快和水样腹泻的产生, 这就解释了D-IBS患者精神行为变化与腹泻的关系. 焦虑、抑郁动物模型脑区CRF的含量增加, 而焦虑和抑郁情绪在IBS的发病中起着重要的作用. 另有研究[14]发现, CRF还可以促进5-HT的释放进一步加剧胃肠道动力和内脏敏感异常, 中枢注射CRFR1拮抗剂或CRF-R2激动剂能引起内脏高敏感大鼠脑-肠轴中不同部位5-HT的变化, 证明了CRF具有调控5-HT信号通路的作用, 这可能是产生IBS内脏高敏感的机制之一[15]. Taché等[16]发现, 中枢神经系统和胃肠道的CRFR1信号过度激活与IBS的肠道症状和精神症状密切相关, 认为CRFR1拮抗剂是IBS的新治疗方法. 大鼠脑内注射CRF可以模拟束缚应激引起的内脏高敏感性, 外周注射CRFR1激动剂可以降低患者直肠扩张引起的泄泻的阈值及增加腹部不适感[17]. 总之, CRF及其受体在IBS的研究中发挥着极其重要的作用.
本课题组前期药效学实验结果显示[3,4], 健脾化湿颗粒可以降低D-IBS大鼠结肠运动及内脏敏感性, 其作用机制可能与降低前额叶皮质CRF、CRFR1 mRNA及中枢c-fos的表达有关. 在本实验结果中, 模型组大鼠结肠、海马、下丘脑中CRF和CRFR1阳性表达及其mRNA表达水平显著高于正常组(P<0.01), 3种剂量(0.25, 0.50, 1.00 g/mL)的健脾化湿颗粒能不同程度地降低结肠和中枢CRF、CRFR1水平, 改善D-IBS大鼠腹泻症状和内脏敏感性, 提示健脾化湿颗粒可能通过降低脑和肠中CRF和CRFR1 mRNA的表达水平, 从而升高内脏痛阈水平, 减慢结肠运动, 消除肠道反应. D-IBS发病机制十分复杂, 并不是单一的病理生理变化就能解释得了的, 同样健脾化湿颗粒在改善IBS症状的作用机制也并不是单一的, 在以后的研究中还需要从多个角度进一步探讨其在治疗D-IBS中的作用机制.
肠易激综合征(irritable bowel syndrome, IBS)是常见的消化系统疾病, 病位在结肠, 多发于青壮年, 发病率高, 目前尚无特效药, 只能对症治疗, 暂时缓解症重, 复发率高, 严重影响患者生活质量, 且耗费医疗资源巨大, 已经成为科研工作者亟待解决的关键问题.
李晓波, 教授, 上海交通大学药学院
IBS病机复杂, 至今仍未能阐明, 随着神经胃肠病学的发展, 脑-肠轴理论成为目前研究IBS的热点, 其中更多的是对各个脑肠肽的研究.
Tache等发现, 中枢神经系统和胃肠道的促肾上腺皮质激素释放因子受体1(corticotropin releasing factor receptor 1, CRFR1)信号过度激活与IBS的肠道症状和精神症状密切相关, 认为CRFR1拮抗剂是IBS的新治疗方法.
本文在验证健脾化湿颗粒改善腹泻型肠易激综合征(diarrhea-predominant irritable bowel syndrome, D-IBS)模型大鼠结肠运动及内脏敏感性的基础上, 进一步揭示了其作用机制可能与调节脑肠肽促肾上腺皮质激素释放因子(corticotropin releasing factor, CRF)及其受体相关.
健脾化湿颗粒为临床验方, 具有理气健脾, 祛湿止泻的作用, 适用于D-IBS, 本文为该方临床应用提供了理论依据.
促肾上腺皮质激素释放因子: 是通过丘脑下部-脑垂体神经分泌系统分泌进入垂体门静脉系统, 他直接作用于腺垂体的促肾上腺皮质素分泌细胞, 促进促肾上腺皮质素的分泌. 有α1-、α2-和β-CRF 3种, 类似多肽, 是脑肠肽的一种.
文章在前期研究基础上, 采用酶联免疫法和免疫组织化学等方法对D-IBS模型大鼠结肠、海马及下丘脑中CRF及其受体进行进一步考察, 探讨健脾化湿颗粒改善D-IBS的作用机制.
编辑: 郭鹏 电编: 都珍珍
| 1. | Moore NA, Sargent BJ, Manning DD, Guzzo PR. Partial agonism of 5-HT3 receptors: a novel approach to the symptomatic treatment of IBS-D. ACS Chem Neurosci. 2013;4:43-47. [PubMed] [DOI] |
| 2. | Fang CF, Tang HM, Liao XH, He JL, Li DT, Qiu ZW. [Effect of changji'an capsule on mRNA expressions of NPY and ACTH contents in brain-gut axis of IBS-D model rats]. Zhongxiyi Jiehe Zazhi. 2013;33:948-952. [PubMed] |
| 4. | 陈 光晖, 刘 玉玲, 杜 海燕, 张 晓峰, 赵 素微, 胡 楠, 靳 继伟, 于 海龙, 王 迎寒. 健脾化湿颗粒对腹泻型肠易激综合征模型大鼠结肠运动及中枢c-fos的影响. 世界华人消化杂志. 2015;23:1943-1948. [DOI] |
| 6. | Stengel A, Taché Y. Neuroendocrine control of the gut during stress: corticotropin-releasing factor signaling pathways in the spotlight. Annu Rev Physiol. 2009;71:219-239. [PubMed] [DOI] |
| 8. | Bravo JA, Dinan TG, Cryan JF. Alterations in the central CRF system of two different rat models of comorbid depression and functional gastrointestinal disorders. Int J Neuropsychopharmacol. 2011;14:666-683. [PubMed] [DOI] |
| 10. | Nijsen M, Ongenae N, Meulemans A, Coulie B. Divergent role for CRF1 and CRF2 receptors in the modulation of visceral pain. Neurogastroenterol Motil. 2005;17:423-432. [PubMed] |
| 11. | Spiller RC. Treatment of Irritable Bowel Syndrome. Curr Treat Options Gastroenterol. 2003;6:329-337. [PubMed] |
| 12. | Hirata T, Funatsu T, Keto Y, Nakata M, Sasamata M. Pharmacological profile of ramosetron, a novel therapeutic agent for IBS. Inflammopharmacology. 2007;15:5-9. [PubMed] |
| 13. | 刘 晓丽, 阎 芳, 王 琳, 刘 兆霞, 韩 慧蓉, 张 广学, 石 剑飞, 曲 梅花. CRF、UCN1和CRFR1在肠易激综合征大鼠结肠中变化的研究. 时珍国医国药. 2012;23:1542-1545. |
| 15. | Tan H, Zhong P, Yan Z. Corticotropin-releasing factor and acute stress prolongs serotonergic regulation of GABA transmission in prefrontal cortical pyramidal neurons. J Neurosci. 2004;24:5000-5008. [PubMed] |