修回日期: 2015-04-28
接受日期: 2015-06-09
在线出版日期: 2015-07-18
目的: 探讨表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate, EGCG), 对人肝癌细胞株HepG2的作用及其机制.
方法: 对数生长期的HepG2细胞分别用不同浓度的EGCG处理(0、10、20、40 µg/mL). 细胞培养48 h后, 利用MTT检测细胞增殖; 流式检测细胞凋亡和膜电位, 免疫印迹法检测磷脂酰肌醇-3-激酶(phosphatidylinositol 3 kinase, PI3K)、蛋白激酶B(protein kinase B, AKT)、p-AKT、BCL-2、Bax、pro-Caspase3、clevage-Caspase3、多聚ADP-核糖聚合酶[poly(ADP-ribose)polyrnerase, PARP]、Clevage-PARP和细胞色素C(cytochrome C, CytC)表达.
结果: EGCG可以成浓度依赖诱导HepG2细胞增殖抑制和凋亡, 上调Bax, pro-Caspase3, PARP和CytC表达, 下调PI3K, p-AKT, Cleavage-PARP, Cleavage-Caspase3和Bcl-2的表达和细胞膜电位, 但对AKT表达无明显影响.
结论: EGCG可通过抑制PI3K/AKT信号通路而诱导HepG2细胞增殖抑制和凋亡.
核心提示: 表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate, EGCG)可通过抑制磷脂酰肌醇-3-激酶/蛋白激酶B(phosphatidylinositol 3 kinase/protein kinase B)信号通路激活而诱导HepG2细胞增殖抑制和凋亡, 其机制可能与调节线粒体膜通透性转运孔(mitochondrial permeability transition pore)的开放程度来实现的.
引文著录: 李懿, 赵莉莉, 李易, 赵燕, 李良平. 表没食子儿茶素没食子酸酯通过PI3K/AKT信号通路抑制人肝癌细胞株HepG2增殖和促进凋亡. 世界华人消化杂志 2015; 23(20): 3188-3194
Revised: April 28, 2015
Accepted: June 9, 2015
Published online: July 18, 2015
AIM: To investigate the effect of epigallocatechin-3-gallate (EGCG) on cell apoptosis and proliferation in the human liver cancer cell line HepG2 and to explore the underlying mechanism.
METHODS: HepG2 cells in logarithmic growth phase were treated with different concentrations of EGCG (0, 10, 20, 40 µg/mL) for 48 h. MTT and flow cytometric analysis were used to evaluate the proliferation, membrane potential and apoptosis of HepG2 cells. The expression of phosphatidylinositol 3 kinase (PI3K), p-protein kinase B (p-AKT), AKT, BCL-2, Bax, pro-Caspase3, cleaved Caspase3, poly(ADP-ribose) polymerase (PARP), cleaved PARP and cytochrome C (CytC) in HepG2 cells was detected by Western blot.
RESULTS: EGCG treatment significantly decreased the cell proliferation, membrane potential and the expression of PI3K, p-AKT, cleaved PARP, cleaved Caspase3 and Bcl-2 in HepG2 cells, and increased cell apoptosis and the expression of pro-Caspase3, PARP, CytC and Bax. However, EGCG treatment had no significant influence on the expression of AKT.
CONCLUSION: EGCG induces cell apoptosis and growth inhibition in the human liver cancer cell line HepG2 possibly by suppressing PI3K/AKT signaling
- Citation: Li Y, Zhao LL, Li Y, Zhao Y, Li LP. Epigallocatechin-3-gallate induces human liver cancer HepG2 cell apoptosis and growth inhibition by suppressing phosphatidylinositol 3 kinase/protein kinase B signaling. Shijie Huaren Xiaohua Zazhi 2015; 23(20): 3188-3194
- URL: https://www.wjgnet.com/1009-3079/full/v23/i20/3188.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i20.3188
肝癌(hepatocellular carcinoma, HCC)是人类常见的恶性肿瘤之一, 发病率高, 目前占据我国肿瘤致死性疾病的第2位, 严重威胁人类的生命健康. 由于癌症早期低诊断率, 许多患者一经发现大多已进入肝癌终末期, 早已失去手术治疗的指征[1-6]. 因此, 寻找一种具有抗癌活性的药物是一个紧迫而现实的问题. 表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate, EGCG)是从绿茶提取的儿茶素单体成分, 研究[7-10]发现其具有抑制肿瘤细胞增殖和促进肿瘤细胞凋亡的作用. 而增殖过度和凋亡受阻是肝癌的重要的发病机制[11-13]. 因此本研究以人肝癌细胞株HepG2为靶细胞, 探讨EGCG对人肝癌细胞株HepG2作用及及其机制.
人肝癌细胞株HepG2, 购自ATCC, EGCG(Signa, USA)经HPLC鉴定纯度超过99%; MTT试剂盒(上海碧云天, 中国), Annexin V-FITC细胞凋亡检测试剂盒(南京凯基, 中国)RPMI 1640培养基, 美国Gibgo公司; 小牛血清, 杭州四季青公司; 12孔培养板, 美国Falcon公司; β-actin抗体(Abmart, China), Bcl-2抗体(Santa Cruz, CA), Bax抗体(Santa Cruz, CA), 磷脂酰肌醇-3-激酶(phosphatidylinositol 3 kinase, PI3K)(CST, USA), 多聚ADP-核糖聚合酶[poly(ADP-ribose)polyrnerase, PARP] (CST, USA), Cleavage-PARP(CST, USA), pro-Caspase3(Santa Cruz, CA), Cleavage-Caspase3(Santa Cruz, CA), 蛋白激酶B(protein kinase B, AKT)抗体(CST, USA) , p-AKT抗体(CST, USA), 细胞色素C(cytochrome C, CytC) (CST, USA). 蛋白裂解液RIPA(碧云天), 蛋白酶抑制剂cocktail及Western blot凝胶制备试剂盒购自武汉谷歌生物公司, BCA蛋白定量试剂盒(碧云天). 酶标仪(Thermo Fisher).
1.2.1 细胞培养: 人肝癌细胞株HepG2自中国科学院上海细胞生物所, 置于含有10%胎牛血清的RPMI 1640, 细胞培养于37 ℃、50 mL/L CO2培养箱中, 加入浓度含10%胎牛血清的RPMI 1640培养基, 生长至占据75%-85%培养瓶面积时用胰蛋白酶消化传代.
1.2.2 细胞增殖的MTT法检测: 取对数生长期HepG2细胞, 每孔0.5×105个细胞接种于96孔培养板中, 每孔体积200 μL; 细胞完全贴壁后离心弃上清分别加入EGCG(0、10、20、40 μmol/L作用48 h); 同时设置对照组(加入等量的培养基), 空白组(不加细胞加等量的PBS液), 每组均设6个复孔; 结束培养前4 h每孔加入5 g/L的MTT液20 μL, 弃去上清液后每孔加 200 μL DMSO, 轻微振荡10 min, 溶解MTT沉淀物, 待孔内结晶完全彻底溶解并色素均匀后上酶标仪于570 nm检测各孔的吸光度(A)值, 记录结果, 计算细胞增殖率. 细胞增殖率 = (蛇床子素组A值-空白组A值)/(对照组A值-空白组A值)×100%.
1.2.3 流式细胞术检测HepG2细胞凋亡: 采用Annexin V-FITC/PI双染色法检测HepG2细胞凋亡. 将2×105个对数生长期HepG2细胞接种在6孔培养板中, 生长至90%融合时, 药物处理同上. 然后按凋亡试剂盒说明以500 μL的结合缓冲液重悬, 按步骤说明加入5 μL Annexin V-FITC混匀后, 再加入5 μL PI, 轻微震荡混匀后避光, 室温反应15 min. 同时设立阴性对照组(不加Annexin V-FITC和PI), 置入流式细胞仪检测HepG2细胞凋亡率.
1.2.4 流式细胞术检测线粒体膜电位: 取对数生长期的细胞接种于6孔板中, 调整密度为1×105/mL. 细胞培养48 h后, 收集各组所有悬浮细胞, 调整细胞密度为1×105/mL, 每孔100 μL, 加入EGCG(0、10、20、40 μg/mL), 48 h后收集各组细胞悬液, PBS洗涤, 弃上清液, 1 mmol/L Fluo-3, 1 mmol/L rhodamine 123, 37 ℃孵育20 min, PBS洗涤, 重悬, 流式检测.
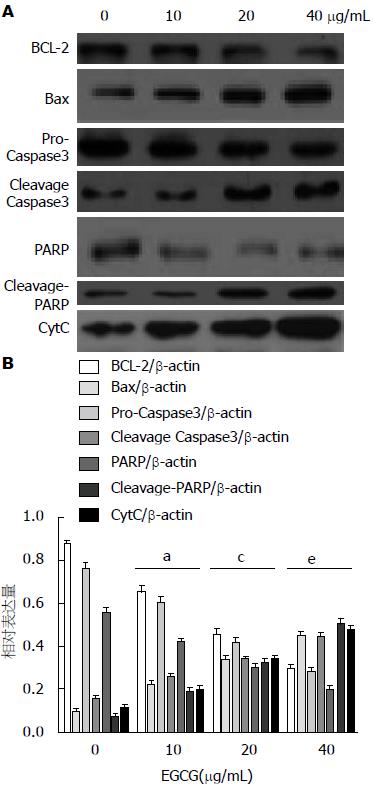
1.2.5 Western blot检测各组细胞PI3K、AKT、p-AKT、Bax、Bcl-2、pro-Caspase3、PARP、Cleavage-PARP、Cleavage-Caspase3和CytC蛋白表达: 将各浓度组收集的细胞用预冷的PBS清洗后, 按照蛋白裂解液RIPA操作说明提取蛋白, BCA法进行蛋白定量, 将各组蛋白浓度调成一致, 沸水煮5 min, 待用. 取各组细胞总蛋白样品80 μg, 以样品中的β-actin为内参, 经SDS-PAGE凝胶电泳, 转膜, 然后用含5%脱脂奶粉的PBS封闭2 h, 分别加入适量含2%脱脂奶粉的PBS稀释[PI3K(1:500)、AKT抗体(1:1000)、p-AKT(1:500)、Bax(1:500)、Bcl-2(1:500)、PARP(1:1000)、pro-Caspase3(1:1000)、Cleavage-PARP(1:300)、Cleavage-Caspase3(1:500)、CytC(1:500)和β-actin(1:3000)]抗体, 4 ℃孵育过夜. PBS洗膜3次, 10 min/次, 根据一抗的来源, 再分别加入适量含2%脱脂奶粉的PBS稀释的HRP标记羊抗兔IgG(1:500)、HRP标记羊抗鼠IgG(1:5000)室温下作用2 h, PBS洗膜3次, 10 min/次, ECL化学发光显色、压片、显影、定影、胶片扫描保存. 用Ge-l Pro Analy zer(Ver.3.0)软件测定蛋白条带灰度值条带灰度值PI3K、AKT、p-AKT、Bax、Bcl-2、pro-Caspase3、PARP、Cleavage-PARP、Cleavage-Caspase3、CytC与β-actin内参条带灰度值的比值分别将上述蛋白表达量化.
统计学处理 采用SPSS12.0统计软件包进行资料分析, 实验结果采用mean±SD表示, 资料采用单因素方差分析(ANOVA), P<0.05为差异有统计学意义.
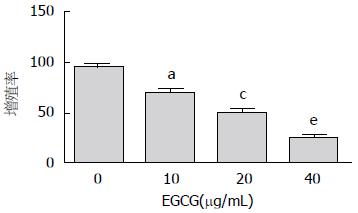
MTT检测实验结果显示, EGCG呈浓度依赖性抑制HepG2细胞增殖, 10、20、40 μg/mL EGCG处理HepG2细胞后, 细胞的增殖率依次下降, 且10 μg/mL EGCG处理组与对照组相比, 20 μg/mL EGCG处理组与10 μg/mL EGCG处理组相比, 40 μg/mL EGCG处理组与20 μg/mL EGCG处理组相比, 差异均有统计学意义(P<0.05)(图1).
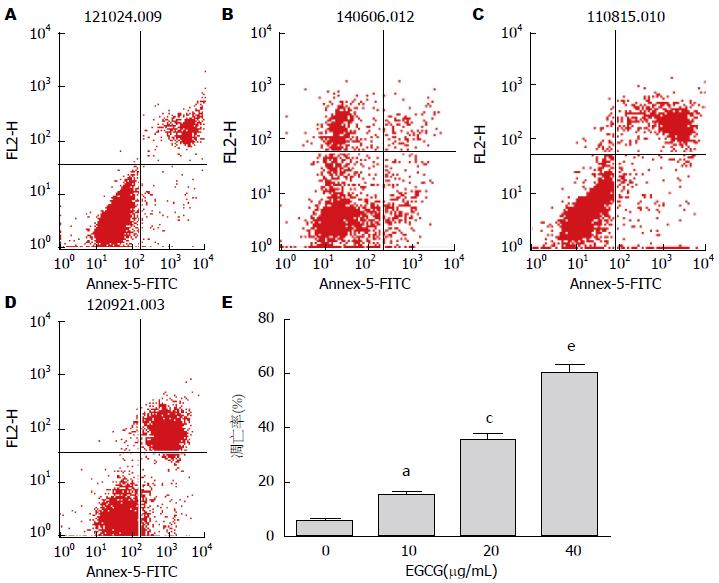
流式检测结果显示, EGCG可以成浓度依赖性促进HepG2细胞凋亡, 10、20、40 μg/mL EGCG处理HepG2细胞后, 细胞的凋亡率依次升高, 且10 μg/mL EGCG处理组与对照组相比, 20 μg/mL EGCG处理组与10 μg/mL EGCG处理组相比, 40 μg/mL EGCG处理组与20 μg/mL EGCG处理组相比, 差异均有统计学意义(P<0.05)(图2).
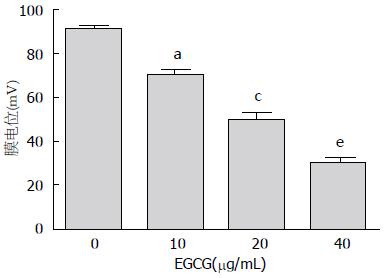
流式检测结果显示, EGCG可以成浓度依赖性降低HepG2细胞膜电位, 10、20、40 μg/mL EGCG处理HepG2细胞后, 细胞的膜电位依次降低, 且10 μg/mL EGCG处理组与对照组相比, 20 μg/mL EGCG处理组与10 μg/mL EGCG处理组相比, 40 μg/mL EGCG处理组与20 μg/mL EGCG处理组相比, 差异均有统计学意义(P<0.05)(图3).
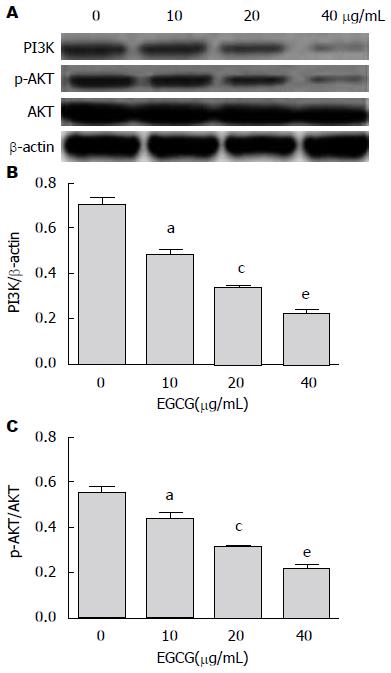
Western blot显示, EGCG成浓度依赖性降低PI3K, p-AKT的表达, 且10 μg/mL EGCG处理组与对照组相比, 20 μg/mL EGCG处理组与10 μg/mL EGCG处理组相比, 40 μg/mL EGCG处理组与20 μg/mL EGCG处理组相比, 差异均有统计学意义(P<0.05), 但对AKT表达无明显影响(P>0.05). 这显示EGCG可以抑制HepG2细胞PI3K/AKT信号通路的激活(图4).
Western blot显示: EGCG可以成浓度依赖性促进BCL-2、pro-Caspase3、PARP的降解和上调Bax、Cleavage-PARP、Cleavage-Caspase3和CytC的表达, 且10 μg/mL EGCG处理组与对照组相比, 20 μg/mL EGCG处理组与10 μg/mL EGCG处理组相比, 40 μg/mL EGCG处理组与20 μg/mL EGCG处理组相比, 差异均有统计学意义(P<0.05)(图5).
肝癌是好发于人类的常见恶性肿瘤, 死亡率极高, 严重威胁人类健康. 目前肝癌的治疗方式主要包括手术切除, 肝移植等、放化疗等, 目前疗效都欠佳, 寻找一种新的抗癌治疗方案成为一个紧迫而现实问题[1-6].
绿茶是东方民族常用的茶叶之一, 其主要成分为EGCG, 最近研究[13-21]发现表EGCG具有广泛的抗肿瘤活性, 其机制包括诱导肿瘤细胞凋亡, 阻止肿瘤细胞增殖、浸润和转移. 如抑制肺癌、胃癌等的生长及转移、降低乳腺癌的发生率改善子宫颈癌的预后等.
本研究中我们利用不同的浓度处理人肝癌细胞株HepG2 48 h, 实验结果显示EGCG可以成浓度依赖性抑制HepG2增殖和促进HepG2细胞凋亡, 上调PARP和Pro-Caspase3的表达和 下调Clevage-PARP和Clevage-Caspase3的表达. 证实了EGCG具有诱导HepG2细胞增殖压抑制和凋亡受阻的活性, 因而具有抗肿瘤的活性, 这进一步证实了先前的研究报道EGCG具有拮抗肝癌细胞HepG2细胞增殖的活性[22,23].
研究发现线粒体在细胞凋亡的过程中起着至关重要的枢纽作用, 线粒体膜电位与线粒体内膜通透性呈负相关, 而线粒体内膜通透性取决于线粒体外膜与内膜接触位点由多个蛋白质组成的通透转运孔道-线粒体膜通透性转运孔(mitochondrial permeability transition pore, MPTP)开放, MPIP开放增多, 线粒体内膜通透性增加, 而线粒体膜电位下降[24,25]. 线粒体膜间隙含有细胞色素C、钙离子, 凋亡诱导因子等多种促凋亡因子. MPTP开放导致线粒体的膜电位崩解, 使线粒体内部如细胞色素C等促凋亡因子外流, 而细胞色素C等促凋亡因子外流可导致凋亡信号通路的激活, 进而增加促凋亡蛋白的表达[24-27]. 在实验中我们发现EGCG可以成浓度依赖性降低细胞膜电位和抗凋亡蛋白表达, 而增加细胞色素C和促凋亡蛋白Bax的表达, 因此我们可以推测EGCG可以促进MPTP的开放, 进而增加线粒体内膜通透性, 导致细胞色素C增加, 进而凋亡信号通路广泛激活. 但EGCG如何调节MPTP的开放具体机制不清楚. 最近研究发现PI3K/AKT信号途径与MPTP的开放密切相关[28-30], 而EGCG可调控PI3K/AKT信号途径[31].
实验结果显示EGCG可以成浓度依赖性促进PI3K降解和下调p-AKT的表达, 但对AKT表达无明显影响. 因此, 我们可推测EGCG可通过抑制PI3K/AKT信号通路而促进MPTP的开放, 引发线粒体内膜通透性增加, 导致细胞色素C增加, 从而诱发凋亡信号通路广泛激活, 进而导致HepG2细胞增殖抑制和凋亡.
总之, EGCG可通过抑制PI3K/AKT信号通路而诱导HepG2细胞增殖抑制和凋亡. 但是EGCG是直接作用于PI3K信号分子还是通过调节其上游激酶和/或信号分子而间接发挥作用仍不清楚, 除PI3K/AKT信号通路外, 是否还有其他信号通路涉及EGCG诱导Hep2细胞增殖抑制和凋亡尚需进进一步更深入的研究.
肝癌是肝癌细胞增殖过度而凋亡受阻的恶性疾病, 而表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate, EGCG)可通过抑制磷脂酰肌醇-3-激酶/蛋白激酶B(phosphatidylinositol 3 kinase/protein kinase B, PI3K/AKT)信号通路而诱导肿瘤细胞凋亡、阻止肿瘤细胞增殖, 浸润和转移. 如抑制肺癌、胃癌等的生长及转移、降低乳腺癌的发生率改善子宫颈癌的预后等.
黄成, 副主任医师, 复旦大学附属中山医院肝外科
目前研究发现EGCG具有广泛的抗癌活性, 具有抗肺癌, 乳腺癌, 胃癌等多种肿瘤活性, 但具体机制不明, 最大的问题是如何在临床获得具有保护作用的EGCG浓度.
在类似研究中, 已经有人通过低表达和高表达进一步确认了EGCG抗肿瘤的信号机制.
进一步证实了EGCG具有抗肿瘤活性, 并从机制探讨了其抗肿瘤活性与抑制PI3K/AKT信号通路激活, 而促进线粒体膜通透性转运孔(mitochondrial permeability transition pore, MPTP)的开放, 促进凋亡信号通路激活.
为临床上预防和治疗肝癌提供了新的选择, 需要得到纯度更高的单体.
本研究探讨了绿茶成分EGCG对肝细胞癌HepG2增殖和凋亡的影响, 该研究思路清晰, 设计合理, 统计学处理可靠, 行文尚流畅, 但创新性一般, 有一定的临床应用价值.
编辑: 郭鹏 电编:闫晋利
| 1. | Khaderi S, Guiteau J, Cotton RT, O'Mahony C, Rana A, Goss JA. Role of liver transplantation in the management of hepatoblastoma in the pediatric population. World J Transplant. 2014;4:294-298. [PubMed] [DOI] |
| 2. | Clark T, Maximin S, Meier J, Pokharel S, Bhargava P. Hepatocellular Carcinoma: Review of Epidemiology, Screening, Imaging Diagnosis, Response Assessment, and Treatment. Curr Probl Diagn Radiol. 2015;44:479-486. [PubMed] [DOI] |
| 3. | Hong YP, Li ZD, Prasoon P, Zhang Q. Immunotherapy for hepatocellular carcinoma: From basic research to clinical use. World J Hepatol. 2015;7:980-992. [PubMed] [DOI] |
| 4. | Wáng YX, De Baere T, Idée JM, Ballet S. Transcatheter embolization therapy in liver cancer: an update of clinical evidences. Chin J Cancer Res. 2015;27:96-121. [PubMed] [DOI] |
| 5. | Kalyan A, Nimeiri H, Kulik L. Systemic therapy of hepatocellular carcinoma: current and promising. Clin Liver Dis. 2015;19:421-432. [PubMed] [DOI] |
| 6. | Govaere O, Roskams T. Pathogenesis and prognosis of hepatocellular carcinoma at the cellular and molecular levels. Clin Liver Dis. 2015;19:261-276. [PubMed] [DOI] |
| 7. | Zhang L, Wei Y, Zhang J. Novel mechanisms of anticancer activities of green tea component epigallocatechin- 3-gallate. Anticancer Agents Med Chem. 2014;14:779-786. [PubMed] |
| 8. | Camfield DA, Stough C, Farrimond J, Scholey AB. Acute effects of tea constituents L-theanine, caffeine, and epigallocatechin gallate on cognitive function and mood: a systematic review and meta-analysis. Nutr Rev. 2014;72:507-522. [PubMed] [DOI] |
| 9. | Yiannakopoulou ECh. Effect of green tea catechins on breast carcinogenesis: a systematic review of in-vitro and in-vivo experimental studies. Eur J Cancer Prev. 2014;23:84-89. [PubMed] [DOI] |
| 10. | Lecumberri E, Dupertuis YM, Miralbell R, Pichard C. Green tea polyphenol epigallocatechin-3-gallate (EGCG) as adjuvant in cancer therapy. Clin Nutr. 2013;32:894-903. [PubMed] [DOI] |
| 11. | Zhang W, Yang P, Gao F, Yang J, Yao K. Effects of epigallocatechin gallate on the proliferation and apoptosis of the nasopharyngeal carcinoma cell line CNE2. Exp Ther Med. 2014;8:1783-1788. [PubMed] |
| 12. | Steinway SN, Dang H, You H, Rountree CB, Ding W. The EGFR/ErbB3 Pathway Acts as a Compensatory Survival Mechanism upon c-Met Inhibition in Human c-Met+ Hepatocellular Carcinoma. PLoS One. 2015;10:e0128159. [PubMed] [DOI] |
| 13. | Fang F, Chang RM, Yu L, Lei X, Xiao S, Yang H, Yang LY. MicroRNA-188-5p suppresses tumor cell proliferation and metastasis by directly targeting FGF5 in hepatocellular carcinoma. J Hepatol. 2015;63:874-885. [PubMed] [DOI] |
| 14. | Khan N, Mukhtar H. Dietary agents for prevention and treatment of lung cancer. Cancer Lett. 2015;359:155-164. [PubMed] [DOI] |
| 15. | Gao Y, Li W, Jia L, Li B, Chen YC, Tu Y. Enhancement of (-)-epigallocatechin-3-gallate and theaflavin-3-3'-digallate induced apoptosis by ascorbic acid in human lung adenocarcinoma SPC-A-1 cells and esophageal carcinoma Eca-109 cells via MAPK pathways. Biochem Biophys Res Commun. 2013;438:370-374. [PubMed] [DOI] |
| 16. | Bai J, Ma M, Cai M, Xu F, Chen J, Wang G, Shuai X, Tao K. Inhibition enhancer of zeste homologue 2 promotes senescence and apoptosis induced by doxorubicin in p53 mutant gastric cancer cells. Cell Prolif. 2014;47:211-218. [PubMed] [DOI] |
| 17. | Ranzato E, Magnelli V, Martinotti S, Waheed Z, Cain SM, Snutch TP, Marchetti C, Burlando B. Epigallocatechin-3-gallate elicits Ca2+ spike in MCF-7 breast cancer cells: essential role of Cav3.2 channels. Cell Calcium. 2014;56:285-295. [PubMed] [DOI] |
| 18. | Wang S, Chen R, Zhong Z, Shi Z, Chen M, Wang Y. Epigallocatechin-3-gallate potentiates the effect of curcumin in inducing growth inhibition and apoptosis of resistant breast cancer cells. Am J Chin Med. 2014;42:1279-1300. [PubMed] [DOI] |
| 19. | Muthusami S, Prabakaran DS, An Z, Yu JR, Park WY. EGCG suppresses Fused Toes Homolog protein through p53 in cervical cancer cells. Mol Biol Rep. 2013;40:5587-5596. [PubMed] [DOI] |
| 20. | Zhang Y, Duan W, Owusu L, Wu D, Xin Y. Epigallocatechin-3-gallate induces the apoptosis of hepatocellular carcinoma LM6 cells but not non-cancerous liver cells. Int J Mol Med. 2015;35:117-124. [PubMed] [DOI] |
| 21. | Sharma C, Nusri Qel-A, Begum S, Javed E, Rizvi TA, Hussain A. (-)-Epigallocatechin-3-gallate induces apoptosis and inhibits invasion and migration of human cervical cancer cells. Asian Pac J Cancer Prev. 2012;13:4815-4822. [PubMed] |
| 22. | Shan X, Li Y, Meng X, Wang P, Jiang P, Feng Q. Curcumin and (-)-epigallocatechin-3-gallate attenuate acrylamide-induced proliferation in HepG2 cells. Food Chem Toxicol. 2014;66:194-202. [PubMed] [DOI] |
| 23. | Shen X, Zhang Y, Feng Y, Zhang L, Li J, Xie YA, Luo X. Epigallocatechin-3-gallate inhibits cell growth, induces apoptosis and causes S phase arrest in hepatocellular carcinoma by suppressing the AKT pathway. Int J Oncol. 2014;44:791-796. [PubMed] [DOI] |
| 24. | Juhaszova M, Zorov DB, Kim SH, Pepe S, Fu Q, Fishbein KW, Ziman BD, Wang S, Ytrehus K, Antos CL. Glycogen synthase kinase-3beta mediates convergence of protection signaling to inhibit the mitochondrial permeability transition pore. J Clin Invest. 2004;113:1535-1549. [PubMed] |
| 25. | da Silva MF, Natali AJ, da Silva E, Gomes GJ, Teodoro BG, Cunha DN, Drummond LR, Drummond FR, Moura AG, Belfort FG. Attenuation of Ca2+ homeostasis, oxidative stress, and mitochondrial dysfunctions in diabetic rat heart: insulin therapy or aerobic exercise? J Appl Physiol (1985). 2015;119:148-156. [PubMed] [DOI] |
| 26. | Nazari A, Sadr SS, Faghihi M, Azizi Y, Hosseini MJ, Mobarra N, Tavakoli A, Imani A. Vasopressin attenuates ischemia-reperfusion injury via reduction of oxidative stress and inhibition of mitochondrial permeability transition pore opening in rat hearts. Eur J Pharmacol. 2015;760:96-102. [PubMed] [DOI] |
| 27. | Weiss JN, Korge P, Honda HM, Ping P. Role of the mitochondrial permeability transition in myocardial disease. Circ Res. 2003;93:292-301. [PubMed] |
| 28. | Jie B, Zhang X, Wu X, Xin Y, Liu Y, Guo Y. Neuregulin-1 suppresses cardiomyocyte apoptosis by activating PI3K/Akt and inhibiting mitochondrial permeability transition pore. Mol Cell Biochem. 2012;370:35-43. [PubMed] |
| 29. | Zhao J, Cheng YY, Fan W, Yang CB, Ye SF, Cui W, Wei W, Lao LX, Cai J, Han YF. Botanical drug puerarin coordinates with nerve growth factor in the regulation of neuronal survival and neuritogenesis via activating ERK1/2 and PI3K/Akt signaling pathways in the neurite extension process. CNS Neurosci Ther. 2015;21:61-70. [PubMed] [DOI] |
| 30. | Kim SN, Kim ST, Doo AR, Park JY, Moon W, Chae Y, Yin CS, Lee H, Park HJ. Phosphatidylinositol 3-kinase/Akt signaling pathway mediates acupuncture-induced dopaminergic neuron protection and motor function improvement in a mouse model of Parkinson's disease. Int J Neurosci. 2011;121:562-569. [PubMed] [DOI] |
| 31. | Yu DK, Zhang CX, Zhao SS, Zhang SH, Zhang H, Cai SY, Shao RG, He HW. The anti-fibrotic effects of epigallocatechin-3-gallate in bile duct-ligated cholestatic rats and human hepatic stellate LX-2 cells are mediated by the PI3K/Akt/Smad pathway. Acta Pharmacol Sin. 2015;36:473-482. [PubMed] [DOI] |