修回日期: 2014-11-06
接受日期: 2014-11-12
在线出版日期: 2015-01-18
目的: Peutz-Jeghers综合征(Peutz-Jeghers syndrome, PJS)是一种较为罕见的以胃肠道多发息肉和皮肤黏膜色素沉着为特征的常染色体显性遗传性疾病, 具有较高的肿瘤易感性. 研究表明, 位于19p13.3位点丝/苏氨酸蛋白激酶(serine/threonine kinase 11, STK11)基因的突变是PJS发病的主要原因. 我们通过检测36例(16例具有家族史, 20例散发患者)PJS患者STK11基因外显子及侧翼序列突变情况, 捕获新的突变位点.
方法: 采用PCR扩增及DNA直接测序的方法检测36例PJS患者STK11基因外显子及侧翼序列突变情况, 并与STK11基因的正常序列对比分析.
结果: 在所有36例PJS患者中22例检测到STK11基因编码区的突变, 其中3例患者携带同一个突变位点, 余19例患者均携带单一突变位点. 其余14例患者STK11基因编码区未见突变位点. 22例发生突变的患者中, 5例患者发生移码突变(其中2例移码突变位点已被SNP收录); 17例患者发生错义突变(其中8例患者错义突变为终止密码子, 此8例中4例突变已被SNP收录). 所有突变的患者中共15例未被SNP及Clinwar基因库收录, 未见相关报道, 考虑为新发现的突变位点. 家族史组STK11基因突变率62.5%(10/16), 散发组STK11基因突变率60.0%(12/20), 两组差异无统计学意义(P>0.05).
结论: STK11基因突变是PJS(无论家族史或散发患者)发病的主要致病原因, 新发现的移码突变或错义突变可能是PJS患者发病的遗传基础之一.
核心提示:STK11基因突变是Peutz-Jeghers综合征(Peutz-Jeghers syndrome, PJS)(无论家族史或散发患者)发病的主要致病原因, 新发现的移码突变或错义突变可能是PJS患者发病的遗传基础之一.
引文著录: 毛旭燕, 张亚飞, 毛高平, 王海丰, 宁守斌. Peutz-Jeghers综合征患者STK11基因突变情况. 世界华人消化杂志 2015; 23(2): 332-337
Revised: November 6, 2014
Accepted: November 12, 2014
Published online: January 18, 2015
AIM: To identify point mutations in the STK11 gene coding region in patients with Peutz-Jeghers syndrome (PJS).
METHODS: The sequences of the coding region of the STK11 gene in 36 PJS patients were analyzed using PCR and DNA sequencing and compared with the normal sequence of the STK11 gene.
RESULTS: Of the 36 patients with PJS, 22 showed STK11 gene mutations in the coding region, including 3 patients having the same mutation and 19 patients with a unique mutation site. The remaining 14 patients were not found to have mutations in the STK11 gene coding region. Of the 22 patients with STK11 gene mutations, 5 showed frame-shift mutations, of which 2 were included in SNP gene databases, and 17 showed missense mutations, of which 8 were changed to a termination codon and 4 were included in SNP gene databases. Among the gene mutations identified in our patients, 15 were not included in gene databases and were considered new mutations. The gene mutation rate was 62.5% in patients with a family history and 60.0% in sporadic cases (P > 0.05).
CONCLUSION: Mutations of the STK11 gene are a major cause of PJS. The newly found missense and frame-shift mutations may be associated with PJS.
- Citation: Mao XY, Zhang YF, Mao GP, Wang HF, Ning SB. STK11 gene mutations in patients with Peutz-Jeghers syndrome. Shijie Huaren Xiaohua Zazhi 2015; 23(2): 332-337
- URL: https://www.wjgnet.com/1009-3079/full/v23/i2/332.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i2.332
Peutz-Jeghers综合征(Peutz-Jeghers syndrome, PJS)是一种较为罕见的以胃肠道多发息肉和皮肤黏膜色素沉着为特征的常染色体显性遗传性疾病, 约30%-50%PJS患者有家族遗传病史[1]. 发病无种族和性别间的差异[2]. 色素沉着斑可行激光治疗[3]. PJS息肉可致急慢性腹痛、肠套叠、肠扭转、肠梗阻、胃肠道出血等严重并发症, 其中以小肠套叠最常见[4]. 同时, PJS患者更易患胃肠道及胃肠道以外的多种恶性肿瘤, 考虑也与相关的基因突变有关[5,6], PJS患者息肉主要为错构瘤, 可发生癌变, 建议每2-3年进行息肉检查及切除[7]. 分子遗传学研究表明, 位于19号染色体短臂19p13.3区间的丝/苏氨酸蛋白激酶(serine/threonine kinase 11, STK11)基因是PJS的主要致病基因[8,9], 可发生基因的杂合性缺失、移码突变或无义突变等, 从而造成STK11基因功能丧失. STK11基因DNA全长2155 bp, 编码区含1302 bp, 含有9个外显子和11个内含子, 分布在23 kb的gDNA区域, 转录方向是从端粒到着丝粒, 编码相对分子质量为60 kDa的433个氨基酸组成的丝氨酸/苏氨酸激酶, 是迄今为止发现的唯一有抑癌作用的蛋白激酶, 属于一种cAMP依赖的蛋白激酶, 其功能催化区域位于第44-309位氨基酸残基. 国内一些学者对PJS患者进行STK11基因分析也发现STK11基因存在着散在的突变位点, 但仍有部分患者未见STK11基因突变, 提示可能有其他基因参与或还存在其他未知的突变位点[10,11]. 本研究通过PCR-DNA测序技术对36例中国PJS患者STK11基因编码区进行检测, 与STK11基因的正常序列比对分析(http://blast.ncbi.nlm.nih.gov/), 发现了新的突变位点, 现将结果报道如下.
收集2013-04/2014-08在中国人民解放军空军总医院确诊PJS患者36例. 其中男20例, 女16例, 年龄范围7-48岁, 平均年龄23.57岁±7.75岁. 15个家系共16例患者, 20例散发患者. 所有患者均符合PJS的诊断标准[12], 即: (1)胃肠道 ≥ 3个息肉, 且组织学符合PJS特点, 即起源于黏膜肌层的平滑肌像树枝样延伸至息肉的黏膜下层, 称之为PJ息肉(Peutz-Jeghers polyps); (2)具有PJS家族史且伴有PJS的发生; (3)具有PJS家族史且典型的皮肤黏膜色素沉着; (4)典型的皮肤黏膜色素沉着且伴有PJS的发生, 符合2项或以上患者可诊断本病. 本研究征得所有患者及家属同意, 并签署知情同意书. 抽取所有患者外周血, 肝素抗凝, -80 ℃保存备用.
1.2.1 DNA提取: 提取PJS患者外周静脉血2 mL, EDTA-K2抗凝. 采用血液基因组DNA提取试剂盒(上海南方基因科技有限公司)方法提取基因组DNA, 经紫外分光光度法检测DNA的浓度及纯度, -20 ℃保存备用.
1.2.2 引物设计: 对外周血DNA外显子及侧翼序列设计引物, 引物合成由上海南方基因科技有限公司合成, 合成后稀释成反应浓度20 μmol/L, -20 ℃保存备用.
1.2.3 PCR扩增及琼脂糖凝胶电泳: 对以上STK11外显子区域及侧翼序列在PCR仪上进行PCR扩增, 并用2%的琼脂糖凝胶电泳检测PCR扩增效果.
1.2.4 DNA测序: 对PCR扩增产物纯化后用DNA全自动测序仪进行测序, 测序反应引物同扩增产物, 测序产物用Bio Edit软件进行序列分析, 并将测序结果与基因库中提供的STK11基因进行比对.
统计学处理 数据处理采用SPSS17.0统计软件, 对患者的相关资料及临床检查数据进行描述性统计, 对连续计量资料采用mean±SD表示, 均数比较采用χ2检验, P<0.05为差异有统计学意义.
对36例PJS患者提取的DNA样本在上述扩增条件下进行扩增. 扩增后所得PCR产物用1%琼脂糖凝胶电泳进行检测, 结果表明PCR扩增产物长度符合目的片段理论值且特异性好.
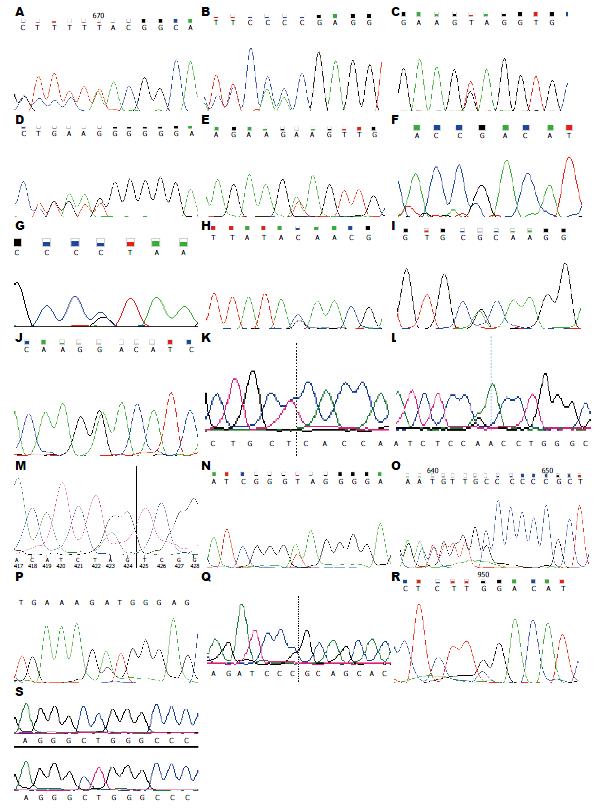
将36例PJS患者纯化后的PCR产物作为反应模板直接测序, 经与基因库中STK11基因的正常序列比对(http://blast.ncbi.nlm.nih.gov/), 发现22例PJS患者中存在STK11基因编码区的突变(表1), 15例患者突变于SNP基因库中及Clinwar数据库中未见报道, 其中3例于外显子1处因碱基缺失或插入突变为移码突变, 导致后序氨基酸的种类及顺序发生改变, 余12例发生错义突变(包括8例终止突变), 考虑为PJS综合征新的突变位点. 其余14例患者STK11基因编码区未检测到突变. 在外显子1处共发生8例突变: 3例移码突变, 导致后序氨基酸种类及顺序发生改变; 1例碱基置换致错义突变为另一种氨基酸; 4例错义突变为终止密码子, 导致终止氨基酸提前出现, 蛋白质翻译停止. 外显子2处, 发生1例错义突变为终止氨基酸, 导致编码停止. 外显子4处, 4例错义突变导致氨基酸种类改变, 蛋白质功能可能发生改变. 外显子5处发生一例错义突变为终止氨基酸. 外显子6处, 2例错义突变致氨基酸种类改变(包括1例错义突变为终止氨基酸, 导致编码终止). 外显子7及外显子9处各发生1例错义突变. 所收集的36例患者中, 2例患者在外显子6处携带同一位点突变, 发生碱基的缺失或插入, 导致移码突变的发生, 但已报道为STK11基因的SNP现象. 2例家系共3例患者于外显子1处C.180位点发生同一点突变类型C>G, 此突变为终止密码子, 导致氨基酸编码终止, 致疾病发生. 具体测序结果如图1. 家族史组STK11基因突变率62.5%(10/16), 散发组STK11基因突变率60.0%(12/20), 两组差异无统计学意义(P>0.05)(表2).
| 患者 | 外显子 | 核苷酸改变 | 突变类型 | 氨基酸改变 | 病理类型 | SNP编码 |
| PJS-1 | Exon1 | c.178 Int1A | 移码突变 | Y60&Termination | 错构瘤 | Novel |
| PJS-2 | Exon1 | c.95 del2C | 移码突变 | T32T | 错构瘤 | Novel |
| PJS-3 | Exon1 | c.193 G>3T | 错义突变 | E65&Termination | 错构瘤 | Novel |
| PJS-4 | Exon1 | c.152 IntG | 移码突变 | M51M | 错构瘤 | Novel |
| PJS-5 | Exon1 | c.250 A>T | 错义突变 | K84&Termination | 错构瘤 | rs137853076 |
| PJS-6 | Exon1 | c.56 G>C | 错义突变 | S19W | 错构瘤 | Novel |
| PJS-7 | Exon1 | c.180 C>G | 错义突变 | Y60&Termination | 错构瘤 | Novel |
| PJS-8 | Exon1 | c.180 C>G | 错义突变 | Y60&Termination | 错构瘤 | Novel |
| PJS-9 | Exon1 | c.180 C>G | 错义突变 | Y60&Termination | 错构瘤 | Novel |
| PJS-10 | Exon2 | c.354 C>G | 错义突变 | Y118&Termination | 错构瘤 | Novel |
| PJS-11 | Exon4 | c.521 A>G | 错义突变 | H174R | 错构瘤 | Novel |
| PJS-12 | Exon4 | c.526 G>A | 错义突变 | D176N | 错构瘤 | Novel |
| PJS-13 | Exon4 | c.552 T>G | 错义突变 | L184R | 错构瘤 | Novel |
| PJS-14 | Exon4 | c.580 G>A | 错义突变 | D194N | 错构瘤 | rs121913315 |
| PJS-15 | Exon5 | c.716 G>A | 错义突变 | W239&Termination | 错构瘤 | Novel |
| PJS-16 | Exon6 | c.805 A>T | 错义突变 | K269&Termination | 错构瘤 | Novel |
| PJS-17 | Exon6 | c.837 delC | 移码突变 | G215G | 错构瘤 | rs121913321 |
| PJS-18 | Exon6 | c.837 IntC | 移码突变 | G215G | 错构瘤 | rs121913321 |
| PJS-19 | Exon6 | c.862 G>A | 错义突变 | G288S | 错构瘤 | Novel |
| PJS-20 | Exon7 | c.911 G>C | 错义突变 | R304P | 错构瘤 | rs376280361 |
| PJS-21 | Exon8 | c.950 C>G | 错义突变 | S317W | 错构瘤 | rs59912467 |
| PJS-22 | Exon9 | c.1113 C>T | 错义突变 | R371W | 错构瘤 | rs368466538 |
| 类型 | 阳性 | 阴性 | 合计 | P值 |
| 家族史 | 10 | 6 | 16 | |
| 散发者 | 12 | 8 | 20 | |
| 合计 | 22 | 14 | 36 | 0.577 |
PJS, 即黑斑息肉综合征, 是一种较罕见的以皮肤/黏膜黑斑及胃肠多发息肉为特征的肿瘤易感性常染色体显性遗传性疾病, 约50%的PJS患者有家族史, 发病率约1/200000. 目前, 随着研究深入, 对PJS诊治已受到越来越多的关注. 研究表明, 位于19p13.3区域的STK11基因是PJS的主要致病基因, STK11通过控制AMP相关蛋白激酶(AMP-activated protein kinase, AMPK)家族成员的活性参与细胞代谢、血管内皮生长因子信号途径、细胞极性、p53依赖的细胞凋亡和DNA损伤应答过程, 是目前发现的唯一有抑癌作用的蛋白激酶, 属于cAMP依赖的蛋白激酶, 研究已表明此基因的缺失与突变也是PJS患者发生多器官恶性肿瘤的重要原因. 迄今为止, 在PJS和散发癌症患者中, 在人类基因突变库(Human Gene Mutations Database, HGMD)(http://www.hgmd.cf.ac.uk; the state on 08.2012)中已鉴定出的STK11突变有230余种, 所以, 随着基因检测技术的不断提高, PJS的基因突变率和类型也会不断增多, 通过对STK11基因突变的研究, 一方面可填补尚未被证实的基因突变谱, 同时又将有助于更精确的评估PJS患者的临床过程和预测其患癌风险强度, 并为该病的基因诊断与遗传咨询提供分子生物学依据, 为进一步阐明PJS患者发病机制提供科学依据, 并为后期研究新的突变基因及其位点奠下坚实的基础.
我们通过对36例PJS患者进行STK11基因测序, 测序结果与基因库中正常STK11序列对比, 发现22例患者存在STK11基因突变, 13例突变未被SNP基因库及Clinwar数据库收录, 2例发生同义突变, 1例移码突变, 余10例发生错义突变, 导致氨基酸的种类或顺序发生改变, 考虑可能为新的突变位点. 其中10例发生错义的类型中, 7例错义突变后导致终止密码子的提前产生, 致蛋白质翻译提前终止, 最终影响STK11蛋白激酶功能表达; 余3例发生碱基的置换, 引起错义突变致氨基酸序列的改变, 由于此突变位点位于具有催化活性的激酶区, 我们推测可能导致激酶活性的降低或缺失. 在我们所研究的36例家系中, 2例家系共3例患者于外显子1处C.180位点发生同一点突变类型C>G, 此突变为终止密码子, 导致氨基酸编码终止, 致疾病发生. 考虑常见STK11基因突变位点. 余家系携带的突变位点类型不同. 在我们发现的突变中, 突变位点主要集中在外显子1、4、6, 表明1、4、6号外显子为PJS最常见的突变位点, 可进一步通过大量样本检测, 进行此外显子区域突变位点蛋白功能的测定, 发现突变与STK11蛋白改变之间的关系.
此次发生突变的22例患者中, 突变类型均为DNA的杂合突变, 一条链正常, 而另一条异常的DNA链导致STK11蛋白表达量的减少, 进而影响蛋白功能及活性导致疾病的发生. 进而我们推测, STK11蛋白表达量的多少可能与疾病的发生成正相关, 而STK11基因的纯和突变可能致命, 此蛋白功能的改变有待深入研究.
此次研究的36例患者中, 8例散发及6例家族史患者具有典型PJS临床特征, 但未发现STK11基因的突变, 可能存在以下原因: (1)据文献报道[13], STK11基因在PJS患者中检测的阳性率大约在70%-94%, 除此之外, 在个别家系的患者中检测到与19q13.4、6p11-cen[7]及MYH11[14]有关; (2)DNA测序技术尚未发现STK11基因的突变, DNA测序尚未检测到阳性突变的患者通过MLPA可检测到若干大的片段的缺失[1]. 此现象表明可能存在除STK11基因外其他的基因突变, 对其致病基因的研究尚需深入开展. 同时家族史和散发患者STK11基因突变率比较, 两者无显著性差异, 表明STK11基因是散发和家族史PJS患者最常见致病基因, 无论家族史或散发PJS患者, 应首先考虑此基因突变情况, 阴性者可进行其他致病基因的检测.
总之, 通过对36例PJS患者行STK11基因编码区的检测, 发现22例患者存在突变位点, 13例突变位点未被SNP及Clinwar基因库收录, 此些突变位点的发现丰富了STK11基因突变数据库, 表明了STK11基因突变在PJS综合征发生发展中的重要地位, 为进一步阐明PJS发生机制提供理论依据, 为早期疾病的预防及下一步发现PJS其他致病基因奠定理论基石.
既往研究表明位于19号染色体短臂19p13.3区间的丝/苏氨酸蛋白激酶(serine/threonine kinase 11, STK11)基因是Peutz-Jeghers综合征(Peutz-Jeghers syndrome, PJS)的主要致病基因, 但STK11基因仍存在着散在的突变位点, 仍有部分患者未见STK11基因突变, 提示可能有其他基因参与或还存在其他未知的突变位点.
王蒙, 副教授, 中国人民解放军第二军医大学附属东方肝胆外科医院肝外综合治疗一科
STK11基因突变是PJS(无论家族史或散发患者)发病的主要致病原因, 新发现的移码突变或错义突变可能是PJS患者发病的遗传基础之一. 不仅填补尚未被证实的基因突变谱, 又有助于更精确的评估PJS患者的临床过程和预测其患癌风险强度, 并为该病的基因诊断与遗传咨询提供分子生物学依据.
国内一些学者对PJS患者进行STK11基因分析也发现STK11基因存在着散在的突变位点, 但仍有部分患者未见STK11基因突变, 提示可能有其他基因参与或还存在其他未知的突变位点.
STK11基因是PJS患者主要的致病基因, 对于STK11基因突变阴性患者可能有其他基因或还存在其他未知的突变位点参与疾病的发生, 此研究通过检测36例PJS患者STK11基因外显子突变情况, 捕获新的突变位点.
STK11基因突变是PJS(无论家族史或散发患者)发病的主要致病原因, 新发现的移码突变或错义突变可能是PJS患者发病的遗传基础之一. STK11基因突变在PJS综合征发生发展中的重要地位, 为进一步阐明PJS发生机制提供理论依据, 为早期疾病的预防及下一步发现PJS其他致病基因奠定理论基石.
Peutz-Jeghers综合征(PJS): 又称皮肤黏膜色素斑-肠道多发息肉综合征, 是一种常染色体显性遗传疾病, LKB1/STK11为其主要的致病基因, 临床表现以口唇、手指、足趾等部位黑/褐色素斑沉着和胃肠道多发息肉为主要特征.
本文为充填地区PJS基因库有重要参考意义.
编辑: 韦元涛 电编:闫晋利
| 1. | Aretz S, Stienen D, Uhlhaas S, Loff S, Back W, Pagenstecher C, McLeod DR, Graham GE, Mangold E, Santer R. High proportion of large genomic STK11 deletions in Peutz-Jeghers syndrome. Hum Mutat. 2005;26:513-519. [PubMed] [DOI] |
| 2. | McGarrity TJ, Kulin HE, Zaino RJ. Peutz-Jeghers syndrome. Am J Gastroenterol. 2000;95:596-604. [PubMed] [DOI] |
| 3. | 童 晓荣, 李 延, 刘 凌, 谭 志建, 郭 小红, 崔 曙光, 涂 亚庭. 调Q开关紫翠宝石激光治疗40例色素沉着肠息肉综合征唇部皮疹的疗效观察. 中国美容医学. 2012;21:87-88. |
| 4. | van Lier MG, Mathus-Vliegen EM, Wagner A, van Leerdam ME, Kuipers EJ. High cumulative risk of intussusception in patients with Peutz-Jeghers syndrome: time to update surveillance guidelines? Am J Gastroenterol. 2011;106:940-945. [PubMed] [DOI] |
| 5. | Korsse SE, Peppelenbosch MP, van Veelen W. Targeting LKB1 signaling in cancer. Biochim Biophys Acta. 2013;1835:194-210. [PubMed] [DOI] |
| 6. | Zhu XS, Dai YC, Nan QZ, Chen ZX, Xie JP, Zeng W, Fu YK, Lin YY, Lian QN, Sang QF. Analysis of differentially expressed tumor related genes in Peutz-Jeghers syndrome combined with colorectal carcinoma with cDNA microarrays. Chinese-German J Clin Oncol. 2011;10:462-467. [DOI] |
| 7. | Zhang YF, Mao XY, Zheng JC, Zu ZF, Mao GP, Ning SB. Small intestine adenocarcinoma associated with Peutz-Jeghers syndrome: a report of 5 cases and literature review. Chinese-German J Clin Oncol. 2014;13:337-340. [DOI] |
| 8. | Jiang CY, Esufali S, Berk T, Gallinger S, Cohen Z, Tobi M, Redston M, Bapat B. STK11/LKB1 germline mutations are not identified in most Peutz-Jeghers syndrome patients. Clin Genet. 1999;56:136-141. [PubMed] [DOI] |
| 9. | Yajima H, Isomoto H, Nishioka H, Yamaguchi N, Ohnita K, Ichikawa T, Takeshima F, Shikuwa S, Ito M, Nakao K. Novel serine/threonine kinase 11 gene mutations in Peutz-Jeghers syndrome patients and endoscopic management. World J Gastrointest Endosc. 2013;5:102-110. [PubMed] [DOI] |
| 10. | Zuo YG, Xu KJ, Su B, Ho MG, Liu YH. Two novel STK11 mutations in three Chinese families with Peutz-Jeghers syndrome. Chin Med J (Engl). 2007;120:1183-1186. [PubMed] |
| 11. | Gao Y, Zhang FM, Huang S, Wang X, Zhang P, Huang XD, Ji GZ, Fan ZN. A De Novo mutation of STK11 gene in a Chinese patient with Peutz-Jeghers syndrome. Dig Dis Sci. 2010;55:1032-1036. [PubMed] [DOI] |
| 12. | Beggs AD, Latchford AR, Vasen HF, Moslein G, Alonso A, Aretz S, Bertario L, Blanco I, Bülow S, Burn J. Peutz-Jeghers syndrome: a systematic review and recommendations for management. Gut. 2010;59:975-986. [PubMed] [DOI] |
| 13. | Salloch H, Reinacher-Schick A, Schulmann K, Pox C, Willert J, Tannapfel A, Heringlake S, Goecke TO, Aretz S, Stemmler S. Truncating mutations in Peutz-Jeghers syndrome are associated with more polyps, surgical interventions and cancers. Int J Colorectal Dis. 2010;25:97-107. [PubMed] [DOI] |
| 14. | Alhopuro P, Phichith D, Tuupanen S, Sammalkorpi H, Nybondas M, Saharinen J, Robinson JP, Yang Z, Chen LQ, Orntoft T. Unregulated smooth-muscle myosin in human intestinal neoplasia. Proc Natl Acad Sci U S A. 2008;105:5513-5518. [PubMed] [DOI] |