修回日期: 2015-04-29
接受日期: 2015-05-08
在线出版日期: 2015-07-08
目的: 探讨Toll样受体4(Toll-like receptor 4, TLR4)对乙型肝炎相关性肝癌细胞增殖的影响及作用机制.
方法: Western blot法检测36例乙型肝炎相关性肝癌患者组织及相应癌旁组织中TLR4、周期蛋白依赖激酶(cyclin-dependent kinase, CDK)4和CDK6的蛋白表达水平, 并分析癌组织中TLR4与CDK4、CDK6之间的关联性. 构建3个特定干扰TLR4的siRNA序列和一个阴性对照序列, 通过脂质体转染肝癌细胞Hep-3B, Western blot法筛选出最佳干扰序列. Western blot法检测转染前后肝癌细胞中TLR4、CDK4和CDK6的蛋白表达水平; MTT比色法、平板克隆形成实验检测干扰TLR4表达后肝癌细胞增殖能力.
结果: 在乙型肝炎相关性肝癌患者组织中, TLR4、CDK4和CDK6蛋白的总体表达水平高于相应癌旁组织(P<0.05), 且TLR4分别与CDK4、CDK6的表达呈正相关性(r1 = 0.66, r2 = 0.57). 成功构建并筛选出最佳干扰序列TLR4-siRNA-03. 转染TLR4-siRNA-03后, 与Control组相比, TLR4-siRNA组中CDK4、CDK6蛋白表达均随之降低(P<0.05), 肝癌细胞Hep-3B的生长速度也明显下降(P<0.05), TLR4-siRNA组克隆形成率(18.77%±4.61%)也明显下降(P<0.05).
结论: 在乙型肝炎相关性肝癌中TLR4可能通过调控CDK4、CDK6来影响其增殖.
核心提示: Toll样受体4(Toll-like receptor 4, TLR4)基因在人类多种肿瘤中呈过表达、在肝癌中TLR4调控周期蛋白依赖激酶4/6(cyclin-dependent kinase 4/6, CDK4/6)的表达影响肝癌细胞增殖的研究目前未见报道, 本实验在组织和细胞水平探讨TLR4调控CDK4/6的表达对乙型肝炎相关性肝癌细胞增殖的影响.
引文著录: 周勇, 黄文峰, 冯潜, 石世代, 李恩亮, 李科浩, 吴荣寿, 邬林泉. 乙型肝炎相关性肝癌中Toll样受体4调控周期蛋白依赖激酶4/6对其增殖的影响. 世界华人消化杂志 2015; 23(19): 3029-3037
Revised: April 29, 2015
Accepted: May 8, 2015
Published online: July 8, 2015
AIM: To explore the effect of Toll-like receptor 4 (TLR4) on the proliferation of hepatitis B virus (HBV) related hepatic carcinoma cells and the underlying mechanism.
METHODS: The expression of TLR4, cyclin-dependent kinase (CDK) 4 and CDK6 protein in 36 HBV-related hepatic carcinoma tissues and matched adjacent tissues were detected by Western blot, and their correlations in carcinoma tissues were analyzed. Three TLR4 specific siRNAs and a negative control were synthesized and transfected into hepatoma cells Hep-3B using liposomes. The siRNA sequence with the best performance was selected for Western blot analysis. The expression of TLR4, CDK4 and CDK6 proteins was measured by Western blot assay before and after transfection. The proliferation of hepatoma cells was observed by MTT assay and colony formation assay.
RESULTS: The overall expression levels of TLR4, CDK4 and CDK6 proteins in HBV-related hepatic carcinoma were significantly higher than those in the matched adjacent tissues (P < 0.05). There was a positive correlation between TLR4 and CDK4 expression (r = 0.66, P < 0.05), and between TLR4 and CDK6 expression (r = 0.57, P < 0.05). Using the best interference sequence (TLR4-siRNA-03), it was found that the protein levels of CDK4 and CDK6 were significantly decreased in the TLR4-siRNA group (P < 0.05), compared to the control group. In addition, the proliferation of Hep-3B cells and the colony formation rate were both decreased (P < 0.05) in the TLR4-siRNA group.
CONCLUSION: TLR4 may regulate the proliferation of HBV-related hepatic carcinoma cells by controlling the expression of CDK4 and CDK6.
- Citation: Zhou Y, Huang WF, Feng Q, Shi SD, Li EL, Li KH, Wu RS, Wu LQ. Toll-like receptor 4 regulates hepatitis B virus related hepatic carcinoma cell proliferation by controlling cyclin-dependent kinase 4/6 expression. Shijie Huaren Xiaohua Zazhi 2015; 23(19): 3029-3037
- URL: https://www.wjgnet.com/1009-3079/full/v23/i19/3029.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i19.3029
肝细胞性肝癌(hepatocellular carcinoma, HCC)又称原发性肝癌(简称肝癌)是世界范围内发病率最高、恶性程度最高和死亡率最高的恶性肿瘤之一. 每年全球大概有60万人死于肝癌, 我国约占55%[1]. 在我国, 肝癌的发生主要与乙型病毒性肝炎有关, 在高发地区高达70%-80%的持续性乙型肝炎病毒(hepatitis B virus, HBV)感染患者最终发展成肝癌. 大量研究[2-4]发现HBV及其X基因产物可改变肝癌微环境, 促使肝癌的发生发展.
Toll样受体4(Toll-like receptors, TLR4)是TLRs家族中的一员, TLR4可介导不同的信号转导途径来影响肿瘤细胞的增殖、抑制肿瘤细胞凋亡, 如胃癌[5,6]、结肠癌[7]和宫颈癌[8-11]等. 研究[12-14]发现TLR4基因在多种肿瘤细胞中存在过表达和基因多态性, 敲除该基因或使用其拮抗剂可抑制肿瘤细胞的生长. 周期蛋白依赖性激酶(cyclin-dependent kinases, CDKs)在细胞周期中起中心作用, 研究[15,16]发现CDK4/6在多种肿瘤细胞中过表达如鼻咽癌、胃癌等, 特异性地降低CDK4/6表达可使肿瘤细胞的生长速度明显减慢. 本研究通过收集乙型肝炎相关性肝癌组织标本, 检测TLR4、CDK4和CDK6在肝癌组织中的表达水平, 并分析其相关性. 采用Western blot法、MTT实验和平板克隆实验, 在体外细胞水平探讨肝癌细胞中TLR4调控CDK4、CDK6对其增殖的影响及作用机制.
2013-06/2014-09收集南昌大学第二附属医院与乙型肝炎相关性肝癌及相应癌旁组织(距离肿瘤组织>2 cm)标本36例, 所有患者均经检验科和病理科检测确诊, 其中男25例, 女11例, 患者平均年龄48.00岁±4.60岁. 标本收集后立即液氮保存. 标本采集均经患者本人知情同意和南昌大学第二附属医院伦理委员会审核通过. Hep-3B肝癌细胞购自中国科学院细胞库, 由江西省南昌大学第二附属医院分子中心重点实验室冻存储备. 胎牛血清、胰酶和1640培养基(Gibco公司), 两步法蛋白提取试剂盒(普利莱), Western blot制胶盒(长城生物技术有限公司), 兔抗人TLR4、CDK4和CDK6蛋白多克隆抗体(Proteintech公司), 辣根过氧化物酶标记羊抗兔IgG(中杉金桥公司), 脂质体Lipofectamine™ 2000(Invitrogen公司), MTT检测试剂盒(Sigma公司), 姬姆萨染液(博光生物科技有限公司), 发光试剂盒(天根), BCA蛋白定量分析检测试剂盒(碧云天). 由上海吉凯公司设计并合成3对特异性干扰TLR4的siRNA序列及阴性干扰序列如表1.
| 序列名称 | 5' to 3' |
| TLR4-siRNA-01 | F: ATTACCTACCAATGCATG |
| TLR4-siRNA-01 | R: CATGCATTGGTAGGTAAT |
| TLR4-siRNA-02 | F: ACTCAGCAAAGTCCCTGA |
| TLR4-siRNA-02 | R: ATCAGGGACTTTGCTGAG |
| TLR4-siRNA-03 | F: UUCGAGACUGGACAAGCC |
| TLR4-siRNA-03 | R: UGGCUUGUCCAGUCACGA |
| siRNA(-) | F: UUCUCCGAACGUGUCACG |
| siRNA(-) | R: ACGUGACACGUUCGGAGA |
1.2.1 Western blot法检测组织、细胞总蛋白水平的表达: 参照普利莱公司两步法蛋白提取试剂盒说明分别提取组织和细胞总蛋白, 根据BCA法测定蛋白浓度. 制胶(10%分离胶和5%浓缩胶), 每孔蛋白上样30 μg, 进行SDS-PAGE凝胶电泳, 湿转法将蛋白转膜至PVDF膜, 用5%的脱脂奶粉封闭2 h, TBST稀释一抗(TLR4 1:2000, CDK4 1:1000, CDK6 1:1000)4 ℃孵育过夜, 5%脱脂奶粉稀释二抗(1:5000)室温孵育2 h, 于暗室根据发光试剂盒说明书滴加发光工作液, 胶片曝光, 显影, 定影后自然晾干胶片, 拍照后采用Image-Proplus 6.0软件进行灰度分析.
1.2.2 细胞培养和转染: 将肝癌细胞Hep-3B接种于含12%的胎牛血清的DMEM培养基中, 于37 ℃、50 mL/L CO2培养箱中培养观察. 待细胞融合度达80%-90%时, 根据Invitrogen公司脂质体Lipofectamine™ 2000转染说明书, 用不含血清的DMEM培养基进行转染, 转染4-6 h后观察荧光蛋白情况, 更换成含12%胎牛血清的DMEM培养基培养, 48 h后提取细胞总蛋白.
1.2.3 MTT法检测转染后肝癌细胞Hep-3B生长曲线: 消化、收集Hep-3B细胞, 反复重悬各组细胞, 计数并接种到96孔板(10000/孔), 每组设5个复孔, 每孔加MTT溶液20 μL, 于37 ℃、50 mL/L CO2孵箱中培养4 h, 终止培养, 每孔加150 μL DMSO, 混匀10 min. 测定各孔的吸光度(A)值(490 nm波长), 操作重复测3次, 取平均值. 根据公式: 细胞生长抑制率 = (实验组平均A490-对照组平均A490)/对照组平均A490×100%, 计算细胞生长抑制率. 实验重复3次.
1.2.4 平板克隆观察转染后肝癌细胞Hep-3B克隆形成能力: 消化、收集Hep-3B细胞, 反复重悬各组细胞, 计数并接种到6孔板(1000/孔), 每组设3个复孔, 于37 ℃、50 mL/L CO2培养箱中培养2-3 wk. 终止培养, PBS清洗2遍, 甲醛固定, GIMSA染色液染色10-30 min, 清洗后晾干. 随机选取10个镜下视野计算菌落数量, 取平均值. 计算克隆形成率(%): 克隆形成率 = 克隆数/接种细胞数×100%. 实验重复3次.
统计学处理 数据分析采用SPSS19.0统计软件进行, 定量数据进行正态性检验, 符合正态分布时, 以mean±SD表示(本研究所有数据均符合正态性). 配对t检验(用于来源相同的癌组织和癌旁组织蛋白表达水平的比较)、相关性分析(探索肝癌组织中两蛋白表达的相关性), 多组均数方差齐性检验和成组设计的方差分析用于本实验数据分析, 方差分析后通过最小显著法(LSD法)或Dunnett's T3进行两两比较, P<0.05为差异有统计学意义.
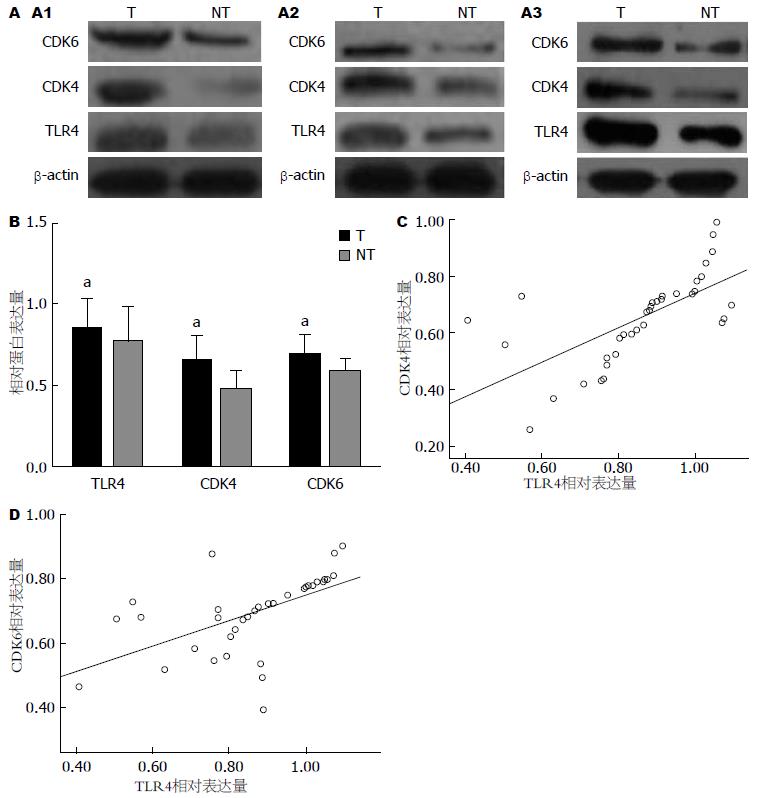
Western blot法检测36例乙型肝炎相关性肝癌及相应癌旁组织中TLR4、CDK4和CDK6蛋白均表达, 且对36对组织的TLR4、CDK4和CDK6蛋白经配对t检验发现, 癌组织中TLR4、CDK4和CDK6蛋白的总体表达水平高于癌旁组织, 差异具有统计学意义(P<0.05)(图1A, B).
进一步经相关性分析发现, 36例患者中, 有50%(18/36)患者TLR4蛋白高于癌旁组织的同时, CDK4蛋白在癌组织中的表达也高于癌旁组织, 且经相关性分析表明, TLR4与CDK4表达呈正相关(r = 0.66, P<0.05). 同样, 55.6%(20/36)患者癌组织TLR4和CDK6表达水平同时高于癌旁组织, 且在癌组织中二者的表达水平呈正相关(r = 0.57, P<0.05)(图1C, D).
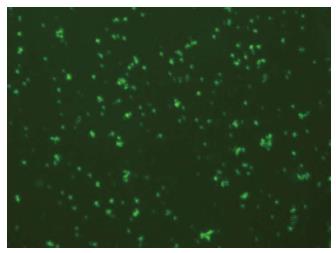
2.2.1 脂质体转染效率的检测: 利用脂质体转染法转染干扰序列进入肝癌细胞Hep-3B后, 在高倍(×100)视野下通过荧光显微镜观察绿色荧光蛋白的表达情况, 随机抽取10个视野, 观察转染细胞占正常细胞的百分比来描述转染效率, 结果显示转染效率达88.00%±3.47%(图2).
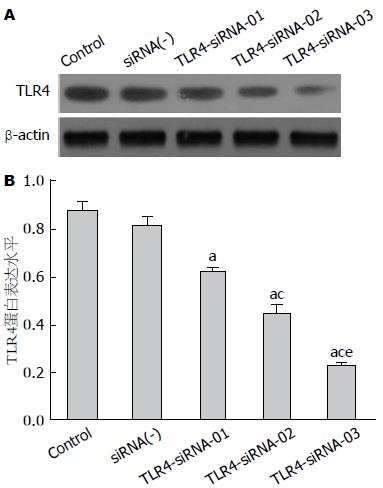
2.2.2 Western blot法检测各组干扰序列转染后对TLR4的干扰效果: 与正常细胞组和阴性干扰序列组相比, 转染干扰序列TLR4-siRNA-03后, 肝癌细胞Hep-3B中TLR4蛋白表达量明显下降(P<0.05); 而正常细胞组和阴性干扰序列组之间差异无统计学意义(P>0.05), 同时转染干扰序列TLR4-siRNA-01、TLR4-siRNA-02的干扰效果不如TLR4-siRNA-03干扰序列明显(P<0.05, P<0.05)(图3).
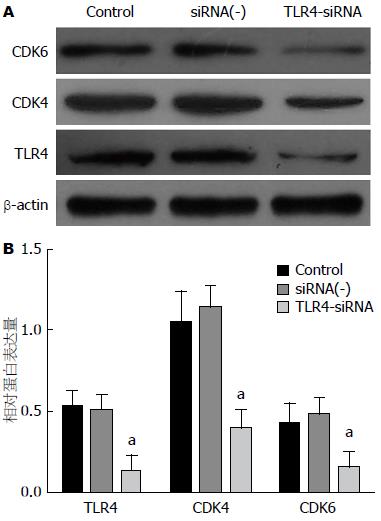
2.2.3 Western blot法检测TLR4-siRNA-03干扰序列转染后肝癌细胞Hep-3B中TLR4、CDK4和CDK6蛋白的表达情况: TLR4-siRNA组肝癌细胞中TLR4降低的同时, CDK4和CDK6蛋白的表达水平均较Control组明显降低(P<0.05), 而Control组和siRNA(-)组肝癌细胞中TLR4、CDK4和CDK6蛋白表达水平差异均无统计学意义(P>0.05)(图4).
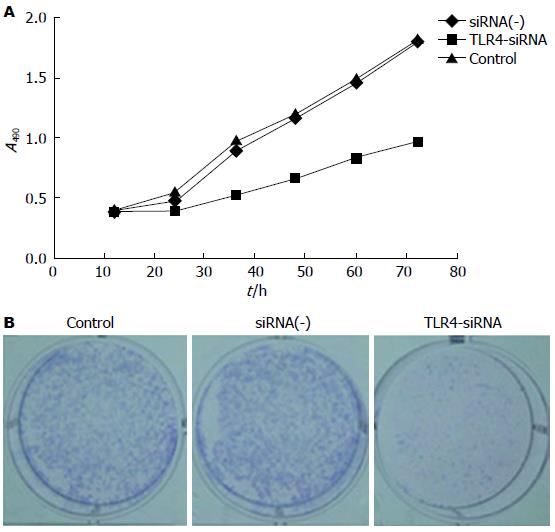
2.2.4 转染TLR4-siRNA-03干扰序列后对肝癌Hep3B细胞增殖能力的影响: 从生长曲线中的结果可显示: 与Control组比较, siRNA(-)组中肝癌细胞在12-36 h期间生长速度受到抑制(P<0.05), 此后, 细胞增殖活力恢复, 差异无统计学意义(P>0.05), 而TLR4-siRNA组肝癌细胞在12 h后生长速度明显减慢, 增殖受到明显抑制, 差异有统计学意义(P<0.05)(表2, 图5A).
平板克隆结果显示: TLR4-siRNA组、Control组和siRNA(-)组的克隆形成率依次为18.77%±4.61%、80.42%±8.23%、78.46%±9.06%; 与Control组比较, 转染TLR4-siRNA-03干扰序列后Hep-3B肝癌细胞的克隆集落数显著减少, 差异有统计学意义(P<0.05)(图5B).
目前, 临床上肝癌的发生年龄越来越年轻化, 严重威胁着人类的健康. 肝癌具有恶性程度高, 发展速度快, 复发转移性强, 预后差的特点[17]. 尽管肝癌的治疗方式已是多元化, 但手术治疗仍然是肝癌治疗的主要手段, 并可同时结合放化疗、栓塞治疗等其他治疗手段. 近年来, 分子靶向治疗成了治疗肝癌的热点和难点, 他是近年来传统治疗模式的突破. 在我国肝癌与乙型肝炎病毒性肝炎密切相关, 乙型肝炎相关性肝癌的分子靶向治疗是我国的大难题.
最初, 在人类中发现TLR蛋白与果蝇Toll蛋白具有高度的同源性, 然后命名为TLR4蛋白. TLR4是病原相关分子模式(pathogen-associated molecular pattern, PAMP)识别受体中的一种, 属于TLR家族中的一员, 位于9q32-33, 含有879个氨基酸, cDNA大小为3811 bp. TLR4是一种由胞外区、胞质区和胞内区组成的Ⅰ型跨膜蛋白. 目前已经证实TLR4既可特异性结合外源性配体, 还可以与内源性配体发生特异结合; TLR4识别以革兰氏阴性菌表面的脂多糖和内毒素部分脂质A为代表的外源性配体后, 形成同源或异源二聚体, 这个过程需要LPS结合蛋白、CD14、髓样分化因子2参与[18], 继而激活丝裂原激活的蛋白激酶(mitogen-activated protein kinase, MAPK)家族、AP-1、干扰素调节因子(interferon regulatory factor, IRF)5以及核因子-κB(nuclear factor κB, NF-κB)信号通路等, 然后上调大量的炎性细胞因子, 如: 白介素-6、基质酶、转化生长因子-β1等, 最后产生炎症反应. TLR4还可以识别的内源性配体主要有: 热休克蛋白、胎球蛋白A、纤维链接蛋白中的EDA片段以及游离脂肪酸等, 参与非感染性炎症反应[19,20]. 与TLR4有关的通路主要分为髓样分化因子(myeloid differentiation factor 88, MyD88)依赖性转导途径和非MyD88依赖性转导途径两种. 在TLRs下游有许多与肿瘤相关的重要信号分子, 如: NF-κB/p38、MAPK、Jun/c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)和细胞外信号调节激酶(extracellular signal-regulated kinase 1/2, ERK1/2)等信号通路[21,22]. 特异性干扰前列腺癌细胞PC3中TLR4表达可以有效控制MyD88表达, 使产生的IFN-β和IRF-1的分泌下降, 从而影响前列腺癌细胞的生长活力[23]. Wei等[24]发现TLR4与慢性乙型肝炎的发生发展有关. 曾治民等[25]进一步发现TLR4与HBV相关性肝癌细胞的增殖有着密切的关系.
CDKs是丝氨酸/苏氨酸蛋白激酶家族中的一组与细胞周期密切相关的蛋白集体. 目前发现的CDKs家族有13个, CDK1-13, 相互有着40%的同源性, 而只有CDK1、2、4、6、7在细胞周期中有活性. 在细胞周期蛋白参与下, cdks主要通过磷酸化其底物而对细胞周期进行调控, CDK4主要是使Rb蛋白发生磷酸化, 释放更多的E2F, 从而影响G1期细胞的增殖[26]; 而CDK6可通过抑制p21表达来诱导转录因子E2F1表达来影响细胞周期G1/S期细胞的转化[27]. Liu等[28]发现CDK4/6在非小细胞肺癌发病机制和演进中发挥着重要的作用. 目前已有多种CDK4/6抑制剂在抗肿瘤中的研究得到很好的验证处于二期研究状态, 如乳腺癌、套细胞淋巴瘤和卵巢癌等[29-31]. 研究[32]报道显示在HCC中CDK4/6呈现高表达, 通过抑制肝癌细胞中CDK4/6的表达, 可阻滞细胞G1期引起细胞凋亡来抑制细胞增殖. 然而, 在乙型肝炎相关性肝癌中TLR4与CDK4/6的表达及其关系目前还未有文献报道.
本实验收集36例乙型肝炎相关性肝癌组织及相应癌旁组织标本发现: 癌组织中TLR4、CDK4和CDK6蛋白的总体表达水平高于癌旁组织, 差异具有统计学意义(P<0.05). 且在癌组织中TLR4与CDK4、CDK6的表达存在正相关. 并通过体外实验发现干扰TLR4表达后, CDK4、CDK6的表达均下降, 肝癌细胞的生长速度明显减慢, 增殖收到明显抑制, 平板克隆形成能力明显降低. 这些数据表明在乙型肝炎相关性肝癌中TLR4可能调控肿瘤增殖相关蛋白CDK4、CDK6对其增殖产生一定作用. 因此, TLR4可能作为测定肝癌细胞增殖的一个新指标, 为肝癌靶向治疗提供一个新靶点.
由于原发性肝癌的发病率逐渐提高, 肝癌的诊治成了全人类的大难题; 尽管肝癌的治疗手段已是多样化, 但分子靶向治疗是当今的研究主流, 对肝癌细胞增殖和转移基因水平的研究可为分子靶向治疗提供一定的依据.
范学工, 教授, 中南大学湘雅医院感染病科
Toll样受体4(Toll-like receptor 4, TLR4)属于病原相关分子模式(pathogen-associated molecular pattern, PAMP)识别受体, 是人们最早发现的TLR, 在人多种肿瘤中呈过表达, TLR4基因及其信号通路在肿瘤细胞增殖过程中的作用是目前肿瘤研究的热点.
研究发现, TLR4不仅可以促进肿瘤发生和转移, 而且参与了肿瘤的免疫逃逸. TLR4可能通过促进肿瘤细胞增殖、抑制肿瘤细胞凋亡及免疫逃逸等机制参与炎症相关性肿瘤的发生发展.
本研究首次从组织和细胞水平探讨TLR4与周期蛋白依赖性激酶(cyclin-dependent kinase, CDK)4/6在乙型肝炎相关性肝癌中的关系及TLR4对肝癌细胞增殖的影响.
根据研究推测沉默TLR4基因表达可能影响CDK4/6表达来抑制乙型肝炎相关性肝癌细胞增殖能力, 可以把TLR4基因作为肝癌分子靶向治疗的一个新的靶点.
PAMP: 是模式识别受体识别结合的配体受体, 主要是指病原微生物表面某些共用的高度保守的分子结构, 如G+菌的脂多糖等.
本文设计合理, 研究思路清晰, 其结果有较好的科学意义.
编辑: 韦元涛 电编:都珍珍
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 3. | Neuveut C, Wei Y, Buendia MA. Mechanisms of HBV-related hepatocarcinogenesis. J Hepatol. 2010;52:594-604. [PubMed] [DOI] |
| 4. | Aravalli RN, Steer CJ, Cressman EN. Molecular mechanisms of hepatocellular carcinoma. Hepatology. 2008;48:2047-2063. [PubMed] [DOI] |
| 5. | Chochi K, Ichikura T, Kinoshita M, Majima T, Shinomiya N, Tsujimoto H, Kawabata T, Sugasawa H, Ono S, Seki S. Helicobacter pylori augments growth of gastric cancers via the lipopolysaccharide-toll-like receptor 4 pathway whereas its lipopolysaccharide attenuates antitumor activities of human mononuclear cells. Clin Cancer Res. 2008;14:2909-2917. [PubMed] [DOI] |
| 6. | Yokota S, Okabayashi T, Rehli M, Fujii N, Amano K. Helicobacter pylori lipopolysaccharides upregulate toll-like receptor 4 expression and proliferation of gastric epithelial cells via the MEK1/2-ERK1/2 mitogen-activated protein kinase pathway. Infect Immun. 2010;78:468-476. [PubMed] [DOI] |
| 7. | Liu L, Li YH, Niu YB, Sun Y, Guo ZJ, Li Q, Li C, Feng J, Cao SS, Mei QB. An apple oligogalactan prevents against inflammation and carcinogenesis by targeting LPS/TLR4/NF-κB pathway in a mouse model of colitis-associated colon cancer. Carcinogenesis. 2010;31:1822-1832. [PubMed] [DOI] |
| 8. | Stanley MA, Pett MR, Coleman N. HPV: from infection to cancer. Biochem Soc Trans. 2007;35:1456-1460. [PubMed] [DOI] |
| 9. | Hasimu A, Ge L, Li QZ, Zhang RP, Guo X. Expressions of Toll-like receptors 3, 4, 7, and 9 in cervical lesions and their correlation with HPV16 infection in Uighur women. Chin J Cancer. 2011;30:344-350. [PubMed] |
| 10. | Zhang J, Wang L, Li B, Huo M, Mu M, Liu J, Han J. miR-145 downregulates the expression of cyclin-dependent kinase 6 in human cervical carcinoma cells. Exp Ther Med. 2014;8:591-594. [PubMed] [DOI] |
| 11. | Cheng YX, Qi XY, Huang JL, Hu M, Zhou LM, Li BS, Xu XX. Toll-like receptor 4 signaling promotes the immunosuppressive cytokine production of human cervical cancer. Eur J Gynaecol Oncol. 2012;33:291-294. [PubMed] |
| 12. | Szajnik M, Szczepanski MJ, Czystowska M, Elishaev E, Mandapathil M, Nowak-Markwitz E, Spaczynski M, Whiteside TL. TLR4 signaling induced by lipopolysaccharide or paclitaxel regulates tumor survival and chemoresistance in ovarian cancer. Oncogene. 2009;28:4353-4363. [PubMed] [DOI] |
| 13. | Szczepanski MJ, Czystowska M, Szajnik M, Harasymczuk M, Boyiadzis M, Kruk-Zagajewska A, Szyfter W, Zeromski J, Whiteside TL. Triggering of Toll-like receptor 4 expressed on human head and neck squamous cell carcinoma promotes tumor development and protects the tumor from immune attack. Cancer Res. 2009;69:3105-3113. [PubMed] [DOI] |
| 14. | Hold GL, Rabkin CS, Chow WH, Smith MG, Gammon MD, Risch HA, Vaughan TL, McColl KE, Lissowska J, Zatonski W. A functional polymorphism of toll-like receptor 4 gene increases risk of gastric carcinoma and its precursors. Gastroenterology. 2007;132:905-912. [PubMed] |
| 15. | Clinicaltrials. gov. A clinical research study to detemine whether PD 0332991 may be efective In treating patients with liver cancer. May 22. 2013;https://clinicaltrials.gov/ct2/show/NCT01356628. |
| 16. | Zheng Q, Zhao LY, Kong Y, Nan KJ, Yao Y, Liao ZJ. CDK-associated Cullin 1 can promote cell proliferation and inhibit cisplatin-induced apoptosis in the AGS gastric cancer cell line. World J Surg Oncol. 2013;11:5. [PubMed] [DOI] |
| 17. | Kamsa-ard S, Wiangnon S, Suwanrungruang K, Promthet S, Khuntikeo N, Kamsa-ard S, Mahaweerawat S. Trends in liver cancer incidence between 1985 and 2009, Khon Kaen, Thailand: cholangiocarcinoma. Asian Pac J Cancer Prev. 2011;12:2209-2213. [PubMed] |
| 18. | Honda H, Nagai Y, Matsunaga T, Saitoh S, Akashi-Takamura S, Hayashi H, Fujii I, Miyake K, Muraguchi A, Takatsu K. Glycyrrhizin and isoliquiritigenin suppress the LPS sensor toll-like receptor 4/MD-2 complex signaling in a different manner. J Leukoc Biol. 2012;91:967-976. [PubMed] [DOI] |
| 19. | Soares JB, Pimentel-Nunes P, Roncon-Albuquerque R, Leite-Moreira A. The role of lipopolysaccharide/toll-like receptor 4 signaling in chronic liver diseases. Hepatol Int. 2010;4:659-672. [PubMed] [DOI] |
| 20. | Lu YC, Yeh WC, Ohashi PS. LPS/TLR4 signal transduction pathway. Cytokine. 2008;42:145-151. [PubMed] [DOI] |
| 21. | Maeda S. NF-κB, JNK, and TLR Signaling Pathways in Hepatocarcinogenesis. Gastroenterol Res Pract. 2010;2010:367694. [PubMed] [DOI] |
| 22. | Krishnan J, Selvarajoo K, Tsuchiya M, Lee G, Choi S. Toll-like receptor signal transduction. Exp Mol Med. 2007;39:421-438. [PubMed] [DOI] |
| 23. | Hua D, Liu MY, Cheng ZD, Qin XJ, Zhang HM, Chen Y, Qin GJ, Liang G, Li JN, Han XF. Small interfering RNA-directed targeting of Toll-like receptor 4 inhibits human prostate cancer cell invasion, survival, and tumorigenicity. Mol Immunol. 2009;46:2876-2884. [PubMed] [DOI] |
| 24. | Wei XQ, Guo YW, Liu JJ, Wen ZF, Yang SJ, Yao JL. The significance of Toll-like receptor 4 (TLR4) expression in patients with chronic hepatitis B. Clin Invest Med. 2008;31:E123-E130. [PubMed] |
| 27. | Wikonkal NM, Remenyik E, Knezevic D, Zhang W, Liu M, Zhao H, Berton TR, Johnson DG, Brash DE. Inactivating E2f1 reverts apoptosis resistance and cancer sensitivity in Trp53-deficient mice. Nat Cell Biol. 2003;5:655-660. [PubMed] [DOI] |
| 28. | Liu J, Liao Q, Zhang Y, Sun S, Zhong C, Liu X. Cyclin D1 G870A polymorphism and lung cancer risk: a meta-analysis. Tumour Biol. 2012;33:1467-1476. [PubMed] [DOI] |
| 29. | Finn RS, Dering J, Conklin D, Kalous O, Cohen DJ, Desai AJ, Ginther C, Atefi M, Chen I, Fowst C. PD 0332991, a selective cyclin D kinase 4/6 inhibitor, preferentially inhibits proliferation of luminal estrogen receptor-positive human breast cancer cell lines in vitro. Breast Cancer Res. 2009;11:R77. [PubMed] [DOI] |
| 30. | Bose P, Simmons GL, Grant S. Cyclin-dependent kinase inhibitor therapy for hematologic malignancies. Expert Opin Investig Drugs. 2013;22:723-738. [PubMed] [DOI] |
| 31. | Konecny GE, Winterhoff B, Kolarova T, Qi J, Manivong K, Dering J, Yang G, Chalukya M, Wang HJ, Anderson L. Expression of p16 and retinoblastoma determines response to CDK4/6 inhibition in ovarian cancer. Clin Cancer Res. 2011;17:1591-1602. [PubMed] [DOI] |
| 32. | 车 宇芳, 叶 飞, 张 泳, 姜 泊, 吴 本俨. Flavopiridol通过调节CDK4/CDK6/cyclinD1复合物表达抑制肝癌细胞增殖. 中华老年多器官疾病杂志. 2012;11:370-373. |