修回日期: 2014-12-06
接受日期: 2014-12-18
在线出版日期: 2015-05-08
目的: 本文旨在了解在超声介导下载药微泡对肝癌的治疗作用.
方法: 我们的研究中以聚乳酸(poly lactic acid, PLA)和卵磷脂为药物载体, 以紫杉醇为模型药物, 通过冷冻干燥技术以及改良的超声复乳-溶剂挥发法制备载紫杉醇的聚乳酸-卵磷脂纳米级微泡, 考察主要的制备参数: (1)超声时间对载药微泡理化特性(包括: 粒径、形态、载药量、包封率和超声介导下体外释药特性)的影响; (2)卵磷脂含量, 优化其制备最佳条件; 然后考察其对于人肝癌细胞的细胞毒性, 及其在超声介导下对荷瘤小鼠的抑瘤率和治疗效果.
结果: 在制备初乳和复乳过程中我们发现在超声时间均为100 s、PLA与卵磷脂质量比为250:50时可以制得较好的聚乳酸-卵磷脂纳米级微泡. 其平均粒径为615 nm、内部为空心的纳米级微泡, 药物包封率可达90.90%±5.79%, 载药率可达到8.26%±0.53%, 紫杉醇以无定型状态分布在微泡的壳内; 其在体外药物释放具有零级释放、缓释以及在超声介导下加快药物释放的特点. 并且在紫杉醇浓度为10 µg/mL时HepG2人肝癌细胞的增殖率仅为43.37%±3.23%.
结论: 相对于单纯的紫杉醇注射剂而言, 在超声介导下载药纳米级微泡注射剂可以提高抑瘤率并且还能减少对小鼠的不良反应.
核心提示: 本文结合本实验室以往的研究成果, 本文以聚乳酸为载体, 以紫杉醇为模型药物, 采用SPG(shirasu porous glass)膜乳化法制备出一定粒径、高载药量和包封率的缓释微泡, 并通过MTT细胞毒性实验和小鼠肝癌模型的体内抑瘤实验考察所得微泡本身以及采用联合超声协同作用的抑瘤效果.
引文著录: 葛建丽, 唐杰. 载紫杉醇的聚乳酸-卵磷脂纳米级微泡的制备及其在超声介导下对肝癌细胞生物效应的评价. 世界华人消化杂志 2015; 23(13): 2098-2103
Revised: December 6, 2014
Accepted: December 18, 2014
Published online: May 8, 2015
AIM: To prepare paclitaxel loaded polylactide-lecithin nanobubbles and assess their antitumor effect after ultrasound-mediated delivery.
METHODS: Paclitaxel-loaded polylactide (PLA)-lecithin nano-scale bubbles were prepared using the modified ultrasonic double emulsion solvent evaporation technology (UDES). The impact of preparing ultrasonic time and lecithin content on chemical and physical properties of drug-loaded microbubbles (including drug load, particle size, morphology, in vitro release characteristics and encapsulation efficiency) was assessed. Then, the inhibitory effect of the bubbles after ultrasound-mediated delivery on H22 tumors in mice derived from human hepatoma cells was evaluated.
RESULTS: The obtained paclitaxel-loaded PLA-lecithin nano-scale bubbles had a relatively uniform size of around 615 nm, and the drug load rate was 8.26%. The drug entrapment efficiency could reach 90.90%. The drug was amorphously dispersed in the shell of the bubble. The in vitro drug release test showed zero-order release and retained release, which could be speeded up by ultrasound. HepG2 cell only had a proliferation rate of 43.37% ± 3.23% when the paclitaxel concentration was at 10 µg/mL.
CONCLUSION: Ultrasound-mediated delivery of PLA-lecithin nanobubbles might have potential anticancer effects.
- Citation: Ge JL, Tang J. Paclitaxel loaded polylactide-lecithin nanobubbles: Preparation and antitumor effect after ultrasound-mediated delivery. Shijie Huaren Xiaohua Zazhi 2015; 23(13): 2098-2103
- URL: https://www.wjgnet.com/1009-3079/full/v23/i13/2098.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i13.2098
超声造影剂(ultrasound contrast agent, UCA)除了应用于影像学帮助诊断疾病以外, 目前还被广泛地应用于溶栓治疗、基因治疗、药物运送及肿瘤治疗等领域, 并向纳米级和功能化方向发展[1-3]. 由于超声波可以破坏载药微泡从而可以让微泡在特定的组织器官释放其包含的药物, 所以超声介导已经开创了药物靶向传递的新方法. 目前既具有超声造影又具有载药功能的常规药物微泡平均粒径为2-5 µm, 不能透过血管到相应组织发挥作用, 而且其载药率相对较低; 而纳米级载药微泡由于其尺寸小因此具有极强的血管穿透力, 可穿过血管到达组织器官, 从而实现了血管外的靶向诊断与治疗[4-6]. 原发性肝细胞癌是一种严重危害人类健康的疾病, 目前肝癌的治疗手段主要还是手术和化疗, 然而手术切除治愈率低易复发且对患者伤害比较大; 传统化疗由于没有器官及组织靶向性, 所以不良反应较大[7,8]. 因此, 寻找一种治疗效果好, 组织器官靶向性好, 对正常组织伤害小的治疗方法显得尤为重要. 近年来, 载药超声微泡已经引起了不少人的关注, 并且已经有不少学者载药微泡联合超声治疗肿瘤方面做出了一些研究成果[9,10]. 我们结合以往的研究成果, 以紫杉醇为模型药物选用聚乳酸为载体, 采用SPG(shirasu porous glass)膜乳化法制备出粒径均匀、载药量高和包封率高的缓释药物微泡, 通过小鼠肝癌模型的体内抑瘤实验和MTT细胞毒性实验考察制得的微泡本身以及在采用联合超声协同作用下的对肝癌细胞的抑制作用.
紫杉醇标准品(中国食品药品鉴定研究院, 批号100578-200401); 海藻糖(美国Amresco公司); 透析袋(MD77, 8000-14000, 北京索莱宝科技有限公司); 利福平标准品(中国食品药品鉴定研究院, 批号110757-200206); 吐温-80(美国Amresco公司); 聚乳酸(PLA, MW20000, 山东省医疗器械研究所); 牛血清白蛋白(BSA)(美国Amresco公司); 紫杉醇原料药(武汉富驰生物科技有限公司); 桂皮醛(上海楷洋生物技术有限公司, 批号Q0324); 甘露醇(上海楷洋生物技术有限公司); 磷酸二氢钠、三氯醋酸、磷酸二氢钾为分析纯; 试验用水为纯化水; 甲醇和乙腈为色谱纯.
1.2.1 聚乳酸-卵磷脂纳米级微泡的制备及表观测定: (1)水相的制备: 使用200 mL纯水将1.00 g牛血清白蛋白和0.40 g紫杉醇溶解, 并使用超声使二者充分溶解, 使之成为水相. 将所得的水相分成4份; (2)有机相的制备: 用34 mL丙酮并借助磁力搅溶解0.16 g聚乳酸, 在聚乳酸充分溶解后向溶液中加入0.42 g利福平; 取400 µL吐温-80缓慢滴加到34 mL无水乙醇中, 充分搅拌, 使其溶解; 把获得的吐温-80溶液在充分搅拌下加入先前制备得到的利福平溶液中; (3)制备纳米微粒注射液: 在磁力搅拌下向50 mL水相中缓慢滴加入有机相17 mL, 为使得两者可以充分互溶, 在滴加完毕后再继续磁力搅拌10 min. 充分搅拌后, 将所得溶液在避光下放于通风厨内, 使有机溶剂完全挥发, 从而制得半透明砖红色的纳米液. 最后将2%(质量体积比)甘露醇和3%(质量体积比)海藻糖加入制得的上述纳米液, 在-45 ℃--55 ℃冷冻干燥后, 获得分散性好的白蛋白纳米微粒粉末.
1.2.2 微观形态观察及粒径测定: 将微泡分散液加蒸馏水稀释50倍后, 应用NICOMPTM380亚微粒径分析仪测定粒径分布及大小. 取适量纳米微利粉末滴至铜筛网上, 用2%磷钨酸染色, 然后在室温下放置. 直至形成薄膜后使用透射电镜观察其形态, 并拍摄照片.
1.2.3 在体外状态下载药微泡对人肝癌细胞的细胞毒性测定: 使用MTT法检测FFC对HepG2细胞增殖的抑制作用, 选取对数生长期的HepG2细胞, 用完全培养基将细胞稀释成为1×105/mL细胞悬液, 加入96孔板中, 每孔100 µL. 在培养箱培养24 h后, 分别加入不同浓度的载紫杉醇的聚乳酸-卵磷脂纳米级微泡10 µL, 使得各孔载紫杉醇的聚乳酸-卵磷脂纳米级微泡终浓度分别为1、2、5、10 µg/mL, 阴性对照组加入紫杉醇的聚乳酸-卵磷脂纳米级微泡. 每组设定5个平行孔, 各组细胞分别在培养箱培养24、36、48 h, 在孵育结束后每孔加入MTT(5 mg/mL)10 µL, 再继续培养4 h, 弃去培养基, 每孔分别加入150 µL二甲基亚砜(dimethyl sulfoxide, DMSO), 然后震荡15 min, 使用酶标仪490 nm测定在参考波长620 nm下测定每孔光密度(A)值, 并计算FFC对细胞增殖的抑制率. 抑制率(%) = (1-实验组A/对照组A)×100%.
1.2.4 在超声介导下载药纳米级微泡对荷瘤小鼠的治疗效果和抑瘤率: 肝癌动物模型的建立: 用颈椎脱臼法处死BALB/c HGC-27荷瘤裸鼠, 然后剥离荷瘤鼠的肿瘤组织, 并去除坏死瘤组织, 筋膜以及结缔组织. 将瘤组织剪成大约1 mm3大小的组织块, 将20号穿刺针塞入瘤组织, 并将瘤组织接种到25只BABL/c裸鼠的右腋下, 在约15 d后肿瘤长至约0.7 cm后, 测量肿瘤大小并将25只荷瘤鼠利用随机分组分成5组, 每组5只, 1组为生理盐水组作为阴性对照组, 2组为接受低剂量载紫杉醇的聚乳酸-卵磷脂纳米级微泡治疗组(1 µg/mL), 3组为接受中低剂量载紫杉醇的聚乳酸-卵磷脂纳米级微泡治疗组(2 µg/mL), 4组为接受中高剂量载紫杉醇的聚乳酸-卵磷脂纳米级微泡治疗组(5 µg/mL), 5组为接受高剂量载紫杉醇的聚乳酸-卵磷脂纳米级微泡治疗组(10 µg/mL). 所有的实验组动物均为隔天接受瘤内注射药物1次, 每次注射0.2 mL药物, 共处理4次, 观察荷瘤鼠生长状态, 在最后1次用药2 d后用颈椎脱臼法处死荷瘤鼠, 取下肿瘤组织, 并用电子天平称质量, 计算抑瘤率[抑瘤率(%) = (阴性对照组平均瘤质量-实验组平均瘤质量)/阴性对照组平均瘤质量×100%].
统计学处理 使用SPSS13.0统计软件进行统计数据处理, 结果以mean±SD表示, 各实验小组均数与阴性对照组比较用LSD-t检验. P<0.05为差异有统计学意义.
白蛋白纳米粒外观为砖红色, 得到分散性较好的冻干粉末, 借助透射电镜可以观察到白蛋白纳米微粒的大小均匀, 粒径较为一致, 互不黏连, 所有纳米颗粒表面光滑, 无突起及毛糙, 外观圆整. 通过激光衍射粒度分析仪测定, 纳米微粒粒径分布范围窄, 微粒粒径为60.5 nm±4.6 nm, 粒径大小波动在30-110 nm之间. 具体图像如图1.
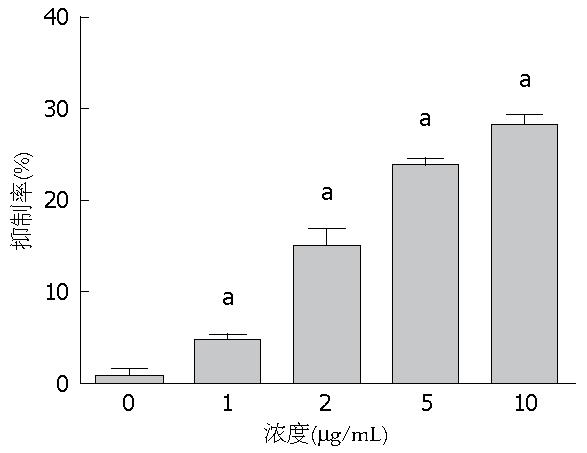
通过对人肝癌细胞HepG2细胞给予不同浓度的载药微泡处理后, 现将对细胞的抑制率经计算后发现在添加不同浓度载药微泡处理后, 肝癌细胞增殖能力受到不同程度的抑制, 在载药微泡浓度为10 µg/mL时达到抑制能力达到最大(48.0%±2.2%). 各浓度载药微泡处理组人肝癌细胞增殖抑制率如图2显示.
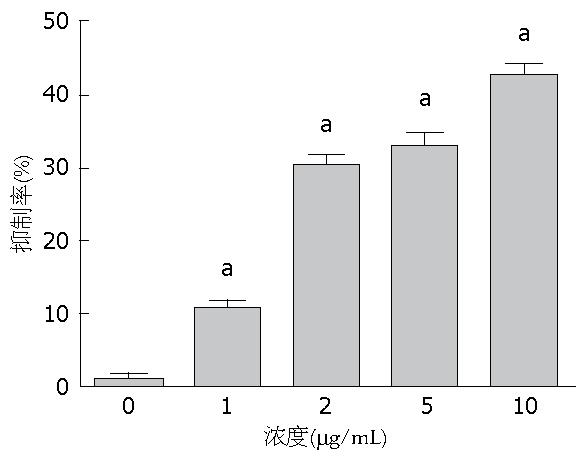
同对照组比较后发现, 在接受不同浓度载药微泡治疗后, 小鼠接种的肿瘤大小均有不同程度的减小, 这表明载药微泡在不同浓度下对肿瘤生长均有抑制作用, 当给药浓度为10 µg/mL时, 抑制作用达到最大, 对肿瘤的抑制率达到45%左右, 达到此浓度后再加大给药剂量对肿瘤的抑制率改变不大. 具体各组抑制率情况如图3.
合格的纳米药须要兼备较高的包封率和载药量, 因此我们需要对制备载药微泡的技术条件进行优化以达到所得的载药微泡可以达到较高水准的目的. 有文献提示, 有学者通过改良后的自乳化-溶剂蒸发法制得了具有较高包封率的载利福平聚乳酸-羟基乙酸共聚物的纳米微粒, 其粒径为128 nm, 包封率65.84%, 虽然制得的利福平具有较高的包封率[11], 但是其载药量仅为3.78%, 还比较低, 难以起到治疗结核病的功效. 现在我们在先前研究基础上对原有的方法进行了改良和优化. 我们选用聚乳酸和白蛋白两种物质共同来作为载药基质. 有机相则创新地选用了无水乙醇和丙酮, 因为他们可以和水互溶. 不仅如此, 我们还调整了原有方法中中加入溶剂丙酮与无水乙醇的次序: 我们先将利用丙酮溶解聚乳酸, 待丙酮完全将PLA溶解以后, 再向丙酮中加入利福平[12]. 同时我们为了能够提高利福平的载药量, 我们将吐温-80(0.1%, V/V)引入到体系中, 把他加入到无水乙醇中, 然后再向丙酮中加入这种无水乙醇和吐温-80混合液. 通过技术的优化, 我们的到了粒径更大60.5 nm±4.6 nm, 封包率和载药量更高的异烟肼-利福平-牛血清蛋白-囊泡(isonicotinic acid hydrazide-rifampicin-bovine serum albumin-vesicle, INH-RFP-BSA), 载药量包封率分别达到了20.1%、98.0%. 而通过这种方法制得的紫杉醇纳米微粒的载药量和包封率也分别达到了19.8%、87.8%. 通过这种方式得到的药品可以更好地应用于治疗疾病[13,14].
绝大部分的纳米级药物, 因为选择的载体及制备方法的差异, 其粒径差异较大, 文献报道采用原有方法制备的INH-RFP-BSA-NPs, 大多为粒径在186-290 nm之间的纳米粒[15]. 由于粒径<5 µm的微粒在通过肺循环的时候容易在被血管内皮摄取, 而当粒径<150 nm时, 纳米粒则因为具有穿越骨髓-血屏障的能力可以靶向分布于骨髓[16,17]. 所以通过原有方法制得的载药微粒虽然封包率高, 但是由于无法透过血骨髓屏障而无法治疗骨关节结核病. 但是通过我们改良后方法制得的纳米微粒其粒径仅为60.5 nm±4.6 nm, 可以透过血骨髓屏障, 为应用与治疗骨关节结核打下了理论基础.
本研究中同时使用聚乳酸和白蛋白作为载药基质, 主要是由于以下的几点原因: (1)白蛋白分子具有空间网状空隙, 因此有了镶嵌药物的能力; (2)白蛋白这种载药基质还可以负载亲水性药物; (3)聚乳酸这种载药基质由于本生无抗原性不会引起过敏反应, 而且可以生物降解无毒性所以他被我们选为骨架材料. 我们的研究证明了使用这两种载药基质可以将两种极性完全相反的药物(INH、RFP)同时包埋在同一个微粒中为治疗结核病提供了新的思路.
我们制备的载药微粒其粒径较小(<150 nm)并且可以透过血-骨髓屏障, 并且在体外研究中显示, 载紫杉醇微粒体外释药时间可达144 h以上, 载利福平微粒体外释放也达到了120 h. 体内药物释放显示本纳米微粒中INH、RFP的Cmax<普通制剂, 而半衰期(t1/2α)、平均驻留时间也远大于普通制剂. 给药后纳米微粒组INH的血药浓度更加相对稳定, 给药后120 h仍能检测到药物在血液中的存在; 其RFP的血药浓度也相对更稳定, 药物浓度曲线下降较缓慢, 给药后48 h仍能检测到. 而对照组的INH血药浓度下降更快速, 给药后24 h即检测不到血液中药物的存在; RFP血药浓度也迅速下降, 给药12 h即检测不到血液中药物存在. 这显示了本纳米药微粒的缓释特性比较好, 已经超越了现有的口服抗结核药物.
超声造影剂(ultrasound contrast agent, UCA)除了应用于增强声学造影外, 目前已经广泛地应用于基因治疗、药物输送、溶栓治栓及肿瘤治疗等领域, 并向纳米级和功能化方向发展.
毛高平, 教授, 中国人民解放军空军总医院
由于超声破坏载药微泡可使微泡在特定组织释放药物, 超声介导治疗开创了靶向药物传递的新途径. 具有超声造影和载药双功能的常规微泡平均粒径为2-5 µm, 不能透过血管, 且载药率较低; 纳米级载药微泡由于其尺寸小而具有极强的穿透力, 可穿过血管内皮细胞间隙实现血管外的靶向诊断与治疗, 具有巨大的发展潜力.
原发性肝癌是威胁人类健康的重要疾病之一, 目前关于肝癌的治疗手段以手术切除和化疗为主, 然而手术切除治愈率低且易复发; 传统的化疗药物无靶向性, 不良反应较大. 因此, 寻找更安全有效、靶向性高、不良反应小的治疗方法非常必要.
我们通过技术创新, 制得粒径为60.5 nm±4.6 nm的INH-RFP-BSA-NPs, 以及得到载药量19.8%、包封率87.8%的紫杉醇, 载药量20.1%、包封率98%的利福平, 由此所获得的载药纳米粒的载药量和包封率均明显优于文献报道.
本文结合本实验室以往的研究成果, 本文以聚乳酸为载体, 以紫杉醇为模型药物, 采用SPG膜乳化法制备出一定粒径、高载药量和包封率的缓释微泡, 并通过MTT细胞毒性实验和小鼠肝癌模型的体内抑瘤实验考察所得微泡本身以及采用联合超声协同作用的抑瘤效果.
超声造影剂: 是指应用于超声成像中以增强图像对比度的物质. 多为微米量级粒径的有包膜的微气泡, 由静脉注射进入血液, 用来达到增强超声波的反射强度的目的, 从而得以实现超声造影成像的目的
本文选题较新颖, 设计合理, 载药微泡制备技术上有一定创新, 对超声介导的靶向药物治疗具有临床参考价值.
编辑: 郭鹏 电编: 都珍珍
| 1. | Ke H, Wang J, Dai Z, Jin Y, Qu E, Xing Z, Guo C, Yue X, Liu J. Gold-nanoshelled microcapsules: a theranostic agent for ultrasound contrast imaging and photothermal therapy. Angew Chem Int Ed Engl. 2011;50:3017-3021. [PubMed] [DOI] |
| 2. | Liu P, Wang X, Zhou S, Hua X, Liu Z, Gao Y. Effects of a novel ultrasound contrast agent with long persistence on right ventricular pressure: Comparison with SonoVue. Ultrasonics. 2011;51:210-214. [PubMed] [DOI] |
| 3. | Klibanov AL. Microbubble contrast agents: targeted ultrasound imaging and ultrasound-assisted drug-delivery applications. Invest Radiol. 2006;41:354-362. [PubMed] |
| 4. | Pochon S, Tardy I, Bussat P, Bettinger T, Brochot J, von Wronski M, Passantino L, Schneider M. BR55: a lipopeptide-based VEGFR2-targeted ultrasound contrast agent for molecular imaging of angiogenesis. Invest Radiol. 2010;45:89-95. [PubMed] [DOI] |
| 5. | Anderson CR, Hu X, Zhang H, Tlaxca J, Declèves AE, Houghtaling R, Sharma K, Lawrence M, Ferrara KW, Rychak JJ. Ultrasound molecular imaging of tumor angiogenesis with an integrin targeted microbubble contrast agent. Invest Radiol. 2011;46:215-224. [PubMed] [DOI] |
| 6. | Welzel TM, Graubard BI, Zeuzem S, El-Serag HB, Davila JA, McGlynn KA. Metabolic syndrome increases the risk of primary liver cancer in the United States: a study in the SEER-Medicare database. Hepatology. 2011;54:463-471. [PubMed] [DOI] |
| 7. | Kang TW, Yevsa T, Woller N, Hoenicke L, Wuestefeld T, Dauch D, Hohmeyer A, Gereke M, Rudalska R, Potapova A. Senescence surveillance of pre-malignant hepatocytes limits liver cancer development. Nature. 2011;479:547-551. [PubMed] [DOI] |
| 8. | 康 娟, 吴 小翎, 张 勇, 冉 海涛, 王 志刚. 载多西紫杉醇脂质微泡联合超声靶向微泡破裂对兔VX2肝癌微血管的作用. 中国介入影像与治疗学. 2011;8:431-434. |
| 11. | 丁 小力, 王 自立, 戈 朝晖, 王 文萍, 马 小明, 牛 宁奎, 李 平, 杨 小英. 载异烟肼利福平聚乳酸纳米粒的制备及体外释药. 中国组织工程研究. 2012;16:2909-2912. |
| 12. | Ahmad Z, Pandey R, Sharma S, Khuller GK. Pharmacokinetic and pharmacodynamic behaviour of antitubercular drugs encapsulated in alginate nanoparticles at two doses. Int J Antimicrob Agents. 2006;27:409-416. [PubMed] |
| 13. | Booysen LL, Kalombo L, Brooks E, Hansen R, Gilliland J, Gruppo V, Lungenhofer P, Semete-Makokotlela B, Swai HS, Kotze AF. In vivo/in vitro pharmacokinetic and pharmacodynamic study of spray-dried poly-(dl-lactic-co-glycolic) acid nanoparticles encapsulating rifampicin and isoniazid. Int J Pharm. 2013;444:10-17. [PubMed] [DOI] |
| 14. | Pandey R, Sharma A, Zahoor A, Sharma S, Khuller GK, Prasad B. Poly (DL-lactide-co-glycolide) nanoparticle-based inhalable sustained drug delivery system for experimental tuberculosis. J Antimicrob Chemother. 2003;52:981-986. [PubMed] |
| 17. | Murakami H, Kobayashi M, Takeuchi H, Kawashima Y. Preparation of poly(DL-lactide-co-glycolide) nanoparticles by modified spontaneous emulsification solvent diffusion method. Int J Pharm. 1999;187:143-152. [PubMed] |