修回日期: 2015-02-22
接受日期: 2015-03-09
在线出版日期: 2015-04-18
目的: 通过葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导建立小鼠溃疡性结肠炎(ulcerative colitis, UC)急、慢性模型, 并动态监测小鼠结肠损伤、病理变化及血浆、结肠黏膜中白介素(interleukin, IL)-1β、IL-18、IL-33等细胞因子的变化, 以评估该模型.
方法: 64只C57BL/6小鼠随机分为正常组和模型组. 模型组采用3%DSS(分子量36000-50000)饮水1 wk造成结肠损伤, 再恢复正常饮水3 wk, 分别于第1、2、3、4周4个时间点对小鼠进行动态观察: 小鼠粪便性状改变; 结肠长度及结肠质量变化; 结肠病理变化; 结肠黏膜炎症评分; 血浆与结肠黏膜中IL-1β、IL-18、IL-33变化.
结果: 造模1 wk后, 小鼠出现腹泻、血便、懒动、蜷缩成堆, 病理观察见结肠上皮糜烂、出血、多病灶浅溃疡, 大量炎性细胞浸润黏膜及黏膜下层; 与正常组相比, 模型组结肠质量增加(P<0.05), 结肠长度缩短(P<0.01), 结肠黏膜炎症评分明显增高(P<0.01); 血浆和结肠黏膜中炎症因子IL-1β、IL-18、IL-33的含量显著升高(P<0.05、P<0.01); 造模2 wk后, 模型小鼠血便逐渐减少, 结肠黏膜下可见大量炎细胞浸润, 结肠质量增高(P<0.01), 结肠长度减少(P<0.01), 结肠黏膜炎症评分增高(P<0.01), 血浆中IL-1β、IL-18的浓度与结肠黏膜中IL-18的浓度仍明显高于正常组(P<0.05); 造模后3、4 wk, 小鼠活动及粪便性状恢复正常, 结肠黏膜仍可见炎细胞浸润, 肌纤维排列紊乱, 结肠质量增加(P<0.01), 结肠长度缩短(P<0.01), 黏膜炎症评分、血浆与结肠黏膜中IL-1β、IL-18、IL-33含量与正常组比较差异无统计学意义(P>0.05).
结论: 上述指标的动态监测结果在一定程度上体现了DSS诱导的小鼠UC模型从急性到慢性的病理变化过程, 可以为临床及相关药物作用研究提供病理模型.
核心提示: 本研究通过葡聚糖硫酸钠(dextran sulfate sodium)诱导小鼠溃疡性结肠炎(ulcerative colitis, UC)模型的动态观察, 建立了UC的研究所需的病理动物模型. 该模型为临床及相关药物作用的研究提供了病理动物模型, 对UC治疗的进一步研究具有重要意义.
引文著录: 李富凤, 王汝俊, 潘华新, 巫燕莉, 李燕舞. DSS诱导小鼠溃疡性结肠炎模型的动态评估. 世界华人消化杂志 2015; 23(11): 1721-1727
Revised: February 22, 2015
Accepted: March 9, 2015
Published online: April 18, 2015
AIM: To develop an experimental mouse model of ulcerative colitis (UC) and to dynamically monitor the colonic injures, pathological changes, and contents of interleukin (IL)-1β, IL-18, and IL-33 in plasma and colonic mucosa to evaluate the model.
METHODS: Sixty-four C57BL/6 mice were randomly divided into either a normal group or a model group. The model group was fed 3% dextran sulfate sodium (DSS) solution for a week, followed by normal drinking water for another 3 wk. We then dynamically observed fecal condition, alterations of colon length and weight, pathological changes, colonic mucosa inflammation score and contents of IL-1β, IL-18, and IL-33 in plasma and colonic mucosa every week.
RESULTS: One week after modeling, the mice developed diarrhea, bloody stools, crouching, and huddled together. Pathological examination showed colon epithelial erosion, bleeding, multifocal ulcers and numerous inflammation cells infiltrating the mucosa and submucosa. Compared to the normal group, the colon weight was markedly increased (P < 0.05), the colon length was significantly shortened (P < 0.01), the colonic mucosa inflammation score was significantly increased (P < 0.01), and the contents of IL-1β, IL-18, and IL-33 in both plasma and mucosa were significantly elevated (P < 0.05, P < 0.01) in the model group. At the end of the second week, compared to the normal group, the model group had gradually decreased bleeding, a large number of inflammatory cells in the submucosa, increased colon weight (P < 0.01), shortened colon length (P < 0.01), increased colonic mucosa inflammation score (P < 0.01), and dramatically elevated contents of IL-1β and IL-18 in plasma and IL-18 in colonic mucosa (P < 0.05). At the third and fourth weeks, the mouse activity and fecal condition returned to normal, inflammation cells could be seen in colonic mucosa, muscle fiber was arranged disorderly; compared to normal group, colon weight was increased (P < 0.01), colon length was shortened (P < 0.01), but colonic mucosa inflammation score and the contents of IL-1β, IL-18, and IL-33 showed no significant changes in the model group (P > 0.05).
CONCLUSION: The dynamic changes in the mouse UC model show a shift from acute to chronic disease process, and this mouse model could be used for studying UC mechanism and treatment in the future.
- Citation: Li FF, Wang RJ, Pan HX, Wu YL, Li YW. Dynamic evaluation of a mouse model of DSS induced ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2015; 23(11): 1721-1727
- URL: https://www.wjgnet.com/1009-3079/full/v23/i11/1721.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i11.1721
溃疡性结肠炎(ulcerative colitis, UC)是以直肠、结肠黏膜及黏膜下层的炎症和溃疡形成为病理特点的非特异性炎性肠病, 多呈反复发作的慢性病程. 葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导的小鼠结肠炎模型的肠道病变与人类病理形态最为近似[1]. 有大量文献[[2-4]]报道DSS诱导小鼠UC急性期模型的建立, 对UC疾病的发生、发展及药物作用的时机和周期研究存在一定局限性. 本实验模型选取4 wk作为考察小鼠UC炎症发生发展的时间段, 分别以1、2、3、4 wk 4个时间点动态监测的方式观察DSS诱导的UC小鼠从急性发作期到慢性缓解期的变化过程, 以评价DSS诱导的UC急慢性病理模型.
C57BL/6小鼠, 雌雄各半, 体质量18-22 g, 由广东省实验动物中心提供(动物合格证号: No. 44007200004497). DSS(M.W. = 36000-50000, 广州市红烁林生物科技有限公司); ELISA试剂盒(广州辰冉生物科技有限公司). TDZ5-WS多管架自动平衡离心机(长沙湘仪离心机仪器有限公司); DKZ系列电热恒温振荡水槽(上海一恒科技有限公司); iMark Microplate Reader(BIO-RAD).
1.2.1 分组与造模: 64只C57BL/6小鼠随机分为正常组和模型组. 正常组正常饮水28 d, 模型组给3%DSS水溶液7 d, 每隔1 d更换新鲜的DSS溶液, 后给自来水21 d. 于第1、2、3、4周4个时间点处死部分小鼠(8只/组).
1.2.2 观察小鼠一般情况: 体质量、饮食饮水量、大便性状、便血率.
1.2.3 采集小鼠结肠质量及结肠长度数据: 用颈椎脱臼法处死小鼠, 剖腹, 取肛门至回盲部的结肠并测量结肠长度, 沿肠系膜边缘纵向剖开, 清理肠内容物并称取整段结肠质量.
1.2.4 HE染色观察结肠形态学改变: 剪取中段约0.5 cm结肠, 用生理盐水清洗后迅速固定于4%甲醛中, 石蜡包埋, HE染色, 光镜下观察.
1.2.5 肠黏膜炎症评分: 按Cooper等方法, 评分分为5个等级, 0级: 少量炎细胞; 1级: 黏膜固有层和黏膜下层轻度炎症; 2: 黏膜固有层和黏膜下层重度炎症; 3级: 全结肠壁轻度炎症; 4: 全结肠壁重度炎症.
1.2.6 白介素(interleukin, IL)-1β、IL-18、IL-33水平测定: 用ELISA法测定血浆及结肠黏膜中IL-1β、IL-18、IL-33含量, 操作严格按ELISA试剂盒说明进行.
统计学处理 数据均用mean±SD表示, 采用SPSS13.0软件进行统计学分析, 各组间的差异比较用t检验(方差齐)或者t'检验(方差不齐), 设α = 0.05, P<0.05为差异有统计学意义.
与正常组相比, 模型组呈急性期表现: 造模第3天, 出现血便, 大便松散. 造模第6天, 小鼠饮食饮水量减少, 体质量减轻, 便血、腹泻, 蜷缩成堆, 精神萎靡, 毛色无光, 饮用DSS 1 wk后剖开小鼠结肠可见肠壁肿胀充血, 部分小鼠肠内脏器黏连, 肉眼未见明显溃疡灶. 第2周呈急性后期表现: 小鼠体质量增加, 饮食饮水恢复正常, 腹泻症状轻微, 便血减少甚至消失, 但活动量不增多, 病理见炎症细胞浸润加重, 可涉及到肌层. 缓解期小鼠活动量增加, 体质量增加, 毛色较有光泽, 病理示炎症减轻, 结肠肌纤维排列紊乱, 结肠处于自身修复状态.
与正常组比较, 模型组小鼠结肠质量在结肠炎急慢性过程中(1、2、3、4 wk)显著增加(P<0.05), 肉眼可见结肠水肿充血; 模型组结肠长度(1、2、3 wk)显著缩短(P<0.01), 结肠组织变厚, 脆性增加, 缺少弹性, 镜下观察见结肠肌层纤维结构排列紊乱, 有多灶性小溃疡(表1).
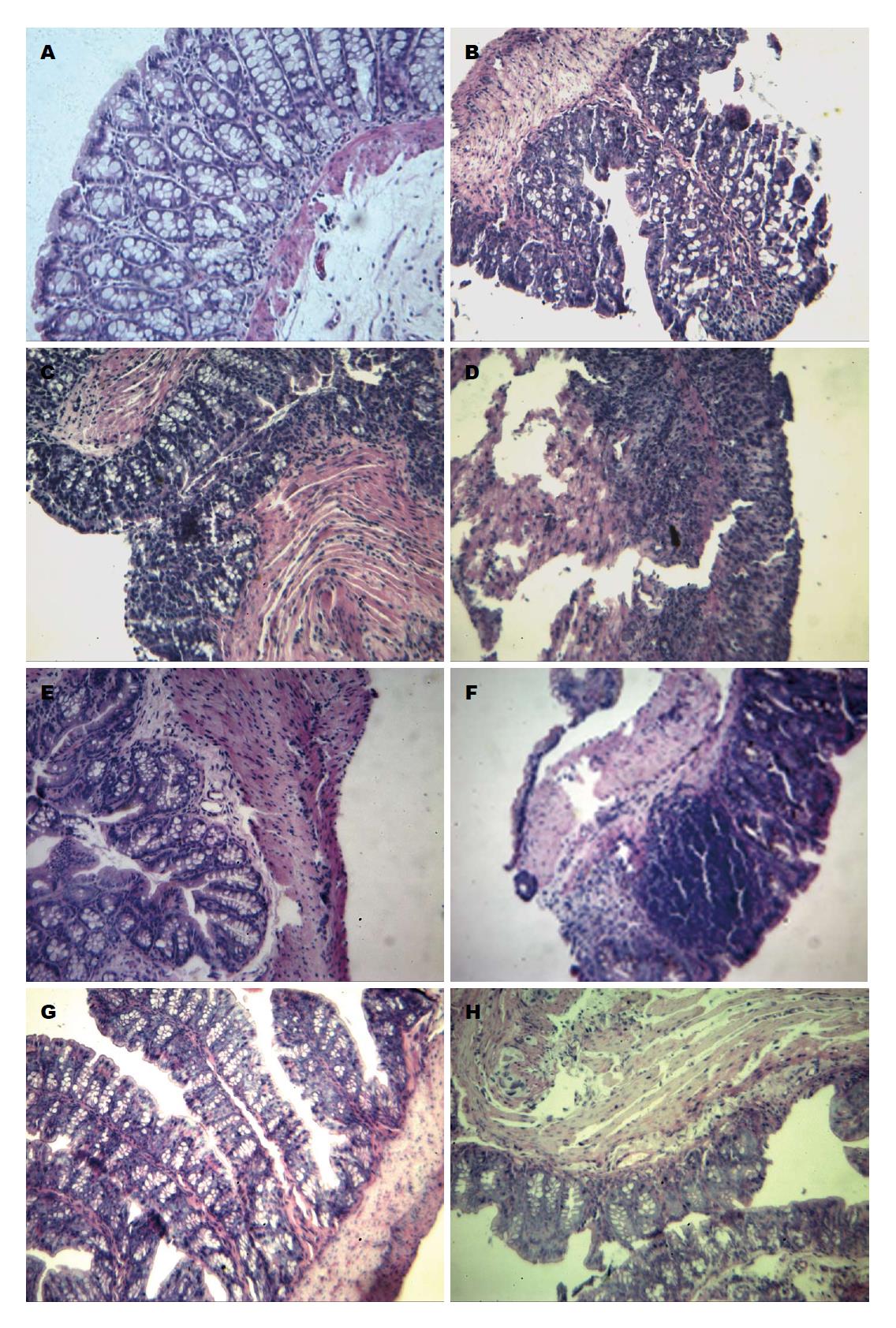
结肠由黏膜层、黏膜下层、肌层及浆膜层组成. 黏膜层向腔内突起形成皱褶, 皱褶表面被覆单层柱状上皮, 其间有大量±状细胞, 固有层致密. 病理观察显示: 1、2、3、4 wk正常组小鼠结肠未见明显病理改变. 1 wk模型组黏膜下层结缔组织有些疏松, 有大量炎性细胞浸润, 结缔组织有些坏死, 黏膜上皮细胞有少量坏死脱落. 2 wk模型组黏膜上皮细胞坏死明显, 上皮细胞脱落, 大量炎性细胞浸润, 黏膜下层有大量炎性细胞浸润, 肌层肌纤维溶解脱落, 周围有炎性细胞浸润. 3 wk模型组黏膜下层淋巴小结增生明显, 周围有明显的炎性细胞浸润, 黏膜上皮有少量细胞坏死脱落. 4 wk模型组黏膜上皮局部有缺损, 炎性细胞浸润明显, 黏膜下层结构疏松水肿明显, 炎性细胞浸润, 肌层纤维排列紊乱, 肌纤维间有点状坏死, 周围有炎性细胞浸润(图1).
与正常组相比, 模型组结肠在1、2 wk黏膜层及黏膜下层有大量炎症性细胞浸润, 2 wk程度最重, 可涉及肌层; 3、4 wk炎症因子浸润程度明显减轻, Cooper评分与正常组差异无统计学意义(表2).
在第1周结肠炎急性期时, 模型组血浆及结肠中IL-1β、IL-18、IL-33的表达较正常组均显著增高; 结肠炎急性后期2 wk时, 模型组血浆中IL-1β、IL-18和结肠组织中IL-18表达仍处于较高水平, 与正常组差异有统计学意义, 第3、4周上述炎症因子含量逐步降低, 与正常组比较差异无统计学意义(表3, 4).
| 分组 | 1 wk | 2 wk | 3 wk | 4 wk | ||||||||
| IL-1β | IL-18 | IL-33 | IL-1β | IL-18 | IL-33 | IL-1β | IL-18 | IL-33 | IL-1β | IL-18 | IL-33 | |
| 正常组 | 35.96± 5.37 | 1.21± 0.48 | 45.37± 2.64 | 45.05± 20.70 | 1.45± 0.29 | 46.95± 3.99 | 49.31± 18.91 | 1.64± 0.31 | 41.77± 6.79 | 46.17± 21.85 | 1.60± 1.04 | 42.14± 8.37 |
| 模型组 | 74.46± 22.49b | 2.26± 1.10a | 68.45± 24.71a | 66.92± 12.73a | 1.91± 0.41a | 52.20± 19.84 | 46.16± 5.99 | 1.99± 1.06 | 43.18± 23.83 | 47.89± 8.88 | 2.36± 0.12 | 45.97± 9.54 |
| 分组 | 1 wk | 2 wk | 3 wk | 4 wk | ||||||||
| IL-1β | IL-18 | IL-33 | IL-1β | IL-18 | IL-33 | IL-1β | IL-18 | IL-33 | IL-1β | IL-18 | IL-33 | |
| 正常组 | 560.89 ± 161.42 | 31.75 ± 7.32 | 278.40 ± 98.20 | 514.59 ± 186.67 | 34.14 ± 0.71 | 241.50 ± 55.10 | 500.55 ± 184.84 | 34.56 ± 0.52 | 242.70 ± 63.40 | 413.34 ± 67.53 | 34.84 ± 1.13 | 260.50 ± 49.30 |
| 模型组 | 869.41 ± 312.98a | 50.84 ± 18.85a | 417.70 ± 61.50b | 449.05 ± 93.11 | 35.23 ± 0.84a | 213.9 ± 75.1 | 508.11 ± 129.99 | 38.93 ± 12.48 | 316.00 ± 136.00 | 442.03 ± 226.96 | 34.57 ± 0.34 | 277.40 ± 53.30 |
UC以患者腹痛腹泻、便血为主要症状, 活动期与缓解期常交替发作, 病程缠绵. 建立类似人类UC急慢性动物模型对研究UC的发病机制及药物治疗作用十分必要. 日本大草敏史于1985年首次应用DSS制备了鼠UC模型. DSS诱导动物UC模型制备简单、经济, 能较好复制人UC复发缓解的特点. 本实验于1、2、3、4 wk 4个时间点处死小鼠欲动态观察DSS诱导小鼠UC模型急慢性过程的病理变化. 实验发现DSS诱导的小鼠UC具有从急性到慢性发病过程的特点: 造模3 d后小鼠出现便血、腹泻、体质量减轻等症, 1 wk病理示大量炎症细胞浸润肠道黏膜及黏膜下层, 起病快, 炎症反应强烈, 黏膜层变薄、黏膜腺体受损或消失及溃疡形成, 这些结肠炎改变与以往研究[1,2,5-8]观察到的病变相似, 是UC急性期表现; 2 wk内小鼠整体症状有所改善, 病理示大量炎细胞以浆细胞、淋巴细胞浸润为主浸润肌层组织, 提示肠道促炎症细胞因子开始大量产生, 炎症反应进一步加重, Cooper肠黏膜炎症评分达到最高. 整体症状改善可能与自身免疫的激活、吞噬细胞大量清除肠道致炎因子有关, 此为炎症急性后期; 3、4 wk镜下观察见肌层有肌纤维的增生, 结构排列紊乱, 结肠仍存在水肿、充血, Cooper肠黏膜炎症评分示炎症因子水平与正常对照组差异无统计学意义, 此为UC的缓解期. 本实验模型在急慢性病理过程与人UC病理变化接近, 可为UC病机及治疗方法研究提供病理模型.
IL-1β是一种由单核细胞、肥大细胞、平滑肌细胞和内皮细胞等分泌产生具有多种功能的细胞因子, 尤其在应对病原入侵时宿主反应的启动与发展中起着关键性作用, 是免疫与炎症启动的重要调节因子. 有研究[9]发现, UC患者组IL-1β水平显著高于对照组, 受累黏膜的IL-1β显著高于未受累黏膜, 后者又显著高于正常组, 随着病情的缓解, IL-1β水平又显著降低, 说明IL-1β确实参与UC发生、发展过程. IL-1β可以通过诱导释放H2O2, 影响Ca2+释放和NK-A的信号转导途径的开关, 从而导致UC患者的结肠平滑肌收缩功能紊乱[10], 可引起腹泻症状. 本实验小鼠UC活动期(1 wk)腹泻症状明显, 血浆及结肠组织IL-1β的含量显著增加, 而缓解期(3、4 wk)下降, 与文献[11-15]报道一致.
IL-18是一种炎症前细胞因子, 研究表明, IL-18与UC的发生密切相关, 文献[16]报道在UC中IL-18能降低IL-4、IL-10的产生, 另一方面, IL-18可促进肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、IL-8、IL-6、IL-1、细胞间黏附分子-1(intercellular cell adhesion molecule-1, ICAM-1)等细胞因子的产生, 促进炎症的级联反应[17,18]. 本实验通过ELISA法检测小鼠UC血浆和结肠组织中IL-18表达变化与文献[19]报道的人体UC急慢性期相似. 有研究[20]显示, UC活动期患者血清IL-18(376.91 pg/mL±119.24 pg/mL)水平与对照组(183.27 pg/mL±89.63 pg/mL)及UC缓解期(228.15 pg/mL±113.76 pg/mL)患者比较差异有统计学意义, UC缓解期患者与正常对照组比较差异无统计学意义. 其表达的高低与UC疾病严重程度、病变累及范围有关, IL-18表达水平可作为观察UC患者病情进展及判断预后的参考指标[21].
IL-33是IL-1家族的新成员[22], 在胃肠道中显著高表达. IL-33在未受到炎症刺激时主要存在于细胞核内[23], IL-33是一种Th2型辅助因子, IL-33与Th2细胞膜上的受体结合经IL-33/ST2信号通路, 促进细胞因子IL-4、IL-5、IL-13等[22,24]抗炎性细胞因子的表达, IL-33表达在肌成纤维细胞中, 被认为可以修复破损的组织. 但目前认为其可以促进Th1型免疫反应, 也可以诱导IL-1和IL-18的分泌. 因此IL-33是一种双重功能的细胞因子[25-27], 在不同的组织中可表现为促炎或抗炎的作用. 在炎症性肠病研究[28]发现, UC活动期患者结肠黏膜组织中IL-33在蛋白及mRNA表达水平与对照组相比显著上调, 同时血液中IL-33表达量也升高. 当患者给予抗TNF单克隆抗体治疗后, UC患者血液中IL-33较治疗前下降, 而sST2水平升高[29]. 本实验中显示IL-33血浆及结肠组织含量仅在UC模型急性期显著增高, 可能参与结肠黏膜的炎症反应.
可见, 在UC的急性发病阶段, 结肠炎症明显, 炎症因子分泌显著增高, 而UC后期, 炎症因子虽然降低至正常水平, 但结肠组织结构仍然异常, 提示在UC慢性期结肠黏膜防御能力可能降低, 结肠黏膜屏障功能较为低下, 是易于复发的阶段, 在此阶段用药可能降低该病的复发率. 该模型的建立也为UC慢性期治疗药物的评价提供基础.
溃疡性结肠炎(ulcerative colitis, UC)是多呈反复发作的慢性病程, 在葡聚糖硫酸钠(dextran sulfate sodium, DSS)成功诱导UC急性期模型基础上进行UC急慢性动物模型研究具有一定趋势. 近几年发现的与白介素(interleukin, IL)-1β结构和功能类似的IL-18、IL-33细胞因子在机体免疫机制中发挥着重要作用, 其在UC炎症过程中扮演的角色也成为研究的热点.
任粉玉, 教授, 延边大学附属医院消化内科; 吴焕淦, 教授, 博士生导师, 上海市针灸经络研究所
本文在结肠炎症评价及病理形态学的基础上, 以Nod样受体蛋白3(Nod-like receptor protein 3, NLRP3)炎性体活化为核心, 选择其下游的炎症因子IL-1β、IL-18和IL-33进行分析, 探讨该炎性体活化在UC发病机制中的作用, 对于治疗性药物的研发具有指导作用.
Pastorelli等较为系统阐述了IL-33/ST2的分布、表达、激活途径等, 对IL-33/ST2与肠道疾病的病理机制有一个全面的阐述, 语言表达清楚, 脉络清晰, 结构严谨, 对读者发散性思维具有启发.
有以下两点为本文独具的特点: 一是造模周期的选择. 较多文献报道采用7-10 d UC急性期作为观察周期, 本文选取了1、2、3、4 wk作为观察时间点, 全面动态检测了动物UC发生发展过程, 为UC临床机理研究及药物干预时机提供了参考; 二是对于细胞因子的选择, IL-1β、IL-18及IL-33前炎症因子均作为NLRP3炎性体下游炎症因子, 信号通路激活后发挥固有免疫作用, 对UC病机研究提供一定参考.
DSS诱导的小鼠结肠炎急、慢性病理变化模型对临床研究UC急慢性交替出现的病理机制具有一定参考性, 本文以动态观察方式对DSS诱导的小鼠结肠炎模型进行全面评估, 为临床UC机制及药物研究提供依据, 具有一定的先进性.
Th1/Th2: Th1细胞由Th0细胞在IL-12等细胞因子作用下分化而成, 主要分泌IL-2、干扰素(interferon, IFN)-γ、TNF等, 功能为辅助细胞毒性T细胞分化, 介导细胞免疫应答, 参与迟发型超敏反应等; Th2细胞: Th2细胞主要分泌IL-4、IL-5、IL-6和IL-10, 其主要功能为刺激B细胞增殖并产生抗体, 与体液免疫相关; IL-33/ST2信号通路: IL-33是近年来发现的IL-1超家族的一员, 其特异性受体是ST2, IL-33/ST2信号通路可直接诱导Th2细胞因子的产生, IL-4、IL-5、IL-13等, 从而影响机体的固有免疫.
本文以DSS诱导建立C57BL/6小鼠UC模型, 该模型为临床及相关药物作用的研究提供了病理动物模型, 对于基础研究具有一定的参考价值, 对UC治疗的进一步研究具有重要意义.
编辑: 韦元涛 电编: 都珍珍
| 1. | Okayasu I, Hatakeyama S, Yamada M, Ohkusa T, Inagaki Y, Nakaya R. A novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice. Gastroenterology. 1990;98:694-702. [PubMed] |
| 2. | 张 艳丽, 黄 Ѭ铷, 王 承党. 小鼠葡聚糖硫酸钠急性溃疡性结肠炎模型的建立和评价. 胃肠病学和肝病学杂志. 2006;15:37-40. |
| 6. | Murano M, Maemura K, Hirata I, Toshina K, Nishikawa T, Hamamoto N, Sasaki S, Saitoh O, Katsu K. Therapeutic effect of intracolonically administered nuclear factor kappa B (p65) antisense oligonucleotide on mouse dextran sulphate sodium (DSS)-induced colitis. Clin Exp Immunol. 2000;120:51-58. [PubMed] [DOI] |
| 7. | Dieleman LA, Palmen MJ, Akol H, Bloemena E, Peña AS, Meuwissen SG, Van Rees EP. Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines. Clin Exp Immunol. 1998;114:385-391. [PubMed] [DOI] |
| 8. | Cooper HS, Murthy SN, Shah RS, Sedergran DJ. Clinicopathologic study of dextran sulfate sodium experimental murine colitis. Lab Invest. 1993;69:238-249. [PubMed] |
| 11. | Leal RF, Coy CS, Ayrizono ML, Fagundes JJ, Milanski M, Saad MJ, Velloso LA, Góes JR. Differential expression of pro-inflammatory cytokines and a pro-apoptotic protein in pelvic ileal pouches for ulcerative colitis and familial adenomatous polyposis. Tech Coloproctol. 2008;12:33-38. [PubMed] [DOI] |
| 12. | Chang YY, Ouyang Q. [Expression and significance of mucosal beta-defensin-2, TNFalpha and IL-1beta in ulcerative colitis]. Zhonghua Neike Zazhi. 2008;47:11-14. [PubMed] |
| 13. | Szkaradkiewicz A, Marciniak R, Chudzicka-Strugała I, Wasilewska A, Drews M, Majewski P, Karpiński T, Zwoździak B. Proinflammatory cytokines and IL-10 in inflammatory bowel disease and colorectal cancer patients. Arch Immunol Ther Exp (Warsz). 2009;57:291-294. [PubMed] [DOI] |
| 17. | Olee T, Hashimoto S, Quach J, Lotz M. IL-18 is produced by articular chondrocytes and induces proinflammatory and catabolic responses. J Immunol. 1999;162:1096-1100. [PubMed] |
| 18. | Morel JC, Park CC, Kumar P, Koch AE. Interleukin-18 induces rheumatoid arthritis synovial fibroblast CXC chemokine production through NFkappaB activation. Lab Invest. 2001;81:1371-1383. [PubMed] [DOI] |
| 19. | Haas SL, Abbatista M, Brade J, Singer MV, Böcker U. Interleukin-18 serum levels in inflammatory bowel diseases: correlation with disease activity and inflammatory markers. Swiss Med Wkly. 2009;139:140-145. [PubMed] |
| 21. | Wiercinska-Drapalo A, Flisiak R, Jaroszewicz J, Prokopowicz D. Plasma interleukin-18 reflects severity of ulcerative colitis. World J Gastroenterol. 2005;11:605-608. [PubMed] [DOI] |
| 22. | Schmitz J, Owyang A, Oldham E, Song Y, Murphy E, McClanahan TK, Zurawski G, Moshrefi M, Qin J, Li X. IL-33, an interleukin-1-like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2-associated cytokines. Immunity. 2005;23:479-490. [PubMed] [DOI] |
| 23. | Baekkevold ES, Roussigné M, Yamanaka T, Johansen FE, Jahnsen FL, Amalric F, Brandtzaeg P, Erard M, Haraldsen G, Girard JP. Molecular characterization of NF-HEV, a nuclear factor preferentially expressed in human high endothelial venules. Am J Pathol. 2003;163:69-79. [PubMed] [DOI] |
| 24. | Suzukawa M, Iikura M, Koketsu R, Nagase H, Tamura C, Komiya A, Nakae S, Matsushima K, Ohta K, Yamamoto K. An IL-1 cytokine member, IL-33, induces human basophil activation via its ST2 receptor. J Immunol. 2008;181:5981-5989. [PubMed] [DOI] |
| 25. | Milovanovic M, Volarevic V, Radosavljevic G, Jovanovic I, Pejnovic N, Arsenijevic N, Lukic ML. IL-33/ST2 axis in inflammation and immunopathology. Immunol Res. 2012;52:89-99. [DOI] |
| 26. | Carriere V, Roussel L, Ortega N, Lacorre DA, Americh L, Aguilar L, Bouche G, Girard JP. IL-33, the IL-1-like cytokine ligand for ST2 receptor, is a chromatin-associated nuclear factor in vivo. Proc Natl Acad Sci USA. 2007;104:282-287. [PubMed] |
| 27. | Yang Q, Li G, Zhu Y, Liu L, Chen E, Turnquist H, Zhang X, Finn OJ, Chen X, Lu B. IL-33 synergizes with TCR and IL-12 signaling to promote the effector function of CD8+ T cells. Eur J Immunol. 2011;41:3351-3360. [PubMed] [DOI] |
| 28. | Seidelin JB, Bjerrum JT, Coskun M, Widjaya B, Vainer B, Nielsen OH. IL-33 is upregulated in colonocytes of ulcerative colitis. Immunol Lett. 2010;128:80-85. [PubMed] [DOI] |
| 29. | Pastorelli L, Garg RR, Hoang SB, Spina L, Mattioli B, Scarpa M, Fiocchi C, Vecchi M, Pizarro TT. Epithelial-derived IL-33 and its receptor ST2 are dysregulated in ulcerative colitis and in experimental Th1/Th2 driven enteritis. Proc Natl Acad Sci USA. 2010;107:8017-8022. [PubMed] [DOI] |