修回日期: 2014-11-13
接受日期: 2014-11-19
在线出版日期: 2015-01-08
目的: 探讨血浆miR-210联合血清肿瘤标志物糖链抗原199(carbohydrate antigen 199, CA199)、CA242、癌胚抗原(carcino-embryonic antigen, CEA)对胰腺癌的诊断价值.
方法: 对60例胰腺癌患者、20例慢性胰腺炎患者及10例正常对照组的血标本进行RNA抽提, 并进行miR-210的实时PCR检测, 同时对血清肿瘤标志物CA199、CA242、CEA进行检测, 分析血浆miR-210相对表达量与临床特征的关系, 评估血浆miR-210联合血清肿瘤标志物CA199、CA242、CEA对胰腺癌的诊断效能.
结果: miR-2l0在胰腺癌血浆中的相对表达量显著高于慢性胰腺炎组及正常对照组(4.12±4.51 vs 1.49±3.94, -1.73±4.82; 均P<0.01), 胰腺癌患者血浆miR-21水平与CA199、CA242、CEA、肿瘤最大直径、TNM分期及临床分期无关. 经二分类Logistic回归模型分析发现, 血浆miR-210单独在胰腺癌组比正常组、胰腺癌组比慢性胰腺炎组和胰腺癌组比慢性胰腺炎组+正常组中的敏感性、特异性分别为: 96.7%、50.0%; 95.0%、25.0%; 86.7%、40.0%. 血浆miR-210联合肿瘤标志物CA199、CA242、CEA后在以上三组中的敏感性、特异性分别为: 96.7%、70.0%; 90.0%、85.0%; 86.7%、90.0%.
结论: 血浆miR-210联合血清肿瘤标志物CA199、CA242、CEA能提高胰腺癌的诊断效能.
核心提示: 本研究探讨血浆miR-210联合血清肿瘤标志物糖链抗原199(carbohydrate antigen 199, CA199)、CA242、癌胚抗原(carcino-embryonic antigen, CEA)对胰腺癌的诊断价值, 结果显示血浆miR-210联合血清肿瘤标志物CA199、CA242、CEA能提高胰腺癌的诊断效能.
引文著录: 胡应霞, 张海蓉, 石围, 唐君瑞. 血浆miR-210联合血清肿瘤标志物对胰腺癌的诊断价值. 世界华人消化杂志 2015; 23(1): 147-152
Revised: November 13, 2014
Accepted: November 19, 2014
Published online: January 8, 2015
AIM: To evaluate the diagnostic value of the combination of plasma miR-210 with serum tumor markers in patients with pancreatic cancer.
METHODS: Sixty patients with pancreatic cancer, twenty patients with chronic pancreatitis, and ten normal people were included in the study. Total RNA was extracted from plasma samples for measurement of miR-210 levels using real-time PCR. Simultaneously, serum tumor markers carbohydrate antigen 199 (CA199), CA242 and carcino-embryonic antigen (CEA) were determined. The relationship between miR-210 levels and clinical characteristics of pancreatic cancer patients was analyzed. The diagnostic efficiency of combination of plasma miR-210 with serum tumor markers CA199, CA242, and CEA in pancreatic cancer patients was evaluated.
RESULTS: The relative abundance of plasma miR-210 was significantly higher in the pancreatic cancer group than in the chronic pancreatitis and normal groups (4.12 ± 4.51 vs 1.49 ± 3.94, -1.73 ± 4.82; P < 0.01 for both). Plasma miR-210 levels showed no significant correlation with CA199, CA242, CEA, tumor diameter, TNM stage or clinical stage in pancreatic cancer patients. Analysis using a binary logistic regression model showed that the diagnostic sensitivity and specificity of miR-210 alone were 96.7% and 50% for the pancreatic cancer group vs normal group, 95% and 25% for the pancreatic cancer group vs chronic pancreatitis group, and 86.7% and 40% for the pancreatic cancer group vs chronic pancreatitis and normal group. When plasma miR-210 was combined with serum tumor markers CA199, CA242, or CEA, the sensitivity and specificity in the three groups were 96.7% and 70%, 90% and 85%, 86.7% and 90%, respectively.
CONCLUSION: The combination of plasma miR-210 with serum tumor markers CA199, CA242 or CEA can improve diagnostic efficiency in patients with pancreatic cancer.
- Citation: Hu YX, Zhang HR, Shi W, Tang JR. Diagnostic value of plasma miR-210 combined with serum tumor markers in pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(1): 147-152
- URL: https://www.wjgnet.com/1009-3079/full/v23/i1/147.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i1.147
胰腺癌是一种常见的严重威胁人类健康的消化系恶性肿瘤, 据世界卫生组织(World Health Organization, WHO)2008年全球癌症报告(GLOBOCAN, 2008)数据统计[1], 全世界范围内每年胰腺癌发病人数约为27.87万, 居恶性肿瘤的第12位. 2008年在我国全部登记地区胰腺癌发病率居所有恶性肿瘤第7位, 死亡率居第6位[2]. 患者总体5年生存率<5%[3]. 目前, 临床上外科手术切除仍是胰腺癌的唯一治愈方法, 而大部分确诊时已失去手术机会. 相关资料显示目前常用的血清肿瘤标志物中CA199在胰腺癌诊断中的敏感性为70%-80%[4], 而特异性甚至不到50%[5], 作为胰腺癌的早期诊断及胰腺癌的筛选指标尚有许多不足. 故寻找一种早期诊断胰腺癌敏感性和特异性高的肿瘤标志物尤为重要. 微小RNA(microRNA, miRNA)是内源性的非编码RNA分子, 具有抑癌基因与癌基因的双重作用, 在细胞增殖、分化和凋亡等方面发挥重要的作用, 是与肿瘤发生发展有关的新的调节分子家族之一. 许多研究[6-13]表明, miRNAs可作为肿瘤诊断标志物, 也可用于肿瘤的鉴别和预后判断. 本研究旨在探讨血浆miR-210联合血清肿瘤标志物糖链抗原199(carbohydrate antigen 199, CA199)、CA242、癌胚抗原(carcino-embryonic antigen, CEA)对胰腺癌的诊断价值.
收集2012-08/2013-10昆明医科大学第一附属医院收治的60例胰腺癌患者, 所有胰腺癌患者均经手术病理或影像学诊断证实. 20例慢性胰腺炎患者通过影像学诊断, 并随访半年以上无肿瘤发生. 10例年龄、性别匹配的正常对照健康体检者, CA199、CA242、CEA及腹部超声均未见异常, 无任何肿瘤病史. miRcute miRNA cDNA第一链合成试剂盒和miRcute miRNA荧光定量检测试剂盒购自TIANGEN公司, hsa-miR-210、内参U6购自Qiagen公司. 普通PCR扩增仪为日本TakaRa公司, 实时荧光定量PCR仪为Stratagene公司的Mx3000P.
1.2.1 血液总RNA的提取: 采集患者的EDTA抗凝外周静脉血2 mL, 储存于4 ℃冰箱, 2 d内进行处理. 将外周血移入装有人淋巴细胞分离液的玻璃试管中, 然后在6 ℃下3000 g离心20 min, 之后将中间液转入另一份装有生理盐水的玻璃试管中, 6 ℃下3000 g离心10 min, 将玻璃试管底物转入1.5 mL EP管中, 加入1 mL TRIzol液, 反应5 min, 加入氯仿200 μL, 混匀6 ℃下12000 g离心15 min, 之后将上层液转至另一份1.5 mL EP管中, 加入异丙醇500 μL, 混匀6 ℃下12000 g离心10 min, 倒掉管中液体, 加入750 mL/L乙醇1 mL, 6 ℃下12000 g离心10 min, 倒掉管中液体, 室温下干燥10 min, 根据EP管底白色胶状物大小分别加入30-100 μL RNase-free water, 溶解后-80 ℃保存.
1.2.2 RNA浓度及纯度检测: 用Thermo Scientific BioMate 3S紫外可见分光光度计进行检测.
1.2.3 cDNA的合成及荧光定量PCR: 根据RNA浓度的不同切取2-5 μL, 用miRcute miRNA cDNA第一链合成试剂盒进行反转, 反应条件为37 ℃ 60 min. 取反转产物0.5 μL作为模板, 用miRcute miRNA荧光定量检测试剂盒进行Real-Time PCR检测, 所有反应采用三复孔, 反应条件为94 ℃ 2 min, 94 ℃ 20 s, 60 ℃ 34 s, 40个循环. 采用Stratagene公司的实时荧光定量PCR仪Mx3000P进行检测, U6作为内参, 相对定量值 = -△△Ct = -[(Ct目的基因-CtU6)实验样本-(Ct目的基因-CtU6)对照样本].
统计学处理 采用SPSS17.0统计软件进行处理, 计量资料符合正态分布用mean±SD表示, 符合偏态分布用median±Q表示, 相对定量值成偏态分布、方差不齐采用Mann-WhimeY U检验, 建立二分类logistic回归模型, 应用ROC曲线评价诊断效能, P<0.05为差异有统计学意义.
60例胰腺癌中, 男33例, 女27例, 中位年龄58(33-81)岁, 其中胰头癌44例、胰体尾癌16例, TNM分期, Ⅰ期19例、Ⅱ期17例、Ⅲ期8例、Ⅳ期16例. 20例慢性胰腺炎中, 男19例, 女1例, 中位年龄49岁(33-78岁). 10例对照中, 男5例, 女5例, 中位年龄52岁(27-65岁).
所有样品浓度较好, A260/280均在1.8-2.1之间.
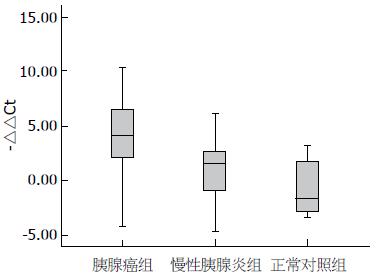
胰腺癌患者血浆miR-210水平均高于慢性胰腺炎组和正常对照组(P<0.01), 慢性胰腺炎患者血浆miR-210水平高于正常对照组, 但差异无统计学意义(图1).
胰腺癌患者血浆miR-210水平与患者性别、年龄、CA199、CA242、CEA、肿瘤最大直径、TNM分期、临床分期均无关(表1).
血浆miR-210的ROC曲线下面积, 在胰腺癌组+正常组、胰腺癌组+慢性胰腺炎组、胰腺癌+慢性胰腺炎组+正常组的3组人群中血浆miR-210诊断胰腺癌的AUC分别为(0.870, 95%CI: 0.770-0.970)、(0.788, 95%CI: 0.685-0.892)、(0.816, 95%CI: 0.728-0.903).
根据不同组人群中血浆miR-210及CA199+CA242+CEA的表达量建立二分类Logistic回归(entry 0.05, removal 0.1), 将Logistic回归模型的估算概率>0.5被判定诊断为胰腺癌. 将血浆miR-210、CA199/CA242/CEA单独及联合在胰腺癌比正常对照组、胰腺癌比慢性胰腺炎组和胰腺癌比慢性胰腺炎及正常对照组中的敏感性、特异性、准确性、阳性似然比(LR+)及阴性似然比(LR-)做比较, 发现血浆miR-210在各组单独诊断中敏感性较高, 但特异性稍低, 同时联合肿瘤标志物CA199+CEA+CA242可提高诊断效能, 且miR-210联合CA199与miR-210联合CA199+CEA+CA242的诊断效能在各组的比较基本一致(表2).
| 分组 | 敏感性(%) | 特异性(%) | 准确性(%) | LR+ | LR- |
| 胰腺癌组 vs 正常组 | |||||
| miR-210 | 96.7 | 50.0 | 90.0 | 1.93 | 0.07 |
| CA199 | 91.7 | 30.0 | 82.9 | 1.31 | 0.28 |
| CA242 | 98.3 | 10.0 | 85.7 | 1.09 | 0.17 |
| CEA | 100.0 | 0.0 | 85.7 | -- | -- |
| CA199+CA242+CEA | 93.3 | 30.0 | 84.3 | 1.33 | 0.22 |
| miR-210+CA199 | 96.7 | 70.0 | 92.9 | 3.22 | 0.05 |
| miR-210+CA199+CA242+CEA | 96.7 | 70.0 | 92.9 | 3.22 | 0.05 |
| 胰腺癌组 vs 慢性胰腺炎组 | |||||
| miR-210 | 95.0 | 25.0 | 77.5 | 1.14 | 0.22 |
| CA199 | 81.7 | 80.0 | 81.3 | 4.08 | 0.23 |
| CA242 | 85.0 | 30.0 | 71.3 | 1.21 | 0.50 |
| CEA | 100.0 | 0.0 | 75.0 | -- | -- |
| CA199+CA242+CEA | 81.7 | 75.0 | 80.0 | 3.27 | 0.24 |
| miR-210+CA199 | 90.0 | 85.0 | 88.8 | 6.00 | 0.12 |
| miR-210+CA199+CA242+CEA | 90.0 | 85.0 | 88.8 | 6.00 | 0.12 |
| 胰腺癌组 vs 慢性胰腺炎组+正常组 | |||||
| miR-210 | 86.7 | 40.0 | 71.1 | 1.44 | 0.33 |
| CA199 | 78.3 | 93.3 | 83.3 | 11.75 | 0.23 |
| CA242 | 76.7 | 83.3 | 78.9 | 4.60 | 0.28 |
| CEA | 98.3 | 10.0 | 68.9 | 1.09 | 0.17 |
| CA199+CA242+CEA | 80.0 | 93.3 | 84.4 | 12.00 | 0.21 |
| miR-210+CA199 | 88.3 | 90.0 | 88.9 | 8.83 | 0.13 |
| miR-210+CA199+CA242+CEA | 86.7 | 90.0 | 87.8 | 8.67 | 0.15 |
miRNA是内源性的非编码RNA分子, 是由长约21-23个核苷酸组成的非编码的单链RNAs, 其参与调控基因表达, 具有高度的保守性, 时序性和组织特异性. 具有抑癌基因与癌基因的双重作用, 在细胞增殖、分化和凋亡等方面发挥重要的作用, 是与肿瘤发生发展有关的新的调节分子家族之一. miRNA比mRNA更短, 这意味着他抵抗核酸酶降解的能力更强, 基于miRNA的诊断结果也就更可靠. miRNA在血清中可长期稳定存在, 耐RNA酶降解、煮沸、反复冻融、酸碱环境、长期保存等各种处理方法均不会造成血清miRNA的损失[6]. 故miRNAs不易被降解是血浆检测miRNAs的理论基础, 且血液标本易取得, 患者痛苦小. Mitchell等[7]对前列腺癌的研究中也证实了血浆miRNAs的稳定性和可定量检测.
相关研究表明, miR-210与缺氧及癌症有关, 其是内皮细胞对于低氧环境产生的一个重要物质[8]. 缺氧是肿瘤微环境的一个特征, 胰腺癌时组织处于缺氧, 缺氧时诱导了组织miR-210的表达, 释放人血从而血浆中miR-210的表达升高[9]. miR-210在胰腺癌[10]、乳腺癌[11]、肺癌[12]、肾癌[13]等肿瘤中高表达. Bloomston等[14]研究发现, 与正常胰腺癌组织相比miR-210在胰腺癌组织中高表达, 并可与慢性胰腺炎及正常组织区分. 同样, 在胰腺癌患者的血浆中miR-210表达量升高, 是健康对照组的4倍[15], 并可与慢性胰腺炎及正常对照组区分[16]. 在胰腺癌患者中高表达的miR-210提示患者存活率低, 有可能成为预后的指标[17].
有学者[18]在对胰腺导管内乳头状黏液性肿瘤miR-101、miR-21、miR-155的研究中选用了65例侵袭性胰腺组织、16例非侵袭性胰腺组织及5例正常胰腺组织. 本研究中, 选用了60例胰腺癌、20例慢性胰腺炎及10例正常对照组的血浆进行分析. 发现血浆miR-210相对表达量高于慢性胰腺炎和正常对照组, 可与慢性胰腺炎组及正常对照组区分, 而在慢性胰腺炎组与正常对照组无统计学差异. 胰腺癌患者血浆miR-210水平与患者性别、年龄、CA199、CA242、CEA、肿瘤最大直径、TNM分期、临床分期无关, 与Liu等[16]研究一致. 在二分类Logistic模型进行分析时发现在胰腺癌组比正常对照组时miR-210单独用于诊断敏感性较高为96.7%, 特异性为50%, CA199单独用于诊断时敏感性为91.7%, 而特异性较低为30%, 在联合miR-210与CA199或CA199+CA242+CEA诊断时特异性均可达70%. 在胰腺癌组比慢性胰腺炎组、胰腺癌组比慢性胰腺炎+正常对照组中miR-210联合肿瘤标志物CA199或CA199+CA242+CEA诊断比miR-210单独诊断更能提高诊断效能, 且在联合miR-210与CA199或CA199+CA242+CEA诊断时诊断效能基本一致.
血浆miRNAs可反应组织中miRNAs的情况, 且血液标本易取得, 患者痛苦小, 有望成为检测胰腺癌的肿瘤标志物. 本次研究表明血浆miR-210用于胰腺癌的诊断有一定实用价值, 而联合肿瘤标志物更能提高其诊断效能. 随着研究的深入, 有望在血浆miRNAs中找到更加适合诊断胰腺癌的标志物, 从而提高胰腺癌的早期诊断, 让胰腺癌患者早期得到治疗, 并改善胰腺癌患者预后.
胰腺癌是一种常见的严重威胁人类健康的消化系恶性肿瘤, 目前, 临床上外科手术切除仍是胰腺癌的唯一治愈方法, 而大部分确诊时已失去手术机会. 目前常用的血清肿瘤标志物中糖链抗原199(carbohydrate antigen 199, CA199)作为胰腺癌的早期诊断及胰腺癌的筛选指标尚有许多不足. 因此需要发现新的肿瘤标志物.
潘阳林, 副主任医师, 副教授, 第四军医大学西京医院消化病医院消化六科; 谷俊朝, 主任医师, 首都医科大学附属北京友谊医院普外科
微小RNA(micro-RNA, miRNA)是内源性的非编码RNA分子, 具有抑癌基因与癌基因的双重作用, 是与肿瘤发生发展有关的新的调节分子家族之一. miRNA比mRNA更短, 抵抗核酸酶降解的能力更强, 基于miRNA的诊断结果也就更可靠. miRNA在血清中可长期稳定存在, 且不易被降解. 故有望成为胰腺癌诊断标志物.
研究表明, miR-210与缺氧及癌症有关, 其是内皮细胞对于低氧环境产生的一个重要物质. miR-210在胰腺癌组织中高表达, 并可与慢性胰腺炎及正常组织区分. 同样, 在胰腺癌患者的血浆中miR-210表达量亦升高, 同样可与慢性胰腺炎及正常对照组区分.
本研究分析了血浆miR-210对胰腺癌的诊断价值, 同时联合临床常用血清肿瘤标志物CA199、CA242、CEA对胰腺癌的诊断价值作了进一步分析, 并发现血浆miR-210联合血清CA199+CA242+CEA可提高胰腺癌的诊断价值.
本研究对胰腺癌的诊断有一定实用价值, 加之联合目前常用肿瘤标志物一起可提高诊断价值, 这可为今后研究方向提供一定指引意义.
miRNA: 是内源性的非编码RNA分子, 是由长约21-23个核苷酸组成的非编码的单链RNAs, 其参与调控基因表达, 具有高度的保守性, 时序性和组织特异性. 具有抑癌基因与癌基因的双重作用, 在细胞增殖、分化和凋亡等方面发挥重要的作用, 是与肿瘤发生发展有关的新的调节分子家族之一.
血清miRNA可能有用于疾病诊断的价值. 本研究的尝试对于胰腺癌的诊断很重要的临床意义, 发现miR-210在胰腺癌患者血清中高表达, 并且可能独立于其他胰腺癌标志物, 联合检测更有意义. 本研究目的明确, 实验设计合理, 统计方法恰当, 结果丰富, 结论尚可靠, 有一定的临床价值.
编辑: 韦元涛 电编:都珍珍
| 1. | Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-2917. [PubMed] [DOI] |
| 2. | He J, Chen W. Chinese Cancer Registry Annual Report, 2012. Beijing: Military Medical Science Press 2012; . |
| 3. | Sergeant G, Vankelecom H, Gremeaux L, Topal B. Role of cancer stem cells in pancreatic ductal adenocarcinoma. Nat Rev Clin Oncol. 2009;6:580-586. [PubMed] [DOI] |
| 4. | Slesak B, Harlozinska-Szmyrka A, Knast W, Sedlaczek P, van Dalen A, Einarsson R. Tissue polypeptide specific antigen (TPS), a marker for differentiation between pancreatic carcinoma and chronic pancreatitis. A comparative study with CA 19-9. Cancer. 2000;89:83-88. [PubMed] [DOI] |
| 5. | Iorio MV, Ferracin M, Liu CG, Veronese A, Spizzo R, Sabbioni S, Magri E, Pedriali M, Fabbri M, Campiglio M. MicroRNA gene expression deregulation in human breast cancer. Cancer Res. 2005;65:7065-7070. [PubMed] [DOI] |
| 6. | Chen X, Ba Y, Ma L, Cai X, Yin Y, Wang K, Guo J, Zhang Y, Chen J, Guo X. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases. Cell Res. 2008;18:997-1006. [PubMed] [DOI] |
| 7. | Mitchell PS, Parkin RK, Kroh EM, Fritz BR, Wyman SK, Pogosova-Agadjanyan EL, Peterson A, Noteboom J, O'Briant KC, Allen A. Circulating microRNAs as stable blood-based markers for cancer detection. Proc Natl Acad Sci U S A. 2008;105:10513-10518. [PubMed] [DOI] |
| 8. | Ivan M, Harris AL, Martelli F, Kulshreshtha R. Hypoxia response and microRNAs: no longer two separate worlds. J Cell Mol Med. 2008;12:1426-1431. [PubMed] [DOI] |
| 9. | Huang X, Zuo J. Emerging roles of miR-210 and other non-coding RNAs in the hypoxic response. Acta Biochim Biophys Sin (Shanghai). 2014;46:220-232. [PubMed] [DOI] |
| 10. | Papaconstantinou IG, Manta A, Gazouli M, Lyberopoulou A, Lykoudis PM, Polymeneas G, Voros D. Expression of microRNAs in patients with pancreatic cancer and its prognostic significance. Pancreas. 2013;42:67-71. [PubMed] [DOI] |
| 11. | Camps C, Buffa FM, Colella S, Moore J, Sotiriou C, Sheldon H, Harris AL, Gleadle JM, Ragoussis J. hsa-miR-210 Is induced by hypoxia and is an independent prognostic factor in breast cancer. Clin Cancer Res. 2008;14:1340-1348. [PubMed] [DOI] |
| 12. | Puisségur MP, Mazure NM, Bertero T, Pradelli L, Grosso S, Robbe-Sermesant K, Maurin T, Lebrigand K, Cardinaud B, Hofman V. miR-210 is overexpressed in late stages of lung cancer and mediates mitochondrial alterations associated with modulation of HIF-1 activity. Cell Death Differ. 2011;18:465-478. [PubMed] [DOI] |
| 13. | Juan D, Alexe G, Antes T, Liu H, Madabhushi A, Delisi C, Ganesan S, Bhanot G, Liou LS. Identification of a microRNA panel for clear-cell kidney cancer. Urology. 2010;75:835-841. [PubMed] [DOI] |
| 14. | Bloomston M, Frankel WL, Petrocca F, Volinia S, Alder H, Hagan JP, Liu CG, Bhatt D, Taccioli C, Croce CM. MicroRNA expression patterns to differentiate pancreatic adenocarcinoma from normal pancreas and chronic pancreatitis. JAMA. 2007;297:1901-1908. [PubMed] [DOI] |
| 15. | Ho AS, Huang X, Cao H, Christman-Skieller C, Bennewith K, Le QT, Koong AC. Circulating miR-210 as a Novel Hypoxia Marker in Pancreatic Cancer. Transl Oncol. 2010;3:109-113. [PubMed] [DOI] |
| 16. | Liu J, Gao J, Du Y, Li Z, Ren Y, Gu J, Wang X, Gong Y, Wang W, Kong X. Combination of plasma microRNAs with serum CA19-9 for early detection of pancreatic cancer. Int J Cancer. 2012;131:683-691. [PubMed] [DOI] |
| 17. | Greither T, Grochola LF, Udelnow A, Lautenschläger C, Würl P, Taubert H. Elevated expression of microRNAs 155, 203, 210 and 222 in pancreatic tumors is associated with poorer survival. Int J Cancer. 2010;126:73-80. [PubMed] [DOI] |