修回日期: 2014-01-23
接受日期: 2014-01-24
在线出版日期: 2014-03-28
目的: 观察解毒化瘀健脾方对胃黏膜异型增生模型大鼠细胞周期蛋白依赖性激酶抑制剂2A(cyclin-dependent kinase inhibitor 2A, p16)、磷酸酶张力蛋白同源蛋白(phosphatase and tensin homolog, PTEN)基因甲基化状态和蛋白表达的影响, 并探讨解毒化瘀健脾方对胃黏膜异型增生的治疗作用.
方法: 采用低浓度N-甲基-N'-硝基-N-亚硝基胍(N-methyl-N'-nitro-N-nitrosoguanidine, MNNG)的综合造模方法, 创建实验性大鼠胃黏膜异型增生病变模型; 分模型对照组、西药维甲酸治疗组、解毒化瘀健脾方治疗组, 并选择正常大鼠作为阳性对照组进行干预; 应用甲基化特异PCR技术检测大鼠胃黏膜p16、PTEN基因甲基化状态; Real-time PCR、Western blot、免疫组织化学技术检测p16, PTEN在mRNA和蛋白表达水平的变化.
结果: 模型组胃黏膜异型增生细胞p16、PTEN基因的甲基化阳性检出率均为33.33%(6/18), 均高于正常对照组20%(2/10), 但差异不显著; 解毒化瘀健脾方治疗组p16基因甲基化检出率均未0%(0/15), 相比模型组20%(2/10)甲基化程度降低, 但差异均无统计学意义; p16在mRNA(P<0.001)和蛋白(P<0.01)水平的表达相比模型组极显著升高; PTEN在mRNA(P<0.05)和蛋白(P<0.01)水平的表达相比模型组极显著升高.
结论: 解毒化瘀健脾方对异型增生胃黏膜细胞p16、PTEN基因具有一定的去甲基化作用, 并显著诱导二者的表达量增加. 解毒化瘀健脾组方的对胃黏膜异型增生具有潜在的治疗作用.
核心提示: 解毒化瘀健脾中药可通过对抑癌基因p16、PTEN一定的去甲基化作用及诱导二者mRNA和蛋白水平表达量增加, 实现对胃黏膜异型增生的治疗作用.
引文著录: 李志钢, 张伟, 邱作成, 夏宽宏, 纪勇, 李玲, 连军, 安娟. 解毒化瘀健脾方对胃黏膜异型增生模型大鼠p16、PTEN基因的去甲基化和蛋白诱导表达. 世界华人消化杂志 2014; 22(9): 1247-1255
Revised: January 23, 2014
Accepted: January 24, 2014
Published online: March 28, 2014
AIM: To observe the effect of Jiedu Huayu Jianpi Fang (JHJF) on the methylation status and expression of cyclin-dependent kinase inhibitor 2A (p16) and phosphatase and tensin homolog (PTEN) in rats with gastric dysplasia (GD), and to explore the therapeutic effect of JHJF on GD.
METHODS: A low concentration of N-methyl -N'-nitro-N-nitrosoguanidine (MNNG)-based modeling method was adopted to induce GMD, and model rats were randomly divided into a model control group, a retinoic acid treatment group, and a JHJF treatment group. Normal rats treated with JHJF were used as positive controls. Methylation specific PCR was used to detect the methylation status of p16 and PTEN genes in gastric mucosal cells, and real-time PCR, Western blot and immunohistochemistry were used to detect the mRNA and protein expression of p16 and PTEN.
RESULTS: The rates of p16 and PTEN gene methylation in the model control group were both 33.33% (6/18), higher than those in the normal control group 20% (2/10), but the differences were not significant. In the JHJF treatment group, the rates of p16 and PTEN gene methylation were both 0% (0/15), significantly lower than those in the model control group (33.33%, 6/18). The expression levels of p16 and PTEN mRNAs (P < 0.001, P < 0.05) and proteins (P < 0.01 for both) were significantly higher in the JHJF treatment group than in the model control groups.
CONCLUSION: JHJF can induce demethylation and increase expression of the p16 and PTEN genes in GD in rats. JHJF has a potential value for the treatment of GD.
- Citation: Li ZG, Zhang W, Qiu ZC, Xia KH, Ji Y, Li L, Lian J, An J. Jiedu Huayu Jianpi Fang induces demethylation and increased expression of p16 and PTEN genes in gastric dysplasia in rats. Shijie Huaren Xiaohua Zazhi 2014; 22(9): 1247-1255
- URL: https://www.wjgnet.com/1009-3079/full/v22/i9/1247.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i9.1247
胃癌居全球癌症病死率第2位[1], 居我国恶性肿瘤死亡率首位[2,3], 严重威胁人类健康. 一般认为胃癌的发生常在癌变之前经历多个步骤的演变. Correa等[4]在1988年提出目前较为认可的胃癌进展模式: 正常胃黏膜-慢性浅表性胃炎-慢性萎缩性胃炎-小肠型肠上皮化生-大肠型肠上皮化生-异型增生(中重度)-胃癌(肠型). 其中肠上皮化生和异型增生又称为胃癌前病变(precancerous lesions of gastric cancer, PLGC), 其中重度异型增生的患者发展为胃癌的几率高达60%-80%[5-7]. 如何有效阻断异型增生向胃癌的转变成为目前防治胃癌的研究关键. 而研究表明, 胃癌的发生涉及遗传学与表观遗传学两大机制的共同作用, 其中表观遗传学机制的DNA甲基化在胃癌发生进展中具有重要的作用[8,9]. 研究证实DNA甲基化是使抑癌基因失活的除基因突变和缺失之外的第3种机制[10], p16和PTEN基因是机体重要的抑癌基因. p16可抑制周期蛋白依赖性激酶CDK4/6的活性使细胞周期停滞于G1/S期, 对细胞周期起负控的作用[11]; 目前研究证实在胃癌中p16基因启动子区甲基化可导致表达缺失, 引起肿瘤的发生[12,13]. PTEN基因DNA甲基化导致其基因失活与胃癌的关系, 目前仍存在一定的争议. 因此, 本实验拟通过检测中药解毒化瘀健脾方干预异型增生的胃黏膜细胞中p16、PTEN的甲基化状态, 以及二者的蛋白表达变化, 旨在探讨该中药方对于胃黏膜异型增生的治疗作用, 为临床预防治疗胃癌前病变提供参考资料.
SPF级健康♂SD大鼠[SCXK(新)2011-00-04]260只, 体质量100 g±10 g(体质量<120 g), 均购自新疆医科大学实验动物中心. DNeasy Blood and Tissue Kit(69581, Lot: 143374302)与EpiTect Fast Bisulfite Conversion Kits(59104, Lot: 142347785)均购自德国Qiagen公司; Robust HotStart DNA Polymerase购自美国KAPA Biosystems公司; 96孔PCR板及封板膜(PCR-96M2-HS-C)购自美国AXYGEN公司; RevertAid First Strand cDNA Synthesis Kit(K1622, Lot#E00143469)购自美国Thermo公司; SYBR Select Master Mix(4472919, Lot#1210006)购自美国ABI公司; 小鼠抗P16单克隆抗体(sc1661, Lot#B0612)购自美国Santa Cruz公司; 兔抗PTEN多克隆抗体(ab31392, Lot#GR51025-1)购自美国ABCAM公司; 兔抗小鼠HPR标记二抗(31431, Lot#90091028)购自美国Thermo scientific; 免疫组织化学染色试剂盒(KIT9902, Lot#1301319902), 浓缩型DAB试剂盒(DAB0031, Lot#1307290031)购自福州迈新生物公司; 抗体稀释液(ABD0030, Lot#13147A01)购自北京中杉金桥生物技术公司; 0.45 μm PVDF膜(IPVH0010, Lot#K9NN010313)购自美国Millipore公司; BCA蛋白定量试剂盒(Sk3021, Lot#L1101), RIPA裂解液(PL006, Lot#20130626)购自上海生工公司.
解毒化瘀健脾方全方制备药液3 mL/kg(含生药9 g/kg); 维甲酸(货号: 20090506 河北环海药业)使用当日碾成粉末状, 配制成10 mL/kg(4 mg/mL)悬浊液; N-甲基-N'-硝基-N-亚硝基胍(N-methyl-N'-nitro-N-nitrosoguanidine, MNNG)(货号: M0527日本TCI东京化成工业)用去离子水配制成1 g/L的母液, 存放于4 ℃冰箱备用, 使用当日用SPF级动物饮用水稀释成120 μg/mL的溶液, 整个过程均需避光操作保存; 盐酸雷尼替丁胶囊(2011杭州赛诺菲安万特制药)制成0.04%雷尼替丁的颗粒状SPF级大鼠饲料.
1.2.1 胃黏膜异型增生动物模型建立: 根据朱萱萱等[14]采用低浓度MNNG的综合法综合造模方法, 创建实验性大鼠胃黏膜异型增生病变模型. 具体方法如下: 动物分笼饲养, 每日自由饮用167 μg/L MNNG溶液, 期间不再给予其他饮水; 同时下午灌胃0.017 mol/L浓度的MNNG溶液, 每只每天灌液1 mL; 给其食用含0.04%雷尼替丁的标准粉末状饲料, 同时每只大鼠每3天给予1 mL 40 mL/L乙醇灌胃1 次, 造模期间每进食2 d, 再禁食1 d; 每24 h更换1次饮用水和饲料, 连续9 wk, 9 wk末时随机检杀造模大鼠8只, 通过光镜下观察确认造模成功, 大鼠胃黏膜萎缩, 异型增生.
1.2.2 分组及给药: 分组: SPF级♂SD大鼠260只, 随机选择10只作为正常对照组(control group CG), 其余大鼠全部进行9 wk造模. 经造模后存活的SD大鼠131只, 造模死亡率为47.6%. 8 wk末时随机检杀造模大鼠8只, 检测造模是否成功后. 将剩余的123只大鼠随机分为8组: 模型组(model group MG)18只、维甲酸治疗组(PCG)15只、中药解毒化瘀健脾治疗组(A)15只、五组中药拆方治疗组各15只(结果本文中暂未作介绍), 进行药物干预治疗. 给药: 正常对照组和模型对照组灌服生理盐水10 mL/kg, 1次/d; 维甲酸对照组灌服维甲酸悬浊液10 mL/kg(4 mg/mL), 1次/d; 解毒化瘀健脾方组用制备药液灌胃, 1次/d, 每次灌液2 mL; 共治疗6 wk, 药物剂量的换算按照人和动物体表面积折算. 所有大鼠于实验第15 wk末处死.
1.2.3 取材: 断颈法处死大鼠, 剪取完整的胃黏膜腺区, 随机分为两份: 一半新鲜胃组织样品置于40 g/L甲醛溶液中固定, 常温保存, 待后续免疫组织化学试验用; 剩余样品置于液氮中, 用于蛋白、DNA、RNA提取.
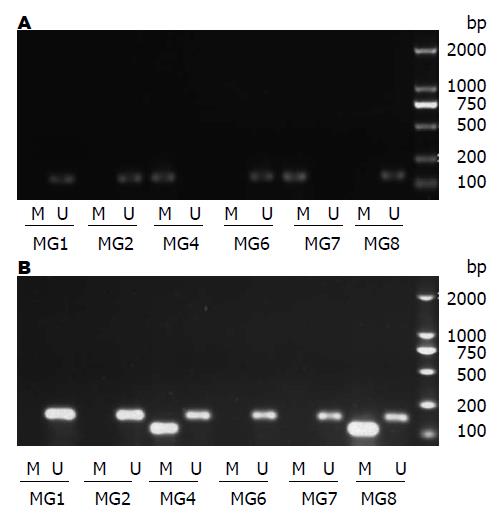
1.2.4 甲基化特异PCR法(methylation specific PCR, MSP)法检测胃黏膜细胞中p16、PTEN基因的甲基化状态: 将液氮中保存的组织样品, 参照天根公司动物组织基因组提取试剂盒说明书提取细胞DNA; Nanodrop 2000核酸定量仪检测DNA浓度和纯度, 琼脂糖凝胶电泳检测DNA完整性; 用EpiTect Fast Bisulfite Conversion Kits试剂盒对DNA进行亚硫酸盐修饰, 纯化. 甲基化特异PCR反应体系50 μL, 包括样品DNA 1 μL, 10×PCR buffer 5 μL, MgCl2 4 μL, 引物各0.75 μL, dNTP 1 μL, Taq酶0.3 μL, 双蒸水37.2 μL. 反应条件: 95 ℃预变性3 min; 95 ℃ 30 s, 51 ℃ 30 s, 72 ℃ 1 min, 40个循环; 72 ℃延伸7 min. p16甲基化(M)引物: F: 5'-TGTTTGTTGAGGATAAGGATTATTC-3', R: 5'-AAAAAAAACACAAAAAAATCACGAC-3', 扩增产物147 bp; p16非甲基化(U)引物: F 5'-GTTTGTTGAGGATAAGGATTATTTG-3', R 5'-AAAAAAAACACAAAAAAATCACAAC-3', 扩增产物147 bp; PTEN甲基化(M)引物: F: 5'-TTTTTGAGTAGTTTCGGAAAGAGAC-3', R: 5'-CCAACCCTAACAATAATAACAAACG-3', 扩增产物167 bp; PTEN非甲基化(U)引物: F: 5'-TTTTGAGTAGTTTTGGAAAGAGATG-3', R: 5'-AACCCTAACAATAATAACAAACAAC-3', 扩增产物126 bp; PCR产物经琼脂糖凝胶电泳, EB染色, 激光密度扫描仪(Pharmacia LKB Ul troscan)采集数据, 取同一基因的所有样本的平均值进行统计分析.
1.2.5 Real-time PCR法检测p16, PTEN基因mRNA的表达: 将液氮中冻存的组织样品在液氮中研磨成粉末, TRIzol法总RNA; 核酸定量仪及琼脂糖凝胶电泳检测RNA浓度及完整性; 逆转录酶和Oliga(dT)15引物合成cDNA. p16引物: F: 5'-TCGTGCGGTATTTGCGGTAT-3', R: 5'-TAGTCTCGCGTTGCCAGAAG-3', 扩增产物184 bp; PTEN引物: F: 5'-TACCAGGACCAGAGGAAACCT-3', R: 5'-GGGTGAGCACAAGATACTCCT-3', 扩增产物120 bp; 以β-actin为外参, 引物: F: 5'-GTGGGGCGCCCCAGGCACCA-3', R: 5'-CTCCTTAATGTCACGCACGATTTC-3', 扩增长度为198 bp. 荧光定量PCR反应体系20 μL, 包含样品cDNA 1 μL, 上下游引物各0.4 μL, SYBRR Select Master Mix(2×)10 μL, RNase-free water 8.2 μL. 在ABI 7500 fast荧光定量仪上设置以下反应条件: p16 PCR反应条件为: 50 ℃ 2 min, 95 ℃变性2 min, 95 ℃ 15 s, 72 ℃, 共40个循环; PTEN PCR反应条件为: 50 ℃ 2 min, 95 ℃变性2 min, 95 ℃ 15 s, 72 ℃, 共40个循环.
1.2.6 免疫组织化学检测p16, PTEN蛋白的表达: 将制作好的石蜡切片60 ℃烤片2 h使蜡熔化, 脱蜡2次, 经无水乙醇, 950、900、800、700 mL/L乙醇、蒸馏水完成水化; 抗原修复采用柠檬酸高温高压法; 加一抗前用H2O2处理切片以灭活内源性过氧化物酶, 并用山羊血清封闭; 滴加稀释后的一抗50 μL, 37 ℃孵育2 h; PBS漂洗3次, 滴加约50 μL二抗, 37 ℃孵育30 min; DAB显色, 苏木素复染; 经700、800、900、950 mL/L乙醇、无水乙醇脱水, 二甲苯透明2次, 中性树胶封片. 100倍光学显微镜下选择p16、PTEN阳性表达部位采集照片.
1.2.7 Western blot法检测p16、PTEN蛋白表达情况: 称取100 mg冷冻的胃黏膜组织样品, 按与细胞裂解液1:3的比例加入300 μL RIPA裂解液, 提取总蛋白, BCA法进行蛋白定量. 取100 μL总蛋白沸水浴加热变性3 min后, 取20 μL上样, SDS-PAGE凝胶(分离胶: 10%, 积层胶: 5%)电泳; 蛋白电泳分离后移至0.45 μm孔径的PVDF膜; 5%脱脂奶粉室温封闭1 h; PVDF膜置于10 mL稀释的一抗稀释液中, 4 ℃过夜; 洗涤3次, 再置于10 mL碱性磷酸酶标记的二抗稀释液中, 37 ℃孵育2 h; 显色, 以β-actin蛋白表达为参照, 用ChemiScope 3000成像, Image-proplus(Version 4.1)系统采集数据, 采用条带灰度密度值与相应的β-actin灰度密度值的比值作为指标进行结果分析. 实验重复3次.
统计学处理 所有实验结果均采用SPSS19.0统计软件进行数据分析, GraphPad Prism 5.0软件作图. 计数资料的比较采用秩和检验; 计量资料组间比较采用t检验; 所有数据均以3次独立实验结果mean±SD表示, P<0.05为差异有统计学意义.
胃黏膜异型增生模型组大鼠与正常对照组p16基因甲基化阳性检出率分别为50%(6/12)与20%(2/10), 模型组p16甲基化程度高于正常组, 但差异不显著(χ2 = 1.023, P>0.05); PTEN基因甲基化阳性检出率分别为33.33%(6/18)与20%(2/10), 模型组PTEN甲基化程度高于正常组, 但差异无统计学意义(χ2 = 0.321, P>0.05)(表1). 图1分别为模型组p16与PTEN基因琼脂糖凝胶电泳检测结果. 维甲酸治疗组、中药治疗组均未检测到p16与PTEN基因甲基化(表2).
| 基因 | 分组 | 甲基化 | χ2 | P值 | OR | 95%CI | ||
| M | U | Down | Up | |||||
| p16 | MG组 | 6 | 12 | 1.023 | 0.312 | 2.500 | 0.410 | 15.230 |
| CG组 | 2 | 10 | ||||||
| PTEN | MG组 | 6 | 18 | 0.321 | 0.571 | 1.667 | 0.282 | 9.856 |
| CG组 | 2 | 10 | ||||||
| 基因 | 分组 | 甲基化 | χ2 | P值 | OR | 95%CI | |
| U | M | ||||||
| p16 | MG组 | 12 | 6 | ||||
| PCG组 | 15 | 0 | 6.111 | 0.013 | 0.4 | / | |
| A组 | 15 | 0 | 6.111 | 0.013 | / | / | |
| PTEN | MG组 | 12 | 6 | ||||
| PCG组 | 15 | 0 | 4.432 | 0.035 | 0.6 | / | |
| A组 | 15 | 0 | 4.432 | 0.035 | / | / | |
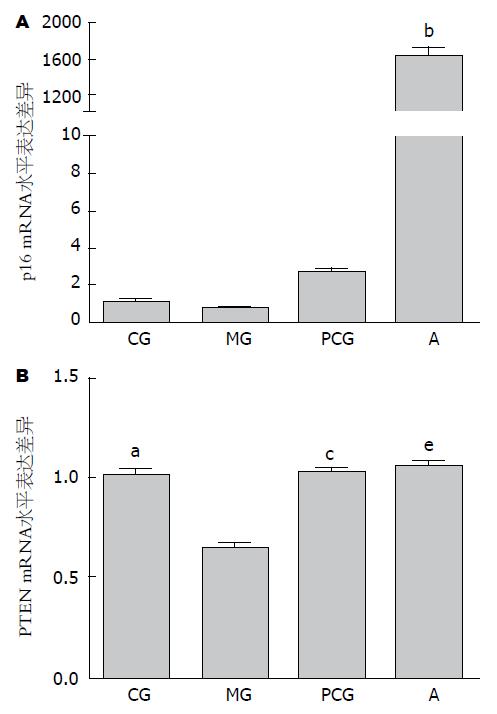
胃黏膜异型增生模型组p16基因相比正常对照组呈现较低的表达; 西药维甲酸组该基因的表达呈现增高趋势, 但无显著性差异; 中药治疗组该基因的表达量相比正常对照组和模型对照组均极显著被诱导增加(P<0.001), 增加倍数约是对照组及模型组基因表达量的1700倍(图2).
胃黏膜异型增生模型组PTEN基因相比正常对照组呈现较低的表达(图2), 中药治疗组和西药维甲酸治疗组治疗干预后该基因的表达呈现回升趋势, 与正常对照组的表达量基本相同, 即中西药治疗干预后, 该基因的表达显著高于模型对照组(P<0.05).
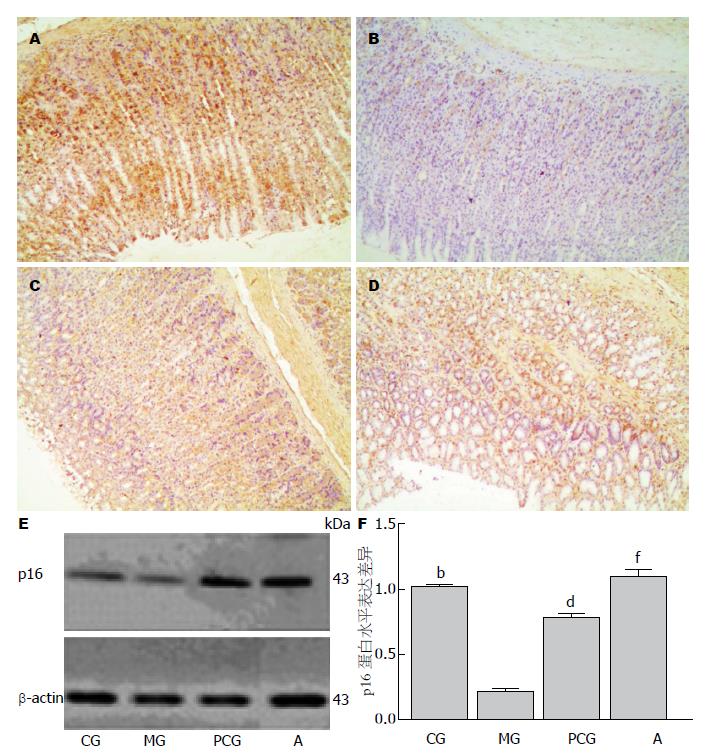
p16蛋白免疫组织化学结果为胞核、胞浆着色(图3A), 中西药药物处理组该蛋白表达阳性率均显著高于模型组; 胃黏膜异型增生模型组p16蛋白相比正常对照组均呈现微量表达, 差异极显著(P<0.01); 且也极显著低于中药治疗组与西药维甲酸治疗组p16蛋白的表达量(P<0.01); 其中西药维甲酸组p16蛋白的表达量约为模型组的3.74倍, 中药组p16蛋白的表达量约为模型组的5.28倍(图3B, C).
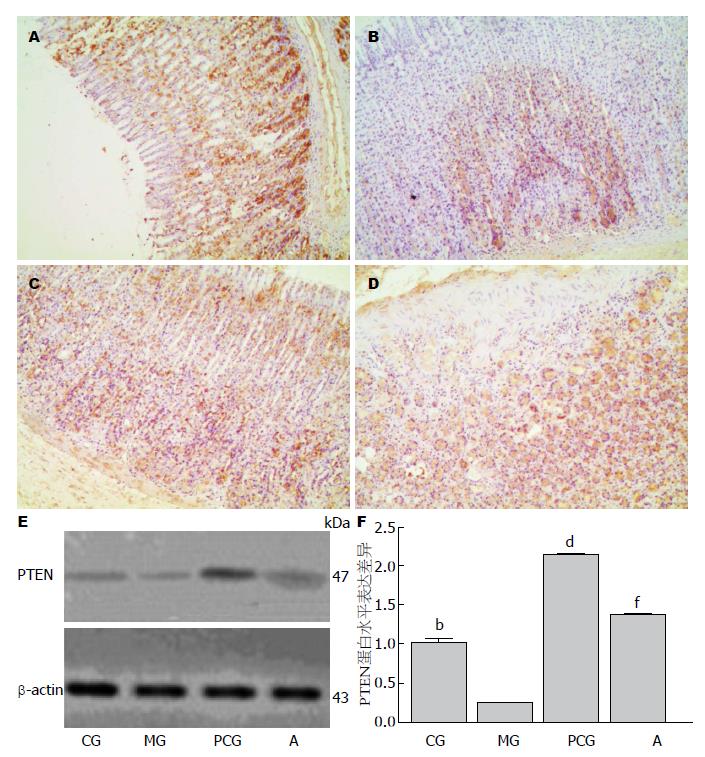
PTEN蛋白免疫组织化学结果为胞浆着色(图4A), 与p16蛋白相同, 中西药药物处理组该蛋白表达阳性率均显著高于模型组(P<0.01); 胃黏膜异型增生模型组PTEN蛋白相比正常对照组均呈现微量表达; 其中西药维甲酸组PTEN蛋白的表达量约为模型组的8.65倍, 中药组p16蛋白的表达量约为模型组的5.54倍. 与p16蛋白不同的是中西药药物处理PTEN蛋白的表达量也显著地高于正常对照组; 但中药处理组该蛋白的表达量显著低于西药维甲酸治疗组(图4B, C).
肿瘤的发生涉及遗传学与表观遗传学的共同作用, 其中DNA甲基化是表观遗传学的重要内容, 是对DNA的一种化学修饰, 在维持染色体结构、胚胎发育、细胞分化及肿瘤发生等方面发挥重要的作用[15]. DNA高甲基化可能抑制基因的表达, 相应的DNA低甲基化则可促进基因表达[16]. 抑癌基因由于5'端启动子调控区CpG岛异常高甲基化而抑制mRNA转录作用[17], 从而使抑癌基因沉默或低表达, 在某些情况下可能是抑癌基因失活的唯一机制[10,18]. 胃癌的发展是一个多基因参与的多阶段过程, 抑癌基因功能的缺失逐渐导致癌症的发生. 胃癌前病变是胃癌发生和发展过程中的一个重要阶段, 该阶段的逆转消失是预防胃癌发生的有效措施[19]. 由于甲基化调节基因的表达过程是可逆且受环境因素的影响, 因此可以通过药物干预使抑癌基因去甲基化, 诱导抑癌基因蛋白的表达, 以此来改变胃癌前病变的进程. 目前去甲基化的诱导多用去甲基化制剂, 利用中药实现对抑癌基因的去甲基化国内外鲜有报道, 而传统中药在治疗胃癌前病变及胃癌方面发挥重要的作用, 因此, 本研究选择解毒化瘀健脾方干预胃黏膜异型增生大鼠, 检测p16和PTEN基因的甲基化状态和表达变化, 通过传统中药对抑癌基因的甲基化状态和蛋白表达的影响为临床采用中药治疗影响胃癌病程提供参考依据.
p16是一个重要的多肿瘤抑制基因, 通过与CDK4/6结合抑制后者的作用, 从而是RB蛋白低磷酸化, 调控G1/S期转变而抑制细胞增殖[20], 已证实胃癌中p16基因启动子区异常甲基化是使其失活的主要机制[21]. 近期的研究表明p16基因蛋白异常表达对胃癌的发生发展、恶变程度、淋巴结转移预后有密切关系[19]. p16基因的启动子区域甲基化后, 其表达被抑制, 使得p16蛋白依赖的人转化生长因子β1生长抑制信号通路失去作用, 进而促进细胞分裂[22]. 本实验的研究结果表明, 解毒化瘀健脾中药组方和西药维甲酸显能一定程度实现大鼠异型增生胃黏膜细胞的p16基因的去甲基化; 此外, 该基因在mRNA表达水平和蛋白表达水平的变化结果均表明中药组方和西药维甲酸治疗组显著诱导了p16的表达量增加, 且中药组方治疗组p16 mRNA和蛋白表达水平(免疫组织化学与Western blot)显著高于西药维甲酸治疗组. 这说明中药解毒化瘀健脾组方能使异型增生的胃黏膜细胞p16基因一定程度去甲基化, 同时诱导p16蛋白的高表达, 从而使胃癌前病变的逆转成为可能.
自1997年PTEN基因首次被发现以来, 在遗传学方面的突变和缺失在多种肿瘤中多有报道, 表观遗传学方面由PTEN基因DNA甲基化导致基因失活相继在前列腺癌及其他肿瘤中得到报道[23]. 胃癌组织中PTEN甲基化检测的文献较少, 且结论存在争议, 部分报道认为PTEN的甲基化与胃癌的发生及分化程度存在一定到各相关性[23-25], 但也有文献得出截然相反的结论[26]. 关于药物使PTEN去甲基化的文献鲜有报道. 本实验采用MSP法检测解毒化瘀健脾中药组方治疗对PTEN基因甲基化的影响发现, 中药组方和西药维甲酸治疗组亦一定程度促进了PTEN基因的去甲基化. PTEN的表达结果也表明, 解毒化瘀健脾组方同西药维甲酸均可以诱导PTEN基因在mRNA水平和蛋白表达水平的显著增加. 与对p16基因的影响不同, 中药治疗组的诱导作用在mRNA和蛋白表达水平均未显现出优于西药维甲酸治疗组组的趋势, 但是相比模型对照组, 解毒化瘀健脾中药的干预的确诱导了PTEN在mRNA水平和蛋白表达水平的极显著的增加. 因此, 我们认为中药解毒化瘀健脾方对于异型增生的胃黏膜细胞PTEN基因具有一定的去甲基化和表达诱导作用. 因PTEN的甲基化与胃癌的相关性存在争议, 故本实验中药组方引起该基因的去甲基化是否对胃癌前病变的转归治疗具有参考价值, 仍需要进一步的实验探索得以确认. 但PTEN作为重要的抑癌基因, 本实验中药物诱导其蛋白表达量的增加仍提示我们解毒化瘀健脾中药组方对异型增生的胃黏膜组织有一定的保护和治疗作用.
实验提示我们解毒化瘀健脾中药可能通过影响p16、PTEN的甲基化状态和蛋白表达实现一定的胃黏膜异型增生治疗作用, 这为临床采用中药干预抑癌基因的甲基化状态和蛋白表达实现胃癌前病变的逆转, 防治胃癌的发生具有一定的参考价值.
此外, 模型组p16、PTEN的甲基化程度虽高于其他各组, 但无显著性差异; 以及正常对照组甲基化程度为20%, 高于两种中药治疗组(0%). 分析其原因, 可能是: 胃黏膜异型增生在胃内呈散发状态, 实验大鼠模型中检测取材针对整个胃窦部位的胃黏膜随机取样, 典型的异型增生的病变部位有遗漏检测或部分样品为非特征性明显的异型增生胃黏膜组织.
肠化生与胃黏膜异型增生属胃癌前病变阶段, 如何有效阻断胃癌前病变向胃癌的转变成为目前防治胃癌的研究关键.
唐世刚, 教授, 湖南省人民医院
DNA甲基化与胃癌的发生发展密切相关. p16和PTEN是机体重要的抑癌基因. 基因甲基化状态可因外界因素干预发生逆转, 选择有效的药物干预, 抑制抑癌基因的甲基化程度, 对于抑制胃癌前病变向胃癌发展的进程具有重要意义.
Shim等证实胃癌中p16基因启动子区异常甲基化是使其失活的主要机制; 范尧夫等研究认为p16蛋白异常表达对胃癌的发生发展、恶变程度密切相关. 刘芬、kang等认为PTEN的甲基化与胃癌的发生及分化程度存在一定到各相关性, 但Sato的报道得出截然相反的结论.
本研究采用MSP法检测解毒化瘀健脾中药干预后抑癌基因p16和PTEN甲基化受抑制程度及二者的表达量变化, 探索该中药治疗胃黏膜异型增生的可能机制.
探讨中药解毒化瘀健脾方对胃黏膜异型增生抑癌基因的甲基化及蛋白表达异常的干预作用, 为中药靶基因治疗胃癌前病变提供依据, 且有助于降低胃癌的发生率.
该课题设计比较合理, 研究方法可靠, 结论可信, 推论合理. 文章用较经典的方法建立胃黏膜异型增生大鼠模型, 观察证实中药解毒化瘀健脾方干预对胃黏膜p16、PTEN基因具有一定的去甲基化作用, 并可诱导二者在mRNA和蛋白水平表达量增加. 提示解毒化瘀健脾组方对胃黏膜异型增生具有潜在的治疗作用.
编辑: 郭鹏 电编: 鲁亚静
| 1. | 胡 品津, 刘 新光. 消化内科学. 第1版. 北京: 人民卫生出版社 2008; 34. |
| 2. | Jemal A, Siegel R, Xu J, Ward E. Cancer statistics, 2010. CA Cancer J Clin. 2010;60:277-300. [PubMed] [DOI] |
| 3. | 李 连弟, 张 思维, 鲁 凤珠, 牧 人, 孙 秀娣, 皇甫 小梅, 孙 杰, 周 有尚, 夏 毅, 戴 旭东. 中国恶性肿瘤死亡谱及分类构成特征研究. 中华肿瘤杂志. 1997;19:323-328. |
| 4. | Correa P, Haenszel W, Cuello C, Tannenbaum S, Archer M. A model for gastric cancer epidemiology. Lancet. 1975;2:58-60. [PubMed] [DOI] |
| 5. | Lee JR, Chung WC, Kim JD, Lee KM, Paik CN, Jung SH, Jung JH, Lee YK, Han SW. Differential LINE-1 Hypomethylation of Gastric Low-Grade Dysplasia from High Grade Dysplasia and Intramucosal Cancer. Gut Liver. 2011;5:149-153. [PubMed] [DOI] |
| 12. | Honoki K, Tsujiuchi T, Mori T, Yoshitani K, Tsutsumi M, Takakura Y, Mii Y. Expression of the p16INK4a gene and methylation pattern of CpG sites in the promoter region in rat tumor cell lines. Mol Carcinog. 2004;39:10-14. [PubMed] [DOI] |
| 13. | Kim H, Kim YH, Kim SE, Kim NG, Noh SH, Kim H. Concerted promoter hypermethylation of hMLH1, p16INK4A, and E-cadherin in gastric carcinomas with microsatellite instability. J Pathol. 2003;200:23-31. [PubMed] [DOI] |
| 15. | Li Y, Tollefsbol TO. Impact on DNA methylation in cancer prevention and therapy by bioactive dietary components. Curr Med Chem. 2010;17:2141-2151. [PubMed] [DOI] |
| 17. | Kaneda A, Kaminishi M, Yanagihara K, Sugimura T, Ushijima T. Identification of silencing of nine genes in human gastric cancers. Cancer Res. 2002;62:6645-6650. [PubMed] |
| 18. | Wajed SA, Laird PW, DeMeester TR. DNA methylation: an alternative pathway to cancer. Ann Surg. 2001;234:10-20. [PubMed] [DOI] |
| 21. | Shim YH, Kang GH, Ro JY. Correlation of p16 hypermethylation with p16 protein loss in sporadic gastric carcinomas. Lab Invest. 2000;80:689-695. [PubMed] [DOI] |
| 22. | Attri J, Srinivasan R, Majumdar S, Radotra BD, Wig J. Alterations of tumor suppressor gene p16INK4a in pancreatic ductal carcinoma. BMC Gastroenterol. 2005;5:22. [PubMed] [DOI] |
| 24. | Kang GH, Lee S, Kim WH, Lee HW, Kim JC, Rhyu MG, Ro JY. Epstein-barr virus-positive gastric carcinoma demonstrates frequent aberrant methylation of multiple genes and constitutes CpG island methylator phenotype-positive gastric carcinoma. Am J Pathol. 2002;160:787-794. [PubMed] [DOI] |
| 25. | Kang YH, Lee HS, Kim WH. Promoter methylation and silencing of PTEN in gastric carcinoma. Lab Invest. 2002;82:285-291. [PubMed] [DOI] |
| 26. | Sato K, Tamura G, Tsuchiya T, Endoh Y, Sakata K, Motoyama T, Usuba O, Kimura W, Terashima M, Nishizuka S. Analysis of genetic and epigenetic alterations of the PTEN gene in gastric cancer. Virchows Arch. 2002;440:160-165. [PubMed] [DOI] |