修回日期: 2014-01-09
接受日期: 2014-01-16
在线出版日期: 2014-03-18
目的: 研究乌司他丁(ulinastatin, UTI)联合血必净对海水浸泡腹腔开放伤大鼠肠屏障功能的保护作用及机制.
方法: 104只♂Wistar大鼠随机分为13组: 对照组(A组), 海水浸泡腹腔开放伤生理盐水治疗1、3、6 h组(B组), UTI处理1、3、6 h组(C组), 血必净处理1、3、6 h组(D组), UTI联合血必净处理1、3、6 h组(E组); 每组8只, 分别在术后第1、3、6 h采集血液、小肠组织标本, 观察血浆二胺氧化酶、内毒素水平、小肠组织镜下病理学变化. 应用酶联免疫分析法检测血浆肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、白介素6(interleukin-6, IL-6)、内毒素(endotoxin, ET)含量, 分光光度法检测血浆中二胺氧化酶(diamine oxidase, DAO), 黄嘌呤氧化酶法测定小肠超氧化物歧化酶(superoxide dismutase, SOD)活性, 硫代巴比妥酸法检测小肠丙二醛(malondialdehyde, MDA)含量, 荧光法检测小肠组织细胞内活性氧(reactive oxygen species, ROS)水平. 非放射性凝胶迁移实验法检测小肠组织核转录因子-κB(nuclear transcription factor-κB, NF-κB) p65活性.
结果: 术后6 h, C组和D组较B组血浆SOD(75.34 U/mg±4.60 U/mg, 75.01 U/mg±4.22 U/mg vs 67.38 U/mg±4.20 U/mg, P<0.05)明显升高, 而血浆DAO(13.64 U/mL±1.08 U/mL, 13.87 U/mL±1.19 U/mL vs 17.06 U/mL±1.56 U/mL, P<0.05)、ET(0.635 eU/L±0.037 eU/L, 0.604 eU/L±0.027 eU/L vs 0.728 eU/L±0.038 eU/L, P<0.01)、TNF-α(122.10 pg/mL±9.72 pg/mL, 121.93 pg/mL±8.67 pg/mL vs 143.89 pg/mL±8.13 pg/mL, P<0.01)、IL-6(261.60 pg/mL±8.73 pg/mL, 268.06 pg/mL±6.87 pg/mL vs 293.42 pg/mL±10.44 pg/mL, P<0.01)、小肠组织镜下病理学评分、小肠组织MDA(5.29 nmol/mg±0.44 nmol/mg, 5.26 nmol/mg±0.42 nmol/mg vs 6.40±0.53 nmol/mg, P<0.01)、ROS含量(83.72 mg/mL±2.89 mg/mL, 74.69 mg/mL±2.94 mg/mL vs 130.13 mg/mL±3.89 mg/mL, P<0.01)、NF-κB p65(122.53±7.02, 98.61±7.86 vs 202.60±8.06, P<0.01)明显降低. E组较C组血浆DAO、ET、TNF-α、IL-6、小肠组织镜下病理学评分、小肠组织MDA、ROS、NF-κB p65明显降低(11.39 U/mL±1.23 U/mL vs 13.64 U/mL±1.08 U/mL, 0.528 eU/L±0.036 eU/L vs 0.635 eU/L±0.037 eU/L, 110.40 pg/mL±5.99 pg/mL vs 122.10 pg/mL±9.72 pg/mL, 213.88 pg/mL±11.69 pg/mL vs 261.60 pg/mL±8.73 pg/mL, 小肠, 4.74 nmol/mg±0.25 nmol/mg vs 5.29 nmol/mg±0.44 nmol/mg, 56.31 mg/mL±3.61 mg/mL vs 83.72 mg/mL±2.89 mg/mL, 61.05±6.69 vs 122.53±7.02, P<0.05), SOD明显升高(85.49 U/mg±3.87 U/mg vs 75.34 U/mg±4.60 U/mg, P<0.05); C、D组相比没有显著差异.
结论: UTI联合血必净对海水浸泡腹腔开放伤大鼠肠屏障功能有较好的保护作用, 其机制可能与抑制NF-κB及其相关炎症因子表达、减轻氧化应激损伤有关.
核心提示: 海水浸泡腹腔开放伤早期即可损伤肠屏障功能. 炎症因子介导的炎症反应及氧化应激损伤是海水浸泡腹腔开放伤后肠黏膜屏障功能障碍的主要原因. 伤后早期联合应用乌司他丁(ulinastatin)、血必净治疗, 可明显减轻氧自由基和脂质过氧化损伤, 抑制核转录因子-κB(nuclear transcription factor-κB, NF-κB)激活及炎症介质的释放, 明显保护海水浸泡腹部开放伤后肠屏障功能, 有效预防全身炎症反应综合征(systemic inflammatory response syndrome)及多器官功能障碍综合征(multiple organ dysfunction syndrome)的发生.
引文著录: 周松, 张行健, 薛小军, 刘强, 张文华, 聂凯, 陈达丰, 江秀文. 乌司他丁联合血必净对海水浸泡腹腔开放伤大鼠肠屏障功能的保护作用. 世界华人消化杂志 2014; 22(8): 1112-1120
Revised: January 9, 2014
Accepted: January 16, 2014
Published online: March 18, 2014
AIM: To investigate the protective effect of ulinastatin combined with Xuebijing injection against intestinal mucosa injury in rats with seawater-immersed open abdominal injury.
METHODS: A total of 104 male Wistar rats were randomly divided into 5 groups that consisted of a normal control group (n = 8), a normal saline treated group (n = 24), a ulinastatin treated group (n = 24), a Xuebijing injection treated group (n = 24), and a ulinastatin plus xuebijing injection group (n = 24). Except for the normal control group, the other groups were further divided into three subgroups for testing at 1, 3 and 6 h after operation. Blood and intestinal tissues were obtained at different time points after operation. Histopathological changes of the ileum were observed. The contents of tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6) and endotoxin (ET) in plasma were determined by enzyme-linked immunosorbent assay (ELISA), and the activities or contents of nuclear transcription factor-κB (NF-κB), malondialdehyde (MDA), superoxide dismutase (SOD), diamine oxidase (DAO) and reactive oxygen species (ROS) in intestinal tissues were measured by non-radioactive electrophoretic mobility shift assay (EMSA), biochemical methods and 2',7'-dichlorofluorescin diacetate (DCFH-DA) staining.
RESULTS: Compared with the normal saline treated group, the contents of DAO (13.64 U/mL ± 1.08 U/mL, 13.87 U/mL ± 1.19 U/mL vs 17.06 U/mL ± 1.56 U/mL, P < 0.05), ET (0.635 eU/L ± 0.037 eU/L, 0.604 eU/L ± 0.027 eU/L vs 0.728 eU/L ± 0.038 eU/L, P < 0.01), TNF-α (122.10 pg/mL ± 9.72 pg/mL, 121.93 pg/mL ± 8.67 pg/mL vs 143.89 pg/mL ± 8.13 pg/mL, P < 0.01), IL-6 (261.60 pg/mL ± 8.73 pg/mL, 268.06 pg/mL ± 6.87 pg/mL vs 293.42 pg/mL ± 10.44 pg/mL, P < 0.01) in plasma and the activities or contents of NF-κB p65 (122.53 ± 7.02, 98.61 ± 7.86 vs 202.60 ± 8.06, P < 0.01), MDA (5.29 nmol/mg ± 0.44 nmol/mg, 5.26 nmol/mg ± 0.42 nmol/mg vs 6.40 nmol/mg ± 0.53 nmol/mg, P < 0.01) and ROS (83.72 mg/mL ± 2.89 mg/mL, 74.69 mg/mL ± 2.94 mg/mL vs 130.13 mg/mL ± 3.89 mg/mL, P < 0.01) in intestinal tissues at 6 h significantly decreased, while the activities or contents of SOD at 6 h (75.34 U/mg ± 4.60 U/mg, 75.01 U/mg ± 4.22 U/mg vs 67.38 U/mg ± 4.20 U/mg, P < 0.05) significantly increased in the ulinastatin treated group and Xuebijing injection treated group. The levels of DAO, ET, TNF-α, IL-6, MDA, ROS, and NF-κB p65 in the combination group were significantly lower than those in the ulinastatin treated group (11.39 U/mL ± 1.23 U/mL vs 13.64 U/mL ± 1.08 U/mL, 0.528 eU/L ± 0.036 eU/L vs 0.635 eU/L ± 0.037 eU/L, 110.40 pg/mL ± 5.99 pg/mL vs 122.10 pg/mL ± 9.72 pg/mL, 213.88 pg/mL ± 11.69 pg/mL vs 261.60 pg/mL ± 8.73 pg/mL, 4.74 nmol/mg ± 0.25 nmol/mg vs 5.29 nmol/mg ± 0.44 nmol/mg, 56.31 mg/mL ± 3.61 mg/mL vs 83.72 mg/mL ± 2.89 mg/mL, 61.05 ± 6.69 vs 122.53 ± 7.02, P < 0.05), while the level of SOD was higher in the combination group. There were no significant differences in the above parameters between the ulinastatin treated group and Xuebijing injection treated group.
CONCLUSION: Ulinastatin combined with Xuebijing injection has a protective effect against intestinal mucosa injury in rats with seawater immersed open abdominal injury possibly by inhibiting NF-κB activity and inflammatory cytokines and reducing oxidative stress.
- Citation: Zhou S, Zhang XJ, Xue XJ, Liu Q, Zhang WH, Nie K, Chen DF, Jiang XW. Protective effect of ulinastatin combined with Xuebijing injection against intestinal mucosa injury in rats with seawater-immersed open abdominal injury. Shijie Huaren Xiaohua Zazhi 2014; 22(8): 1112-1120
- URL: https://www.wjgnet.com/1009-3079/full/v22/i8/1112.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i8.1112
海战中腹部损伤病员合并海水浸泡极为常见. 海水浸泡腹腔开放伤早期即可损伤肠屏障功能, 引起的细菌易位和内毒素入侵, 导致全身炎症反应综合征(systemic inflammatory response syndrome, SIRS), 进而启动多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)并危及生命[1-3]. 研究表明, 海水浸泡腹腔开放伤后小肠组织炎症介质及细胞因子的过度释放及由于组织缺血再灌住所导致的氧化应激损伤是导致肠屏障功能障碍的重要原因[4-6]. 本研究拟从大鼠腹部开放伤海水浸泡模型中, 观察乌司他丁(ulinastatin, UTI)联合血必净对海水浸泡腹腔开放伤大鼠肠屏障功能的作用, 探讨UTI联合血必净对海水浸泡腹腔开放伤肠屏障功能障碍的作用机制.
♂Wistar大鼠104只购自厦门大学实验动物中心(合格证号: 2007000553749, 体质量250-300 g). 大鼠血浆肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素6(interleukin-6, IL-6)、内毒素(endotoxin, ET)ELISA试剂盒、二胺氧化酶(diamine oxidase, DAO)、丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)测试盒购自南京建成生物工程研究所. 非放射性凝胶迁移试剂盒、细胞内活性氧(reactive oxygen species, ROS)检测试剂盒及细胞核蛋白抽提试剂盒购自碧云天生物技术研究所. UTI为广东天普生化医药股份有限公司产品, 国药准字号: H19990132. 血必净为天津红日药业股份有限公司产品, 国药准字号: Z20040033. 实验用人工海水配制: 按国家海洋局第三研究所配方配制[7,8], 其主要指标: 渗透压1250 mmol/L±11.52 mmol/L, pH 8.2, 钠离子浓度630 mmol/L±5.33 mmol/L, 钾离子浓度10.88 mmol/L±0.68 mmol/L, 氯离子浓度658.8 mmol/L±5.25 mmol/L, 温度21 ℃±2 ℃.
1.2.1 实验动物分组及模型建立: 将实验动物编号, 利用随机数字表随机分为13组, 每组8只: 对照组(A组), 生理盐水治疗1、3、6 h组(B1、B3、B6组), UTI处理1、3、6 h组(C1、C3、C6组), 血必净处理1、3、6 h组(D1、D3、D6组), UTI联合血必净处理1、3、6 h组(E1、E3、E6组). A组于术后1 h活杀; B、C、D、E组动物分别于治疗后1、3及6 h活杀, 取腹主动脉血送检. 实验前动物禁食24 h, 自由饮水. 以速眠新1.0 mg/kg肌肉注射麻醉. 脱毛, 酒精消毒皮肤, 按无菌原则铺巾, 取腹部正中切口进入腹腔, 长约3 cm. A组切开腹壁, 敞开腹腔并空气暴露1 h后直接关腹; B、C、D、E组致伤后将动物置于大鼠固定架上, 浸泡入人工海水中, 浸泡平面达剑突水平, 1 h后打捞出水; 出水后尽量控出腹腔内海水, 并以无菌生理盐水100 mL灌洗腹腔后控出, 关腹, 并经尾静脉分别给予生理盐水、UTI(5万U/kg)、血必净(4 mL/kg)、UTI联合血必净(5万U/kg、4 mL/kg)治疗, 液体总量均为10 mL/kg.
1.2.2 血浆DAO、ET、TNF-α、IL-6含量的测定: 各组均于预定时间于腹主动脉抽血, 经离心分离血浆后于-20 ℃保存待测. DAO含量采用黎君友等[9]建立的改良分光光度法测定, ET、TNF-α、IL-6含量采用ELISA法检测[10], 严格按试剂盒说明书进行操作.
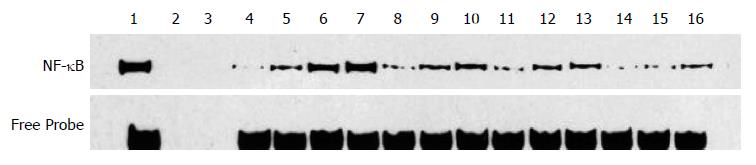
1.2.3 小肠组织的检测: 各组均于预定时间腹主动脉抽血后处死大鼠, 距回盲部15 cm, 留取小肠组织各1份. 每1份又均分为4部分, 1份留作病理学检测, 另3份迅速置于液氮中保存, 分别用于检测下列小肠组织指标. (1)小肠组织MDA、SOD含量检测: 按体质量体积比1:9加入匀浆介质, 电动匀浆机匀浆, 制备成10%小肠组织匀浆, 采用黄嘌呤氧化酶法[11,12]测定SOD活性, 硫代巴比妥酸法[13]检测MDA含量, 严格按试剂盒说明书逐步操作; (2)小肠组织ROS含量检测: 采用荧光法[14,15]检测小肠组织内ROS水平; (3)小肠组织核转录因子-κB (nuclear transcription factor-κB, NF-κB)p65活性检测: 采用非放射性凝胶迁移实验(electrophoretic mobility shift assay, EMSA)检测NF-κB活性[16-18]. 取冻存小肠组织300 g, 按细胞核蛋白抽提试剂盒说明书提取核蛋白. 取5 μg核蛋白与400 fmol生物素标记的双链5'NF-κB寡核苷酸探针(5'-AGTTGAGGGGACTTTCCCAGGC-3')室温孵育30 min, 6%聚丙烯酰胺凝胶电泳分离DNA-蛋白复合物, 再通过电转移发将其转移到带正电荷的尼龙结合膜上, 紫外灯下交联固定10 min, 室温封闭30 min, 再与1:750稀释的Streptavidin-HRP反应液室温孵育20 min, 待化学发光试剂加入结合膜表面后, 立即用Cool imager(Viagene公司)进行化学发光检测. 以积分灰度值表示NF-κB活性; (4)小肠组织病理学观察: 将多聚甲醛固定好的小肠组织石蜡包埋、切片、苏木精-伊红染色法(HE)染色后, 采用盲法由病理科医师在光镜下阅片. 根据Chiu等[19]报道的方法在400倍显微镜下任选5个非重叠视野观察小肠组织损伤程度并评分, 取其平均值用于统计. 评分标准如下: 0分: 正常绒毛与腺体; 1分: 部分绒毛顶部上皮轻度受损; 2分: 上皮下腺体轻度受损; 3分: 上皮腺间隙扩大, 毛细血管充血; 4 分: 上皮与固有层中度分离, 腺体受损; 5 分: 部分绒毛顶部脱落; 6 分: 绒毛顶部脱落明显, 毛细血管扩张; 7分: 绒毛固有层脱落, 腺体明显受损; 8分: 固有层开始消化分解.
统计学处理 利用SPSS13.0软件进行统计分析. 所有数据均以mean±SD表示. 各组均数差异比较采用单因素方差分析法, 组间多重比较采用LSD法, 等级资料比较采用χ2检验. P<0.05为差异有统计学意义.
各组大鼠血浆DAO、内毒素、TNF-α、IL-6含量如表1, 与A组相比, 腹腔开放伤合并海水浸泡后大鼠血浆DAO、内毒素、TNF-α、IL-6各时间点含量均显著升高(P<0.05). 各治疗组与同时点B组相比, 血浆DAO、内毒素、TNF-α、IL-6水平均明显降低(P<0.05). UTI治疗组与血必净治疗组同时点相比, 血浆DAO、内毒素、TNF-α、IL-1水平无明显改变(P>0.05). UTI、血必净合用6 h组与UTI治疗6 h组、血必净治疗6 h组相比, 血浆DAO、内毒素、TNF-α、IL-1及IL-6水平均明显降低, 差异有统计学意义(P<0.05).
| 分组 | DAO(U/mL) | ET(eU/L) | TNF-α(pg/mL) | IL-6(pg/mL) |
| A组 | 7.68±1.12 | 0.077±0.011 | 56.41±9.23 | 129.18±10.77 |
| B1 h组 | 25.15±2.62b | 0.183±0.013b | 107.12±9.61b | 222.19±13.85b |
| B3 h组 | 22.47±1.56b | 0.338±0.035b | 125.46±9.11b | 265.46±11.38b |
| B6 h组 | 17.06±1.56b | 0.728±0.038b | 143.89±8.13b | 293.42±10.44b |
| C1 h组 | 16.78±1.32bdj | 0.130±0.016bdj | 88.94±7.96bdj | 187.94±9.37bdj |
| C3 h组 | 15.34±1.33bl | 0.216±0.015bl | 107.70±7.64bl | 222.539±10.69bl |
| C6 h组 | 13.64±1.08bhm | 0.635±0.037bhn | 122.10±9.72bhn | 261.60±8.73bhn |
| D1 h组 | 16.53±1.54bdj | 0.134±0.013bdj | 89.04±7.06bdj | 183.98±9.10bdj |
| D3 h组 | 15.63±1.26bl | 0.213±0.012bl | 110.17±6.62bl | 217.11±8.48bl |
| D6 h组 | 13.87±1.19bhn | 0.604±0.027bhn | 121.93±8.67bhn | 268.06±6.87bhn |
| E1 h组 | 14.04±1.62bd | 0.098±0.011bd | 79.85±5.68bd | 166.40±5.70bd |
| E3 h组 | 13.05±1.02bf | 0.179±0.010bf | 95.24±5.35bf | 180.59±5.72bf |
| E6 h组 | 11.39±1.23bh | 0.528±0.036bh | 110.40±5.99bh | 213.88±11.69bh |
| F值 | 54.982 | 540.602 | 49.611 | 139.469 |
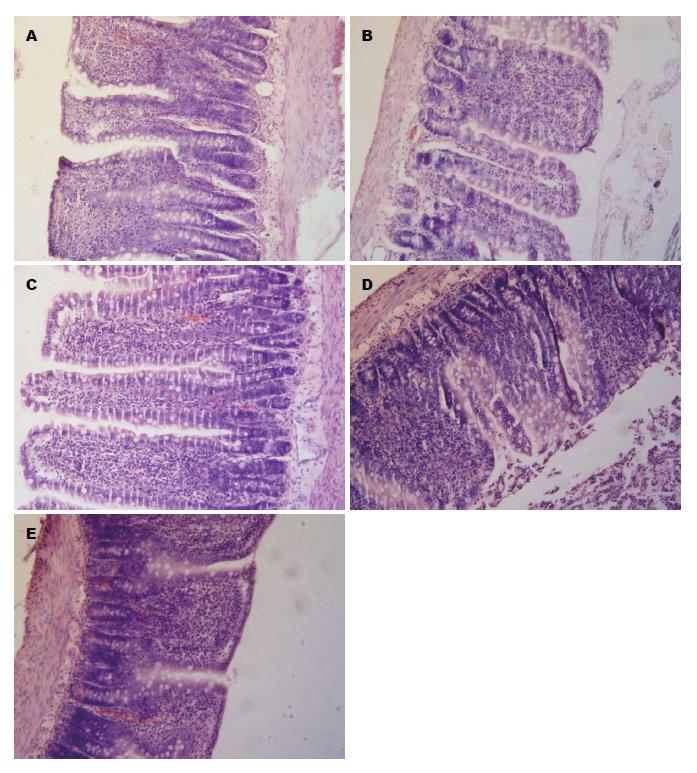
A组肠黏膜未见损伤; B、C、D、E组均有不同程度的肠黏膜损伤, 小肠绒毛顶端水肿、间隙增宽; 黏膜下层区域血管扩张、淤血, 固有膜及黏膜下层淋巴细胞浸润(图1). 小肠黏膜组织损伤Haglund评分如表2. 各组大鼠小肠MDA、SOD、ROS含量如表3, 与A组相比, 腹腔开放伤合并海水浸泡后大鼠小肠MDA、ROS及Haglund评分各时点水平均显著升高(P<0.05), 小肠SOD水平明显降低(P<0.05). 各治疗组与同时点B组相比, 小肠MDA、ROS水平及均显著降低(P<0.01), 小肠SOD水平均明显升高(P<0.05). UTI治疗组与血必净治疗组同时点相比, 小肠MDA、SOD、ROS水平及Haglund评分无明显改变(P>0.01). UTI、血必净合用组与UTI治疗组、血必净治疗组同时点相比, 小肠MDA、ROS水平及Haglund评分均显著降低(P<0.01), 小肠SOD水平均明显升高, 差异有统计学意义(P<0.05).
| 分组 | 小肠病理学评分 | ||
| 1 h | 3 h | 6 h | |
| A组 | 0.50±0.55 | ||
| B组 | 5.67±0.82b | 5.16±0.75b | 4.50±0.55b |
| C组 | 4.12±0.75bci | 3.67±0.82bfk | 3.50±0.84bhm |
| D组 | 4.33±0.82bcj | 3.83±0.84bfl | 3.67±0.82bhn |
| E组 | 3.00±0.63bd | 2.83±0.75bf | 2.50±0.55bh |
| 分组 | MDA(nmol/mg) | SOD(U/mg) | ROS(mg/mL) | NF-κB活性 |
| A组 | 1.44±0.27 | 93.04±5.58 | 24.13±2.26 | 16.65±1.72 |
| B1 h组 | 3.70±0.40bj | 50.36±7.85bj | 44.02±3.15bj | 66.43±4.98bj |
| B3 h组 | 4.39±0.41bl | 61.84±5.15bl | 83.51±3.59bl | 144.89±6.17bl |
| B6 h组 | 6.40±0.53bn | 67.38±4.20bn | 130.13±3.89bn | 202.60±8.06bn |
| C1 h组 | 2.97±0.35bdi | 66.27±7.09bdi | 36.30±2.98bdi | 22.09±4.44d |
| C3 h组 | 3.59±0.38bfk | 71.04±5.93bfk | 51.49±3.77bfl | 76.97±8.11bfl |
| C6 h组 | 5.29±0.44bhm | 75.34±4.60bhm | 83.72±2.89bhm | 122.53±7.02bhn |
| D1 h组 | 2.97±0.37bdi | 66.31±6.16bdi | 34.51±3.25bdj | 21.80±3.00d |
| D3 h组 | 3.55±0.33bfk | 71.08±6.47bfk | 47.59±3.60bfl | 74.83±7.32bfl |
| D6 h组 | 5.26±0.42bhm | 75.01±4.22bgn | 74.69±2.94bhn | 98.61±7.86bhn |
| E1 h组 | 2.43±0.33b | 73.19±7.52b | 28.11±3.52a | 18.82±2.36 |
| E3 h组 | 2.99±0.44b | 78.30±5.55b | 37.93±3.25b | 35.73±4.67b |
| E6 h组 | 4.74±0.25b | 85.49±3.87a | 56.31±3.61b | 61.05±6.69b |
| F值 | 73.725 | 19.743 | 481.818 | 534.031 |
由表3, 图2可知, 腹腔开放伤合并海水浸泡后1-6 h, NF-κB明显增高, 并随时间逐渐增强, 与假手术组相比, 差异有统计学意义(P<0.01). UTI及血必净治疗均可显著降低NF-κB活性, 与生理盐水组相比差异有统计学意义. UTI治疗组与血必净治疗组同时点相比, 小肠NF-κB含量无明显改变(P>0.01). UTI、血必净合用6 h组与UTI治疗6 h组、血必净治疗6 h组同时点相比, 差异有统计学意义(P<0.01).
海水是一种高渗性液体, 导热系数大、温度低, 并含有数十种致病微生物, 故海水浸泡合并腹腔开放性外伤可对机体造成更严重的损害[20-22]. 高渗海水进入腹腔后可通过体腔浆膜透析作用, 导致细胞外液中的水分大量外排, 造成循环血量的急剧减少, 引起高钠、高钾、高氯血症, 进而引起微循环障碍[23,24]. 当机体处于失血与高渗性脱水的双重应激状态下, 为保证重要器官的功能, 交感神经兴奋, 引起广泛肠系膜血管强烈收缩, 转移出大量肠道血液, 导致肠道缺血. 肠黏膜上皮细胞对缺血、缺氧状态耐受力差, 易引起细胞内钠、水潴留, 引起细胞水肿、坏死及细胞连接断裂, 导致肠屏障损伤. 此外, 机体应激及组织缺血再灌注过程中产生的大量具有毒性的活性氧代谢产物及炎症因子亦可加重对肠黏膜屏障的损害, 引起细菌易位及肠源性内毒素血症, 导致SIRS, 最终可导致MODS的发生[25,26]. 本研究结果也进一步证实了海水浸泡腹腔开放伤后早期即可损伤肠道屏障功能, 而UTI联合血必净干预可明显降低血浆ET、DAO水平, 抑制炎症因子及氧化应激产物的生成, 并降低肠黏膜的病理损伤程度, 提示其可保护海水浸泡腹腔开放伤大鼠肠屏障功能.
UTI是一种典型的Kuniz型的丝氨酸蛋白酶抑制剂. 他具有很强的抑制水解酶的作用, 能抑制中性粒细胞弹性蛋白酶、胰蛋白酶原、胰蛋白酶、糜蛋白酶等多种丝氨酸蛋白酶的活性, 稳定溶酶体膜、抑制溶酶体酶释放, 减轻器官损伤. 此外, UTI还可降低纤维蛋白原的合成、抑制中性粒细胞聚集、抑制炎症介质释放、抑制细胞凋亡、改善免疫功能, 从而控制过度炎症反应、降低SIRS发生率[27-31]. Rui[32]研究表明, UTI能抑制NF-κB及其相关炎症因子的活性, 从而降低海水淹溺型急性肺损伤的发生率. Okuhama等[33]研究证明, UTI能抑制肝缺血再灌注过程中过量活性氧代谢产物, 减轻其对肝脏的损害. 血必净注射液是从32组中药处方中筛选出的具有对抗细菌毒素、降低内毒素水平、调节免疫功能、抑制炎性介质释放、改善微循环的有效药物, 主要含有红花、赤芍、川芎、丹参、当归等成份. 血必净具有很强的拮抗内毒素作用, 可强效拮抗内毒素诱导单核-巨噬细胞、T淋巴细胞、中性粒细胞等活性细胞产生内源性炎症介质释放, 减轻炎症反应[34-39]. 蒋涛等[40]研究表明, 血必净可显著降低大鼠脑创伤后MDA 水平, 提高SOD活性, 缓解脑水肿, 提示血必净注射液可减轻氧自由基和脂质过氧化损伤. SOD活力的高低间接体现了机体清除氧自由基的能力. MDA含量则可反映机体内脂质过氧化的程度[41,42]. 本研究显示, 海水浸泡腹腔开放伤后肠组织MDA、ROS含量显著升高, 同时伴随着SOD含量的降低, 提示海水浸泡腹腔开放伤后活性氧代谢产物在肠屏障功能损伤过程中起着重要的介导作用. 血必净、UTI单独使用时均能显著降低肠组织MDA、ROS含量, 提高SOD含量, 有效减轻氧自由基和脂质过氧化损伤; 而血必净与UTI联合应用则能显示出更好的效果, 两者具有协同作用.
在海水浸泡腹部开放伤的病理生理过程中, 核转录因子NF-κB的活化对肠屏障功能的损伤起到核心作用[43,44]. NF-κB是一类关键性的核转录因子, 是多种炎症因子的细胞内信号传导因子, 对机体内免疫应答及炎症反应起到重要的调节作用. 静息状态下, NF-κB以同二聚体或异二聚体形式存在于多种细胞的胞浆内, 并与其抑制蛋白IκB(inhibitors of NF-κB, IκB)结合并非活性状态存在. 在应激、细菌内毒素、炎症因子、活性氧自由基等刺激下, IκB发生磷酸化, 并与NF-κB二聚体解离, 最终使NF-κB从细胞浆转移到核内, 诱导多种细胞因子、炎症介质及黏附分子及蛋白酶类的转录合成, 最终损伤肠屏障功能[45-50]. 本研究结果显示, 海水浸泡腹腔开放伤后肠组织NF-κB活性明显增高, 提示NF-κB的激活可能在肠屏障功能障碍中起着中心调控作用. UTI及血必净治疗均可抑制NF-κB活性, TNF-α、IL-6也随之下调, 与生理盐水对照组相比, 损伤病理评分亦明显降低, 且以两者联合应用疗效最佳. 这一结果从另一侧面证明了NF-κB及其相关炎症因子参与了病变过程, 同时亦提示早期适量使用UTI及血必净能及时阻断NF-κB和炎症因子间正反馈机制, 明显减轻海水浸泡导致的炎症反应和病理损害.
UTI与血必净联合应用, 既能拮抗内毒素作用、减轻氧自由基和脂质过氧化损伤, 又能抑制NF-κB激活及炎症介质的释放, 两者具有协同作用, 可明显保护海水浸泡腹部开放伤后肠屏障功能, 有效预防SIRS及MODS的发生, 为临床救治海水浸泡腹部开放伤提供了新的思路.
海水浸泡腹腔开放伤早期即产生大量炎症因子及氧自由基. 炎症因子介导的炎症反应及氧化应激损伤是海水浸泡腹腔开放伤后肠黏膜屏障功能障碍的共同发病环节. 海水浸泡腹腔开放伤全身并发症的发生与炎症因子及氧自由基所致的损伤有关. 凡能减轻炎症反应及清除氧自由基的物质都能防止或减轻海水浸泡腹腔开放伤后全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)及多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)的发生, 显著提高伤员救治成功率.
庹必光, 教授, 遵义医学院附属医院消化科
海水浸泡腹腔开放伤后肠黏膜屏障功能障碍的发病机制十分复杂, 目前临床尚无确切的治疗方法. 炎症介质及氧化应激导致的肠黏膜损伤, 受到越来越多的关注.
既往研究表明乌司他丁及血必净均可显著降低海水浸泡腹部开放伤炎性介质的过度释放, 显著改善血流动力学及血电解质紊乱, 能够阻断全身炎性反应综合征的病理过程.
本文研究了联合使用乌司他丁及血必净注射液治疗后对大鼠海水浸泡腹腔开放伤后肠黏膜屏障功能的保护作用, 并探讨其可能作用机制, 为临床救治海水战创伤员提供了新的思路.
蛋白酶抑制剂UTI联合血必净能抑制海水浸泡腹腔开放伤大鼠NF-κB、TNF-α、IL-6的表达和合成, 减轻氧化应激损伤, 减少肠道内毒素易位,有效保护肠黏膜屏障功能, 有利于提高海水浸泡腹腔开放伤患者的救治成功率.
本文研究了乌司他丁联合血必净对海水浸泡腹腔开放伤肠屏障功能障碍的保护作用. 该研究发现乌司他丁联合血必净具有更好的效果, 两者具有协同作用. 其研究结果有一定的临床实用价值.
编辑: 郭鹏 电编: 鲁亚静
| 1. | 王 志伟, 吴 印爱, 刘 献棠, 蒋 邦好, 罗 真东, 胡 世雄. 腹腔海水浸泡对大鼠肠黏膜屏障功能的影响. 中华航海医学与高气压医学杂志. 2003;10:129-132. |
| 2. | 孙 涛, 李 欣, 金 博, 刘 超群, 浦 江, 付 山峰, 段 蕴铀. 腹部开放伤后海水浸泡对犬肠功能及形态学的影响. 中华航海医学与高气压医学杂志. 2007;14:261-264. |
| 3. | 刘 刚, 王 强, 王 育红, 周 丽君, 王 欲晓. 腹部开放伤合并人工海水浸泡大鼠肠道免疫屏障功能的变化. 中华航海医学与高气压医学杂志. 2008;15:131-134. |
| 4. | 吴 印爱, 王 志伟, 刘 从棠, 谢 尚奎, 蒋 邦好, 罗 真东. 腹腔开放伤并海水浸泡对犬血浆自由基水平的影响. 中华航海医学与高气压医学杂志. 2001;8:148-150. |
| 5. | 孙 涛, 李 欣, 刘 超群, 金 博, 付 山峰, 吴 姗珊, 胡 媛琴, 胡 晓红, 段 蕴铀. 腹部开放伤后海水浸泡致犬小肠缺血与缺血再灌注损伤的初步研究. 中华航海医学与高气压医学杂志. 2010;17:85-87. |
| 6. | 王 育红, 刘 刚, 虞 积耀, 孟 宇宏, 张 夕凉, 周 丽君, 王 大鹏. 核因子-κB与腹部开放伤合并海水浸泡大鼠全身炎症反应综合征的关系. 创伤外科杂志. 2009;11:163-165. |
| 11. | Cheon JH, Kim JS, Kim JM, Kim N, Jung HC, Song IS. Plant sterol guggulsterone inhibits nuclear factor-kappaB signaling in intestinal epithelial cells by blocking IkappaB kinase and ameliorates acute murine colitis. Inflamm Bowel Dis. 2006;12:1152-1161. [PubMed] [DOI] |
| 12. | Ma L, Zhao Y, Li B, Wang Q, Liu X, Chen X, Nan Y, Liang L, Chang R, Liang L. 3,5,4'-Tri-O-acetylresveratrol attenuates seawater aspiration-induced lung injury by inhibiting activation of nuclear factor-kappa B and hypoxia-inducible factor-1α. Respir Physiol Neurobiol. 2013;185:608-614. [PubMed] [DOI] |
| 13. | Rymsa B, Wang JF, de Groot H. O2-. release by activated Kupffer cells upon hypoxia-reoxygenation. Am J Physiol. 1991;261:G602-G607. [PubMed] [DOI] |
| 14. | Rosenkranz AR, Schmaldienst S, Stuhlmeier KM, Chen W, Knapp W, Zlabinger GJ. A microplate assay for the detection of oxidative products using 2',7'-dichlorofluorescin-diacetate. J Immunol Methods. 1992;156:39-45. [PubMed] [DOI] |
| 15. | Sun X, Ai M, Wang Y, Shen S, Gu Y, Jin Y, Zhou Z, Long Y, Yu Q. Selective induction of tumor cell apoptosis by a novel P450-mediated reactive oxygen species (ROS) inducer methyl 3-(4-nitrophenyl) propiolate. J Biol Chem. 2013;288:8826-8837. [PubMed] [DOI] |
| 16. | Huang YL, Kou JP, Ma L, Song JX, Yu BY. Possible mechanism of the anti-inflammatory activity of ruscogenin: role of intercellular adhesion molecule-1 and nuclear factor-kappaB. J Pharmacol Sci. 2008;108:198-205. [PubMed] [DOI] |
| 17. | Zhang N, Xu Y, Zhang Z, Xiong W. A nonradioactive method for detecting DNA-binding activity of nuclear transcription factors. J Huazhong Univ Sci Technolog Med Sci. 2003;23:227-229. [PubMed] [DOI] |
| 18. | Wang H, Li ZY, Wu HS, Wang Y, Jiang CF, Zheng QC, Zhang JX. Endogenous danger signals trigger hepatic ischemia/reperfusion injury through toll-like receptor 4/nuclear factor-kappa B pathway. Chin Med J (Engl). 2007;120:509-514. [PubMed] [DOI] |
| 19. | Chiu CJ, McArdle AH, Brown R, Scott HJ, Gurd FN. Intestinal mucosal lesion in low-flow states. I. A morphological, hemodynamic, and metabolic reappraisal. Arch Surg. 1970;101:478-483. [PubMed] [DOI] |
| 20. | 薛 小军, 张 文华, 周 松, 李 冉冉, 张 行健, 陈 文有, 陈 达丰, 邹 耀祥. 伤后早期应用乌司他丁对海水浸泡兔腹部开放伤的干预效果. 解放军医学杂志. 2013;25:35-38. |
| 25. | 周 松, 张 文华, 李 冉冉, 张 行健, 薛 小军, 陈 文有, 陈 达丰, 邹 耀祥. 乌司他丁联合血必净对海水浸泡腹腔开放伤兔血流动力学的影响. 西南国防医药杂志. 2012;23:236-239. |
| 27. | Kanai T, Ishiwata T, Kobayashi T, Sato H, Takizawa M, Kawamura Y, Tsujimoto H, Nakatani K, Ishibashi N, Nishiyama M. Ulinastatin, a urinary trypsin inhibitor, for the initial treatment of patients with Kawasaki disease: a retrospective study. Circulation. 2011;124:2822-2828. [PubMed] [DOI] |
| 28. | Inoue K, Takano H, Shimada A, Yanagisawa R, Sakurai M, Yoshino S, Sato H, Yoshikawa T. Urinary trypsin inhibitor protects against systemic inflammation induced by lipopolysaccharide. Mol Pharmacol. 2005;67:673-680. [PubMed] [DOI] |
| 29. | Tanaka R, Fujita M, Tsuruta R, Fujimoto K, Aki HS, Kumagai K, Aoki T, Kobayashi A, Izumi T, Kasaoka S. Urinary trypsin inhibitor suppresses excessive generation of superoxide anion radical, systemic inflammation, oxidative stress, and endothelial injury in endotoxemic rats. Inflamm Res. 2010;59:597-606. [PubMed] [DOI] |
| 30. | Cao YZ, Tu YY, Chen X, Wang BL, Zhong YX, Liu MH. Protective effect of Ulinastatin against murine models of sepsis: inhibition of TNF-α and IL-6 and augmentation of IL-10 and IL-13. Exp Toxicol Pathol. 2012;64:543-547. [PubMed] [DOI] |
| 31. | Huang N, Wang F, Wang Y, Hou J, Li J, Deng X. Ulinastatin improves survival of septic mice by suppressing inflammatory response and lymphocyte apoptosis. J Surg Res. 2013;182:296-302. [PubMed] [DOI] |
| 32. | Rui M, Duan YY, Zhang XH, Wang HL, Wang DP. Urinary trypsin inhibitor attenuates seawater-induced acute lung injury by influencing the activities of nuclear factor-ĸB and its related inflammatory mediators. Respiration. 2012;83:335-343. [PubMed] [DOI] |
| 33. | Okuhama Y, Shiraishi M, Higa T, Tomori H, Taira K, Mamadi T, Muto Y. Protective effects of ulinastatin against ischemia-reperfusion injury. J Surg Res. 1999;82:34-42. [PubMed] [DOI] |
| 34. | 徐 伟松, 范 辉, 刘 玉峰, 王 一平, 李 振东. 血必净对急性胰腺炎大鼠血清中TNF-α、IL-1β和IL-6浓度的影响. 世界华人消化杂志. 2012;20:2777-2781. [DOI] |
| 35. | Qi F, Liang ZX, She DY, Yan GT, Chen LA. A clinical study on the effects and mechanism of xuebijing injection in severe pneumonia patients. J Tradit Chin Med. 2011;31:46-49. [PubMed] [DOI] |
| 36. | Wang YB, Wang Q, Yao YM, Sheng ZY, Liu YF. Effect of Xuebijing injection on systemic lupus erythematosus in mice. Chin J Integr Med. 2013;19:675-682. [PubMed] [DOI] |
| 37. | Jiang M, Zhou M, Han Y, Xing L, Zhao H, Dong L, Bai G, Luo G. Identification of NF-κB Inhibitors in Xuebijing injection for sepsis treatment based on bioactivity-integrated UPLC-Q/TOF. J Ethnopharmacol. 2013;147:426-433. [PubMed] [DOI] |
| 38. | Sun J, Xue Q, Guo L, Cui L, Wang J. Xuebijing protects against lipopolysaccharide-induced lung injury in rabbits. Exp Lung Res. 2010;36:211-218. [PubMed] [DOI] |
| 39. | He XD, Wang Y, Wu Q, Wang HX, Chen ZD, Zheng RS, Wang ZS, Wang JB, Yang Y. Xuebijing Protects Rats from Sepsis Challenged with Acinetobacter baumannii by Promoting Annexin A1 Expression and Inhibiting Proinflammatory Cytokines Secretion. Evid Based Complement Alternat Med. 2013;2013:804940. [PubMed] [DOI] |
| 41. | Lima PR, de Melo TS, Carvalho KM, de Oliveira ÍB, Arruda BR, de Castro Brito GA, Rao VS, Santos FA. 1,8-cineole (eucalyptol) ameliorates cerulein-induced acute pancreatitis via modulation of cytokines, oxidative stress and NF-κB activity in mice. Life Sci. 2013;92:1195-1201. [PubMed] [DOI] |
| 42. | Song WB, Wang YY, Meng FS, Zhang QH, Zeng JY, Xiao LP, Yu XP, Peng DD, Su L, Xiao B. Curcumin protects intestinal mucosal barrier function of rat enteritis via activation of MKP-1 and attenuation of p38 and NF-κB activation. PLoS One. 2010;5:e12969. [PubMed] [DOI] |
| 43. | 韩 志海, 虞 积耀, 胡 明, 王 宇, 王 大鹏, 姜 涛. 实时荧光定量PCR分析海水浸泡伤大鼠小肠组织NF-κB及上游受体TLR4 mRNA的表达. 第二军医大报. 2011;32:688-691. |
| 44. | 虞 积耀, 韩 志海, 王 宇. 海水浸泡对大鼠小肠组织NF-κB, IκBα表达的影响. 中华航海医学与高气压医学杂志. 2009;16:79-81. |
| 45. | Hoesel B, Schmid JA. The complexity of NF-κB signaling in inflammation and cancer. Mol Cancer. 2013;12:86. [PubMed] [DOI] |
| 46. | Tak PP, Firestein GS. NF-kappaB: a key role in inflammatory diseases. J Clin Invest. 2001;107:7-11. [PubMed] [DOI] |
| 47. | Baldwin AS. The NF-kappa B and I kappa B proteins: new discoveries and insights. Annu Rev Immunol. 1996;14:649-683. [PubMed] [DOI] |
| 48. | Schottelius AJ, Baldwin AS. A role for transcription factor NF-kappa B in intestinal inflammation. Int J Colorectal Dis. 1999;14:18-28. [PubMed] [DOI] |
| 49. | Hayden MS, Ghosh S. Shared principles in NF-kappaB signaling. Cell. 2008;132:344-362. [PubMed] [DOI] |
| 50. | Pasparakis M, Luedde T, Schmidt-Supprian M. Dissection of the NF-kappaB signalling cascade in transgenic and knockout mice. Cell Death Differ. 2006;13:861-872. [PubMed] [DOI] |