修回日期: 2013-12-29
接受日期: 2014-01-10
在线出版日期: 2014-03-08
目的: 研究阿螺旋霉素[17-(dimethylaminoethylamino)-17-demethoxygeldanamycin hydrochloride, 17-DMAG]在葡聚糖硫酸钠(dextran sulphate sodium, DSS)诱导的小鼠溃疡性结肠炎治疗中的作用.
方法: C57BL/6小鼠随机分为正常对照组、DSS模型组、磷酸盐缓冲液(phosphate buffer, PBS)治疗组以及17-DMAG治疗组. 采用3%DSS连续饮入以复制溃疡性结肠炎小鼠模型. 对结肠炎模型小鼠每日腹腔注射17-DMAG[10 mg/(kg•d)]或同体积PBS. 观察小鼠体质量、疾病活动度、单位长度结肠质量、结肠病理损伤程度及结肠上皮细胞凋亡情况, 以评价17-DMAG对小鼠溃疡性结肠炎病程发展的影响.
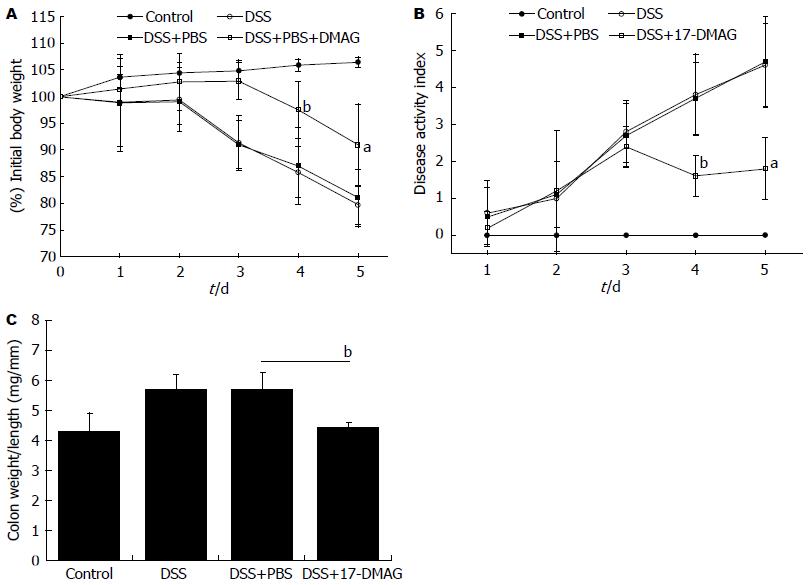
结果: 3%DSS连续饮入5 d后, 模型组小鼠较正常对照组小鼠体质量减轻, 疾病活动度、单位肠道结肠重量、结肠病理评分及结肠上皮细胞凋亡增加. 与PBS治疗组相比, 17-DMAG治疗5 d后, 结肠炎小鼠体质量降低程度(90.9%±7.78% vs 81%±5.44%, P<0.05)及疾病活动度显著改善(1.8±0.84 vs 4.7±1.21, P<0.05), 单位长度结肠质量(4.43 mg/mm±0.16 mg/mm vs 5.71 mg/mm±0.56 mg/mm, P<0.01)及结肠病理评分降低(4.6±1.30 vs 7.4±0.30, P<0.01), 结肠上皮细胞凋亡数目(33.2±5.50 vs 62.6±9.81, P<0.01)显著减少.
结论: 17-DMAG可减轻DSS诱导的小鼠溃疡性结肠炎, 其可能通过抑制结肠上皮细胞的凋亡而发挥作用.
核心提示: 热休克蛋白90(heat shock protein 90, HSP90)参与了溃疡性结肠炎的发病过程.本研究采用经腹腔给予水溶性HSP90分子抑制剂阿螺旋霉素[17-(dimethylaminoethylamino)-17-demethoxygeldanamycin hydrochloride, 17-DMAG]的方法, 观察到溃疡性结肠炎小鼠结肠组织损伤显著减轻. 证实17-DMAG可抑制DSS诱导的结肠炎, 其可能通过抑制结肠上皮细胞的凋亡而发挥作用.
引文著录: 吴琳, 汪芳裕, 路又可, 刘炯, 陆恒, 刘畅, 陈春燕, 李楠, 陶慧. 阿螺旋霉素在急性小鼠溃疡性结肠炎模型中的保护性作用. 世界华人消化杂志 2014; 22(7): 975-981
Revised: December 29, 2013
Accepted: January 10, 2014
Published online: March 8, 2014
AIM: To investigate the potential effect of alvespimycin [17-(dimethylaminoethylamino)-17-demethoxygeldanamycin hydrochloride, 17-DMAG)], a novel water soluble heat shock protein 90 (HSP90) inhibitor, in the treatment of dextran sulphate sodium (DSS) induced murine ulcerative colitis.
METHODS: C57BL/6 mice were randomly assigned to a normal control group, a colitis model group, a PBS treatment group and a 17-DMAG treatment group. Phosphate buffered solution (PBS) or 17-DMAG was given daily by intraperitoneal injection. Acute ulcerative colitis was induced by administering ad libitum 3%DSS in the drinking water for 5 days. Body weight, diarrhea and bleeding scores were determined daily to calculate the disease activity index. Five days later, the mice were sacrificed and colon tissues were collected. Colon length and weight, histological score of colon injury, and apoptotic index of colon epithelial cells were detected to assess the effects of 17-DMAG on the development of DSS induced colitis.
RESULTS: Mice receiving 3% DSS showed significantly reduced body weight, increased disease activity index, colon weight/length ratio, histological score and apoptotic index of colon epithelial cells, compared with controls. Compared with colitis mice treated with PBS, daily intraperitoneal injection of 17-DMAG for 5 d significantly ameliorated body weight loss (90.9 ± 7.78 vs 81 ± 5.44, P < 0.05), significantly decreased disease activity index (1.8 ± 0.84 vs 4.7 ± 1.21, P < 0.05), colon length and weight (4.43 mg/mL ± 0.16 mg/mL vs 5.71 mg/mL ± 0.56 mg/mL, P < 0.01), and histological score (4.6 ± 1.30 vs 7.4 ± 0.30, P < 0.01). Most importantly, 17-DMAG treated mice showed obviously decreased apoptotic index of colon epithelial cells (33.2 ± 5.50 vs 62.6 ± 9.81, P < 0.01) than PBS treated mice.
CONCLUSION: Daily intraperitoneal injection of 17-DMAG attenuated DSS induced acute murine ulcerative colitis possibly by inhibiting apoptosis of colon epithelial cells.
- Citation: Wu L, Wang FY, Lu YK, Liu J, Lu H, Liu C, Chen CY, Li N, Tao H. 17-DMAG protects mice from dextran sulphate sodium induced acute ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2014; 22(7): 975-981
- URL: https://www.wjgnet.com/1009-3079/full/v22/i7/975.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i7.975
炎症性肠病(inflammatory bowel disease, IBD)是一种常见的肠道慢性病, 包括克罗恩病和溃疡性结肠炎. 临床上常表现为腹痛、腹泻、便血等症状[1]. 结肠上皮细胞作为与肠道微生物接触的第一道屏障, 其异常凋亡可能是IBD发病的关键因素[2]. 热休克蛋白90(heat shock protein 90, HSP90)是一种定位于胞浆的分子伴侣蛋白[3], 其在炎症[4]、肿瘤细胞凋亡[5]等病理生理过程中具有重要作用. 在IBD患者[6]及结肠炎小鼠[7]的肠黏膜中, HSP90表达显著升高, 且在治疗后相应降低, 提示该蛋白可能参与了IBD的发病过程, 但具体机制尚不明确. 阿螺旋霉素[17-(dimethylaminoethylamino)-17-demethoxygeldanamycin hydrochloride, 17-DMAG]是一种新型的水溶性HSP90抑制剂, 体内外研究显示其可有效抑制HSP90功能[8], 从而在急性肺损伤[9]、肝损伤[10]及肿瘤[11]等疾病中发挥治疗作用. 其对IBD病程发生、发展的影响目前尚不明确.
♂10-12周龄C57BL/6小鼠, 体质量20 g ± 2 g, 购自上海斯莱克实验动物有限责任公司; 葡聚糖硫酸钠(dextran sulphate sodium, DSS), 分子量36000-50000 Da购自Millipore公司; 17-DMAG购自Selleck公司; 粪便隐血检测试剂盒购自珠海贝索生物技术有限公司; TUNEL试剂盒购自Roche公司.
1.2.1 DSS诱导的结肠炎小鼠模型复制: 小鼠称质量及标记后, 随机分为: 正常对照组、DSS组、DSS+PBS治疗组、DSS+17-DMAG治疗组, 每组5只. 按照文献[12]的方法, 将15 g DSS粉末溶于500 mL饮用水, 配制成3%DSS溶液, 4 ℃保存, 每3 d更换1次. 正常对照组饮入饮用水, 模型组小鼠自由饮入3%DSS溶液. 将25 mg 17-DMAG粉末溶于25 mL PBS中配制成1 mg/mL溶液, 分装后-20 ℃保存. 造模后次日作为第1天, 治疗组造模后当天至第5天每天腹腔注射1次17-DMAG溶液(10 mg/kg), DSS+PBS组予以腹腔注射同等体积PBS.
1.2.2 模型评价: 每天记录小鼠体质量. 采集小鼠新鲜粪便, 按照文献[12]的方法对粪便进行评分. 具体评分标准由粪便黏稠度及便血组成, 每项最高3分, 总分范围在0-6分之间. 造模后第5天, 将小鼠颈椎脱臼处死. 取结肠组织, 用PBS将肠内容物冲洗干净后吸干水分. 记录结肠重量及总长度. 取结肠中段长约0.5 cm组织, 浸泡于4%多聚甲醛中固定24 h.
1.2.3 苏木精-伊红(HE)染色及病理评分: 固定好的组织精脱水、包埋、切片后, 对切片进行HE染色. 在高倍镜下(×400), 对切片随机挑选5个视野进行拍照. 按照文献[13]的方法进行病理评分. 其具体评分由黏膜破坏和炎症细胞浸润两部分组成, 每项最高4分, 总分范围在0-8分之间.
1.2.4 结肠上皮细胞凋亡检测: 采用末端脱氧核苷酸转移酶介导的dUTP缺口末端标记测定法(TUNEL法)评价结肠上皮细胞凋亡情况. 将石蜡包埋的结肠组织经切片、脱蜡、浸水. 将切片置入孵育液中(0.1%Triton X-100, 0.1%sodium citrate)25 ℃ 8 min. 然后将切片进入TUNEL反应混合液中孵育, 37 ℃ 60 min. 40倍光镜下, 随机选择5个视野并计数隐窝中100个结肠上皮细胞, 记录凋亡细胞数. 计算细胞凋亡指数 = (凋亡细胞数/100)×100%
统计学处理 应用SPSS13.0软件进行数据处理, 数据均以mean±SD表示, 多组间均数的比较采用One-way ANOVA检验, 再用Bonferroni检验进行组间比较. P<0.05为差异有统计学意义. P<0.01为差异具有显著统计学意义.
小鼠饮入3%DSS 2 d后出现大便变稀, 第3天开始出现体质量减轻, 大便隐血阳性, 第5天出现便血. 17-DMAG组结肠炎小鼠体质量减轻程度轻于PBS治疗组(图1A), 治疗后第3天起, 疾病活动指数显著低于PBS治疗组(图1B). 造模后第5天, 处死小鼠并收集结肠组织测量后发现, 17-DMAG组小鼠单位长度结肠组织重量显著低于PBS治疗组(图1C).
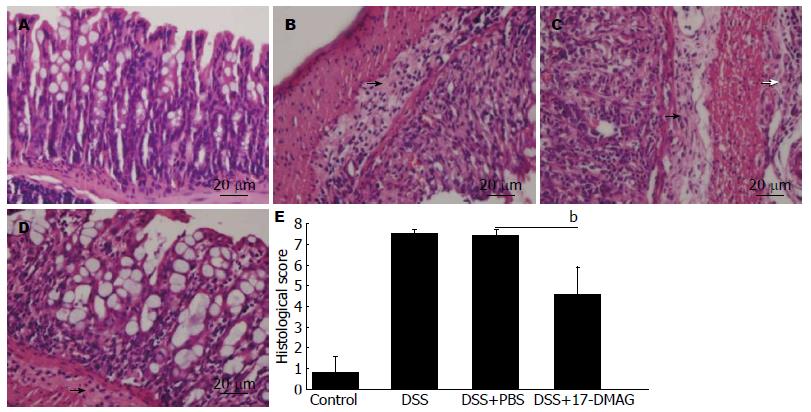
小鼠结肠组织HE染色结果发现, 正常对照组小鼠结肠黏膜完好, 隐窝结构存在, 黏膜下层无水肿(图2A); DSS组小鼠可见结肠大部分黏膜全层被炎症细胞浸润, 导致隐窝结构消失, 黏膜下明显水肿伴大量炎症细胞浸润. 部分切片可见炎症细胞浸润至肌层甚至浆膜下层(图2B). 每日腹腔注入PBS对结肠炎症无明显改善(图2C). 而每日腹腔注入10 mg/mL 17-DMAG治疗的结肠炎小鼠, 结肠黏膜尚可见残存的隐窝及其上的结肠上皮细胞(图2D). 病理评分结果显示, DSS组小鼠结肠病理评分(7.5±0.2)显著高于正常对照组(0.80±0.78), 17-DMAG治疗5 d(4.6±1.3)可较PBS治疗组(7.4±0.3)显著降低结肠病理评分(图2E).
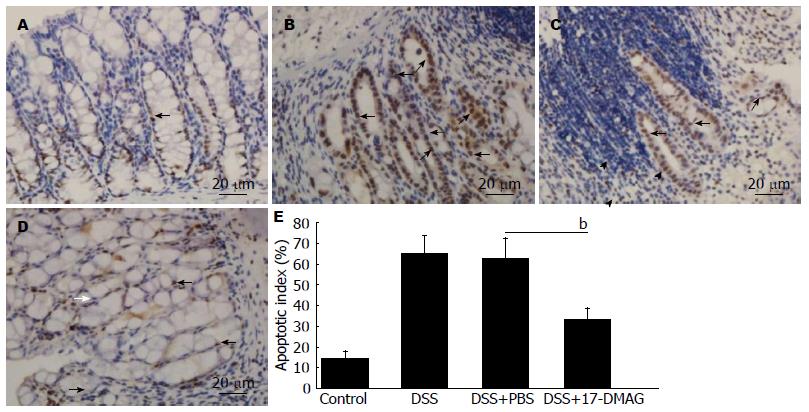
结肠上皮细胞凋亡是IBD病理生理过程的关键环节. 为明确17-DMAG对结肠上皮细胞凋亡的影响, 我们采用TUNEL染色的方法观察各组小鼠结肠上皮细胞凋亡发生情况. 结果显示, 正常对照组小鼠结肠隐窝基底部存在少量细胞凋亡(图3A), DSS饮入后5 d, 正常隐窝结构大部分消失, 在少量残存的隐窝结构中, 可见结肠上皮细胞大量凋亡(图3B). 17-DMAG治疗组结肠黏膜上皮细胞凋亡数目(33.20%±5.50%)较PBS治疗组(62.60%±9.81%)减少(图3C, D), 两者有统计学差异(图3E).
HSP90是一种定位于胞浆的分子伴侣蛋白, 已知其可与激素受体、蛋白激酶及转录因子等200余种蛋白相结合, 在蛋白的转运、成熟等过程中发挥作用[3]. 17-DMAG是格尔德霉素(geldanamycin, GA)的小分子衍生化合物, 是一种新型HSP90抑制剂. 其通过竞争性结合HSP90蛋白N端的ATP结合位点而抑制HSP90的分子伴侣功能[3]. 与GA、17-AAG等需溶于有机溶剂并仅能经静脉输注的HSP90抑制剂相比, 17-DMAG不仅具有水溶性的特点, 而且其经口服生物利用度为50%, 经腹腔注射生物利用度达100%. 静脉注入17-DMAG后, 药物可迅速分布至各个器官中, 半衰期长达24 h. 药物主要通过胆道及尿路以原形排泄, 少量在肝脏中被分解为代谢产物后通过胆道排泄[14]. 这些特点决定了17-DMAG不仅使用方便, 而且药效维持长久. 动物研究中, 小鼠短期使用剂量达75 mg/kg而无明显不良反应, 而大鼠长期使用推荐剂量为12 mg/m2[15]. Ⅰ期临床研究推荐人类长期使用日剂量可达25 mg/m2[16]. 参考现有剂量应用资料[17], 我们采用了10 mg/kg(约4.6 mg/m2)这一剂量. 同时, 参考关于17-DMAG药代学研究结果, 我们采用了经腹腔给药这一安全、方便且能维持预定血药浓度的给药方式.
既往研究显示, 17-AAG[40 mg/(kg•d), 腹腔注射]对DSS诱导的结肠炎具有保护作用[7]. 由于17-AAG必须使用DMSO等有机溶剂溶解, 且不能经胃肠道吸收, 因此极大限制了其可能的临床应用前景. 本研究中, 我们证实水溶性的17-DMAG可抑制DSS诱导的小鼠体质量减轻, 疾病活动度增加、单位长度结肠质量的增加及结肠病理损伤程度, 提示17-DMAG在DSS诱导的小鼠结肠炎的发生、发展过程中发挥了保护性作用. HSP90在肿瘤和炎症性疾病中似乎具有不同的生物学功能. 在肿瘤的发生过程中, 由于高代谢状态的肿瘤细胞合成大量的蛋白, HSP90表达相应上调, 有助于异常表达蛋白的成熟及转运. HSP90抑制剂抑制通过抑制HSP90功能, 使得肿瘤细胞的增殖受限且凋亡增加, 从而起到抗肿瘤作用[18]. 而在炎症性疾病中, 上调的HSP90表达, 可结合热休克因子1等炎症相关的转录因子, 使得炎症因子表达增加[19], 而抑制HSP90功能后, 其靶蛋白如HSF等由于失去HSP90的保护, 转而与泛素酶结合并进而降解, 从而可降低促炎症因子肿瘤坏死因子(tumor necrosis factor-α, TNF-α)、干扰素-γ等的表达[20]. 结肠上皮细胞不仅是结肠吸收水和营养物质的主要细胞, 而且是肠道与肠腔中大量微生物及有毒物质接触的第一道屏障[21]. 越来越多的研究证实, IBD的发生与结肠上皮细胞有着密切关系[22]. 例如, 内质网应激关键调控基因XBP1敲除的结肠上皮细胞, 在应激条件下更易于凋亡. 同时, XBP1基因敲除小鼠可出现自发性肠炎, 且其在DSS诱导后, 结肠病理损伤程度显著高于野生型小鼠, 提示结肠上皮细胞凋亡可促进IBD的发生、发展[23]. 本研究显示17-DMAG治疗组小鼠结肠上皮细胞凋亡水平显著低于PBS对照组, 提示该药物可能是通过抑制上皮细胞的凋亡而在DSS诱导的结肠炎中发挥其保护性作用. 推测一方面, 17-DMAG可通过抑制HSP90, 进而降低TNF-α等死亡受体配体的分泌, 而直接减少结肠黏膜上皮细胞的凋亡[19,24]; 另一方面, 由于HSP90功能的抑制, 其后续的基因转录及蛋白翻译、加工过程可能相应得以抑制, 从而减轻了内质网中由未折叠蛋白反应导致的内质网应激水平升高甚至内质网应激途径诱导的细胞凋亡水平[25], 这还需要进一步研究证实.
由于多项研究均已证实17-DMAG可特异性的抑制HSP90的活性, 故本研究未对此进一步重复. 但是, 鉴于DSS诱导的小鼠溃疡性结肠炎发病过程的复杂性, 众多其他亚型的热休克蛋白及其他炎症蛋白均参与这一过程, 17-DMAG是否也能通过影响这些蛋白分子的功能而发挥在结肠炎中的保护性作用, 值得进一步深入研究.
总之, 本研究发现, 新型的水溶性HSP90分子抑制剂17-DMAG可抑制DSS诱导的结肠炎, 其可能通过抑制结肠上皮细胞的凋亡而发挥作用.
溃疡性结肠炎是一种常见的炎症性肠病. 随着生活方式的西方化, 亚洲人群中该病的发病率近年来逐渐升高. 目前以氨基水杨酸及激素为主的治疗方案, 其疗效尚不让人满意.
杜奕奇, 副教授, 中国人民解放军第二军医大学长海医院
已知热休克蛋白90(heat shock protein 90, HSP90)通过其分子伴侣作用, 在溃疡性结肠炎的发病过程具有促炎症作用. 新型水溶性HSP90抑制剂17-DMAG是否对溃疡性结肠炎发生、发展具有治疗作用, 目前尚未见报道.
HSP90抑制剂17-AAG在溃疡性结肠炎发挥了保护作用, 但该化合物不溶于水, 从而限制了其临床应用前景. 17-DMAG与17-AAG同为格尔德霉素衍生物, 尽管两者均可有效抑制HSP90的生物学活性, 但具有完全不同的物理特性及药代动力学特征.
本文证实17-DMAG可抑制DSS诱导的小鼠溃疡性结肠炎, 其可能通过抑制结肠上皮细胞凋亡而发挥作用.
本文证实HSP90抑制剂17-DMAG在溃疡性结肠炎中的治疗作用, 并初步探索了该药物对结肠上皮细胞凋亡的影响, 为溃疡性结肠炎的治疗策略的制定及深入了解疾病机制提供了新的参考.
本文探讨17-DMAG在溃疡性结肠炎中的治疗作用. 创新性较好, 研究设计严谨, 科学性较强.
编辑: 田滢 电编:鲁亚静
| 1. | Danese S, Fiocchi C. Ulcerative colitis. N Engl J Med. 2011;365:1713-1725. [PubMed] [DOI] |
| 2. | Qiu W, Wu B, Wang X, Buchanan ME, Regueiro MD, Hartman DJ, Schoen RE, Yu J, Zhang L. PUMA-mediated intestinal epithelial apoptosis contributes to ulcerative colitis in humans and mice. J Clin Invest. 2011;121:1722-1732. [PubMed] [DOI] |
| 3. | Li J, Buchner J. Structure, function and regulation of the hsp90 machinery. Biomed J. 2013;36:106-117. [PubMed] [DOI] |
| 4. | Rice JW, Veal JM, Fadden RP, Barabasz AF, Partridge JM, Barta TE, Dubois LG, Huang KH, Mabbett SR, Silinski MA. Small molecule inhibitors of Hsp90 potently affect inflammatory disease pathways and exhibit activity in models of rheumatoid arthritis. Arthritis Rheum. 2008;58:3765-3775. [PubMed] [DOI] |
| 5. | Ayrault O, Godeny MD, Dillon C, Zindy F, Fitzgerald P, Roussel MF, Beere HM. Inhibition of Hsp90 via 17-DMAG induces apoptosis in a p53-dependent manner to prevent medulloblastoma. Proc Natl Acad Sci U S A. 2009;106:17037-17042. [PubMed] [DOI] |
| 6. | Tomasello G, Sciumé C, Rappa F, Rodolico V, Zerilli M, Martorana A, Cicero G, De Luca R, Damiani P, Accardo FM. Hsp10, Hsp70, and Hsp90 immunohistochemical levels change in ulcerative colitis after therapy. Eur J Histochem. 2011;55:e38. [PubMed] [DOI] |
| 7. | Collins CB, Aherne CM, Yeckes A, Pound K, Eltzschig HK, Jedlicka P, de Zoeten EF. Inhibition of N-terminal ATPase on HSP90 attenuates colitis through enhanced Treg function. Mucosal Immunol. 2013;6:960-971. [PubMed] [DOI] |
| 8. | Solit DB, Chiosis G. Development and application of Hsp90 inhibitors. Drug Discov Today. 2008;13:38-43. [PubMed] [DOI] |
| 9. | Chatterjee A, Snead C, Yetik-Anacak G, Antonova G, Zeng J, Catravas JD. Heat shock protein 90 inhibitors attenuate LPS-induced endothelial hyperpermeability. Am J Physiol Lung Cell Mol Physiol. 2008;294:L755-L763. [PubMed] [DOI] |
| 10. | Ambade A, Catalano D, Lim A, Mandrekar P. Inhibition of heat shock protein (molecular weight 90 kDa) attenuates proinflammatory cytokines and prevents lipopolysaccharide-induced liver injury in mice. Hepatology. 2012;55:1585-1595. [PubMed] [DOI] |
| 11. | Jhaveri K, Taldone T, Modi S, Chiosis G. Advances in the clinical development of heat shock protein 90 (Hsp90) inhibitors in cancers. Biochim Biophys Acta. 2012;1823:742-755. [PubMed] [DOI] |
| 12. | Wirtz S, Neufert C, Weigmann B, Neurath MF. Chemically induced mouse models of intestinal inflammation. Nat Protoc. 2007;2:541-546. [PubMed] |
| 14. | Egorin MJ, Lagattuta TF, Hamburger DR, Covey JM, White KD, Musser SM, Eiseman JL. Pharmacokinetics, tissue distribution, and metabolism of 17-(dimethylaminoethylamino)-17-demethoxygeldanamycin (NSC 707545) in CD2F1 mice and Fischer 344 rats. Cancer Chemother Pharmacol. 2002;49:7-19. [PubMed] |
| 15. | Glaze ER, Lambert AL, Smith AC, Page JG, Johnson WD, McCormick DL, Brown AP, Levine BS, Covey JM, Egorin MJ. Preclinical toxicity of a geldanamycin analog, 17-(dimethylaminoethylamino)-17-demethoxygeldanamycin (17-DMAG), in rats and dogs: potential clinical relevance. Cancer Chemother Pharmacol. 2005;56:637-647. [PubMed] |
| 16. | Ramanathan RK, Egorin MJ, Erlichman C, Remick SC, Ramalingam SS, Naret C, Holleran JL, TenEyck CJ, Ivy SP, Belani CP. Phase I pharmacokinetic and pharmacodynamic study of 17-dimethylaminoethylamino-17-demethoxygeldanamycin, an inhibitor of heat-shock protein 90, in patients with advanced solid tumors. J Clin Oncol. 2010;28:1520-1526. [PubMed] |
| 17. | Hertlein E, Wagner AJ, Jones J, Lin TS, Maddocks KJ, Towns WH, Goettl VM, Zhang X, Jarjoura D, Raymond CA. 17-DMAG targets the nuclear factor-kappaB family of proteins to induce apoptosis in chronic lymphocytic leukemia: clinical implications of HSP90 inhibition. Blood. 2010;116:45-53. [PubMed] [DOI] |
| 18. | Zitzmann K, Ailer G, Vlotides G, Spoettl G, Maurer J, Göke B, Beuschlein F, Auernhammer CJ. Potent antitumor activity of the novel HSP90 inhibitors AUY922 and HSP990 in neuroendocrine carcinoid cells. Int J Oncol. 2013;43:1824-1832. [PubMed] [DOI] |
| 19. | Bagatell R, Paine-Murrieta GD, Taylor CW, Pulcini EJ, Akinaga S, Benjamin IJ, Whitesell L. Induction of a heat shock factor 1-dependent stress response alters the cytotoxic activity of hsp90-binding agents. Clin Cancer Res. 2000;6:3312-3318. [PubMed] |
| 20. | Chatterjee A, Dimitropoulou C, Drakopanayiotakis F, Antonova G, Snead C, Cannon J, Venema RC, Catravas JD. Heat shock protein 90 inhibitors prolong survival, attenuate inflammation, and reduce lung injury in murine sepsis. Am J Respir Crit Care Med. 2007;176:667-675. [PubMed] |
| 21. | Cucchiara S, Stronati L, Aloi M. Interactions between intestinal microbiota and innate immune system in pediatric inflammatory bowel disease. J Clin Gastroenterol. 2012;46 Suppl:S64-S66. [PubMed] [DOI] |
| 22. | Jostins L, Ripke S, Weersma RK, Duerr RH, McGovern DP, Hui KY, Lee JC, Schumm LP, Sharma Y, Anderson CA. Host-microbe interactions have shaped the genetic architecture of inflammatory bowel disease. Nature. 2012;491:119-124. [PubMed] [DOI] |
| 23. | Kaser A, Lee AH, Franke A, Glickman JN, Zeissig S, Tilg H, Nieuwenhuis EE, Higgins DE, Schreiber S, Glimcher LH. XBP1 links ER stress to intestinal inflammation and confers genetic risk for human inflammatory bowel disease. Cell. 2008;134:743-756. [PubMed] [DOI] |
| 24. | Edelblum KL, Yan F, Yamaoka T, Polk DB. Regulation of apoptosis during homeostasis and disease in the intestinal epithelium. Inflamm Bowel Dis. 2006;12:413-424. [PubMed] |
| 25. | Kaser A, Blumberg RS. Autophagy, microbial sensing, endoplasmic reticulum stress, and epithelial function in inflammatory bowel disease. Gastroenterology. 2011;140:1738-1747. [PubMed] [DOI] |