修回日期: 2014-02-02
接受日期: 2014-02-18
在线出版日期: 2014-03-08
目的: 研究幽门螺杆菌(Helicobacter pylori, H. pylori)对人肝正常细胞L-02(human normal liver cell line-02)的作用及转化生长因子β受体Ⅰ(transforming growth factor-beta typeⅠ, TβRⅠ)基因表达的影响.
方法: 体外培养L-02细胞、H. pylori; PCR法鉴定CagA+H. pylori和CagA-H. pylori, 采用不同浓度的CagA+H. pylori和CagA-H. pylori作用于L-02细胞24 h, 并设不加H. pylori的L-02细胞为阴性对照组; MTT法检测L-02细胞抑制率, 通过Real-time PCR法检测各组TβRⅠ基因的表达.
结果: MTT法结果显示, 随着CagA+H. pylori、CagA-H. pylori浓度升高, 对L-02细胞的抑制作用增强, 与阴性对照组相比, 差别均有统计学意义(P<0.05); 在同一浓度, CagA+H. pylori对细胞的抑制作用较CagA-H. pylori明显, 两组抑制率(%)分别为101 CFU/mL组10.960±0.231 vs 4.470±0.289; 102 CFU/mL组 25.310±0.398 vs 5.510±0.168; 103 CFU/mL组33.130±0.312 vs 10.330±0.213; 104 CFU/mL组54.570±0.245 vs 17.12±0.309; 105 CFU/mL组79.450±0.402 vs 25.830±0.337; 106 CFU/mL组90.210±0.271 vs 32.350±0.178, 各组比较均P<0.05; Real-time PCR法检测中, 随着CagA+H. pylori、CagA-H. pylori浓度升高, TβRⅠ表达逐渐升高, 在同一浓度, CagA+H. pylori促TβRⅠ表达作用较CagA-H. pylori明显, 两组TβRⅠ相对表达量分别为101 CFU/mL组1.650±0.101 vs 1.110±0.110; 102 CFU/mL组2.770±0.198 vs 1.200±0.203; 103 CFU/mL组4.590±0.112 vs 1.590±0.134; 104 CFU/mL组5.470±0.145 vs 1.990±0.331; 105 CFU/mL组7.450±0.102 vs 2.650±0.268; 106 CFU/mL组8.570±0.221 vs 4.570±0.161, 各组比较均P<0.05.
结论: H. pylori对人肝正常细胞L-02细胞具有抑制作用并与浓度相关, 菌液浓度越高, 抑制细胞增殖作用明显, CagA+H. pylori的抑制作用比CagA-H. pylori强. H. pylori对L-02细胞作用后TβRⅠ基因表达增高并与浓度相关, CagA+H. pylori的影响比CagA-H. pylori大. H. pylori对L-02细胞抑制作用的可能机制是通过TβRⅠ基因表达改变干扰转化生长因子-β1/Smads信号通路传导而影响其生长.
核心提示: 现代分子生物学研究发现转化生长因子β(transforming growth factor beta, TGF-β)/Smads信号通路在肝纤维化、肝炎、肝硬化、肝癌等过程中扮演着重要角色, 是目前分子生物学研究的热点之一. 本文研究发现幽门螺杆菌可通过调节转化生长因子β受体Ⅰ(transforming growth factor-beta typeⅠ, TβRⅠ)基因表达干扰TGF-β1/Smads信号通路传导可能是其抑制L-02细胞生长的分子机制之一.
引文著录: 刘丽, 黄赞松, 黄衍强, 周喜汉. H. pylori对人肝正常细胞L-02的作用及其分子机制. 世界华人消化杂志 2014; 22(7): 956-962
Revised: February 2, 2014
Accepted: February 18, 2014
Published online: March 8, 2014
AIM: To investigate the effect of Helicobacter pylori (H. pylori) infection on the growth of human normal liver cell line-02 (L-02) and the possible mechanisms involved.
METHODS: L-02 cells and H. pylori strains were cultured in vitro. CagA+ and CagA-H. pylori strains were identified by PCR. After L-02 cells were incubated with different densities of CagA+ and CagA-H. pylori strains for 24 h, MTT assay was used to detect the inhibition rate of L-02 cells, and the expression of transforming growth factor-beta typeⅠ(TβRⅠ) in L-02 cells was detected by real-time PCR. Cells without H. pylori infection were used as a negative control group.
RESULTS: Both CagA+ and CagA-H. pylori strains significantly inhibited L-02 cell growth in a dose-dependent manner compared with the control group (P < 0.05). At the same concentration, CagA+H. pylori strain had a more significant inhibitory effect on L-02 cell growth than CagA+H. pylori strain (101 CFU/mL: 10.96 ± 0.231 vs 4.47 ± 0.289; 102 CFU/mL: 25.31 ± 0.398 vs 5.51 ± 0.168; 103 CFU/mL: 33.13 ± 0.312 vs 10.33 ± 0.213; 104 CFU/mL: 54.57 ± 0.245 vs 17.12 ± 0.309; 105 CFU/mL: 79.45 ± 0.402 vs 25.83 ± 0.337; 106 CFU/mL: 90.21 ± 0.271 vs 32.35 ± 0.178; P< 0.05 for all). Both CagA+ and CagA-H. pylori strains significantly increased the expression of TβRⅠin a dose-dependent manner compared with the control group. At the same concentration, CagA+H. pylori strain increased the expression of TβRⅠmore significantly than CagA-H. pylori strain (101 CFU/mL: 1.65 ± 0.101 vs 1.11 ± 0.110; 102 CFU/mL: 2.77 ± 0.198 vs 1.20 ± 0.203; 103 CFU/mL: 4.59 ± 0.112 vs 1.59 ± 0.134; 104 CFU/mL: 5.47 ± 0.145 vs 1.99 ± 0.331; 105 CFU/mL: 7.45 ± 0.102 vs 2.65 ± 0.268; 106 CFU/mL: 8.57 ± 0.221 vs 4.57 ± 0.161; P< 0.05 for all).
CONCLUSION: H. pylori infection inhibits the growth of L-02 cells in a dose-dependent manner, and the inhibitory effect of CagA+H. pylori strain was stronger than that of CagA-H. pylori strain. H. pylori infection increases the expression of TβRⅠin L-02 cells in a dose-dependent manner, and CagA+H. pylori strain increases the expression of TβRⅠmore significantly. These findings suggest that H. pylori strain inhibits L-02 cell proliferation possibly by altering the expression of TβRⅠand disturbing the TGF-β1/Smad signal transduction pathway.
- Citation: Liu L, Huang ZS, Huang YQ, Zhou XH. Effect of Helicobacter pylori infection on growth of normal human liver cells (L-02). Shijie Huaren Xiaohua Zazhi 2014; 22(7): 956-962
- URL: https://www.wjgnet.com/1009-3079/full/v22/i7/956.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i7.956
幽门螺杆菌(Helicobacter pylori, H. pylori)有多种致病因子, 其中特征性致病因子细胞毒素相关基因A(cytotoxin-associated gene A, CagA)是其致病机制研究热点, 研究表明低浓度CagA+H. pylori可促进肿瘤细胞增殖, 高浓度时则起抑制作用[1], 新近的研究发现H. pylori与肝癌有相关性[2-6], 是目前研究热点之一, 但具体机制未明.
转化生长因子β(transforming growth factor beta, TGF-β)/Smads信号通路广泛参与哺乳动物的各种病理生理过程, 转化生长因子β受体Ⅰ(transforming growth factor-beta typeⅠ, TβRⅠ)作为TGF-β信号通路所必须的受体, 在TGF-β信号传导、生物学效应等方面起重要作用.
我们的实验研究(另文报道)发现低浓度CagA+H. pylori具有促进肝癌细胞HepG2生长的作用, 高浓度CagA+H. pylori细胞毒明显, 对HepG2细胞则具有较强的细胞杀伤作用. 目前关于H. pylori对人肝正常细胞L-02细胞的作用及作用分子机制研究较少, 本实验采用不同浓度CagA+H. pylori、CagA-H. pylori感染人肝正常细胞L-02细胞后观察两者对细胞增殖的影响, 并采用RT-PCR技术检测TβRⅠ mRNA表达水平, 探讨H. pylori对正常肝细胞的作用及其作用的可能分子机制, 为进一步研究H. pylori与TGF-β/Smads信号通路对肝细胞的作用提供实验依据.
人正常肝细胞株L-02细胞购自中科院上海细胞库, 并由本实验中心传代、保存[7]. 选择2012-02/2012-06在右江民族医学院附属医院胃镜室行胃镜检查并经病理诊断为胃癌、胃溃疡、胃炎患者共45例, 用胃镜活检钳采集患者胃黏膜, 进行H. pylori培养, 菌株经H. pylori快速诊断实验、过氧化氢酶实验和尿素酶实验进行鉴定[8]. 改良型1640培养基(Hyclone公司), PBS缓冲液、胰酶(含0.25%EDTA)四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)(北京索莱宝科技有限公司), 胎牛血清(FBS, 美国GIBICO公司), CagA+基因[8]、内参β-actin基因引物(Invitrogen公司合成), TβRⅠ基因引物(宝生物工程有限公司设计合成)(表1), TRIzol试剂(Invitrogen公司), Prime Script RT reagent Kit With gDNA Eraser (Perfect Real Time)(RR047A)逆转录试剂盒(TaKaRa公司), Super Real PreMix Plus(SYBR Green)(FP205-02)荧光定量预混试剂增强版试剂盒(TianGen公司). CO2恒温培养箱MCO-18AIC(日本 SANYO), 倒置显微镜(德国Leica)普通PCR仪(BIO-RAD), Real-time PCR IQ5(BIO-RAD), 紫外分光光度仪(BIO-RAD).
| 基因 | 引物序列 | 扩增长度(bp) |
| CagA+ | 上游5'-ATAATGCTAAATAGACAACTTGAGCGA-3' | 297 |
| 下游5'-TTAGAATAATCAACAAACATCACGCCAT-3' | ||
| TβR I | 上游5'-GCAGTAAGACATGATTCAGCCACAG-3' | 190 |
| 下游5'-CAATGGAACATCGTCGAGCAA-3' | ||
| β-actin | 上游5'-AAAAGCCACCCCACTTCTCT-3' | 221 |
| 下游5'-GACCAAAAGCCTTCATACATCTCA-3' |
1.2.1 细胞培养: L-02细胞培养于含10%FBS的改良型1640培养基(以下简称培养液)中, 置于饱和湿度、37 ℃、5%CO2培养箱中培养, 2-3 d更换培养液1次, 胰酶(含0.25%EDTA)消化, 常规传代, 取对数生长期细胞进行实验.
1.2.2 细菌鉴定、培养及菌液制备: 参照文献[8]鉴定CagA+H. pylori和CagA-H. pylori, 分别培养后收集细菌, 用PBS缓冲液洗下菌落, 紫外分光光度仪检测细菌浓度, 用培养液将菌液稀释为1.0×106 CFU/mL, 并做连续5次10倍稀释, 即1.0×105、1.0×104、1.0×103、1.0×102、1.0×101 CFU/mL.
1.2.3 MTT法检测细胞增殖抑制率: 取5×103个细胞接种于96孔板, 培养24 h后换无血清的培养液同步化处理24 h, 加入制备好的不同浓度菌液, 并设空白对照组(加等量培养液)及阴性对照组(有细胞、培养液、无菌液), 每组5个复孔, 培养24 h后, 加20 µL的5 mg/mL MTT, 继续培养4 h后弃含菌液, 加150 µL DMSO, 37 ℃恒温震荡10 min, 待结晶完全溶解, 在酶标仪上测定490 nm波长吸光度(absorbance, A)值, 取平均值. 计算细胞增殖抑制率. 公式: 细胞抑制率(inhibition rate, RI) = (对照组A值-实验组A值)/对照组A值×100%.
1.2.4 细菌与细胞共孵育: 调整L-02细胞浓度为1×106个/mL, 接种到50 mL的细胞培养瓶里, 使细胞分布均匀, 置于饱和湿度、37 ℃、5%CO2培养箱中培养24 h后, 弃去原培养液, 各加入配备好的不同浓度上述菌液, 每个浓度重复3次, 作用时间为24 h. 阴性对照组不加细菌, 只加等量培养液.
1.2.5 细胞总RNA提取及逆转录反应: 采用TRIzol试剂提取细胞总RNA, 取检验合格的RNA进行逆转录反应. 按PrimeScript RT reagent Kit With gDNA Eraser (Perfect Real Time)(RR047A)逆转录试剂盒说明制备cDNA.
1.2.6 Real-time PCR法扩增TβRⅠ基因: 以cDNA为模板, β-actin为内参对照进行Real-time PCR扩增. TβRⅠ基因、β-actin基因引物如表1. 反应体系如下: 2×SuperReal PreMix Plus 12.5 µL, 上、下游引物(浓度10 µmol/L)各0.75 µL, cDNA(稀释4倍)1 µL, 50×ROX Reference Dye 1 µL, RNase Free dH2O 9 µL, 总体系25 µL. 反应条件: 预变性95 ℃ 15 min 1个反应循环, 95 ℃ 10 s, 53.9 ℃ 30 s共40个反应循环, 55 ℃-95 ℃ 30 s共81个反应循环, PCR扩增结束后, 分析仪即显示标准曲线、扩增曲线和熔解曲线. 按公式: 扩增倍数 = 2-∆∆Ct, 计算扩增倍数. 每次反应均设置空白对照.
统计学处理 采用SPSS17.0统计软件对数据进行分析处理; 各组计量资料数据用mean±SD表示, 两组均数比较采用t检验, 多组均数间比较采用单因素方差分析(one-way ANOVA)、两两比较采用SNK法, P<0.05为差异有统计学意义.
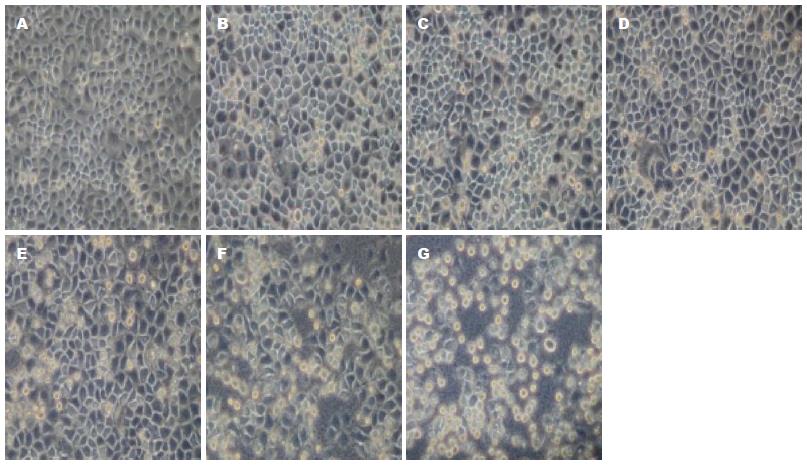
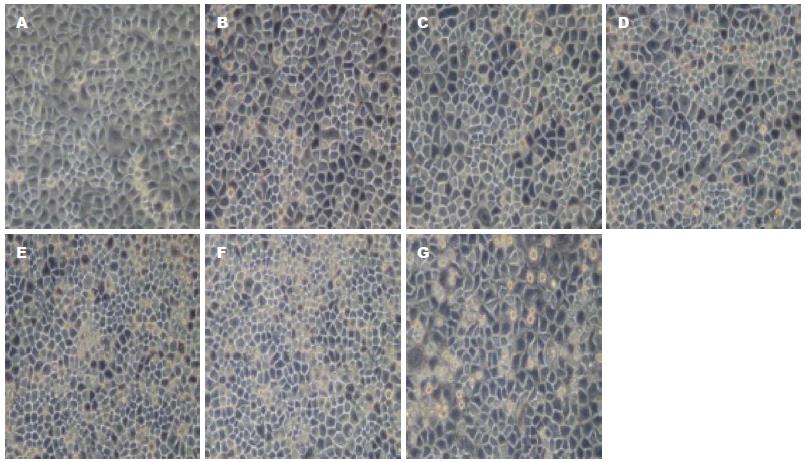
正常情况下, L-02细胞在倒置显微镜下观察呈多边形, 贴壁生长, 轮廓清晰, 生长旺盛, 偶见漂浮细胞. 不同浓度的CagA+H. pylori菌液作用于L-02细胞24 h后, L-02细胞从贴壁的多边形逐渐变为圆形, 折光性减弱, 随着菌液浓度升高, 细胞从瓶壁上脱落, 贴壁细胞逐渐减少, 悬浮细胞增多, 并在细胞周围出现细胞碎片, 细胞形态学的改变与菌液浓度呈正相关(图1). CagA- H. pylori作用下的L-02细胞有类似形态改变, 在同一浓度, CagA-H. pylori的作用比CagA+H. pylori轻(图2).
H. pylori对L-02细胞增殖的抑制作用呈浓度依赖, 随着CagA+H. pylori、CagA-H. pylori浓度升高, 对L-02细胞的抑制作用增强, 各组与对照组相比, 差别均有统计学意义(P<0.05); 在同一浓度, CagA+H. pylori对细胞的抑制作用较CagA-H. pylori强, 各组相比差别均有统计学意义(P<0.05)(表2).
| 菌液浓度(CFU/mL) | CagA+H. pylori | CagA-H. pylori | ||
| 抑制率(%) | TβR I相对表达量 | 抑制率(%) | TβR I相对表达量 | |
| 对照组 | 0.000±0.000 | 1.000±0.000 | 0.000±0.000 | 1.000±0.000 |
| 1.0×101 | 10.960±0.231 | 1.650±0.101 | 4.470±0.289 | 1.110±0.110 |
| 1.0×102 | 25.310±0.398 | 2.770±0.198 | 5.510±0.168 | 1.200±0.203 |
| 1.0×103 | 33.130±0.312 | 4.590±0.112 | 10.330±0.213 | 1.590±0.134 |
| 1.0×104 | 54.570±0.245 | 5.470±0.145 | 17.120±0.309 | 1.990±0.331 |
| 1.0×105 | 79.450±0.402 | 7.450±0.102 | 25.830±0.337 | 2.650±0.268 |
| 1.0×106 | 90.210±0.271 | 8.570±0.221 | 32.350±0.178 | 4.570±0.161 |
Real-time PCR结果显示: 随着CagA+H. pylori、CagA-H. pylori浓度升高, TβRⅠ表达逐渐升高, 在同一浓度, CagA+H. pylori促TβRⅠ表达作用较CagA-H. pylori明显, 两组TβRⅠ相对表达量比较差别有统计学意义(P<0.05)(表2).
CagA蛋白是一种具有强抗原性的亲水性外膜蛋白, 是H. pylori重要的毒力因子之一[9], 被列为来自细菌的癌蛋白[10], 他由H. pylori致病岛CagPAI上的CagA基因编码, 经Ⅳ型分泌系统注入宿主细胞, 定位在质膜表面, 通过磷酸化与非磷酸化的方式与宿主细胞涉及调控细胞生长和运动的多种蛋白相互作用, 并且干扰多种信号通路[11-13], 破坏细胞增殖与凋亡平衡, 导致细胞功能异常, 刺激产生炎症因子, 引起黏膜免疫损伤[14], 相关研究表明该基因敲除可使H. pylori对细胞增殖的抑制作用消失[15,16], 此外还在介导细胞骨架重排、浸润和程序化/反程序化死亡中起关键作用[17,18].
TGF-β/Smads信号通路生物学效应的发挥要通过其受体及下游信号分子Smads, 几乎所有的细胞表面都有TGF-β受体, 目前与TGF-β/Smads信号通路相关的受体有TβRⅠ、TβRⅡ、TβRⅢ, TβRⅠ不能单独与TGF-β自由结合, TβRⅡ能够单独结合TGF-β, 一般是活化的TGF-β首先和TβRⅡ结合后构象发生改变, 才能被TβRⅠ识别并与之结合形成异四聚体, 由TβRⅡ将TβRⅠ彻底活化, TβRⅠ活化是整个通路的起点. TβRⅠ表达异常, 则会导致信号通路异常, 生物学效应发生变化. 已有研究表明CagA+H. pylori可以激活NF-κB信号通路、Wnt/β-连环蛋白(β-catenin)信号通路等[11-13], 目前H. pylori与TGF-β/Smads信号通路之间有无关联, 尚无相关报道, 我们的研究旨在通过CagA+H. pylori、CagA-H. pylori感染L-02细胞后观察细胞增殖情况及检测TβRⅠ表达量的变化, 以了解H. pylori对肝细胞的作用以及与TGF-β/Smads信号通路之间有无关系.
L-02细胞为人肝正常细胞株, 其生物学特性和细胞状态相对稳定, 细胞周期短、繁殖快、繁殖传代时间长(可达60多代)[19], 本实验采用体外培养L-02细胞, MTT法检测不同浓度的CagA+H. pylori、CagA-H. pylori对L-02细胞增殖作用的影响, 发现H. pylori对L-02细胞增殖的抑制作用呈浓度依赖, 随着H. pylori浓度升高, 对L-02细胞的抑制作用增强; 在同一浓度, CagA+H. pylori对细胞的抑制作用较CagA-H. pylori强, 此实验现象说明H. pylori感染可以诱导正常肝细胞增殖紊乱而引发细胞病变, 既往有研究表明, CagA是抑制细胞增殖所必须的因子[20], 陈仁等[21]研究发现CagA-H. pylori不影响肝癌细胞HepG2生长, 而CagA+H. pylori对HepG2细胞具有明显的体外细胞毒作用, 毒性与CagA+H. pylori浓度和作用时间呈正相关. 但多项实验与临床研究表明H. pylori感染致病不是一种因素作用的结果, 而是其多种致病因素整体作用及细菌与宿主细胞相互影响的综合结局[22-26].
CagA+H. pylori、CagA-H. pylori感染L-02细胞24 h后, 通过Real-time PCR法检测TβRⅠ基因的表达情况, 结果显示随着CagA+H. pylori、CagA-H. pylori浓度升高, TβRⅠ表达逐渐上调升高; 在同一浓度, 两组TβRⅠ相对表达量比较t<0.05. 说明CagA+H. pylori促TβRⅠ表达作用较CagA-H. pylori明显, 这提示H. pylori可能通过调节TβRⅠ的表达而影响TGF-β/Smads信号通路, CagA在其中有着举足轻重的作用, 张亚南等[27]研究提示CagA基因是诱导细胞表达IL-8 mRNA的重要因子, 但并非是唯一因素, 验证了H. pylori感染宿主致病机制的复杂性. 菌株之间毒力因子基因差异会影响H. pylori感染宿主导致的疾病[28], 至于CagA+H. pylori、CagA-H. pylori作用机制是否存在差别, 仍须进一步研究.
总之, H. pylori对人肝正常细胞L-02细胞具有抑制作用并与浓度相关, 菌液浓度越高, 抑制L-02细胞增殖作用明显. CagA+H. pylori抑制细胞的作用比CagA-H. pylori强. H. pylori对L-02细胞作用后TβRⅠ基因表达增高并与浓度相关, CagA+H. pylori的影响比CagA-H. pylori大. H. pylori对L-02细胞抑制作用的可能机制是通过TβRⅠ基因表达改变干扰TGF-β1/Smads信号通路传导而影响其生长. H. pylori处理前后对L-02细胞的作用, 涉及细胞增殖、凋亡; 基因表达调控; 信号传导等众多关键事件, 作用过程复杂, 其确切作用和分子机制仍需进一步实验和临床观察研究与证实.
幽门螺杆菌(Helicobacter pylori, H. pylori)感染是一种世界范围内常见的慢性感染, 可导致不同的临床疾病, 我国是H. pylori感染较严重的国家之一, 亦是肝癌高发区, 研究表明H. pylori感染和肝病有相关性, 具体机制未明, 引起了部分学者的研究兴趣.
李瑜元, 教授, 主任医师, 广州市第一人民医院内科
CagA作为H. pylori致病毒力因子的研究热点, 能干扰多种信号通路, 破坏细胞增殖与凋亡平衡, 与肝病的发生发展是否有相关性, 仍需要综合多方面研究来评价.
陈仁等研究发现CagA+H. pylori对人肝癌细胞HepG2细胞具有细胞毒作用, CagA-H. pylori对HepG2细胞生长无影响; 而Boonyanuqomol等研究发现低浓度CagA+H. pylori、CagA-H. pylori可以促进肿瘤细胞增殖, 高浓度CagA+H. pylori、CagA-H. pylori抑制肿瘤细胞生长, CagA+H. pylori作用均比CagA-H. pylori强.
国内外未见有关于H. pylori对L-02细胞的作用及其分子机制这样的研究报道, 本研究发现H. pylori对人肝正常细胞L-02细胞具有抑制作用并与浓度相关, 菌液浓度越高, 抑制细胞增殖作用明显, CagA+H. pylori比CagA-H. pylori作用强. H. pylori对L-02细胞作用后TβRⅠ基因表达增高并与浓度相关, CagA+H. pylori比CagA-H. pylori影响大.
近年来, 人们就H. pylori致肝病机制开展的研究中取得了不少成果, 本文就CagA+H. pylori、CagA-H. pylori对L-02细胞作用及TβRⅠ表达进行研究, 为H. pylori与肝脏致病提供新实验依据.
本文内容新颖, 条理清晰, 研究目的明确, 研究设计科学, 方法先进, 结果可靠, 具有一定的可读性、科学性和临床应用的价值.
编辑: 郭鹏 电编:鲁亚静
| 1. | Boonyanugomol W, Chomvarin C, Baik SC, Song JY, Hahnvajanawong C, Kim KM, Cho MJ, Lee WK, Kang HL, Rhee KH. Role of cagA-positive Helicobacter pylori on cell proliferation, apoptosis, and inflammation in biliary cells. Dig Dis Sci. 2011;56:1682-1692. [PubMed] [DOI] |
| 9. | Al-Ghoul L, Wessler S, Hundertmark T, Krüger S, Fischer W, Wunder C, Haas R, Roessner A, Naumann M. Analysis of the type IV secretion system-dependent cell motility of Helicobacter pylori-infected epithelial cells. Biochem Biophys Res Commun. 2004;322:860-866. [PubMed] [DOI] |
| 10. | 管 张燕. cagA转基因小鼠模型的建立及致病机制的初步研究. 中国人民解放军军事医学科学院. 2011;. |
| 11. | Tomimori K, Uema E, Teruya H, Ishikawa C, Okudaira T, Senba M, Yamamoto K, Matsuyama T, Kinjo F, Fujita J. Helicobacter pylori induces CCL20 expression. Infect Immun. 2007;75:5223-5232. [PubMed] [DOI] |
| 12. | Franco AT, Israel DA, Washington MK, Krishna U, Fox JG, Rogers AB, Neish AS, Collier-Hyams L, Perez-Perez GI, Hatakeyama M. Activation of beta-catenin by carcinogenic Helicobacter pylori. Proc Natl Acad Sci U S A. 2005;102:10646-10651. [PubMed] [DOI] |
| 13. | Murata-Kamiya N, Kurashima Y, Teishikata Y, Yamahashi Y, Saito Y, Higashi H, Aburatani H, Akiyama T, Peek RM, Azuma T. Helicobacter pylori CagA interacts with E-cadherin and deregulates the beta-catenin signal that promotes intestinal transdifferentiation in gastric epithelial cells. Oncogene. 2007;26:4617-4626. [PubMed] [DOI] |
| 17. | Tatemichi M, Hamada GS, Nishimoto IN, Kowalski LP, Iriya K, Rodrigues JJ, Tsugane S. Ethnic difference in serology of Helicobacter pylori CagA between Japanese and non-Japanese Brazilians for non-cardia gastric cancer. Cancer Sci. 2003;94:64-69. [PubMed] |
| 18. | Deguchi R, Mine T, Miwa T, Takagi A. [cag PAI and gastric carcinogenesis-association with p53 gene mutation]. Nihon Rinsho. 2003;61:41-45. [PubMed] [DOI] |
| 22. | Schneider N, Krishna U, Romero-Gallo J, Israel DA, Piazuelo MB, Camargo MC, Sicinschi LA, Schneider BG, Correa P, Peek RM. Role of Helicobacter pylori CagA molecular variations in induction of host phenotypes with carcinogenic potential. J Infect Dis. 2009;199:1218-1221. [PubMed] [DOI] |
| 23. | Kitadai Y. Cancer-stromal cell interaction and tumor angiogenesis in gastric cancer. Cancer Microenviron. 2010;3:109-116. [PubMed] [DOI] |
| 24. | Li WQ, Zhang L, Ma JL, Zhang Y, Li JY, Pan KF, You WC. Association between genetic polymorphisms of DNA base excision repair genes and evolution of precancerous gastric lesions in a Chinese population. Carcinogenesis. 2009;30:500-505. [PubMed] [DOI] |
| 25. | Peleteiro B, Lunet N, Barros R, La Vecchia C, Barros H. Factors contributing to the underestimation of Helicobacter pylori-associated gastric cancer risk in a high-prevalence population. Cancer Causes Control. 2010;21:1257-1264. [PubMed] [DOI] |
| 26. | Hsu PI, Hwang IR, Cittelly D, Lai KH, El-Zimaity HM, Gutierrez O, Kim JG, Osato MS, Graham DY, Yamaoka Y. Clinical presentation in relation to diversity within the Helicobacter pylori cag pathogenicity island. Am J Gastroenterol. 2002;97:2231-2238. [PubMed] |