修回日期: 2013-08-02
接受日期: 2013-08-13
在线出版日期: 2014-02-28
目的: 探讨骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)移植治疗急性肝衰竭(acute liver failure, ALF)大鼠的疗效、移植途径.
方法: 用D-氨基半乳糖(D-galactosamine, D-GalN)/脂多糖(lipopolysaccharide, LPS)诱导大鼠ALF模型. 72只大鼠随机分为ALF对照组、尾静脉移植组、门静脉移植组. 于BMSCs移植后24、72、120、168 h取血清和肝组织, 分别检测血清丙氨酸氨基转移酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST); 采用TUNEL法检测肝细胞凋亡; 采用免疫组织化学、Western blot方法检测肝组织中半胱氨酸蛋白酶1(cysteine-containing aspartate-specific proteases 1, Caspase1)和白介素18(interleukin-18, IL-18)蛋白的表达情况.
结果: ALF对照组大鼠血清ALT、AST水平随病程逐渐升高. 在移植后120、168 h, BMSCs移植组的血清ALT、AST与对照组相比差别有统计学意义(P<0.05); 尾静脉、门静脉移植组细胞凋亡指数分别为28.17%±17.08%、20.67%±12.68%、19.67%±11.82%、13.00%±6.84%, 与对照组相比差异有统计学意义(P<0.01). BMSCs移植组Caspase1、 IL-18蛋白表达水平逐渐降低, 在移植后120、168 h与对照组相比差异有统计学意义(P<0.05); 且二者的表达有明显的相关性(P<0.01). 尾静脉、门静脉移植途径对ALF大鼠均有治疗作用, 但二种途径相比差异无统计学意义(P>0.05).
结论: BMSCs能够改善ALF肝衰竭大鼠的肝功能, 抑制肝细胞凋亡、降低Caspase1、IL-18蛋白水平. Caspase1和IL-18在肝衰竭的发病过程中起重要作用; Caspase1和IL-18可望成为急性肝衰竭的预测因子和未来的治疗靶点.
核心提示: 骨髓间充质干细胞(bone marrow mesenchymal stem cells)能够改善急性肝衰竭(acute liver failure)大鼠的肝功能, 抑制肝细胞凋亡、降低半胱氨酸蛋白酶1(cysteine-containing aspartate-specific proteases 1, Caspase1)、白介素18(interleukin-18, IL-18)蛋白水平. Caspase1和IL-18在肝衰竭的发病过程中起重要作用; Caspase1和IL-18可望成为急性肝衰竭的预测因子和未来的治疗靶点.
引文著录: 袁淑芳, 姜涛, 胡兰英, 孙丽华, 郑嵘炅, 张跃新. 骨髓间充质干细胞移植对急性肝衰竭大鼠Caspase1和IL-18表达的影响. 世界华人消化杂志 2014; 22(6): 759-765
Revised: August 2, 2013
Accepted: August 13, 2013
Published online: February 28, 2014
AIM: To investigate the effect of bone marrow mesenchymal stem cell (BMSC) transplantation in the treatment of acute liver failure (ALF) in rats and optimize the administration route.
METHODS: D-galactosamine (D-GalN)/lipopolysaccharide (LPS) were used to make a rat model of experimental ALF. Seventy-two rats were randomly divided into an ALF group, a tail vein group, and a portal vein transplantation group. At different time points (24, 72, 120, and 168 h) after BMSC transplantation, serum ALT and AST were detected. TUNEL assay was applied to detect hepatocyte apoptosis. Immunohistochemistry and Western blot were performed to detect the expression of Caspase1 and IL-18 proteins in liver tissue.
RESULTS: Serum levels of ALT and AST in the ALF group were gradually increased with the progression of the disease. Compared with the ALF group, significant improvement of liver function parameters and histological findings was observed in the transplantation group 120 and 168 h after transplantation (P < 0.05 for both). The apoptosis indexes in the tail vein group and portal vein transplantation group (120 h: 28.17% ± 17.08%, 20.67% ± 12.68%; 168 h: 19.67 % ± 11.82%, 13.00 % ± 6.84% ) were significantly lower than those in the ALF group (P < 0.01 for all). The expression levels of Caspase1 and IL-18 proteins in the two transplantation groups were decreased significantly at 120 and 168 h compared with the ALF group (P < 0.05 for both). Both administration routes had a therapeutic effect against ALF in rats, but no significant difference was observed between them.
CONCLUSION: BMSCs can improve the liver function, inhibit hepatic apoptosis and reduce the levels of Caspase1 and IL-18 proteins in ALF rats. Caspase1 and IL-18 play an important role in the pathogenesis of ALF and are expected to be predictors of ALF and future therapeutic targets.
- Citation: Yuan SF, Jiang T, Hu LY, Sun LH, Zheng RJ, Zhang YX. Effect of bone marrow mesenchymal stem cell transplantation on expression of Caspase1 and IL-18 in rats with acute hepatic liver failure. Shijie Huaren Xiaohua Zazhi 2014; 22(6): 759-765
- URL: https://www.wjgnet.com/1009-3079/full/v22/i6/759.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i6.759
急性肝衰竭(acute liver failure, ALF)是由多种病因引起的一种综合征, 以短时间内大量肝细胞变性、坏死和炎性细胞浸润等为特征[1,2], 因其进展快、并发症多、治疗难度大、病死率高、预后差, 是临床治疗中至今尚未克服的难题[3,4]. 近年来干细胞及其"横向分化"特性的发现为肝衰竭的治疗提供了新的希望[5,6]. 干细胞移植治疗肝衰竭具有操作简单、应用灵活、可重复进行、免疫源性弱、治疗费用低等优点得到较快发展, 成为继原位肝移植后又一治疗肝功能衰竭的有效方法[7,8]. ALF的发生涉及众多炎症因子和细胞因子, 其发病机制与肝细胞凋亡密切相关. 感染后炎症因子介导的肝细胞凋亡, 坏死是促进ALF发展的重要因素, 同时机体也通过自身的调节释放抗炎因子, 以及抑制免疫来调控炎症反应[9,10]. 诸多报道认为肝细胞凋亡的发生受Fas/FasL、Bcl-2家族、天冬氨酸特异性半胱氨酸蛋白酶(cysteine-containing aspartate-specific proteases, Caspase)家族等因素的调控制[11]. 白介素18(interleukin-18, IL-18)是近年来新近发现的致炎细胞因子, 其前体无生物学活性, 需经Caspase1催化后, 才能转化为活性分子, 发挥多种致炎效应, 促进各种疾病的发生. 研究显示, IL-18及其诱导产生的细胞因子与肝损害密切相关[12,13]. 为此我们通过构建大鼠ALF模型, 观察骨髓间充质干细胞(bone mesenchymal stem cells, BMSCs)移植治疗大鼠ALF的疗效; 探讨BMSCs移植对肝细胞凋亡、肝组织中Caspase1、IL-18蛋白表达的影响. 为临床开展骨髓MSCs移植治疗ALF、评价ALF患者的病情严重程度及预后指标应用于临床实践中, 提供实验依据.
采用健康♂Sprague-Dwley(SD)大鼠72只, 体质量250-300 g, SPF级(许可证号SCXK新2003-0002).
1.2.1 MSC的培养和动物模型建立: 采用全骨髓法分离SD大鼠BMSCs, 进行体外培养. 应用流式细胞仪分析对BMSCs进行表型鉴定. 采用10%D-氨基半乳糖(D-galactosamine)1.4 g/(kg•次)、12 h一次和0.005%脂多糖(lipopolysaccharide LPS)20 μg/kg, 经腹腔注射制备大鼠ALF模型. 通过门静脉和尾静脉注射的方式移植BMSCs. 72只大鼠随机分为3组, 对照组给予等体积生理盐水腹腔注射. 尾静脉移植组给予1.4×107细胞/kg P3代的BMSCs进行尾静脉注射. 门静脉移植组: 大鼠麻醉, 暴露腹腔, 经门静脉注射1.4×107细胞/kg的P3代BMSCs进行移植. 于移植后24、72、120、168 h收集血液样本和肝组织标本. 用4%的多聚甲醛固定肝组织标本, 进行病理组织学研究. 取部分新鲜肝组织快速投入液氮冻存, 然后贮存于-80 ℃供蛋白质检测.
1.2.2 生化指标的测定: 血液离心, 采用全自动生化分析仪(Unicel DXC 800; BECKMAN COULTER)测定不同时间点大鼠血清谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)变化.
1.2.3 苏木素-伊红(HE)与原位细胞凋亡检测(TUNEL法): 大鼠肝组织石蜡包埋后4 μm连续切片, 切取3-5张切片行HE染色, 每张切片分别随机选择5个低倍(×200)和高倍视野(×400), 光镜下观察BMSCs移植后肝组织病理变化. 用TUNEL检测试剂盒(购自瑞士Roche Applied Science)检测细胞凋亡. 按照TUNEL检测试剂盒说明书操作步骤进行, 光镜下分析结果. 每张切片观察500个细胞, 计算每100个细胞中平均阳性细胞数, 即凋亡指数(apoptosis index, AI).
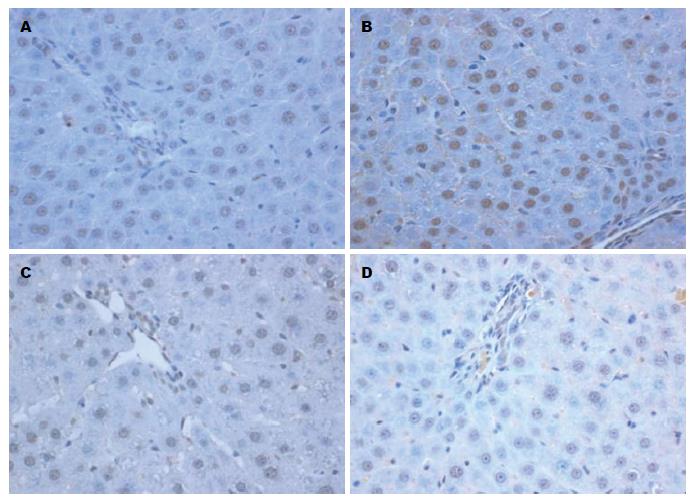
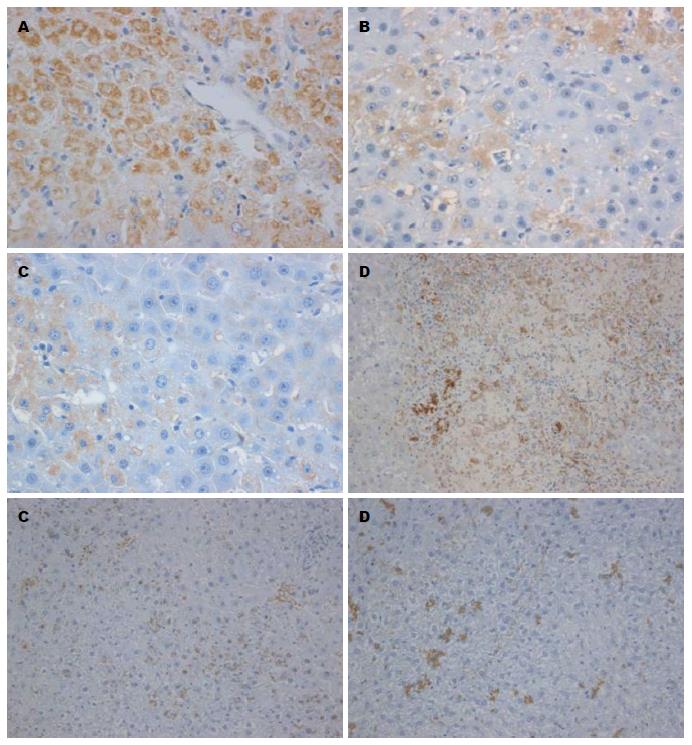
1.2.4 采用免疫组织化学方法检测肝组织Caspase1、IL-18蛋白的表达: 加Caspase1(1:100, ab17820, abcam MA, USA)或IL-18抗体(1:100, sc-6179, Santa Cruz Biotechnology), 再加生物素标记的第二抗体及链霉菌抗生物素蛋白-过氧化物酶溶液, 经DAB显色, 苏木素复染, 中性树胶封片. 在阳性标本上以磷酸盐缓冲液代替第一抗体作阴性对照. 细胞膜或胞浆染成棕黄色的为阳性细胞.
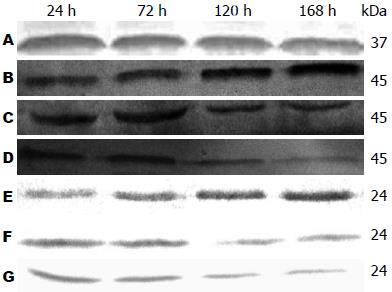
1.2.5 采用Western blot检测肝组织Caspase1、IL-18蛋白的表达: 称取不同时间点的肝组织约100 mg, 加入预冷的细胞裂解液, 冰磨匀浆3-5 min, 按1:3加入上样缓冲液, 加热变性(96 ℃加热5 min). 用10%聚丙烯酰胺凝胶垂直平板电泳, 待嗅酚蓝接近底线时终止电泳. 将分离后的蛋白质从SDS聚丙烯酰胺凝胶电泳转至硝酸纤维素滤膜上, 封闭液室温封闭1 h. 加入一抗Caspase1(1:200)、IL-18(1:200)、GAPDH(1:1000, sc-25778, Santa Cruz Biotechnology), 4 ℃过夜. 次日, TBST洗膜后, 置于碱性磷酸酶标记的二抗中孵育, 洗后显色, 免疫反应在酶的作用底物下显影. 用Quantity One分析软件进行图像分析, 以GAPDH的测定结果相比较, 计算其比值.
统计学处理 采用SPSS18.0统计学软件进行统计学处理. 计量资料以mean±SD表示, 组间比较采用随机区组设计的方差分析; 计数资料采用秩转换后的方差分析; 相关分析采用Pearson相关分析, P<0.05为差异有统计学意义.
从表1可知经D-GalN/LPS处理后, 对照组大鼠血清ALT、AST水平随着时间的延长逐渐升高, BMSCs移植组的大鼠血清ALT、AST逐渐下降. 移植后120、168 h BMSCs移植组的血清ALT、AST与对照组相比差别有统计学意义(P<0.05)(表1). 尾静脉与门尾静脉移植组之间血ALT、AST差异无统计学意义(P>0.05).
TUNEL染色可见BMSCs移植组肝细胞坏死、凋亡明显减轻. 移植后120 h尾静脉组、门静脉组细胞凋亡指数分别为28.17%±17.08%、20.67%±12.68%; 移植后168 h细胞凋亡指数分别为19.67%±11.82%、13.00%±6.84%, 与对照组相比差异有统计学意义(P<0.01). 尾静脉和门静脉植组之间肝细胞凋亡改善情况无统计学差异(P>0.05)(图1, 表2).
免疫组织化学显示: BMSCs移植组中Caspase1、IL-18蛋白的表达水平随肝功能的好转逐渐降低, 在移植后120、168 h与对照组相比有显著性差异(P<0.05, 表3). 相关分析发现Caspase1、IL-18两者呈正相关, 相关系数为0.56(P<0.01); Caspase1、IL-18与肝细胞凋亡之间均有明显的相关性, 相关系数分别0.753, 0.737(P<0.01)(图2).
Western blot结果显示: BMSCs移植组中Caspase1、IL-18灰度值随肝功能好转逐渐下降. 移植后120 h BMSCs移植组中Caspase1、IL-18灰度值分别为0.46±0.24、0.10±0.01; 移植后168 h, Caspase1、IL-18灰度值分别为0.38±0.25、0.08±0.02, 与对照组相比差异有统计学意义(P<0.05). 相关分析显示Caspase1、IL-18两者呈正相关(r = 0.719, P<0.01, 图3).
肝衰竭是一种重症肝病, 可由不同原因引发, 但归根结底表现为肝细胞和肝脏内其他类型细胞的过度死亡[14,15]. 目前认为肝脏大面积坏死的机制主要和肝细胞凋亡、微循环障碍等因素有关. 其中细胞凋亡是导致肝脏二次打击的重要细胞机制[5,16]. 近年来关于细胞死亡的细胞内信号转导机制研究已取得了很大进展. Parekkadan等[17]发现BMSCs来源的细胞因子能够防止肝细胞坏死, 提高暴发性肝衰竭的生存率. 研究发现BMSCs具有抑制肝细凋亡、促进肝细胞增殖作用[18,19]. BMSCs能通过旁分泌作用, 分泌多种细胞因子和生长因子, 促进肝细胞再生, 抑制炎症反应及细胞凋亡[20,21]. 明确急性肝衰竭的发病机制, 在早期阻止肝细胞凋亡、促进肝再生是提高ALF患者生存率的关键[22]. 目前研究显示在肝脏严重受损、肝细胞增殖受抑制时, BMSCs具有持久生成肝细胞和胆管细胞的能力, 在肝损伤后的修复过程中, 参与补充因损伤而减少的肝细胞数量, 参与修复因损伤破坏的肝组织结构[23]. 国内外多次实验证明, 将BMSCs移植入受损的肝脏组织中, 通过免疫荧光标记和体内成像追踪均有BMSCs在肝脏中的定植, 且对比BMSCs移植入肝损伤组和正常组后, 发现BMSCs在肝损伤组中定植的数量、分布范围明显高于正常组[24]. Aurich等[25]将人BMSCs在体外用特定的生长因子向肝细胞诱导分化, BMSCs表现了肝细胞的形态和功能, 将此种诱导的BMSCs移植入免疫缺陷小鼠肝脏内, BMSCs可在肝脏内定居, 并且细胞开始贮存糖原、表达白蛋白、表达人肝细胞特异性抗原等, 这表明移植的细胞保持了肝细胞的特性, 因此BMSCs有希望为肝脏疾病治疗提供新的细胞来源.
本研究采用了D-Gal/LPS诱导的大鼠AHF模型. 模型建立后, 肝衰竭对照组大鼠血清ALT、AST水平和肝细胞凋亡指数较BMSCs移植组明显升高. BMSCs移植120、168 h后大鼠肝功能逐渐恢复, 肝细胞坏死、凋亡较对照组明显减轻, 与以往报道一致. 提示BMSCs移植可抑制炎症反应及细胞程序性死亡, 从而修复缺损组织, 说明BMSCs对ALF大鼠具有一定治疗作用.
Caspases是一组天门冬氨酸特异性的半胱氨酸蛋白酶, Caspases的活化是导致凋亡的中心环节. Caspase1是Caspase家族的奠基成员, 因可催化IL-1β转化为活性分子, 曾被命名为IL-1转化酶, 他不仅参与多种细胞的凋亡, 而且对致炎细胞因子IL-18、IL-1β的成熟起着至关重要的作用, 是IL-18活化所必须的蛋白酶. 通过对小鼠的Caspase1基因敲除后也发现, Caspase1-/-小鼠缺乏成熟的IL-18, 提示Caspase1为发育成熟的IL-18所必须. Caspase1还可通过FasL刺激机制及其他IL-18前体切断酶来增加IL-18的产生[26,27]. IL-18是一种能强烈诱生γ干扰素(interferon-γ, INF-γ)的新型细胞因子, 主要由活化的巨噬细胞产生, 诱导Thl、NK、NKT细胞, 同时还具有抗感染、介导炎症反应、诱导神经细胞凋亡等多种生物学活性[28,29]. IL-18可诱导免疫细胞产生大量INF-γ、肿瘤坏死因子-α、Fas配体及穿孔素, 还能增强自然杀伤细胞及CTL活性杀伤靶细胞活性, 引起肝细胞坏死和凋亡, 在重型肝炎发病机制中起着重要的作用[30,31].
我们通过免疫组织化学和Western blot法检测了大鼠ALF肝组织中Caspase1、IL-18表达的情况, 发现二者的表达趋势一致. 随着凋亡的加重, 其表达逐渐增高, 且Caspase1、IL-18与肝细胞凋亡之间有明显的相关性, 说明Caspase1、IL-18在肝细胞凋亡中发挥一定作用. 由于Caspase1是IL-18的活化酶, ALF时二者的同时增高提示Caspase1的表达激活并增加了IL-18的释放, 后者参与并进一步加重了组织的损伤, 促进了ALF的发生.
本研究结果发现, 随着血清中ALT、AST水平的升高, ALF大鼠肝组织Caspase1、IL-18水平显著升高, 反映了肝功能的急剧恶化和疾病严重程度, 说明Caspase1、IL-18在ALF的发病过程中起到相当重要的作用, 提示Caspase1、IL-18可作为ALF的诊断和预后观察的敏感标志蛋白. BMSCs移植治疗后, 肝组织中Caspase1、IL-18的表达水平呈下降趋势, 大鼠肝功能逐渐恢复, 提示BMSCs移植能改善ALF大鼠的免疫状况、对ALF大鼠有一定的保护作用, 可以降低Caspase1、IL-18水平, 调节促炎与抗炎因子达到新的平衡, 这可能是BMSC移植治疗ALF的作用机制之一. 肝衰竭病情凶险, 客观、及时有效地评价肝衰竭患者的病情及预后并指导临床治疗显得尤为重要. 该研究提示Caspase1、IL-18治疗过程中的变化趋势可以一定程度上反映ALF的治疗效果及预后, 因此Caspase1、IL-18可望成为ALF的预后评估和未来的治疗靶点.
急性肝衰竭(acute liver failure, ALF)是由多种病因引起的一种综合征, 因其进展快、并发症多、治疗难度大、病死率高、预后差, 是临床治疗中至今尚未克服的难题. ALF的发生涉及众多炎症因子和细胞因子, 发病机制与肝细胞凋亡关系密切.
庄林, 主任医师, 昆明市第三人民医院肝病科
近年来干细胞及其"横向分化"特性的发现为ALF治疗提示了新的切入点. 骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)能抑制炎症反应、细胞凋亡. Caspase1和IL-18在ALF的发病过程中起重要作用. 明确ALF的发病机制, 早期阻止肝细胞凋亡、促进肝再生是提高ALF患者生存率的关键.
Parekkadan等发现BMSCs来源的细胞因子能够防止肝细胞坏死, 提高暴发性肝衰竭的生存率. 研究发现BMSCs具有抑制肝细凋亡、促进肝细胞增殖作用. BMSCs能通过旁分泌作用, 分泌多种细胞因子和生长因子, 促进肝细胞再生, 抑制炎症反应及细胞凋亡.
ALF病情凶险, 客观、及时有效地评价ALF患者的病情及预后并指导临床治疗显得尤为重要. 该研究提示Caspase1、IL-18治疗过程中的变化趋势可以一定程度上反映ALF的治疗效果及预后, 因此Caspase1、IL-18可望成为ALF的预后评估和未来的治疗靶点.
本研究通过观察BMSCs治疗大鼠ALF的疗效, 探讨BMSCs移植对肝细胞凋亡、肝组织Caspase1、IL-18蛋白表达的影响. 为临床开展BMSCs移植治疗ALF、评价ALF患者的病情严重程度及预后指标应用于临床实践中提供实验依据.
本文结果可靠, 条理分明, 实验证据较充足, 得出的科学结论有一定价值, 为今后ALF在临床方面的快速进展展示了曙光.
编辑: 田滢 电编:鲁亚静
| 1. | Bernal W, Auzinger G, Dhawan A, Wendon J. Acute liver failure. Lancet. 2010;376:190-201. [PubMed] [DOI] |
| 2. | Oketani M, Ido A, Tsubouchi H. Changing etiologies and outcomes of acute liver failure: A perspective from Japan. J Gastroenterol Hepatol. 2011;26 Suppl 1:65-71. [PubMed] [DOI] |
| 3. | Korman JD, Volenberg I, Balko J, Webster J, Schiodt FV, Squires RH, Fontana RJ, Lee WM, Schilsky ML. Screening for Wilson disease in acute liver failure: a comparison of currently available diagnostic tests. Hepatology. 2008;48:1167-1174. [PubMed] |
| 4. | Stravitz RT, Kramer DJ. Management of acute liver failure. Nat Rev Gastroenterol Hepatol. 2009;6:542-553. [PubMed] |
| 5. | Muraca M. Evolving concepts in cell therapy of liver disease and current clinical perspectives. Dig Liver Dis. 2011;43:180-187. [PubMed] [DOI] |
| 6. | Chen Y, Xiang LX, Shao JZ, Pan RL, Wang YX, Dong XJ, Zhang GR. Recruitment of endogenous bone marrow mesenchymal stem cells towards injured liver. J Cell Mol Med. 2010;14:1494-1508. [PubMed] [DOI] |
| 7. | Stutchfield BM, Forbes SJ, Wigmore SJ. Prospects for stem cell transplantation in the treatment of hepatic disease. Liver Transpl. 2010;16:827-836. [PubMed] [DOI] |
| 8. | Bajek A, Olkowska J, Drewa T. [Mesenchymal stem cells as a therapeutic tool in tissue and organ regeneration]. Postepy Hig Med Dosw (Online). 2011;65:124-132. [PubMed] [DOI] |
| 9. | Stuart WD, Kulkarni RM, Gray JK, Vasiliauskas J, Leonis MA, Waltz SE. Ron receptor regulates Kupffer cell-dependent cytokine production and hepatocyte survival following endotoxin exposure in mice. Hepatology. 2011;53:1618-1628. [PubMed] [DOI] |
| 10. | Lee WM, Squires RH, Nyberg SL, Doo E, Hoofnagle JH. Acute liver failure: Summary of a workshop. Hepatology. 2008;47:1401-1415. [PubMed] |
| 11. | Tschoeke SK, Oberholzer A, Moldawer LL. Interleukin-18: a novel prognostic cytokine in bacteria-induced sepsis. Crit Care Med. 2006;34:1225-1233. [PubMed] [DOI] |
| 13. | Yi T, Song SU. Immunomodulatory properties of mesenchymal stem cells and their therapeutic applications. Arch Pharm Res. 2012;35:213-221. [PubMed] |
| 14. | Kisseleva T, Gigante E, Brenner DA. Recent advances in liver stem cell therapy. Curr Opin Gastroenterol. 2010;26:395-402. [PubMed] [DOI] |
| 15. | Popp FC, Renner P, Eggenhofer E, Slowik P, Geissler EK, Piso P, Schlitt HJ, Dahlke MH. Mesenchymal stem cells as immunomodulators after liver transplantation. Liver Transpl. 2009;15:1192-1198. [PubMed] [DOI] |
| 16. | Guicciardi ME, Gores GJ. Apoptosis: a mechanism of acute and chronic liver injury. Gut. 2005;54:1024-1033. [PubMed] [DOI] |
| 17. | Parekkadan B, Milwid JM. Mesenchymal stem cells as therapeutics. Annu Rev Biomed Eng. 2010;12:87-117. [PubMed] |
| 18. | Cho KA, Ju SY, Cho SJ, Jung YJ, Woo SY, Seoh JY, Han HS, Ryu KH. Mesenchymal stem cells showed the highest potential for the regeneration of injured liver tissue compared with other subpopulations of the bone marrow. Cell Biol Int. 2009;33:772-777. [PubMed] [DOI] |
| 19. | Ding DC, Shyu WC, Lin SZ. Mesenchymal stem cells. Cell Transplant. 2011;20:5-14. [PubMed] [DOI] |
| 20. | Sordi V, Piemonti L. Therapeutic plasticity of stem cells and allograft tolerance. Cytotherapy. 2011;13:647-660. [PubMed] [DOI] |
| 21. | Parekkadan B, van Poll D, Suganuma K, Carter EA, Berthiaume F, Tilles AW, Yarmush ML. Mesenchymal stem cell-derived molecules reverse fulminant hepatic failure. PLoS One. 2007;2:e941. [PubMed] |
| 22. | Peterbauer-Scherb A, van Griensven M, Meinl A, Gabriel C, Redl H, Wolbank S. Isolation of pig bone marrow mesenchymal stem cells suitable for one-step procedures in chondrogenic regeneration. J Tissue Eng Regen Med. 2010;4:485-490. [PubMed] [DOI] |
| 23. | Petrie Aronin CE, Tuan RS. Therapeutic potential of the immunomodulatory activities of adult mesenchymal stem cells. Birth Defects Res C Embryo Today. 2010;90:67-74. [PubMed] |
| 24. | Ju S, Teng GJ, Lu H, Zhang Y, Zhang A, Chen F, Ni Y. In vivo MR tracking of mesenchymal stem cells in rat liver after intrasplenic transplantation. Radiology. 2007;245:206-215. [PubMed] |
| 25. | Aurich I, Mueller LP, Aurich H, Luetzkendorf J, Tisljar K, Dollinger MM, Schormann W, Walldorf J, Hengstler JG, Fleig WE. Functional integration of hepatocytes derived from human mesenchymal stem cells into mouse livers. Gut. 2007;56:405-415. [PubMed] [DOI] |
| 26. | 邓 利娟, 李 湛军, 罗 楹, 范 慧红. Caspase抑制剂F1013对急性肝衰竭大鼠肝细胞凋亡的影响. 中国临床药理学与治疗学. 2010;15:1229-1233. |
| 27. | Fantuzzi G, Puren AJ, Harding MW, Livingston DJ, Dinarello CA. Interleukin-18 regulation of interferon gamma production and cell proliferation as shown in interleukin-1beta-converting enzyme (caspase-1)-deficient mice. Blood. 1998;91:2118-2125. [PubMed] |
| 29. | Dinarello CA. Interleukin-18 and the pathogenesis of inflammatory diseases. Semin Nephrol. 2007;27:98-114. [PubMed] [DOI] |
| 30. | Dinarello CA. Interleukin 1 and interleukin 18 as mediators of inflammation and the aging process. Am J Clin Nutr. 2006;83:447S-455S. [PubMed] |
| 31. | 党 双锁, 高 宁, 程 延安. 实验性肝硬化大鼠细胞因子IL-18、TNF-α、IFN-γ的变化及意义. 西安交通大学学报(医学版). 2010;31:148-153. |