修回日期: 2013-12-15
接受日期: 2013-12-27
在线出版日期: 2014-02-18
目的: 观察腹腔镜胆囊切除术(laparoscopic cholecystectomy, LC)对不同免疫缺陷程度的人免疫缺陷病毒(human immunodeficiency virus, HIV)感染者细胞免疫功能的影响.
方法: 62例HIV阳性(HIV+)与同期随机32例HIV阴性(HIV-)共94例需LC患者, 检测其术前1 d(D0)、术后第3天(D3)、术后第7天(D7)外周静脉血T淋巴细胞亚群CD4和CD8计数(单位cell/μL). 各自计算D3、D7两次CD4计数相对于D0百分比D3/D0(%)、D7/D0(%). 并根据术前1 d(D0)CD4计数分层(组), Ⅰ≥500>Ⅱ≥200>Ⅲ≥0. SPSS19.0软件包分析每组内前后差异以及各层组之间差异.
结果: 在各组内部前后3次检测中, 白细胞计数、中性粒细胞率、淋巴细胞率、CD8计数差异无统计学意义(P>0.05), CD4计数各组内部前后3次检测两两对比差异有统计学意义(P<0.001). 不同组别之间差异有统计学意义(F = 203.80, P<0.001). 时间和组别两个因素之间有交互效应(F = 8.08, P<0.001).
结论: LC手术对以CD4为主的细胞免疫功能有"先抑制后恢复"的影响过程, 其影响过程体现出从HIV-Ⅰ组的"V"型到HIV+Ⅲ组的"L"型的渐变规律. HIV感染者免疫缺陷程度越重, 其免疫抑制越明显, 其免疫恢复也更缓慢. 对HIV感染者施行手术需要正确把握手术适应症、重视免疫干预并且进行有针对性的围术期处理.
核心提示: 本研究基于前瞻性分层对照研究, 观察到腹腔镜胆囊切除术(laparoscopic cholecystectomy)手术对人类免疫缺陷病毒(human immunodeficiency virus, HIV)感染者细胞免疫有 "先抑制后恢复"影响过程, 其影响过程还体现出从"V"型到"L"型的渐变规律. HIV感染者免疫缺陷越重, 其免疫抑制越明显, 其免疫恢复也更缓慢. 作者强调对HIV感染者施行手术要正确把握手术适应症、重视免疫干预并且有针对性地围术期处理.
引文著录: 胡明辉, 魏国, 赵勇, 范合璋, 华欣, 何永, 蔡林. 腹腔镜胆囊切除术对HIV感染者细胞免疫的影响. 世界华人消化杂志 2014; 22(5): 700-704
Revised: December 15, 2013
Accepted: December 27, 2013
Published online: February 18, 2014
AIM: To observe the impact of laparoscopic cholecystectomy (LC) on cellular immunity in HIV-infected patients with different levels of immunodeficiency.
METHODS: Ninety-four patients who underwent LC, including 62 HIV-positive (HIV+) patients and 32 randomly selected HIV-negative (HIV-) patients, were included in the study. Peripheral venous blood samples were collected to count the number of CD4+ (cell/μL) and CD8+ (cell/μL) T lymphocyte subsets on preoperative day 1 (D0) and postoperative days 3 (D3) and 7 (D7). The ratios of the number of CD4+ cells on D3 to that on D0 [D3/D0 (%)] and D7 to D0 [D7/D0 (%)] were calculated. Patients were stratified into three groups according to the count of CD4+ cell count on D0: Ⅰ(≥ 500), Ⅱ (≥ 200 but < 500) and Ⅲ (≥ 0 but < 200). The differences in the cell count between preoperation and postoperation in each group and between each group were analyzed by statistical methods.
RESULTS: There were no significant differences in WBC count, neutrophil percentage, lymphocyte percentage and CD8+ cell count between preoperation and postoperation in each group (P > 0.05 for all), but significant differences were observed in CD4+ cell count between preoperation and postoperation in each group (P < 0.001 for all) as well as between different groups (F = 203.80, P < 0.001). There was an interactive effect between time and group (F = 8.08, P < 0.001).
CONCLUSION: LC has an impact on CD4-based cellular immunity, with a process from suppression to restoration. The more serious the immunodeficiency, the more significant the immunosuppression and the more slow the immune recovery. Attention should be paid to surgical indications and appropriate perioperative management including immune intervention in HIV-infected patients undergoing surgery.
- Citation: Hu MH, Wei G, Zhao Y, Fan HZ, Hua X, He Y, Cai L. Impact of laparoscopic cholecystectomy on cellular immunity in patients with HIV infection. Shijie Huaren Xiaohua Zazhi 2014; 22(5): 700-704
- URL: https://www.wjgnet.com/1009-3079/full/v22/i5/700.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i5.700
1981年美国首次报道"获得性免疫缺陷综合症"(acquired immune deficiency syndrome, AIDS)即"艾滋病". 1983年发现了导致AIDS的人类免疫缺陷病毒(human immunodeficiency virus, HIV). HIV通过对CD4 T淋巴细胞(CD4 T lymphocyte, CD4)亚群的破坏导致AIDS[1]. 随着HIV感染的传播以及高效抗逆转录病毒治疗(highly active antiretroviral therapy, HAART)的推广, 生存的HIV感染者越来越多, HIV感染者合并外科疾病并需要手术者也不断增多[2]. 我院2006年开始了对HIV感染者手术安全性及手术适应症的探索. 2009年启动了对合并HIV感染的腹腔镜胆囊切除术(laparoscopic cholecystectomy, LC)患者的前瞻性临床分层对照研究, 报告如下.
选择2009-01/2013-12我院收治的所有18-65岁, 具有明确LC手术适应症并且术前2 wk内未使用过糖皮质激素或免疫抑制剂的患者94例, 包括合并HIV感染(HIV+)者62例及同期随机选取的未合并HIV感染(HIV-)者32例, 其中男43例, 女51例; 年龄18-65岁, 平均40.2岁±14.7岁; 结石合并胆囊炎40.43%(37/94), 胆囊结石34.04%(32/94), 急慢性胆囊炎17.02%(16/94), 胆囊息肉及其他9.57%(9/94). 美国麻醉师协会(American Society of Anesthesiology, ASA)麻醉前分级Ⅰ-Ⅲ级. 此94例患者纳入前瞻性临床对照研究, 依据LC术前1 d外周静脉血CD4计数(D0, 单位cell/μL)分层, Ⅰ≥500>Ⅱ≥200>Ⅲ≥0. 结合有无HIV感染分为HIV-Ⅰ、HIV+Ⅰ、HIV+Ⅱ、HIV+Ⅲ共4组.
1.2.1 治疗: 手术前后处理参照《临床诊疗指南-外科学分册》[3], 经必要术前准备, 各组均在气管插管全身麻醉下由同一治疗小组施行LC, 各组患者术后1 wk均未使用糖皮质激素或免疫抑制剂. (HIV+)者按照《艾滋病诊疗指南》进行抗病毒治疗和并发症处理[4]. 符合抗病毒治疗标准的24例(HIV+)患者术前抗病毒治疗2 wk, 术后继续HAART抗病毒及治疗AIDS并发症. HIV+Ⅲ组均经过包括营养支持和并发症处理等充分的术前准备.
1.2.2 检测指标: HIV抗体ELISA法初筛实验阴性为(HIV-)组, HIV抗体 ELISA法初筛实验阳性且蛋白印迹法(Western blot)确证阳性为(HIV+)组, 所有研究对象除诊疗指南要求项目外, 于术前1 d(D0)、术后第3天(D3)、术后第7天(D7)分别抽取外周静脉血, 检测血液常规和T淋巴细胞亚群, 包括CD4、CD8计数(cell/μL)及CD4/CD8. 分别计算D3、D7两次CD4计数相对于D0的百分比D3/D0(%)、D7/D0(%). T淋巴细胞亚群检测采用Beckman Coulter Epics XL流式细胞仪.
统计学处理 结果以mean±SD的形式表示, 使用SPSS19.0软件包, 重复测量数据采用Repeated Measures单因素(组内前后比较)或两因素(组间、组内同时比较)多水平方差分析(ANOVA). 按α = 0.05水准, P<0.05差异有统计学意义.
全部94例患者麻醉及LC手术顺利(其中3例因合并胆总管结石附加了经十二指肠镜胆总管取石术). 所有患者未发生麻醉及手术相关并发症, 无围手术期死亡病例, 胆道疾病全部一期治愈. 各组手术前后检测指标如表1及表2.
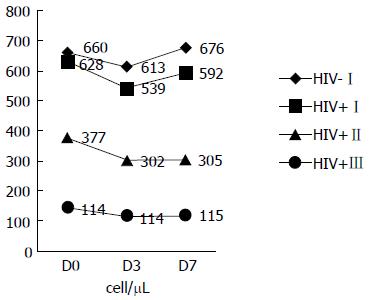
| 分组 | n | 时间 | 白细胞(109/L) | 中性粒细胞率(%) | 淋巴细胞率(%) | CD4(cell/μL) | CD8(cell/μL) |
| HIV-Ⅰ | 32 | D0 | 7.5±3.3 | 62.6±10.8 | 42.4±8.3 | 660±169 | 530±124 |
| D3 | 8.8±2.4 | 72.6±12.3 | 38.6±12.3 | 613±97 | 512±108 | ||
| D7 | 8.1±3.6 | 67.9±7.7 | 46.2±4.3 | 676±104 | 503±93 | ||
| HIV+ Ⅰ | 14 | D0 | 6.7±3.1 | 60.5±28.3 | 40.5±5.8 | 628±73 | 620±186 |
| D3 | 7.2±2.4 | 68.7±12.6 | 35.6±8.4 | 539±39 | 668±210 | ||
| D7 | 6.9±4.2 | 64.2±13.5 | 38.3±6.5 | 592±91 | 647±164 | ||
| HIV+ Ⅱ | 36 | D0 | 5.6±3.6 | 67.5±8.6 | 35.9±9.6 | 377±85 | 726±241 |
| D3 | 6.0±2.9 | 72.3±10.3 | 32.4±17.3 | 302±85 | 764±186 | ||
| D7 | 5.4±3.5 | 77.6±8.6 | 30.8±11.5 | 305±72 | 670±104 | ||
| HIV+ Ⅲ | 12 | D0 | 4.7±3.4 | 71.8±12.6 | 30.5±16.4 | 144±37 | 432±210 |
| D3 | 4.4±2.6 | 78.4±14.9 | 25.4±8.9 | 114±38 | 478±251 | ||
| D7 | 3.9±3.2 | 76.3±15.1 | 23.1±12.5 | 115±33 | 423±142 |
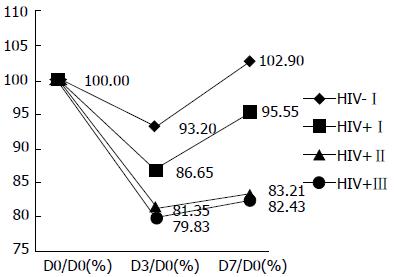
| 分组 | n | 术前1 d(D0) | 术后第3天(D3) | 术后第7天(D7) | |||
| CD4 | D0/D0(%) | CD4 | D3/D0(%) | CD4 | D7/D0 (%) | ||
| HIV-Ⅰ | 32 | 660±169 | 100 | 613±97 | 93.20±5.73 | 676±104 | 102.90±7.48 |
| HIV+Ⅰ | 14 | 628±73 | 100 | 539±39 | 86.65±8.81 | 592±91 | 95.55±18.39 |
| HIV+Ⅱ | 36 | 377±85 | 100 | 302±85 | 81.35±21.12 | 305±72 | 83.21±20.35 |
| HIV+Ⅲ | 12 | 144±37 | 100 | 114±38 | 79.83±21.35 | 115±33 | 82.43±20.74 |
各组内部, 手术前后3次检测各项目均数差异中, 白细胞计数、中性粒细胞率、淋巴细胞率、CD8计数无统计学意义(P>0.05); CD4计数有统计学意义(P<0.001); 进一步两两比较发现, 对于CD4计数, D0 vs D3、D0 vs D7和D3 vs D7差异有计学意义(P<0.0001); 对于CD4计数相对百分比, D0/D0 vs D3/D0和D0/D0 vs D7/D0差异有统计学意义(P<0.0001), D3/D0 vs D7/D0差异有统计学意义(P<0.05). 不同分组之间的差异效应有统计学意义(F = 203.80, P<0.001). 时间与分组两个因素之间有交互效应(F = 8.08, P<0.001). 各组CD4计数的变化趋势以及时间与分组两因素的交互作用如图1, 图2.
HIV感染(包括AIDS)是全球共同面临的巨大挑战!HIV感染也已经成为我国当前面临的重大公共卫生问题之一. HIV通过对CD4 T淋巴细胞亚群的破坏导致AIDS. CD4计数、病毒载量和全身营养状况是常用于评估HIV感染者病情、预后及疗效的最常用指标[5]. HIV感染者合并外科疾病并需要手术者也不断增多. 关于HIV感染者外科手术安全性和适应症的研究日益受到重视.
国内外已有一些关于外科手术对HIV感染者免疫功能影响的研究. Jiang等[1]将微芯片技术用于HIV感染者的研究, 认为HIV主要攻击人体免疫系统中的CD4 T淋巴细胞、巨噬细胞和树突状细胞. 有研究[6-9]通过对HIV感染者腹腔镜手术前后免疫功能的对比观察认为腹腔镜手术可以短暂、轻度抑制细胞免疫, 对体液免疫无明显影响, 并认为术前检查CD4≥200 cell/μL可确保手术安全性. 但这些研究大多样本量较少, 而且缺乏对照, 尤其是缺乏针对不同免疫力缺陷程度患者的分层对比研究.
我们设计了前瞻性分层对比研究. HIV感染按照WHO分级标准[10], 根据术前1天(D0)CD4计数水平(cell/μL)分为3层, Ⅰ≥500>Ⅱ≥200>Ⅲ≥0, 加上阴性对照组(同期随机选择的非HIV感染者)共分为4层(组). 为减少混杂影响, 研究对象年龄控制在18-65岁, 并且剔除术前2 wk内曾使用过糖皮质激素或免疫抑制剂的患者. 由于各层组术前1d(D0)CD4计数基数不同, 为更本质地反映各组变化趋势和幅度, 我们还观察分析了各组手术前后3次CD4计数的"相对比"(与D0的相对百分比)的变化情况.
结果显示, 手术前后3次检测中, 白细胞计数、中性粒细胞率、淋巴细胞率、CD8计数差异无统计学意义, 可能LC手术相对创伤较小、对其的影响不显著. 每组组内手术前后CD4计数差异有统计学意义(P<0.0001). 进一步分析发现, 不同组别之间的差异效应有统计学意义、时间与组别有交互效应(P<0.0001). 而且各组CD4计数都有"先降后升"(先抑制后恢复)的变化过程. 这种趋势在(为矫正CD4计数基数差异的影响)将其转化为相对比后更显著(图1, 2).
本研究显示: 不同层(组)的下降和回升的速度(斜率)及幅度不同. 各组CD4计数D3下降速度及幅度排序: HIV-Ⅰ<HIV+Ⅰ<HIV+Ⅱ<HIV+Ⅲ, CD4计数D7回升速度及幅度排序正好相反: HIV-Ⅰ>HIV+Ⅰ>HIV+Ⅱ>HIV+Ⅲ. 其影响过程还体现出从HIV-Ⅰ组的"V"型到HIV+Ⅲ组的"L"型的渐变规律. 这表明病情越重(CD4破坏越多、计数越低), 手术麻醉对其免疫抑制越明显, 其免疫恢复也更慢. 其中HIV-Ⅰ组D7超过D0 (D7/D0 = 102.9%), 可能与其免疫系统受到刺激后产生代偿性反应性增生有关. HIV+Ⅰ组虽然也表现出代偿, 但与术前CD4计数基数相当的HIV-Ⅰ组相比也体现出有统计学意义的差异, 可能与其代偿潜能已经受到一定程度的破坏有关.
创伤和应激可对机体免疫功能产生影响, 轻者可激发和增强免疫, 重者可导致免疫抑制. 其影响程度和持续时间与创伤的大小密切相关[11]. 创伤后机体T淋巴细胞总数可减少, 其中主要是属CD4 T细胞的Th细胞减少. 创伤后免疫细胞恢复速度与创伤严重程度和并发症情况有关, 一般数天至数周[5].
以LC为代表的微创手术近年来逐步用于合并HIV感染(有不同程度免疫缺陷)的外科患者. 卢春燕、张锡贵等证实腹腔镜手术创伤应激小、疼痛轻、恢复快、免疫抑制轻, 并认为HIV感染者CD4 T淋巴细胞≥200 cell/μL可以安全手术[12-16]. 本研究表明LC手术和插管全身麻醉引起了创伤和应激类似免疫抑制和恢复的过程. 本研究还提示手术产生的免疫抑制以及恢复的程度与CD4基数水平具有连续渐变的线性关系. 没有观察到明显的"分界线", 这表明: 所有HIV感染者的免疫功能都应给予重视, 即使CD4≥500 cell/μL也并非绝对安全.
通过规范、细致的围手术期处理(特别是HIV+Ⅲ组都经过包括营养支持和并发症处理等充分的术前准备; 与刘保池等[17]类似, CD4 T淋巴细胞<200 cell/μL者常规加用预防肺孢子虫和真菌感染的药物). 全部94例患者临床效果满意, 胆道疾病全部一期治愈, 无手术及麻醉相关并发症发生. 该研究表明: 通过正确把握手术适应症以及适当的围手术期处理, 对于伴HIV感染的胆道患者, 全麻下施行LC手术可以取得与非HIV感染者相似临床疗效.
总之, LC手术对CD4为主的细胞免疫功能有"先抑制后恢复"的影响过程. 其影响过程还体现出从HIV-Ⅰ组的"V"型到HIV+Ⅲ组的"L"型的渐变规律. HIV感染者免疫缺陷程度越重, 其免疫抑制越明显, 其免疫恢复也更缓慢. 对HIV感染者施行手术要正确把握手术适应症、重视免疫干预并且进行有针对性的围术期处理. 对于不同程度免疫缺陷的外科HIV感染者, 其手术安全性、手术适应症以及针对性的免疫干预等多个方面, 都还需要更多更深入的研究.
人类免疫缺陷病毒(human immunodeficiency virus, HIV)感染已成为全球性重大公共卫生问题!随着HIV感染的传播以及高效抗逆转录病毒治疗的推广, HIV感染者存活者越来越多, 这些伴有免疫缺陷的HIV感染者对医学的诸多领域提出了新的要求和挑战.
薛东波, 教授, 哈尔滨医科大学附属第一医院
HIV感染者施行手术治疗, 亟待解决以下问题: 手术对HIV感染者免疫功能的影响如何? 手术适应症如何把握? 如何规范有效地围手术期处理? 如何保证医患各方的安全?
本研究通过较大样本含量的前瞻性分层对照, 采用两因素多水平方差分析, 总结出手术对不同免疫缺陷程度HIV感染者细胞免疫影响的特征和规律. 为外科HIV感染者围手术期的免疫干预提供了理论依据.
本研究发现了腹腔镜胆囊切除术(laparoscopic cholecystectomy, LC)手术对HIV感染者细胞免疫影响的特征和规律; 文章强调对HIV感染者施行手术要正确把握手术适应症、重视免疫干预并且进行有针对性的围术期处理.这些规律和观点可用于启发和指导相关的科研和临床工作.
本文设计新颖科学, 统计规范明晰, 论证有理有据, 讨论深入有序. LC手术对HIV感染者细胞免疫影响的"先抑制后恢复"过程及其从"V"型到 "L"型的渐变规律等创新性发现对相关科研和临床都具有较大的启发和参考价值.
编辑: 田滢 电编:鲁亚静
| 1. | Jiang X, Spencer MG. Electrochemical impedance biosensor with electrode pixels for precise counting of CD4+ cells: a microchip for quantitative diagnosis of HIV infection status of AIDS patients. Biosens Bioelectron. 2010;25:1622-1628. [PubMed] [DOI] |
| 2. | Geocze L, Mucci S, De Marco MA, Nogueira-Martins LA, Citero Vde A. Quality of life and adherence to HAART in HIV-infected patients. Rev Saude Publica. 2010;44:743-749. [PubMed] [DOI] |
| 3. | 中华医学会编著. 临床诊疗指南-外科学分册. 北京: 人民卫生出版社 2006; 292-335. |
| 4. | 中华医学会感染病学分会艾滋病学组. 艾滋病诊疗指南. 中华传染病杂志. 2006;24:133-144 [doi: 10.3760/j.issn: 1000-6680.2006.02.021]. |
| 5. | Ni Choileain N, MacConmara M, Zang Y, Murphy TJ, Mannick JA, Lederer JA. Enhanced regulatory T cell activity is an element of the host response to injury. J Immunol. 2006;176:225-236. [PubMed] |
| 10. | Bahebeck J, Bedimo R, Eyenga V, Kouamfack C, Kingue T, Nierenet M, Sosso M. The management of musculoskeletal infection in HIV carriers. Acta Orthop Belg. 2004;70:355-360. [PubMed] |
| 11. | Broder S. The development of antiretroviral therapy and its impact on the HIV-1/AIDS pandemic. Antiviral Res. 2010;85:1-18. [PubMed] [DOI] |