修回日期: 2013-12-08
接受日期: 2013-12-15
在线出版日期: 2014-02-18
目的: 预测可能调控神经纤毛蛋白2(neuropilin-2, NRP2)的微小RNA(microRNA, miRNA), 鉴定其对NRP2的调控作用及可能的调控机制.
方法: 使用生物信息学软件预测可能调控NRP2的miRNA, 选择可能性最大的miRNA-486-5p进一步研究, 构建miRNA-486-5p过表达质粒, 采用脂质体法将质粒转染入人结肠癌细胞株SW620, 实时定量PCR(qRT-PCR)验证miRNA-486-5p的表达丰度, Western blot检测NRP2的表达, 双荧光素酶实验验证miRNA-486-5p对NRP2的调控机制.
结果: 生物信息学技术预测共有25条miRNA可能调控NRP2的表达, 结合文献选择miR-486-5p进一步研究; miR-486-5p过表达质粒转染SW620细胞后, 表达丰度升高, NRP2蛋白表达明显下调, 双荧光素酶实验证实miRNA-486-5p可与NRP2 mRNA 3'非转录区(3' untranslated region, 3'UTR)直接结合, 从而发挥对NRP2转录后翻译的抑制作用.
结论: miRNA-486-5p可调控的NRP2的表达, 其作用机制是通过结合NRP2 3'UTR而抑制NRP2 mRNA的正常翻译.
核心提示: 本研究应用生物信息学软件预测可能调控神经纤毛蛋白2(neuropilin-2, NRP2)的微小RNA, 选择可能性最大的miRNA-486-5p进一步研究, 上调SW620细胞miRNA-486-5p的表达量后, Western blot表明miR-486-5p可抑制NRP2的表达, 双荧光素酶实验证实miRNA-486-5p可与NRP2 mRNA 3'非转录区直接结合, 从而发挥对NRP2转录后翻译的抑制作用.
引文著录: 李明, 连海峰, 刘成霞, 马锋振, 谢书阳. 结肠癌中相关miRNA对NRP2调控的预测及鉴定. 世界华人消化杂志 2014; 22(5): 624-629
Revised: December 8, 2013
Accepted: December 15, 2013
Published online: February 18, 2014
AIM: To predict and identify the possible microRNAs (miRNAs) involved in regulating neuropilin-2 (NRP2) in colorectal carcinoma.
METHODS: Bioinformatic technique was used to predict the possible miRNAs which might participate in regulating NRP2. miR-486-5p, which is most possibly involved in regulating NRP2, was selected for further study. A miR-486-5p over-expressing plasmid was constructed and transfected into the human colorectal carcinoma cell line SW620 using Lipofectamine 2000. The expression of miR-486-5p in transfected cells was measured by quantitative real-time PCR (qRT-PCR). Western blot was conducted to detect the expression of NRP2 protein, and miR-486-5p targeting NRP2 3'UTR was verified by dual luciferase reporter assay.
RESULTS: Twenty-five possible NRP2-regulating miRNAs were predicted using bioinformatic software. By searching the literature, we chose miR-486-5p for further study. The expression of miR-486-5p in SW620 cells transfected with miR-486-5p over-expressing plasmid was obviously up-regulated. Western blot analysis revealed that miR-486-5p reduced the expression level of NRP2. Dual luciferase reporter assay demonstrated that miR-486-5p could directly target the NRP2 3'UTR.
CONCLUSION: miR-486-5p is involved in the post-transcriptional regulation of NRP2 by binding to the NRP2 3'UTR and interfering the normal translation of NRP2.
- Citation: Li M, Lian HF, Liu CX, Ma FZ, Xie SY. Prediction and identification of microRNAs involved in regulating neuropilin-2 in colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(5): 624-629
- URL: https://www.wjgnet.com/1009-3079/full/v22/i5/624.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i5.624
结直肠癌(colorectal carcinoma, CRC)在全世界范围内普遍高发, 其发病率在恶性肿瘤中居第4位, 术后复发和转移是结直肠癌患者的主要死因, 淋巴结转移是其最常见的转移途径, 也是判断患者预后及制定治疗方案的重要指标[1]. 神经纤毛蛋白2(neuropilin-2, NRP2)是一种单链跨膜糖蛋白, 首先作为神经导向因子semaphorins的受体而被发现的[2]. 新近发现NRP2可以与VEGFR3形成受体复合物, 促进淋巴管生成[3]. 多项研究表明NRP2在肿瘤中发生发展中其重要作用: Gray等[4]研究发现NRP2在结直肠癌组织高表达, 周琪等[5]发现结直肠组织中NRP2高表达, 并与肿瘤的淋巴结转移及肿瘤微淋巴管密度(micro-lymphatic density, MLD)呈正相关. 目前关于NRP2在肿瘤中上调机制仍不明确, 研究其作用机制可为针对淋巴结转移的生物靶向治疗、预防结直肠癌的转移和复发及提高肿瘤患者的生存率提供理论依据. miRNA是一类长约22 nt的非编码小RNA, 作为基因转录后调控因子, 可抑制靶蛋白的转录后翻译, 由于miRNA作用于靶基因时只需其种子区域(seed region, 第2个至第8个核苷酸)完全匹配, 而不需要完全配对结合, 故一条miRNA可调控多个靶基因, 一个靶基因受多条miRNA的调控[6]. 研究证明异常表达的miRNA在肿瘤的发生发展过程中起着重要的作用. 我们推测NRP2在结直肠癌中的高表达可能与异常表达的miRNA相关, 故研究NRP2调控相关的miRNA可为结直肠癌的生物靶向治疗提供新的研究方向. 本实验通过生物信息学技术及相关文献筛选高度可能调控NRP2的miRNA, 并验证其对NRP2的作用及机制.
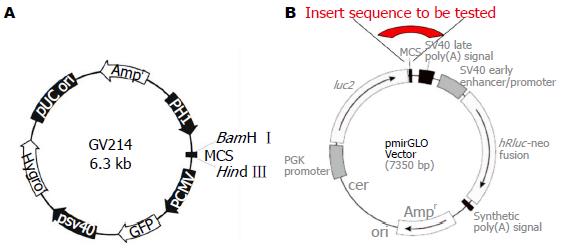
结肠癌细胞株SW620购自武汉博士德公司; miRNA-486-5p过表达质粒(GV214-miR)由上海吉凯公司构建、合成: 合成miRNA-486-5p前体序列并在两端设计BamHⅠ/HindⅢ酶切位点, 插入GV214多克隆位点, 该载体以绿色荧光蛋白(green fluorescent protein, GFP)为报告基因, 同时构建阴性质粒(GV214-NC); 双荧光素酶报告质粒(pmirGLO Vector)由上海吉玛公司构建合成: 全基因合成NRP2 3'UTR, 并在两端设计酶切位点, 插入荧光虫荧光素酶(firefly luciferase)3'UTR的克隆位点, 该质粒同时包含海肾荧光素酶(renilla luciferase)基因, 作为内参验证其转染效率(图1). RPMI 1640培养基、标准胎牛血清、0.25%胰蛋白酶(Hyclone公司); Lipofectamine 2000(Invitrogen公司); 兔抗人NRP2多克隆抗体(英国Abcam公司); BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒、GAPHD兔单克隆抗体、硝酸纤维素膜、双荧光素酶报告基因检测试剂盒(碧云天生物技术研究所); 总RNA提取试剂、逆转录试剂盒、实时荧光定量 PCR试剂盒(大连宝生物公司); 荧光实时定量PCR引物: 广州锐博有限公司设计合成.
1.2.1 TargetScan软件预测NRP2调控相关的miRNA: 利用TargetScan软件预测可能的NRP2调控相关的miRNA, 结果显示共有25条miRNA可能参与了NRP2转录后调控(表1). NRP2在结肠癌中表达上调, miRNA对靶基因的表达是通过结合靶基因3'UTR而抑制基因的表达, 故在癌组织应表达下调的miRNA才有可能对NRP2具有转录后的调控作用. 因此我们首先查阅所有TargetScan预测miRNA的相关文献, 首先排除掉无文献支持、预测评分较低和某些表达上调的miRNA, 然后在剩下的miRNA中选择与肿瘤密切相关的miRNA进一步研究. 结合文献、预测评分, 我们采用miR-486-5p作为目的miRNA作为研究对象. miRNA-486-5p在包括结直肠癌在内的多个肿瘤中表达下调, 并与肿瘤淋巴结转移密切相关. 利用miRanda(v1.9)软件预测miR-486-5p的潜在靶基因, 结果显示NRP2为其可能靶基因, 因此本实验选择miRNA-486-5p进一步研究.
| 编号 | miRNA | Position of NRP2 3'UTR | Context score |
| 1 | has-miR-4433 | 79-86 | 99 |
| 2 | has-miR-876-5p | 85-92 | 99 |
| 3 | has-miR-3167 | 85-92 | 98 |
| 4 | has-miR-371-5p | 107-114 | 98 |
| 5 | has-miR-216b | 112-119 | 97 |
| 6 | has-miR-571 | 76-82 | 90 |
| 7 | has-miR-4298 | 53-59 | 88 |
| 8 | has-miR-1302 | 53-59 | 86 |
| 9 | has-miR-4768-3p | 80-86 | 85 |
| 10 | has-miR-3913-3p | 50-56 | 84 |
| 11 | has-miR-3145-3p | 100-106 | 82 |
| 12 | has-miR-486-5p | 30-36 | 81 |
| 13 | has-miR-4459 | 80-86 | 79 |
| 14 | has-miR-371b-5p | 108-114 | 78 |
| 15 | has-miR-452 | 63-69 | 75 |
| 16 | has-miR-1290 | 86-92 | 73 |
| 17 | has-miR-1255a | 72-78 | 69 |
| 18 | has-miR-4676-3p | 32-38 | 68 |
| 19 | has-miR-216a | 113-119 | 68 |
| 20 | has-miR-622 | 43-49 | 67 |
| 21 | has-miR-1255b | 72-78 | 66 |
| 22 | has-miR-339-5p | 32-38 | 59 |
| 23 | has-miR-140-3p | 26-32 | 50 |
| 24 | has-miR-4760-5p | 59-65 | 50 |
| 25 | has-miR-1267 | - | Too close to ORP |
1.2.2 细胞培养: SW620细胞以含10%胎牛血清的RPMI 1640培养基在37 ℃、5%CO2的培养箱中常规培养, 每2-3天用0.25%的胰蛋白酶消化、传代, 取对数期细胞用于实验.
1.2.3 miRNA-486-5p过表达质粒瞬时转染SW620细胞: 取对数生长期细胞1×106个接种于6孔板, 置于37 ℃、5%CO2的培养箱中培养至细胞密度70%后, 将细胞分为3组: 单纯RPMI 1640培养组、GV214-NC质粒转染组、GV214-miR过表达质粒转染组, 将培养基换成无血清无双抗的1640培养基(每孔1 mL), 质粒及转染试剂Lipofectamine 2000分别用100 μL 1640培养基稀释后, 以质粒(μg): 脂质体(μL) = 1:2的比例混匀后静置30 min, 逐滴加入并轻晃混匀, 培养6 h后换为含完全培养基, 48 h后收集细胞进行下一步分析.
1.2.4 实时定量PCR检测miRNA-486-5p丰度: 转染48 h后收集细胞, (1)按照TRIzol试剂说明提取总RNA, 1%的琼脂糖变性凝胶电泳检测RNA的完整性, 紫外可见分光光度计检测RNA的纯度和浓度; (2)按逆转录试剂盒逆转录得到cDNA, 反应条件如下: 70 ℃ 10 min、冰浴2 min、42 ℃ 60 min、70 ℃ 10 min; (3)PCR反应参数设置: 95 ℃ 20 s; 95 ℃ 5 s, 60 ℃ 20 s, 72 ℃ 5 s, 40个循环, 每个样品做3个平行管, 每次实验至少重复3次; (4)数据分析miRNA-486-5p相对表达水平用2-∆∆Ct方法计算(Ct值是目标扩增产物打到设定阈值所经历的循环数), 内参为U6基因.
1.2.5 Western blot检测各组细胞NRP2蛋白的表达: 细胞转染48 h后, 提取总蛋白, BCA蛋白浓度测定试剂盒测定蛋白浓度, 取50 μg变性处理的蛋白质加入SDS-聚丙烯酰胺凝胶小孔进行电泳(浓缩胶层80 V, 分离胶层120 V), 电泳后于冰上0.25 mA转膜2 h 10 min, 丽春红染色观察转移效果满意后, TBST缓冲液洗膜后5%脱脂奶粉与摇床上孵育2 h, 加入一抗(1:500兔抗人NRP2多抗, 1:5000兔抗人GAPDH单抗)4 ℃封闭过夜, 洗膜后加入羊抗兔IgG/HRP二抗(1:2000)室温孵育1 h, 增强化学发光法(ECL)显影得到蛋白印记条带, 以Tanon软件分析条带灰度值.
1.2.6 双荧光素酶实验: 取对数生长期细胞接种于96孔板, 置于37 ℃、5%CO2的培养箱中培养至细胞密度70%后, 将细胞分为3组: 只转染pmirGLO质粒组、共转染GV24-miR质粒和pmirGLO质粒组、共转染GV214-NC和pmirGLO质粒组; 转染方法同前. 转染48 h后吸尽细胞培养液后加入报告基因细胞裂解液, 每孔加入萤火虫荧光素酶检测缓冲液100 μL, 把96孔板放入多功能酶标仪内测定RLU(relative light unit), 检测完成后加入海肾荧光素酶检测工作液, 同样测定RLU. 用萤火虫荧光素酶测定得到的RLU值除以海肾荧光素酶测定得到的RLU值, 作为其荧光素酶活性的相对值.
统计学处理 实验数据以mean±SD表示, 单因素方差分析比较各组间差异, 实验所得数据资料采用SPSS19.0统计分析软件分析, P<0.05为差异有统计学意义.
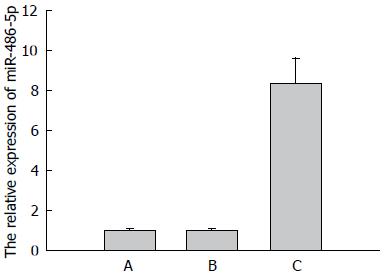
miR-486-5p及U6扩增曲线均为典型S型曲线, 溶解曲线呈单峰且溶解温度均一, 表明引物特异性好, qRT-PCR结果可靠. 分析结果显示: GV214-miR质粒转染组中miRNA表达明显上调, 相对定量显示其表达量约为未转染组的8倍(P<0.05), 转染GV214-NC质粒组则无明显变化(P>0.05)(图2).
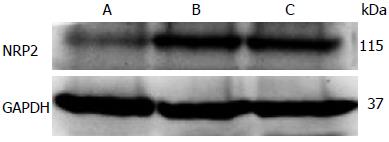
Western blot分析结果显示, 各组细胞β-actin蛋白杂交条带亮度相似, 但NRP2条带亮度有明显差异. 与空白对照组(0.71±0.04)相比, 转染GV214-miR质粒组(0.36±0.06)NRP2表达明显下调(P<0.05), 转染GV214-NC质粒组(0.65±0.07) 则无明显差异(P>0.05)(图3).
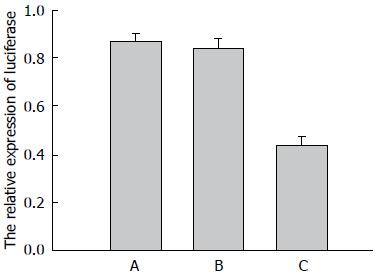
为了研究miR-486-5p是否直接调控NRP2的表达, 我们构建了双荧光素酶报告基因载体, 采用荧光素酶报告基因实验进行检测. 结果显示: 和单独转染双荧光素酶质粒pmirGLO的空白对照组相比, 共转染GV214-miR和pmirGLO质粒组荧光素酶活性明显降低(P<0.05), 而共转染GV214-NC和pmirGLO质粒组荧光素酶无明显改变(P>0.05)(图4).
CRC是消化系最常见的恶性肿瘤之一, 尽管采取手术、放疗、化疗等综合治疗措施, 其疗效仍不理想. 浸润和转移是包括结直肠癌在内的多数恶性肿瘤的基本特征, 也是其死亡的主要原因, 该过程涉及多个信号通路[7]. 早期CRC主要通过淋巴管向局部淋巴结转移, 研究证明结直肠癌周围存在许多扩张状的新生淋巴管, 为其淋巴结转移提供了条件, 目前关于淋巴结转移的具体分子学机制尚不明确[8]. NRP2是近年来被发现血管内皮生长因子(vascular endothelial growth factor, VEGF)家族的新型受体, 与VEGFR-3形成共受体, 促进淋巴管生成, 有研究证明NRP2在多种肿瘤中表达上调, 并与淋巴结转移密切相关, Caunt等[9]在动物实验中使用针对NRP2上与VEGF-C结合的b1b2结构域的特异性抗体阻断NRP2功能后, 出现肿瘤转移至哨淋巴结及远隔器官的减少的现象, 证实其在肿瘤淋巴管生成及肿瘤远处转移中起着重要作用. NRP2在结直肠癌中上调的机制尚不明确, 研究上调机制对于针对结直肠癌淋巴结转移的靶向治疗有着重大的临床意义. miRNA是一类内源性转录后调控因子, 可通过与靶基因mRNA的3'UTR结合抑制其翻译, 调控大约30%的蛋白编码基因的表达, 从而广泛参与发育时序调控、细胞分化、凋亡等各种过程[10]. miRNA的基因突变或表达异常导致其下游靶蛋白的异常表达, 参与包括肿瘤在内的多种疾病发生发展过程. 大量研究表明miRNA在肿瘤中既可作为抑癌基因, 下调原癌基因的活性, 也可作为癌基因, 下调抑癌基因的活性, miRNA在肿瘤转移中的调控作用亦被证实[11]. 本研究旨在预测可能调控NRP2的miRNA, 并验证其对NRP2的调控作用和机制.
生物信息学技术是使用不同的预测软件(主要包括TargetScan、PicTar、miRanda、EMBL、EIMM、PITA), 分析miRNA的序列或靶基因mRNA 3'UTR 的序列, 这些软件使用不同的参数预测miRNA和靶基因mRNA 3'UTR上互补配对的种子序列. 对于一个给定的miRNA可以预测出其所有的靶基因mRNA , 同时也可以根据给定的基因mRNA 3'UTR序列, 则可以预测出此基因的可能相关miRNAs以及结合位点的种子序列. 由于不同的预测工具有不同的计算方法, 会预测出不同的miRNA或靶mRNA以及互补配对的位点, 因此需要使用多个预测工具进行预测, 并结合相关文献, 选择软件中预测出来的有高度的重叠性miRNA或靶基因, 进一步用相关实验进行验证[12]. 本研究首先使用TargetScan 软件预测了25条可能调控NRP2的miRNA. 结合相关文献, 初步筛选可能性较大的miRNA: Tan等[13]使用微阵列实验检测肺癌及癌旁组织中差异表达的miRNA并qRT-PCR验证其准确性, 结果显示miRNA-486-5p表达明显下调, 可作为区分肺癌的分子标志物. Navon等[14]使用微阵列方法证实miRNA-486-5p在胰腺癌、结肠癌、肝癌、肺癌、淋巴瘤、卵巢癌、前列腺癌、睾丸癌的表达均下调. Oh等[15]发现miRNA-486-5p在胃癌中表达明显下调, 且与胃癌淋巴结转移密切相关. miRanda(v1.9)软件显NRP2是miRNA-486-5p的潜在靶基因之一, 因此我们选择miRNA-486-5p作进一步研究.
我们使用miRNA-486-5p过表达质粒转染结肠癌细胞SW620, 使用Western blot验证其对NRP2蛋白表达的影响, 证实miRNA-486-5p可抑制SW620细胞NRP2的表达, 虽然该方法能确定NRP2与miRNA-486-5p的调控相关性, 但不能鉴定miRNA-486-5p的靶位点. 为进一步确定miRNA-486-5p是直接与NRP2 3'UTR直接作用, 我们进行了双荧光素酶实验. 目前双荧光素酶实验是最常用的miRNA靶位点鉴定方法, 其原理是构建荧光素酶表达载体, 将希望鉴定的miRNA靶基因的3'UTR克隆到含荧火虫荧光素酶基因标记的报告质粒中, 然后将构建好的载体与miRNA过表达质粒同时转染细胞, 最后检测荧光素酶的活性以分析转染3'UTR中是否含有miRNA的靶位点. 如果相应基因的3'UTR 内含有miRNA的结合位点, 则细胞内上调的miRNA将结合于靶基因3'UTR, 阻碍萤火虫荧光素酶的翻译. miRNA-486-5p过表达质粒与含有NRP2 3'UTR的双荧光素酶载体共转染SW620细胞时, 萤火虫荧光素酶活性明显降低, 证实miRNA-486-5p是通过结合在NRP2 3'UTR而发挥对NRP2的抑制作用.
总之, 本研究使用生物信息学技术预测NRP2调控相关的miRNA, 从中选择miRNA-486-5p进一步研究, 结果表明miRNA-486-5p可抑制NRP2的表达, 双荧光素酶实验证实miRNA-486-5p可直接作用于NRP2 3'UTR, 提示NRP2可能为miRNA-486-5p的靶基因, 为结直肠癌的防治提供了新的靶点.
结直肠癌是消化系统最常见的恶性肿瘤之一, 在全世界范围内普遍高发, 淋巴结转移是其最常见的转移途径, 也是预示患者肿瘤复发及死亡的强有力指标. 神经纤毛蛋白2(neuropilin-2, NRP2)在结直肠癌淋巴结转移中起着重要作用, 其在结直肠癌中表达上调的机制尚不明确. MiRNA作为内源性、非编码调节RNA在肿瘤相关蛋白的表达中起着重要作用, 研究NRP2调控相关miRNA对于结直肠癌的治疗具有重要的临床意义.
王鲁平, 主任医师, 北京军区总医院病理科
本研究首先应用生物信息学软件预测可能调控NRP2的微小RNA, 结合文献选择可能性最大的miRNA-486-5p深入研究, 通过转染、Western blot及荧光素酶实验证实了其对NRP2的直接调控作用, 丰富了NRP2调控的理论体系, 为结直肠癌的防治提供新的研究方向.
Gray等研究发现NRP2在结直肠癌组织高表达, 并在体外实验证实抑制NRP2的表达可促进细胞凋亡, 抑制其增殖和迁移. MiR-486-5p在胰腺癌、结肠癌、肝癌、肺癌、淋巴瘤、卵巢癌、前列腺癌、睾丸癌均表达下调.
本文将生物信息学技术和转染、Western blot、荧光素酶实验结合起来, 首次验证了miR-486-5p与NRP2之间的调控关系, 为结直肠的基因诊断及基因治疗的研究提供了新的理论依据和治疗靶点.
本文发现miR-486-5p在结直肠癌中参与NRP2的调控, 说明其在结直肠癌淋巴结转移中的重要临床意义, 提示miR-486-5p可作为NRP2潜在的治疗靶位, 并可作为结直肠癌诊断及预后的判断的分子标志, 对于结肠癌的早期诊断和治疗具有重要意义.
本文设计合理, 科学性较强, 层次清楚. 为结肠癌基因治疗的研究提供了新的理论依据和治疗靶点.
编辑: 田滢 电编:鲁亚静
| 1. | Higa R. [Colorectal cancer: epidemiology and primary profilaxis]. Acta Gastroenterol Latinoam. 2011;41:70-73. [PubMed] |
| 2. | He Z, Tessier-Lavigne M. Neuropilin is a receptor for the axonal chemorepellent Semaphorin III. Cell. 1997;90:739-751. [PubMed] |
| 3. | Ellis LM. The role of neuropilins in cancer. Mol Cancer Ther. 2006;5:1099-1107. [PubMed] |
| 4. | Gray MJ, Van Buren G, Dallas NA, Xia L, Wang X, Yang AD, Somcio RJ, Lin YG, Lim S, Fan F. Therapeutic targeting of neuropilin-2 on colorectal carcinoma cells implanted in the murine liver. J Natl Cancer Inst. 2008;100:109-120. [PubMed] [DOI] |
| 6. | Petri A, Lindow M, Kauppinen S. MicroRNA silencing in primates: towards development of novel therapeutics. Cancer Res. 2009;69:393-395. [PubMed] [DOI] |
| 7. | Vather R, Sammour T, Zargar-Shoshtari K, Metcalf P, Connolly A, Hill A. Lymph node examination as a predictor of long-term outcome in Dukes B colon cancer. Int J Colorectal Dis. 2009;24:283-288. [PubMed] [DOI] |
| 8. | Dekker JW, Peeters KC, Putter H, Vahrmeijer AL, van de Velde CJ. Metastatic lymph node ratio in stage III rectal cancer; prognostic significance in addition to the 7th edition of the TNM classification. Eur J Surg Oncol. 2010;36:1180-1186. [PubMed] [DOI] |
| 9. | Caunt M, Mak J, Liang WC, Stawicki S, Pan Q, Tong RK, Kowalski J, Ho C, Reslan HB, Ross J. Blocking neuropilin-2 function inhibits tumor cell metastasis. Cancer Cell. 2008;13:331-342. [PubMed] |
| 10. | Calin GA, Croce CM. MicroRNA-cancer connection: the beginning of a new tale. Cancer Res. 2006;66:7390-7394. [PubMed] |
| 11. | Kunej T, Godnic I, Horvat S, Zorc M, Calin GA. Cross talk between microRNA and coding cancer genes. Cancer J. 2012;18:223-231. [PubMed] [DOI] |
| 12. | Lewis BP, Shih IH, Jones-Rhoades MW, Bartel DP, Burge CB. Prediction of mammalian microRNA targets. Cell. 2003;115:787-798. [PubMed] |
| 13. | Tan X, Qin W, Zhang L, Hang J, Li B, Zhang C, Wan J, Zhou F, Shao K, Sun Y. A 5-microRNA signature for lung squamous cell carcinoma diagnosis and hsa-miR-31 for prognosis. Clin Cancer Res. 2011;17:6802-6811. [PubMed] [DOI] |
| 14. | Navon R, Wang H, Steinfeld I, Tsalenko A, Ben-Dor A, Yakhini Z. Novel rank-based statistical methods reveal microRNAs with differential expression in multiple cancer types. PLoS One. 2009;4:e8003. [PubMed] [DOI] |
| 15. | Oh HK, Tan AL, Das K, Ooi CH, Deng NT, Tan IB, Beillard E, Lee J, Ramnarayanan K, Rha SY. Genomic loss of miR-486 regulates tumor progression and the OLFM4 antiapoptotic factor in gastric cancer. Clin Cancer Res. 2011;17:2657-2667. [PubMed] |