修回日期: 2013-12-04
接受日期: 2013-12-12
在线出版日期: 2014-02-08
目的: 探讨微小染色体维持蛋白7(mini-chromosome maintenance protein 7, MCM7)基因沉默后对人肝癌细胞系SMMC-7721增殖和凋亡的影响及可能作用机制.
方法: 利用RNA干扰技术, 构建4个靶向MCM7基因shRNA载体(MCM7-shRNA表达载体), 并对不同靶点进行有效筛选. 将人肝癌细胞系SMMC-7721接种于六孔板, 分为3组: 以MCM7基因沉默重组慢病毒颗粒(LV-shRNA-MCM7)感染SMMC-7721, 作为实验组; 以对照慢病毒颗粒(LV-shRNA-NC)感染SMMC-7721, 作为阴性对照组; 空白对照组常规培养, 不做任何处理. 应用RT-PCR、实时荧光定量PCR和Western blot技术检测MCM7基因mRNA和蛋白的表达, 评价干扰效果并筛选有效靶点; MTT法检测细胞体外增生能力, Giemsa染色法检测各组细胞的克隆形成; 流式细胞技术(flow cytometry, FCM)分别检测各组细胞增殖和凋亡的变化情况.
结果: 成功构建MCM7-shRNA表达载体, 经测序验证无误, 感染SMMC-7721细胞后, 细胞荧光显示感染率>90%, 内源性靶点得到确认. Western blot及Real-time PCR结果显示: 实验组的四种靶点MCM7-shRNA干扰序列中, 与阴性对照组和空白对照组比较, MCM7 mRNA和MCM7蛋白的表达水平下调均达50%以上, 其中以LV-shRNA-MCM7(4)靶点敲减效率最高, 分别达88.95%、87.89%和82.25%、81.63%, 差异具有统计学意义(P<0.05), 以此作为实验组. MTT法结果显示: 实验组细胞490 nm处的吸光度(A)值在转染后24、48、72和96 h时均低于阴性对照组、空白对照组, 差别显著(P<0.05). 同时Giemsa染色法结果显示: LV-shRNA-MCM7组的克隆形成率(6.00%±0.50%)明显低于空白对照组(14.10%±0.36%)、阴性对照组(13.73%±0.17%), 实验组细胞生长明显受到抑制(P<0.05). 流式细胞技术显示: 实验组较阴性对照组、空白对照组G1期延长, S期缩短, 差别显著(P<0.05). 实验组细胞凋亡率为(22.27%±1.22%), 明显高于阴性对照组(0.05%±0.07%)和空白对照组(0.03%±0.06%), 实验组较阴性对照组、空白对照组出现了明显的细胞凋亡(P<0.05).
结论: MCM7基因的RNAi重组体可以有效地抑制MCM7基因的表达, RNA干扰技术沉默MCM7基因能够抑制肝癌细胞的生长, 阻滞细胞期于G1期, 促进其凋亡.
核心提示: 本实验利用慢病毒为载体, 采用慢病毒转染法将MCM7-shRNA质粒转入人肝癌SMMC-7721细胞后, 肝癌细胞周期进程得到有效阻滞, 凋亡大幅增加, 可明显抑制肝癌生长增殖功能.
引文著录: 孙雯, 曹骥, 卢晓旭, 朱伶群, 杨春, 欧超, 骆成飘, 李瑗, 苏建家. RNA干扰技术沉默MCM7基因对人肝癌SMMC-7721细胞生物学行为的影响. 世界华人消化杂志 2014; 22(4): 553-562
Revised: December 4, 2013
Accepted: December 12, 2013
Published online: February 8, 2014
AIM: To investigate the effects of mini-chromosome maintenance protein7 (MCM7) gene silencing on the proliferation and apoptosis of human liver cancer SMMC-7721 cells and the possible mechanisms involved.
METHODS: Four vectors carrying shRNAs targeting the MCM7 gene (MCM7-shRNA expression vector) were constructed and were selected for effective targets. SMMC-7721 cells were divided into three groups: an experimental group, a normal control group and a negative control group. The experimental group was transfected with the recombinant lentivirirus vector (LV-shRNA-MCM7), the negative control was transfected with an control lentiviral vector (LV-shRNA-NC), and the normal control received no treatment. The mRNA and protein levels of MCM7 were analyzed by RT-PCR, quantitative real-time PCR (qPCR), and Western blot. Cell proliferation was detected by MTT assay, and cell colony formation was detected by Giemsa staining. Cell cycle progression and apoptosis were observed by flow cytometry (FCM).
RESULTS: MCM7-shRNA expression vectors were successfully constructed and verified by DNA sequencing. After transfecting SMMC-7721 cells with various vectors, cell fluorescence was observed in > 90% of cells. MCM7 mRNA and protein expression in the four MCM7-shRNA groups was down-regulated by > 50% compared with the negative control group and normal control group. The LV-shRNA-MCM7 vector had the highest efficiency and was used in subsequent experiments. MTT results showed that cell proliferation in the experimental group at 24, 48, 72 and 96 h after transfection was significantly lower than that in the negative control group and normal control group (P < 0.05 for all). Giemsa staining results showed that the colony formation rate was significantly lower in the experimental group than in the two control groups (6.00% ± 0.50% vs 14.10% ± 0.36%, 13.73% ± 0.17%, P < 0.05 for both). FCM analysis showed that the percentage of cells in G1 phase increased in cells transfected with the MCM7-shRNA (P < 0.05 for both). The apoptosis rate was significantly higher in the experimental group than in the negative control group and blank control group (22.27% ± 1.22% vs 0.05% ± 0.07%, 0.03% ± 0.06%, P < 0.05 for both).
CONCLUSION: RNAi-induced MCM7 down-regulation could inhibit cell growth, suppress cell colony formation, block the cell cycle at G1 phase, and induce cell apoptosis in SMMC-7721 cells.
- Citation: Sun W, Cao J, Lu XX, Zhu LQ, Yang C, Ou C, Luo CP, Li Y, Su JJ. Effects of RNA interference-mediated MCM7 knockdown on biological behavior of human liver cancer SMMC-7721 cells. Shijie Huaren Xiaohua Zazhi 2014; 22(4): 553-562
- URL: https://www.wjgnet.com/1009-3079/full/v22/i4/553.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i4.553
众所周知, 恶性肿瘤的发生发展是一个多因素、多阶段、多基因共同参与的过程. 其中一个显著特征是细胞具有自主生长特性, 即持续地分裂与繁殖. 细胞周期是一个有多种控制因子共同参与的精细平衡的过程, 这一过程的任何缺陷都可能导致遗传信息的改变, 从而导致肿瘤等各种疾病的发生. 研究发现, 细胞周期调控机制紊乱导致的细胞增殖失控是包括肝癌在内多种肿瘤发生的重要机制之一[1]. 微小染色体维持蛋白7(mini-chromosome maintenance protein 7, MCM7)作为DNA复制的准许因子, 可启动和参与DNA复制, 确保DNA的复制在每个细胞周期仅发生一次, 参与调节细胞增殖[2].
本课题组前期研究表明, MCM7蛋白在肝癌组织中呈高表达, 且发现MCM7蛋白表达与患者肝癌分期、转移及复发相关, 提示MCM7基因与肝癌的发生有关[3]. 为了进一步探讨MCM7基因在肝癌发展中的作用, 本研究应用RNA干扰技术, 构建靶向MCM7基因的shRNA载体, 转染人肝癌SMMC-7721细胞, 观察沉默MCM7基因表达后对细胞增殖和凋亡的影响, 为肝癌的分子靶向治疗研究打下基础.
人肝癌SMMC-7721细胞株购自中科院上海细胞研究所, shRNA靶点设计、4种同时带有绿色荧光蛋白(green fluorescent protein, GFP)和嘌呤霉素抗性筛选标记的MCM7基因沉默重组慢病毒颗粒LV-shRNA-MCM7(1、2、3、4)及对照慢病毒颗粒(LV-shRNA-NC)由上海吉凯基因技术有限公司包装; DMEM、胎牛血清和PBS购自Hyclone公司、TRIzol购自Invitrogen公司、逆转录试剂盒购自美国Fermentas公司, 荧光定量PCR试剂盒购自TaKaRa宝生物工程(大连)有限公司、DNA Marker购自广州东盛生物科技有限公司. Western blot及IP细胞裂解液、苯甲基磺酰氟(phenylmethanesulfonyl fluoride, PMSF)、SDS-PAGE蛋白上样缓冲液(5×)、BCA蛋白浓度测试试剂盒(增强型)、20×TBS缓冲液等均购自江苏碧云天生物技术研究所; 蛋白质预染Marker购自美国Fermentas(MBI)公司. PVDF膜购自美国Millipore公司. 细胞周期检测试剂盒购自南京凯基生物技术有限公司. 细胞凋亡试剂盒AnnexinV-PE/7-AAD购自美国Beckman Coulter公司(No. 735618). 噻唑蓝(MTT)、二甲基亚砜(DMSO)均购自北京Solarbio科技有限公司. Giemsa染液(ECM550)购自美国Chemicon公司. MCM7和GAPDH引物由上海生工生物工程公司合成. 兔抗人MCM7单克隆抗体购自美国Abcam公司, 鼠抗人GAPDH单克隆抗体购自北京中杉金桥生物技术有限公司; 近红外染料标记的二抗与Odyssey红外荧光成像仪购自美国LI-COR公司.
1.2.1 细胞培养: 人肝癌细胞株SMMC-7721在37 ℃、5%CO2条件下, 置于含10%胎牛血清、100 U/mL青霉素和100 U/mL链霉素的DMEM培养基中培养. 细胞随机分3组: 实验组(LV-shRNA-MCM7慢病毒转染组, 有4个靶点)、阴性对照组(LV-shRNA-NC空载质粒组)和空白对照组(未转染组). 实验用细胞均处于对数生长期.
1.2.2 细胞转染: 转染过程按照吉凯公司转染说明书进行, 转染前12 h将对数生长期的人肝癌细胞系SMMC-7721接种于6孔板, 每孔种细胞数为6×105个/孔; 12 h后, 细胞融合率达到30%即进行转染; 转染的感染复数(multiplicity of infection, MOI)为30, 4个实验组中分别加入LV-shRNA-MCM7(1、2、3、4), 阴性对照组加入LV-shRNA-NC, 每组均设3个重复孔, 每孔均加入polybrene及感染增强液, 每孔液体总体积为1 mL, 继续在37 ℃、5%CO2培养箱中培养, 并在荧光倒置显微镜下观察荧光表达阳性率. 转染12 h后换含10%新生胎牛血清的高糖DMEM培养. 转染84 h后荧光最强, 转染后4-5 d收获细胞. 空白对照组细胞不做任何处理, 常规培养.
1.2.3 嘌呤霉素(puromycin)筛选稳定转染细胞株: 预实验确定嘌呤霉素抗性细胞的筛选浓度, 即药物处理48 h后SMMC-7721细胞全部死亡的最低药物浓度. 转染48 h后每孔加入1 μg/mL的嘌呤霉素作用于细胞, 筛选稳定转染的细胞(实验过程中必须设置空细胞的加药组, 以确保药物的有效性), 转染96 h后换液弃掉未转染进的无嘌呤霉素抗性的细胞, 之后继续使用含0.1 μg/mL嘌呤霉素的培养基培养细胞, 维持病毒整合后的稳定性.
1.2.4 RT-PCR、实时荧光定量PCR检测MCM7基因的mRNA表达及筛选有效靶点序列: 应用Primer 5.0软件设计引物, MCM7上游引物: 5'-GTGGAGATGGCGAGAG-3', 下游引物: 5'-ATGGCTTCATTCACATCTTC-3', 扩增片段146 bp; 内参GAPDH上游引物: 5'-AAGAAGGTGGTGAAGCAGGC-3', 下游引物: 5'-ACCACCCTGTTGCTGTAGCC-3', 扩增片段200 bp. 引物由上海捷瑞生物工程有限公司合成. TRIzol法分别提取6组细胞总RNA, 并逆转录为cDNA. 设置反应条件为: 95 ℃预变性30 s; 95 ℃变性5 s, 60 ℃退火30 s, 共40个循环. 同时扩增各个样本的目的基因和内参基因. 每组细胞设计3个重复孔. 采用2-△△Ct分析法, 通过GAPDH基因水平校正. Ct值为每个反应管内的荧光信号到达设定的域值时所经历的循环按公式"△CT = CT平均值(目的基因)-CT平均值(内参基因)"分别计算实验组、阴性对照组及空白对照组的△CT, 以阴性对照组RNA的△CT作为参照, 再按公式"△△CT = △CT实验组-△CT阴性对照组", 计算2-△△Ct, 2-△△Ct 即为MCM7 mRNA相对表达量. 根据结果确定有效靶点序列并进行后续试验.
1.2.5 Western blot检测MCM7蛋白表达: 提取各组细胞总蛋白, BCA法测定蛋白浓度, -80 ℃保存备用. 蛋白变性后每孔上样50 µg, 经10%SDS-PAGE胶上电泳, 100 mA电流条件下90 min转至PVDF膜, 用TBST配制5%脱脂牛奶封闭1 h, 用MCM7、GAPDH两张膜一抗4 ℃下孵育过夜(MCM7一抗稀释度为1:2000), 次日用TBST洗膜, 常温下孵育相应二抗(二抗稀释度均为1:10000)1 h, TBST洗膜5 min/次×3次. 采用Odyssey红外荧光成像仪对PVDF膜进行扫描, 获取图像, 并进行条带灰度值分析; 目的蛋白相对表达量 = 目的蛋白条带灰度值/内参蛋白条带灰度值.
1.2.6 MTT法分析细胞增殖: 将对数生长期的各组细胞接种于96孔板, 2×103/孔, 每组细胞均做5个复孔; 分别于种板后24、48、72、96 h 加入新鲜配制的MTT溶液(5 mg/mL)20 μL; 4 h后, 吸弃上清, 每孔加入150 μL DMSO, 振荡器震荡10 min, 充分溶解紫色结晶. 酶标仪测定各孔490 nm波长处吸光度(A)值, 取5个复孔的平均数, 绘制生长曲线.
1.2.7 Giemsa染色检测各组细胞的克隆形成: 取对数生长期细胞重悬, 将3组细胞以1000个/孔接种于6孔板, 每组设3个复孔, 置37 ℃、5%CO2及饱和湿度的细胞培养箱中培养2 wk, 当6孔板中出现肉眼可见克隆时即终止培养, 弃培养液, PBS浸洗细胞2次, 甲醇固定15 min, 去固定液, Giemsa染色30 min, 冲去染色液, 室温下空气干燥, 在显微镜下计数含50个细胞以上的细胞克隆数. 克隆形成率 = (每孔克隆数/每孔接种细胞数)×100%.
1.2.8 细胞周期检测: 取各组对数生长期细胞, 分别按105个/孔接种于6孔板中, 设置1个调机孔. 各组细胞经胰酶消化后, 计数板计数细胞, 每管取1×106个细胞; 预冷的PBS洗细胞3次, 最后一次1000 r/min, 离心1 min, 去上清; 每管加入100 μL RNase, 37 ℃水浴30 min; 每管再加入500 μL PI染液, 室温避光孵育30 min; 流式细胞仪上机检测, 实验重复3次.
1.2.9 细胞凋亡检测: 各组细胞经胰酶消化后, 每管取1×106个细胞, 预冷的PBS洗2次, 将细胞重悬于200 μL Binding Buffer中, 加2 μL AnnexinV-PE, 小心混匀, 冰上避光孵育15 min. 后加入100 μL Binding Buffer和1 μL 7-放线菌素D(7-aminoactinomycin D, 7-AAD), 2 h内上机检测细胞凋亡率. 实验重复3次.
统计学处理 应用SPSS16.0统计软件进行分析, 计量资料采用mean±SD表示, 计量资料多组间比较采用单因素方差分析(One-way ANOVA), P<0.05为差异有统计学意义.
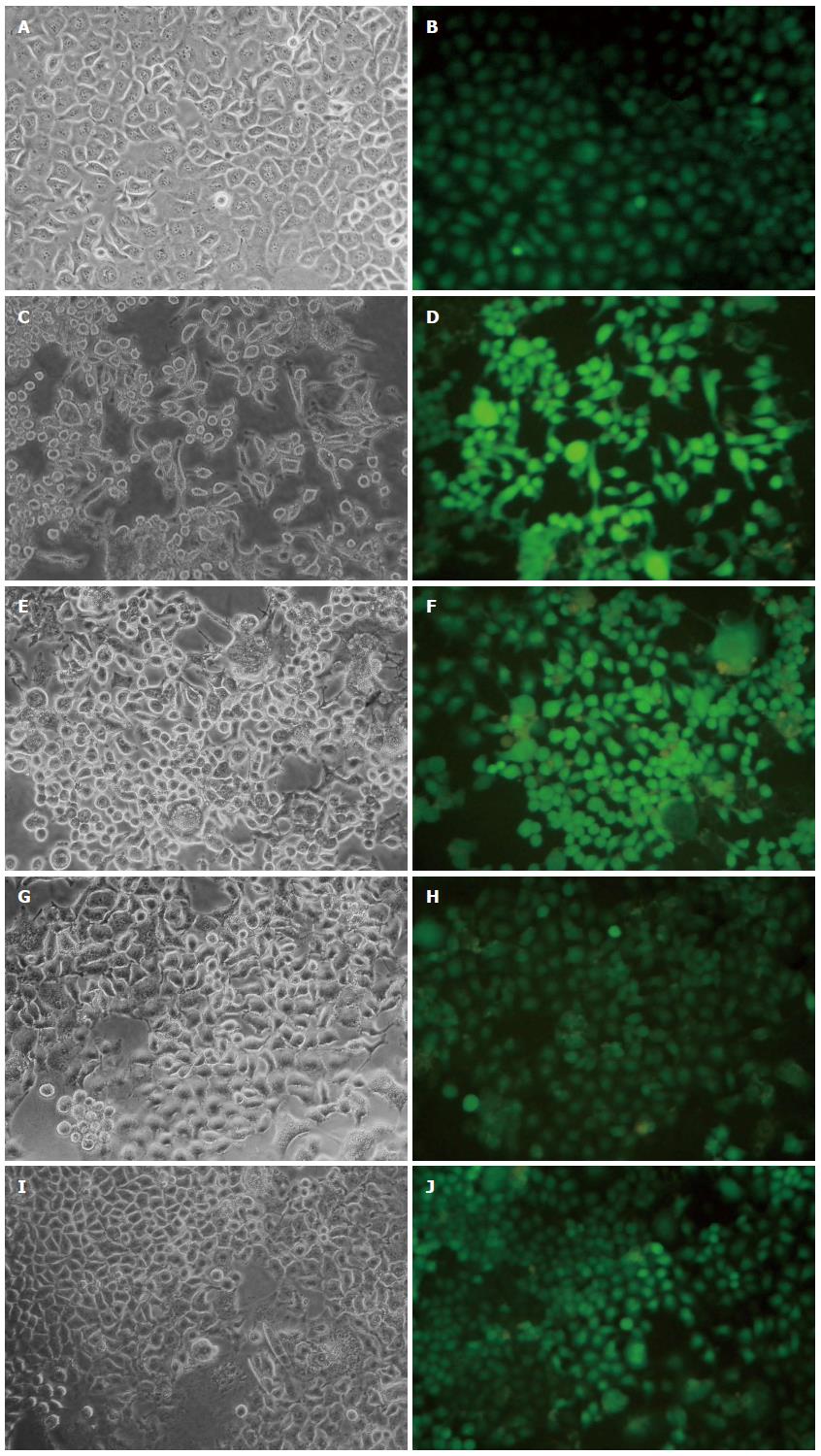
在MOI = 30的条件下, 4种慢病毒LV-shRNA-MCM7和阴性对照病毒LV-shRNA-NC感染SMMC-7721细胞, 48 h后加1 μg/mL的嘌呤霉素处理, 84 h后GFP(绿色荧光蛋白)表达率稳定增强, 荧光镜观察绿色荧光, 慢病毒感染效率>95%, 说明转染率>50%, 内源性靶点得到验证, 可进行实时定量PCR检测. 如图1所示, 在含有不同干扰序列的慢病毒转染后, 各组SMMC-7721细胞GFP荧光显色均匀一致, GFP荧光蛋白表达强度无明显差别, 提示各组细胞的慢病毒感染效率一致.
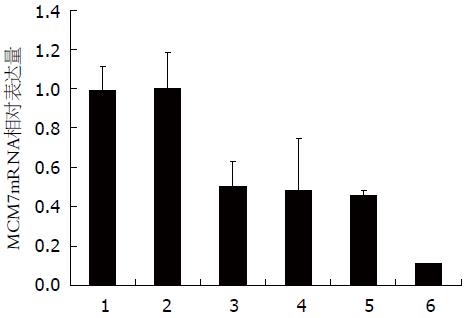
采用RT-PCR、实时荧光定量PCR的方法检测目的基因MCM7 mRNA的表达情况, 进而判断不同靶点的干扰效果. 4个靶点中, 相对NC组和空白对照组, 目的基因的表达水平下调均达50%以上, 其中以4号靶点敲减效率达88.95%和87.89%, 差异均有统计学意义(P<0.05), 所以LV-shRNA-MCM7(4)靶点是RNAi的最佳靶点. 阴性对照组和空白对照组相比较差异无统计学意义(P>0.05)(表1, 2, 图2).
| 各靶点序号 | 靶点序列 |
| LV-shRNA-MCM7(1) | 5'-GGAGAAAGAAGATGTGAAT-3' |
| LV-shRNA-MCM7(2) | 5'-TAGTAAGGATGCCACCTAT-3' |
| LV-shRNA-MCM7(3) | 5'-GGCATGAAGATGTGAAGAA-3' |
| LV-shRNA-MCM7(4) | 5'-GGACTCAATTTGTGAGAAT-3' |
| NC(Negative Control) | 5'-TTCTCCGAACGTGTCACGT-3' |
| 分组 | MCM7 mRNA相对表达量(2-ΔΔCt) |
| Control | 0.989±0.380 |
| LV-shRNA-NC | 1.005±0.126 |
| LV-shRNA-MCM7(1) | 0.500±0.180 |
| LV-shRNA-MCM7(2) | 0.485±0.130 |
| LV-shRNA-MCM7(3) | 0.460±0.263 |
| LV-shRNA-MCM7(4) | 0.110±0.022 |
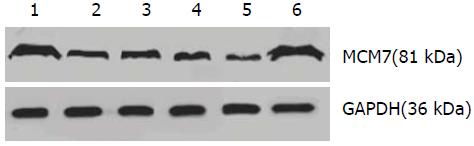
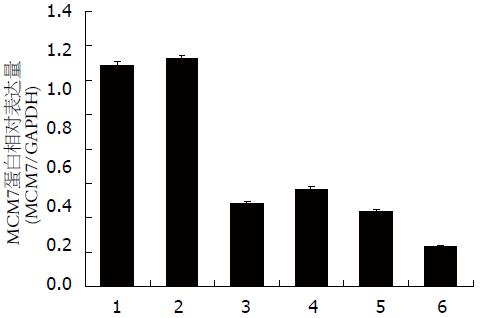
以GAPDH为内参照, 4组LV-shRNA-MCM7组蛋白相对表达量相比阴性对照组相对表达量分别减少了63.54%±0.84%、57.72%±1.07%、66.98%±0.57%、82.25%±0.16%, 且差异均有统计学意义(P<0.05), 均>50%, 并且通过数据可知LV-shRNA-MCM7(4)靶点是RNAi的最有效靶点, MCM7蛋白表达抑制率达82.25%. 相对空白对照组, MCM7蛋白表达抑制率达81.63%(P<0.05). 阴性对照组和空白对照组相比较差异无统计学意义(P>0.05)(表3, 4, 图3, 4).
| 分组 | MCM7蛋白相对表达量 |
| Control | 1.29±0.02 |
| LV-shRNA-NC | 1.33±0.01 |
| LV-shRNA-MCM7(1) | 0.49±0.01 |
| LV-shRNA-MCM7(2) | 0.56±0.01 |
| LV-shRNA-MCM7(3) | 0.44±0.00 |
| LV-shRNA-MCM7(4) | 0.24±0.00 |
| 分组 | 相对LV-shRNA-NC组蛋白表达抑制率 |
| Control | 3.38±1.72 |
| LV-shRNA-NC | 0.00±1.01 |
| LV-shRNA-MCM7(1) | 63.54±0.84 |
| LV-shRNA-MCM7(2) | 57.72±1.07 |
| LV-shRNA-MCM7(3) | 66.98±0.57 |
| LV-shRNA-MCM7(4) | 82.25±0.16 |
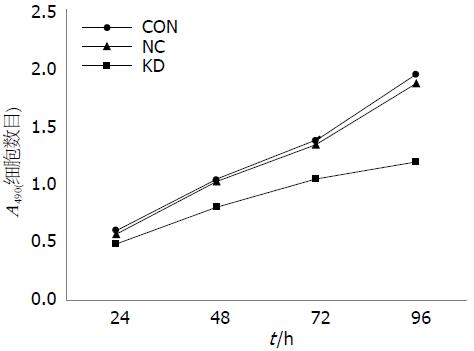
与空白对照组和阴性对照组相比, 实验组细胞490 nm处的A值在转染后24、48、72和96 h时均较低, 且差异均有统计学意义(0.49±0.07 vs 0.60±0.03, 0.57±0.03, F = 8.97; 0.80±0.12 vs 1.03±0.05, 1.02±0.09, F = 10.55; 1.05±0.06 vs 1.37±0.05, 1.34±0.03, F = 33.49; 1.19±0.07 vs 1.94±0.03, 1.87±0.08, F = 216.24, 均P<0.05). 由此可见, 实验组细胞生长明显受到抑制(表5, 图5).
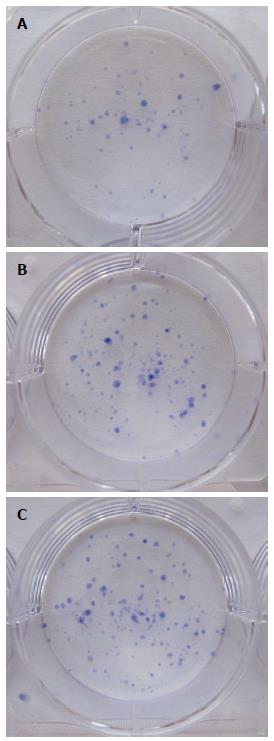
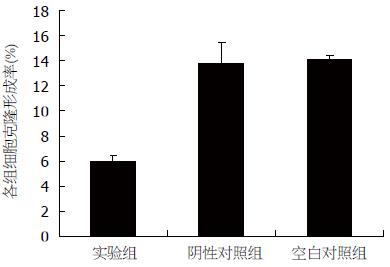
Giemsa染色法检测结果表明, 各组细胞克隆形成数不相等, 但LV-shRNA-MCM7组较空白对照组、阴性对照组均有所减少. LV-shRNA-MCM7组的克隆形成率(6.00%±0.50%)与空白对照组(14.10%±0.36%)、阴性对照组(13.73%±0.17%)比较, 差异有统计学意义(P<0.05); 空白对照组与阴性对照组比较(P>0.05), 差异无统计学意义(图6, 7).
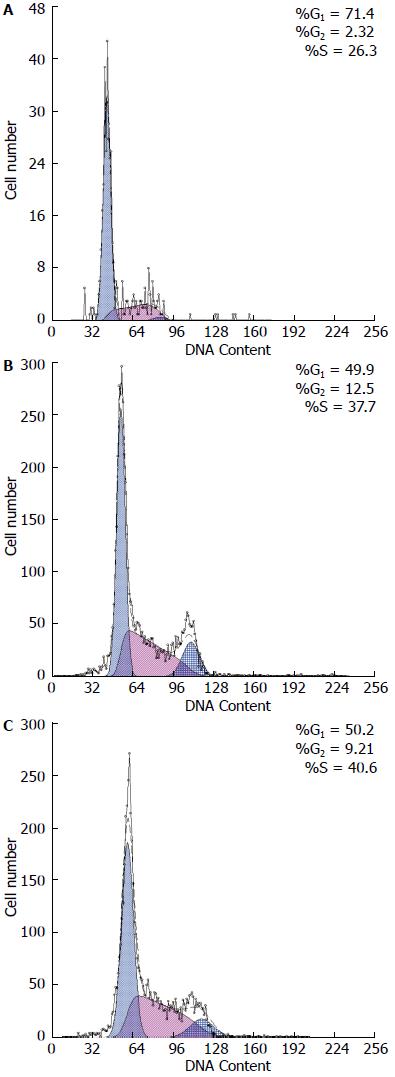
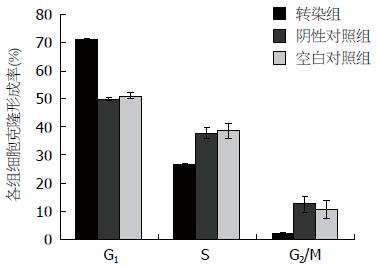
与阴性对照组和空白对照组相比, LV-shRNA-MCM7组SMMC-7721细胞G1期比例明显增多(71.13%±0.31% vs 49.9%±0.64%, 50.97%±1.16%, F = 697.87, P<0.05). 相比阴性对照组和空白对照组, 实验组G2期细胞比例明显减少(26.6%±0.30% vs 37.7%±1.98%, 38.53%±2.69%, F = 14.152, 均P<0.05), 同时实验组S期细胞比例也较阴性对照组和空白对照组明显减少(2.28%±0.06% vs 12.5%±2.72%, 10.51%±3.16%, F = 46.164, P<0.05). LV-shRNA-MCM7组SMMC-7721细胞G1期比例增高, S期比例降低(P<0.05). 阴性对照组和空白对照组比较差异无统计学意义(表6, 图8, 9).
| 分组 | G1期 | G2期 | S期 |
| 实验组 | 71.13±0.31 | 26.60±0.30 | 2.28±0.06 |
| 阴性对照组 | 49.90±0.64 | 37.70±1.98 | 12.50±2.72 |
| 空白对照组 | 50.97±1.16 | 38.53±2.69 | 10.51±3.16 |
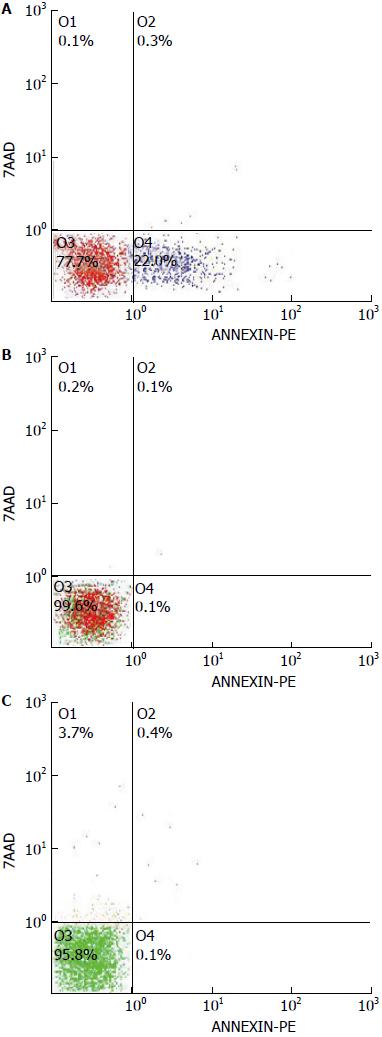
检测结果表明, LV-shRNA-MCM7组SMMC-7721细胞凋亡率为22.27%±1.22%, 明显高于阴性对照组(0.05%±0.07%)和空白对照组(0.03%±0.06%), 差异均有统计学意义(P<0.05). 阴性对照组和空白对照组上述指标比较差异无统计学意义(P>0.05)(图10).
MCM家族是一类在真核生物广泛存在的高度保守的蛋白质, 被认为是复制准许因子(replication licensing factor, RLF)中的一个重要成员, 在真核细胞的复制起始和延伸中发挥着重要的作用. MCM7作为MCM复合体的成分之一, 与其他MCM蛋白形成多聚体, 保证了DNA在一个细胞周期只复制一次, 是细胞周期调控、转录和细胞增殖重要的调节因子[4], 其在DNA复制调控中的重要作用也越来越引起人们的关注. MCM7基因组序列中的微小RNA簇(microRNAs)可下调多个抑癌因子及凋亡因子的表达[5]. 有研究发现, MCM7和MCM复合体上有多个潜在的磷酸化位点, 其自身或者靶蛋白磷酸化在DNA复制过程中起重要作用[6,7], RACK1参与并促进MCM7蛋白的磷酸化, 并使进入S期的细胞增多, 促进细胞增殖和克隆形成[8]. 此外还有研究报道, MCM7蛋白在TGF-β抑癌通路中起关键作用, Rb与MCM7相互结合可抑制DNA的复制, 而肿瘤的抑制因子TGF-β1可在细胞周期G1晚期到S期, 通过阻止Rb与MCM7分离而阻滞细胞周期从而发挥抑制肿瘤的作用, 若Rb丢失或MCM7过表达均可取消TGF-β1的作用, 从而失去其抑癌功能, 导致细胞进入异常的增殖周期, 进而促进肿瘤的进展[9].
目前研究发现, MCM7在众多肿瘤中异常表达, 如在乳腺癌、肺癌、霍奇金淋巴瘤和结肠癌中高表达[10-13], 与肿瘤发生发展密切相关. 有研究报道, MCM7蛋白在人肝癌组织中呈高表达, 对术后预测等有重要的意义[14,15]. 本课题组前期实验结果表明, MCM7蛋白不仅在人肝癌组织中高表达, 在大鼠和树鼩肝癌模型中亦呈高表达, MCM7极可能是肝癌发生发展中的关键作用分子.
已有研究表明, 在非小细胞肺癌中, MCM7可作为一个潜在的肿瘤治疗靶点[16], 通过特异性的小干扰RNA(siRNAs)抑制溴尿嘧啶的整合从而抑制MCM7的表达, 可明显抑制肺癌细胞的生长. 目前尚无MCM7基因沉默对肝癌细胞生长和增殖的影响的报道, 本实验利用慢病毒为载体, 采用慢病毒转染法将MCM7-shRNA质粒转入人肝癌SMMC-7721细胞中, 探讨沉默MCM7表达对SMMC-7721细胞增殖和凋亡的影响.
本实验中我们设计和合成了MCM7小分子干扰RNA, 将其转染进入人肝癌SMMC-7721细胞中后, 通过Western blot和RT-PCR结果显示, 实验组的四种靶点MCM7-shRNA干扰序列中, 和阴性对照组和空白对照组比较, MCM7 mRNA和MCM7蛋白的表达水平下调均达50%以上, 其中以4号靶点敲减效率最高, 分别达88.95%、87.89%和82.25%、81.63%. 所以LV-shRNA-MCM7(4)靶点是RNAi的最佳靶点. 说明慢病毒转染成功, 并且MCM7-shRNA慢病毒载体能有效的下调SMMC-7721细胞MCM7的表达.
流式细胞术检测发现, 与阴性对照组和空白对照组比较, 实验组细胞主要处于G1期, 处于S期的细胞所占比例明显减少, 且实验组凋亡率明显增加. MTT法检测结果显示实验组细胞增殖活力明显弱于空白对照组和阴性对照组. 同时Giemsa染色法试验结果显示实验组细胞克隆形成率明显低于空白对照组和阴性对照组, 与流式细胞术和MTT法检测结果相符. 提示可能是MCM7直接或间接的参与到肝癌细胞周期的调控, 使细胞分裂停滞在G1期附近, 进而抑制肝癌细胞的增殖.
因此, 本研究结果表明, MCM7 RNA干扰后肝癌细胞周期进程得到有效阻滞, 凋亡大幅增加, 可明显抑制肝癌生长增殖功能. MCM7基因有可能成为肝癌基因治疗的一个有效靶点.
肝细胞肝癌(hepatocellular carcinoma, HCC)是世界三大癌症之一, 大多数患者就诊时已属晚期, 具有发病率高、致死率高、预后较差、目前尚无有效治疗手段等特点. 及早对其进行有效干预是改善其疗效的关键. 研究发现, 细胞周期调控机制紊乱导致的细胞增殖失控是肿瘤发生的重要机制之一.
单云峰, 副主任医师, 温州医学院第一附属医院肝胆外科
微小染色体维持蛋白7(miniehromosome maintenanceprotein 7, MCM7)作为DNA复制的准许因子, 可启动和参与DNA复制, 参与调节细胞增殖. 近年来, 越来越多的研究发现MCM7与肿瘤的发生发展、恶性转化密切相关.
本课题组前期实验结果表明, MCM7不仅在人肝癌组织中高表达, 在大鼠和树鼩肝癌模型中亦呈高表达, 且发现MCM7蛋白表达与患者肝癌分期、转移及复发相关, 提示MCM7基因与肝癌的发生有关, MCM7极可能是肝癌发生发展中的关键作用分子.
目前尚无MCM7基因沉默对肝癌细胞生长和增殖的影响的报道, 本实验利用慢病毒为载体, 采用慢病毒转染法将MCM7-shRNA转入人肝癌SMMC-7721细胞中, 探讨沉默MCM7表达对SMMC-7721细胞增殖和凋亡的影响.
本研究结果表明, MCM7 RNA干扰后肝癌细胞周期进程得到有效阻滞, 凋亡大幅增加, 可明显抑制肝癌生长增殖功能. MCM7基因有可能成为肝癌基因治疗的一个有效靶点.
MCM7: 微小染色体维持蛋白家族是一类在真核生物广泛存在的高度保守的蛋白质, 在真核细胞的复制起始和延伸中发挥着重要的作用. MCM7作为MCM复合体的组成成分之一, 与其他MCM蛋白形成多聚体, 保证了DNA在一个细胞周期只复制一次.
RNA干扰(RNA interference, RNAi): 在进化过程中高度保守的、由双链RNA(double-stranded RNA, dsRNA)诱发的、同源mRNA高效特异性降解的现象. 由于使用RNAi技术可以特异性剔除或关闭特定基因的表达, 所以该技术已被广泛用于探索基因功能和传染性疾病及恶性肿瘤的基因治疗领域.
本文选题新颖, 方法科学, 通过RNA干扰抑制肝癌细胞系中MCM7的表达, 同时检测对细胞增殖、细胞克隆形成及细胞周期的影响, 结果能客观的支持研究的结论. 对MCM7在肝细胞癌生长中的作用研究有非常重要的理论价值.
编辑: 郭鹏 电编:闫晋利
| 2. | Walters AD, Chong JP. Methanococcus maripaludis: an archaeon with multiple functional MCM proteins? Biochem Soc Trans. 2009;37:1-6. [PubMed] [DOI] |
| 4. | Nowińska K, Dzięgiel P. [The role of MCM proteins in cell proliferation and tumorigenesis]. Postepy Hig Med Dosw (Online). 2010;64:627-635. [PubMed] |
| 5. | Luo JH. Oncogenic activity of MCM7 transforming cluster. World J Clin Oncol. 2011;2:120-124. [PubMed] [DOI] |
| 6. | Lei M, Tye BK. Initiating DNA synthesis: from recruiting to activating the MCM complex. J Cell Sci. 2001;114:1447-1454. [PubMed] |
| 7. | Kudoh A, Daikoku T, Ishimi Y, Kawaguchi Y, Shirata N, Iwahori S, Isomura H, Tsurumi T. Phosphorylation of MCM4 at sites inactivating DNA helicase activity of the MCM4-MCM6-MCM7 complex during Epstein-Barr virus productive replication. J Virol. 2006;80:10064-10072. [PubMed] [DOI] |
| 9. | Petrocca F, Visone R, Onelli MR, Shah MH, Nicoloso MS, de Martino I, Iliopoulos D, Pilozzi E, Liu CG, Negrini M. E2F1-regulated microRNAs impair TGFbeta-dependent cell-cycle arrest and apoptosis in gastric cancer. Cancer Cell. 2008;13:272-286. [PubMed] [DOI] |
| 11. | Fujioka S, Shomori K, Nishihara K, Yamaga K, Nosaka K, Araki K, Haruki T, Taniguchi Y, Nakamura H, Ito H. Expression of minichromosome maintenance 7 (MCM7) in small lung adenocarcinomas (pT1): Prognostic implication. Lung Cancer. 2009;65:223-229. [PubMed] [DOI] |
| 12. | Marnerides A, Vassilakopoulos TP, Boltetsou E, Levidou G, Angelopoulou MK, Thymara I, Kyrtsonis MC, Pappi V, Tsopra O, Panayiotidis P. Immunohistochemical expression and prognostic significance of CCND3, MCM2 and MCM7 in Hodgkin lymhoma. Anticancer Res. 2011;31:3585-3594. [PubMed] |
| 13. | Nishihara K, Shomori K, Fujioka S, Tokuyasu N, Inaba A, Osaki M, Ogawa T, Ito H. Minichromosome maintenance protein 7 in colorectal cancer: implication of prognostic significance. Int J Oncol. 2008;33:245-251. [PubMed] |
| 15. | Zhou YM, Zhang XF, Cao L, Li B, Sui CJ, Li YM, Yin ZF. MCM7 expression predicts post-operative prognosis for hepatocellular carcinoma. Liver Int. 2012;32:1505-1509. [PubMed] [DOI] |
| 16. | Toyokawa G, Masuda K, Daigo Y, Cho HS, Yoshimatsu M, Takawa M, Hayami S, Maejima K, Chino M, Field HI. Minichromosome Maintenance Protein 7 is a potential therapeutic target in human cancer and a novel prognostic marker of non-small cell lung cancer. Mol Cancer. 2011;10:65. [PubMed] [DOI] |