修回日期: 2013-12-05
接受日期: 2013-12-12
在线出版日期: 2014-02-08
目的: 构建maspin基因shRNA真核表达载体, 为进一步研究maspin基因在胃癌细胞株MKN-28生长、浸润、转移中的作用奠定基础.
方法: 设计合成针对maspin基因的shRNA与表达绿色荧光蛋白的pGenesil-1.1质粒连接, 构建的重组质粒分别命名为阳性质粒maspin/pGenesil和阴性质粒YX/pGenesil. 分别用RT-PCR和Western blot检测转染重组质粒前后胃癌细胞株MKN-28 maspin的表达变化.
结果: 通过凝胶电泳和DNA测序分析, 成功构建针对maspin特异性shRNA真核表达质粒maspin/pGenesil及YX/pGenesil. RT-PCR与Western blot检测发现转染成功后maspin/pGenesil组比YX/pGenesil组maspin mRNA的表达显著下降(0.127±0.02 vs 0.510±0.01, P<0.05); maspin/pGenesil组比YX/pGenesil组maspin蛋白表达也显著下降(0.24±0.10 vs 0.65±0.09, P<0.05).
结论: 成功构建了重组质粒maspin/pGenesil, 经转染能有效抑制人胃癌细胞株MKN-28 maspin基因的表达.
核心提示: 根据shRNA设计原则, 设计针对maspin基因编码区的RNA干扰靶位点, 构建了2个RNAi质粒表达载体即: maspin/pGenesil(阳性对照)、YX/pGenesil(阴性对照). 最后, 通过RT-PCR与Western blot检测发现阳性质粒转染成功后可显著下调胃癌细胞株maspin的表达.
引文著录: 倪江涛, 杨紫汐, 易永芬. shRNA maspin/pGenesil-1.1表达载体的构建及意义. 世界华人消化杂志 2014; 22(4): 469-475
Revised: December 5, 2013
Accepted: December 12, 2013
Published online: February 8, 2014
AIM: To construct a eukaryotic expression vector containing short hairpin RNA (shRNA) targeting the maspin gene.
METHODS: A shRNA targeting the maspin gene was ligated to the pGenesil-1.1 plasmid expressing green fluorescent protein. Recombinant maspin/pGenesil positive plasmid and YX/pGenesil negative plasmid were constructed. After recombinant plasmids were transfected into MKN-28 cells, RT-PCR and Western blot were performed to detect maspin mRNA and protein expression, respectively.
RESULTS: The recombinant plasmids were validated by gel electrophoresis and DNA sequence analysis. RT-PCR and Western blot analyses indicated that after successful transfection, both maspin mRNA and protein expression in the maspin/pGenesil group was dramatically down-regulated, compared with that in the YX/pGenesil group (0.127 ± 0.02 vs 0.510 ± 0.01, P < 0.05; 0.24 ± 0.10 vs 0.65 ± 0.09, P < 0.05).
CONCLUSION: The maspin shRNA recombinant plasmid has been constructed successfully. Transfection with the maspin shRNA recombinant plasmid could inhibit the expression of maspin mRNA and protein effectively in human gastric cancer cell line MKN-28.
- Citation: Ni JT, Yang ZX, Yi YF. Construction of a eukaryotic expression vector containing shRNA targeting maspin. Shijie Huaren Xiaohua Zazhi 2014; 22(4): 469-475
- URL: https://www.wjgnet.com/1009-3079/full/v22/i4/469.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i4.469
Maspin是使用减数杂交和差异显示技术通过对正常乳腺上皮与乳腺癌进行比较研究时得到的一种肿瘤抑制基因, 他是丝氨酸蛋白酶抑制剂超家族成员之一, 参与细胞外基质降解[1]. 在体外, 前列腺癌与乳腺癌细胞株中, maspin显示出抑制肿瘤细胞侵袭与运动的能力, 在动物模型中降低癌细胞株转移的能力[2]. 然而AbdE1-Wahed等[3]在研究卵巢肿瘤时发现卵巢良性上皮肿瘤与正常卵巢表面上皮均无maspin表达, 却在卵巢恶性肿瘤中过表达. 在胆囊癌[4]、胰腺癌、结直肠癌[5]及甲状腺癌[6]中也发现maspin表达上调, 这两种截然相反的现象使人们开始质疑其是否为一种抑癌基因. 为此本课题组前期采用了基因重组的方法, 构建maspin/PCR2.1重组质粒转染至胃癌细胞株, 曾探索上调maspin的表达对胃癌细胞凋亡的影响[7], 证实了maspin基因与胃癌细胞凋亡密切相关, 上调maspin的表达能够提高胃癌细胞对凋亡刺激信号的敏感性, 诱导胃癌细胞发生凋亡, 但是该基因在胃癌发生、浸润、转移中的作用究竟如何, 有待通过实验进一步证实. 为此, 本实验拟构建针对maspin基因shRNA真核表达载体, 转染胃癌细胞株MKN-28, 为进一步研究maspin基因在胃癌细胞株MKN-28生长、浸润、转移中的作用奠定基础.
胃癌细胞株MKN-28细胞, 本实验室保存, 真核表达质粒载体pGenesil-1.1、大肠杆菌DH5α购自武汉晶赛生物技术有限公司; 各工具酶购自TaKaRa公司. RT-PCR及TRIzol试剂、阳离子脂质体LipofectamineTM2000购自Invitrogen公司; PVDF膜是Whatman公司的产品; 兔抗人maspin多克隆抗体购自Abzoom公司; 小鼠抗人GAPDH多克隆抗体购自武汉博士德生物工程有限公司; 无内毒素质粒中量抽提试剂盒购自Omega公司; 小规模质粒纯化试剂盒为中鼎生物技术有限公司产品.
1.2.1 maspin短发夹RNA(short hairpin RNA, shRNA)的设计与构建: 根据shRNA设计原则, 在GenBank中查阅人源maspin基因序列(GI: 453368), 设计针对maspin基因编码区的RNA干扰(RNA interference, RNAi)靶位点1个, 为: 1012-1031: 5'-GTGGCCCTATCAAATGTTA-3'. 阴性对照为已明确的不针对任何人mRNA的RNAi靶位点, 其序列为: 5'-GACTTCATAAGGCGCATGC-3'. 为此, 共构建了2个RNAi质粒表达载体即: maspin/pGenesil、YX/pGenesil. 两个基因片段均由武汉晶赛生物技术有限公司合成(表1). 各用25 μL退火缓冲液溶解上述合成1 A单链目的基因片段. 然后各取单链目的基因片段正链和负链, 分别为2 μL和16 μL, 退火缓冲液混匀. 经95 ℃水浴退火5 min, 自然冷却至37 ℃ 1 h. 用Eco31Ⅰ限制性内切酶酶切质粒载体pGenesil-1.1, 使之线性化. 接着使用T4 DNA连接酶将准备好的目的基因片段连接到线性化质粒载体pGenesil-1.1, 22 ℃水浴过夜, 构建shRNA maspin/pGenesil-1.1重组质粒, 转化入处于感受态大肠杆菌DH5α, 随后接种在含卡那霉素罗氏培养基的培养皿中, 37 ℃过夜.
| shRNA | 序列及结构 |
| maspin/pGenesil | 5'-CACC GTGGCCCTATCAAATGTTA TTCAAGACG TAACATTTGATAGGGCCAC TTTTTT G-3' |
| 5'- AGCTCAAAAAA GTGGCCCTATCAAATGTTA CGTCTTGAA TAACATTTGATAGGGCCAC-3' | |
| YX/pGenesil | 5'-CACCGACTTCATAAGGCGCATGCTTCAAGACGGCATGCGCCTTATGAAGTC TTTTTT G-3' |
| 5'-AGCTCAAAAAAGACTTCATAAGGCGCATGC CGTCTTGAAGCATGCGCCTTATGAAGTC |
1.2.2 shRNA maspin/pGenesil-1.1表达载体的鉴定: 将提取的重组质粒经SalⅠ酶切后进行琼脂糖凝胶电泳, 判断酶切产物大小; 并将含重组质粒的菌液送武汉晶赛生物技术有限公司测序, 以鉴定重组质粒是否构建成功.
1.2.3 shRNA maspin/pGenesil-1.1转染MKN-28细胞: 使用阳离子脂质体LipofectamineTM2000进行转染, 按照脂质体说明书操作. 将表达质粒maspin/pGenesil、YX/pGenesil及空载体分别转染MKN-28细胞, 并用400 μg/mL G418抗性筛选.
1.2.4 计算转染率: 取转染后的细胞常规铺片, 置于荧光显微镜下观察并计算转染率, 转染效率 = (发出绿色荧光的细胞数/可见光下总细胞数)×100%.
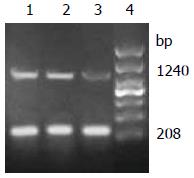
1.2.5 RT-PCR检测转染细胞maspin在转录水平的表达: 用TRIzol提取细胞总RNA, 10×RT Buffer 1 μL, RNase Free H2O 3.75 μL, dNTP Mixture(各10 mmol/L 1 μL, RNase inhibitor 0.25 μL, AMV reverse transcriptase 0.5 μL, Oligo dT-Adaptor Primer 0.5 μL, 总RNA 1 μL, 共10 μL反应体系. 30 ℃ 10 min, 42 ℃ 20 min, 99 ℃ 5 min, 5 ℃ 5 min进行反转录反应, 所得产物用于PCR扩增. 瞬时离心3-5 s, 混匀后maspin与GAPDH(内参)按下列条件进行PCR反应: 94 ℃ 2 min, 94 ℃ 30 s、55 ℃ 30 s、72 ℃ 30 s, 35个循环, 72 ℃ 5 min. PCR结束后各取5 μL反应液1%琼脂糖凝胶电泳, 经Bio-Rad凝胶成像系统采集图像、保存, 用Quantity One 4.5.0软件进行分析, 将各目的基因与GAPDH灰度值的比值作为其mRNA表达量, 每样本重复3次. maspin与GAPDH的RT-PCR引物序列如表2, 引物由上海生工生物工程技术服务有限公司合成.
| 名称 | 引物序列 | 大小(bp) |
| maspin | 5'-CTCCAGGCCCGCAATGGAT-3' | 1240 |
| 5'-GGGCTATGCCAC TAAGGAG-3' | ||
| GAPDH | 5'-CCATGGAGAAGGCTGGGG-3' | 208 |
| 5'-CAAAGTTGTCATGGATGA-3' |
1.2.6 Western blot检测转染细胞maspin蛋白表达: 收集实验组和对照组的细胞1×106个, 提取蛋白, 每空80 μg上样量, 10%聚丙烯酰胺凝胶电泳, 电转印蛋白质, 免疫反应时加入5%蛋白封闭液稀释的HRP标记的羊抗鼠或者羊抗兔二抗体(工作浓度1:1000), 室温下在摇床上振摇60 min. 最后进行化学发光, 在BIO-RAD成像仪上进行图像采集、保存, 并用Quantity One 4.5.0软件分析, 将各目的基因与GAPDH灰度值的比值作为其蛋白表达量, 每样本重复3次.
统计学处理 使用SPSS11.5统计学软件进行统计分析. 数据以mean±SD表示, 两两之间比较采用t检验, P<0.05为差异有统计学意义.
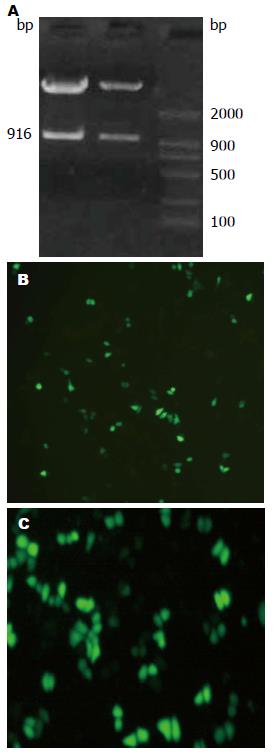
在本研究中插入的目的基因片段里, 设计了一个SalⅠ的酶切位点, 而质粒pGenesil-1.1本来就有一个SalⅠ酶切位点, 如插入正确, 质粒就能被SalⅠ酶切出一条长约916 bp的DNA片段. 经限制性内切酶SalⅠ酶切鉴定分析: 重组质粒maspin/pGenesil与YX/pGenesil符合设计要求(图1A). 测序结果也证实设计基因序列正确插入质粒中, 成功构建重组质粒. 重组质粒maspin/pGenesil与YX/pGenesil在脂质体介导下转染胃癌细胞株MKN-28. 在转染后约6-12 h, 倒置荧光显微镜下即可观察到MKN-28细胞株内出现绿色荧光, 在48 h时荧光强度达到最强, 其转染效率约65%(图1B, C).
实验组maspin/pGenesil与对照组[阴性对照YX/pGenesil、空白对照(仅加入脂质体)]细胞相比, 对照组细胞maspin mRNA表达明显较阴性对照和空白对照组减弱(P = 0.0001), 而阴性对照组与空白对照组之间的差异无统计学意义(P = 0.334)(表3, 图2).
内参GAPDH条带粗细亮度基本一致, 没有显著差别(P = 0.52), 说明蛋白上样量一致(三组细胞的maspin蛋白的表达情况如图3). 实验组与对照组相比, 实验组maspin蛋白表达明显低于阴性对照和空白对照组(表4), 其差异有统计学意义(P = 0.0001), 而阴性对照组与空白对照组之间的差异无统计学意义(P = 0.52), 说明转染重组质粒maspin/pGenesil组的maspin蛋白表达受到抑制.
| 分组 | maspin | GAPDH | 比率 |
| Lipofectamine | 25331.62±2166.22 | 38142.45±4566.32 | 0.66±0.12 |
| YX/pGenesil | 24996.12±3095.28 | 38562.70±3912.55 | 0.65±0.09 |
| maspin/pGenesil | 9121.15±1897.02 | 38384.29±3124.36 | 0.24±0.10b |
恶性肿瘤是严重危害人类健康的疾病. 我国每年约新增312万例恶性肿瘤患者, 因癌死亡超过200万例. 胃癌是最常见的恶性肿瘤之一, 在消化系统中占第一位, 多种癌基因和抑癌基因的异常与胃癌的发生发展密切相关, 因此研究与胃癌密切相关的基因十分必要.
maspin基因于1994年首次发现, 该基因定位于染色体18q21.3-q23, 编码一种42 kDa的蛋白质[6,8], 有研究表明maspin可诱导细胞凋亡、抑制血管形成、促进细胞与基底膜及细胞外基质黏附[9-13], 可用于胆管癌的预后判断及化疗效果判断[14]. 目前国内外关于maspin生物学功能的研究还处在初始阶段, maspin shRNA对胃癌细胞的影响未见报道. RNA干扰(RNA interference, RNAi)是近年发展起来的一种新技术, 是一种由双链RNA(double-stranded RNA, dsRNA)诱发的特定基因沉默技术, 在此过程中, 与双链RNA有同源序列的mRNA被降解, 从而达到沉默该基因表达的目的. 由于其导致的基因沉默发生在转录后水平, 故又被称为转录后基因沉默(post-transcriptional gene silencing, PTGS)[15,16]. RNAi技术作为一种能使生物体特定基因沉默的新方法, 其出现为基因功能研究提供了新的方法[17,18]. RNAi现象在多种生物中存在, 如: 植物[19]、线虫[20,21]以及果蝇[22-25]等. 1999年Tuschl等[26]报道在哺乳动物中也存在RNAi现象. 2001年, Elbashir等[27]应用RNAi技术成功地在哺乳动物细胞中诱导了基因沉默现象. Meng等[28]利用小干扰RNA(small interference RNA, siRNA)沉默胃癌细胞株SGC-7901中Raf-1基因后Raf-1蛋白水平明显下降, 两个血管生长促进因子: 血管内皮细胞生长因子(vascular endothelial cell growth factor, VEGF)和低氧诱导因子-1(hypoxia inducible factor-1, HIF-1)表达也下调. Jinawath等[29]研究发现, 将核仁蛋白NOL8特异性siRNA转染ST-4、TMK-1和MKN45三种不同的胃癌细胞株, 可以有效地降低该基因的表达, 并能诱导这些细胞凋亡.
实施RNA干扰目前可以采用: (1)体外转录法; (2)载体表达法, 将DNA模板导入到细胞内后通过转录的方式再产生dsRNA[30]; (3)化学合成法, 人工制备siRNA, 然后导入细胞内. 本实验根据siRNA载体表达法的原理, 构建针对maspin基因的shRNA重组质粒maspin/pGenesil, 将其转染入胃癌细胞株MKN-28中. 当针对maspin基因的shRNA模板进入细胞内以后, 通过转录的方式产生dsRNA. 所产生的dsRNA被一种双链RNA特异性的核酸内切酶(dsRNA-specific endonuclease, Dicer)识别, 切割成21-23个核苷酸的siRNA片段[31]. 这些片段随后与该核酸酶的dsRNA结构域结合, 并且作为模板识别目的基因maspin mRNA. 识别之后, maspin mRNA与dsRNA的有义链发生链互换, 原先dsRNA中的有义链被maspin mRNA代替, 从Dicer酶-dsRNA复合物中释放出来, 而maspin mRNA则处于原先的有义链所处的位置. 随之, 形成RNA诱导的沉默复合物(RNA-induced silencing complex, RISC), 继而RISC特异性地对目的基因maspin mRNA进行切割, 使maspin mRNA分子失去编码蛋白质的功能, 从而使maspin基因沉默, 产生RNA干扰现象. 由此, 我们采用RT-PCR和Western blot分别在转录及蛋白水平检测maspin基因表达的时候, 发现maspin/pGenesil组都显著低于YX/pGenesil组. 由于真核表达质粒携带有绿色荧光蛋白基因, 在荧光显微镜下可以观察到含有shRNA maspin/pGenesil的细胞, 从而计算转染效率.
总之, 在本实验中我们成功构建了maspin/pGenesil、YX/pGenesil重组质粒, 转染胃癌细胞株MKN-28后, maspin表达下调, 取得了沉默maspin表达的效果, 为深入研究maspin基因在胃癌细胞株MKN-28生长、浸润、转移中的作用奠定了基础.
Maspin是新发现的一种丝氨酸蛋白酶抑制剂, 可诱导多种肿瘤细胞出现凋亡、抑制血管形成、促进细胞与基底膜及细胞外基质黏附, 但有关maspin与胃癌的关系, 国内外少有报道, 本实验拟构建maspin/pGenesil-1.1表达载体沉默maspin的表达, 为后续进一步研究maspin基因在胃癌细胞生长、浸润、转移中的作用奠定基础.
陈光, 教授, 吉林大学第一医院消化器官外科
Maspin基因在多种肿瘤中表现出抑癌活性, 而在有些肿瘤, 如卵巢癌中则相反, 这个矛盾的结果还没有得到合理的解释, 人们开始对maspin基因是否是抑癌基因提出了质疑. 目前需要研究的是maspin基因是通过怎样的途径在肿瘤细胞中发挥作用的.
Maspin基因在体外, 前列腺癌与乳腺癌细胞株中, maspin显示出抑制肿瘤细胞侵袭与运动的能力, 在动物模型中降低癌细胞株转移的能力, 但在卵巢肿瘤中发现卵巢良性上皮肿瘤与正常卵巢表面上皮均无maspin表达, 却在卵巢恶性肿瘤中过表达.
我们通过构建针对maspin基因的shRNA表达载体, 利用特异、高效、快捷的RNA干扰技术, 沉默胃癌细胞maspin基因, 为进一步研究maspin在胃癌细胞中的功能奠定基础.
RNAi独特的作用机制以及其简便的操作流程和对maspin表达抑制的高效性, 为胃癌基因治疗打下一定的基础.
shRNA: 是short hairpin RNA 的缩写, 翻译为"短发夹RNA", shRNA包括两个短反向重复序列, 随后再连上5-6个T作为RNA聚合酶Ⅲ的转录终止子.
本实验选题新颖、设计合理, 所得数据客观可信, 具有明显的临床意义.
编辑: 郭鹏 电编:闫晋利
| 1. | Yatabe Y, Mitsudomi T, Takahashi T. Maspin expression in normal lung and non-small-cell lung cancers: cellular property-associated expression under the control of promoter DNA methylation. Oncogene. 2004;23:4041-4049. [PubMed] [DOI] |
| 2. | Maass N, Hojo T, Zhang M, Sager R, Jonat W, Nagasaki K. Maspin--a novel protease inhibitor with tumor-suppressing activity in breast cancer. Acta Oncol. 2000;39:931-934. [PubMed] [DOI] |
| 3. | Abd El-Wahed MM. Expression and subcellular localization of maspin in human ovarian epithelial neoplasms: correlation with clinicopathologic features. J Egypt Natl Canc Inst. 2005;17:173-183. [PubMed] |
| 4. | Dong P, Zhang Y, Gu J, Wu W, Li M, Yang J, Zhang L, Lu J, Mu J, Chen L. Wogonin, an active ingredient of Chinese herb medicine Scutellaria baicalensis, inhibits the mobility and invasion of human gallbladder carcinoma GBC-SD cells by inducing the expression of maspin. J Ethnopharmacol. 2011;137:1373-1380. [PubMed] [DOI] |
| 5. | Gurzu S, Szentirmay Z, Popa D, Jung I. Practical value of the new system for Maspin assessment, in colorectal cancer. Neoplasma. 2013;60:373-383. [PubMed] [DOI] |
| 6. | Berardi R, Morgese F, Onofri A, Mazzanti P, Pistelli M, Ballatore Z, Savini A, De Lisa M, Caramanti M, Rinaldi S. Role of maspin in cancer. Clin Transl Med. 2013;2:8. [PubMed] [DOI] |
| 9. | Choy B, Findeis-Hosey JJ, Li F, McMahon LA, Yang Q, Xu H. High frequency of coexpression of maspin with p63 and p53 in squamous cell carcinoma but not in adenocarcinoma of the lung. Int J Clin Exp Pathol. 2013;6:2542-2547. [PubMed] |
| 10. | Fawzy AI, Gayyed MF, Elsaghir GA, Elbadry MS. Expression of Snail transcription factor in prostatic adenocarcinoma in Egypt: correlation with Maspin protein expression and clinicopathologic variables. Int J Clin Exp Pathol. 2013;6:1558-1566. [PubMed] |
| 11. | Wang Y, Sheng S, Zhang J, Dzinic S, Li S, Fang F, Wu N, Zheng Q, Yang Y. Elevated maspin expression is associated with better overall survival in esophageal squamous cell carcinoma (ESCC). PLoS One. 2013;8:e63581. [PubMed] [DOI] |
| 12. | Kaplun A, Dzinic S, Bernardo M, Sheng S. Tumor suppressor maspin as a rheostat in HDAC regulation to achieve the fine-tuning of epithelial homeostasis. Crit Rev Eukaryot Gene Expr. 2012;22:249-258. [PubMed] [DOI] |
| 13. | Zhang W, Shi HY, Zhang M. Maspin overexpression modulates tumor cell apoptosis through the regulation of Bcl-2 family proteins. BMC Cancer. 2005;5:50. [PubMed] [DOI] |
| 14. | Romani AA, Soliani P, Desenzani S, Borghetti AF, Crafa P. The associated expression of Maspin and Bax proteins as a potential prognostic factor in intrahepatic cholangiocarcinoma. BMC Cancer. 2006;6:255. [PubMed] [DOI] |
| 16. | McManus MT, Sharp PA. Gene silencing in mammals by small interfering RNAs. Nat Rev Genet. 2002;3:737-747. [PubMed] [DOI] |
| 17. | Hohjoh H. Disease-causing allele-specific silencing by RNA interference. Pharmaceuticals (Basel). 2013;6:522-535. [PubMed] [DOI] |
| 18. | Guo B, Zhang B, Zheng L, Tang T, Liu J, Wu H, Yang Z, Peng S, He X, Zhang H. Therapeutic RNA interference targeting CKIP-1 with a cross-species sequence to stimulate bone formation. Bone. 2013;59C:76-88. [PubMed] [DOI] |
| 19. | Palauqui JC, Elmayan T, Pollien JM, Vaucheret H. Systemic acquired silencing: transgene-specific post-transcriptional silencing is transmitted by grafting from silenced stocks to non-silenced scions. EMBO J. 1997;16:4738-4745. [PubMed] [DOI] |
| 20. | Tijsterman M, May RC, Simmer F, Okihara KL, Plasterk RH. Genes required for systemic RNA interference in Caenorhabditis elegans. Curr Biol. 2004;14:111-116. [PubMed] [DOI] |
| 21. | van Haaften G, Romeijn R, Pothof J, Koole W, Mullenders LH, Pastink A, Plasterk RH, Tijsterman M. Identification of conserved pathways of DNA-damage response and radiation protection by genome-wide RNAi. Curr Biol. 2006;16:1344-1350. [PubMed] [DOI] |
| 22. | Zamore PD, Tuschl T, Sharp PA, Bartel DP. RNAi: double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21 to 23 nucleotide intervals. Cell. 2000;101:25-33. [PubMed] [DOI] |
| 23. | Xiong XP, Kurthkoti K, Chang KY, Lichinchi G, De N, Schneemann A, MacRae IJ, Rana TM, Perrimon N, Zhou R. Core small nuclear ribonucleoprotein particle splicing factor SmD1 modulates RNA interference in Drosophila. Proc Natl Acad Sci U S A. 2013;110:16520-16525. [PubMed] [DOI] |
| 24. | Cernilogar FM, Burroughs AM, Lanzuolo C, Breiling A, Imhof A, Orlando V. RNA-interference components are dispensable for transcriptional silencing of the drosophila bithorax-complex. PLoS One. 2013;8:e65740. [PubMed] [DOI] |
| 25. | Stotz SC, Clapham DE. Anion-sensitive fluorophore identifies the Drosophila swell-activated chloride channel in a genome-wide RNA interference screen. PLoS One. 2012;7:e46865. [PubMed] [DOI] |
| 26. | Tuschl T, Zamore PD, Lehmann R, Bartel DP, Sharp PA. Targeted mRNA degradation by double-stranded RNA in vitro. Genes Dev. 1999;13:3191-3197. [PubMed] [DOI] |
| 27. | Elbashir SM, Harborth J, Lendeckel W, Yalcin A, Weber K, Tuschl T. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature. 2001;411:494-498. [PubMed] [DOI] |
| 28. | Meng F, Ding J, Liu N, Zhang J, Shao X, Shen H, Xue Y, Xie H, Fan D. Inhibition of gastric cancer angiogenesis by vector-based RNA interference for Raf-1. Cancer Biol Ther. 2005;4:113-117. [PubMed] [DOI] |
| 29. | Jinawath N, Furukawa Y, Nakamura Y. Identification of NOL8, a nucleolar protein containing an RNA recognition motif (RRM), which was overexpressed in diffuse-type gastric cancer. Cancer Sci. 2004;95:430-435. [PubMed] [DOI] |
| 30. | Ohta A, Inoue A, Taira K. [Basic research on and application of RNA interference]. Gan To Kagaku Ryoho. 2004;31:827-831. [PubMed] |
| 31. | Hannon GJ, Conklin DS. RNA interference by short hairpin RNAs expressed in vertebrate cells. Methods Mol Biol. 2004;257:255-266. [PubMed] [DOI] |