修回日期: 2013-12-05
接受日期: 2013-12-15
在线出版日期: 2014-02-08
目的: 研究P162是否通过抑制细胞周期检测点激酶(checkpoint kinase, Chk)1/2的表达来增加食管癌细胞株Eca109放射敏感性, 并观察其对细胞周期的影响.
方法: 以食管癌细胞株Eca109为研究对象, 小剂量反复照射形成有一定放射抗拒性的细胞株Eca109R; 将实验分为不加P162不照射组、不加P162照射组、加P162不照射组及加P162照射组四大组, 每组分别包含Eca109与Eca109R二种细胞株; MTT法选取实验合适的照射剂量; CCK-8法测定实验所需的最适P162浓度; Western blot检测4组细胞中Chk1与Chk2蛋白表达的动态变化; 流式细胞仪检测4组细胞的细胞周期变化.
结果: 成功诱导具有放射抗拒性的食管癌细胞株Eca109R; 6 Gy为实验照射剂量; 以20 mg/L的P162为实验浓度; Western blot显示Eca109及Eca109R均存在少量的Chk1及Chk2蛋白, 照射后Chk1与Chk2的表达增高, 加用20 mg/L P162培养48 h后, Eca109中Chk1与Chk2值分别为0.244±0.013、0.148±0.011, 6 Gy照射后24 h其值分别为0.154±0.013、0.124±0.011; Eca109R中Chk1与Chk2值分别为0.139±0.010、0.134±0.008, 6 Gy照射后24 h其值分别为0.083±0.010、0.059±0.009, 照射后二者表达均明显降低(P<0.05); 细胞周期显示, 加用P162不照射组的G2期较不加药组下降, 加药照射组较不加药照射组G2期显著下降(P<0.05).
结论: Eca109R更有放射抗拒性. P162通过抑制Chk1、Chk2的表达来解除细胞G2/M期阻滞, 增加食管癌细胞株Eca109放射敏感性.
核心提示: P162可能通过干预G3BP(Ras-GTPase-activating protein SH3 domain binding protein)功能, 使抑癌基因p53活性增加, 抑制了ATM、ATR通路激活, 进而抑制细胞周期检测点激酶(checkpoint kinase, Chk)1、Chk2的表达来抑制细胞DNA损伤修复, 消除照射后G2期的阻滞, 使G2期未修复的细胞进入M期, 增加食管癌的放射敏感性.
引文著录: 张红, 吴清明, 龙辉, 陈洁, 陈建华. P162通过抑制Chk1/2表达增加食管癌细胞株Eca109的放射敏感性. 世界华人消化杂志 2014; 22(4): 461-468
Revised: December 5, 2013
Accepted: December 15, 2013
Published online: February 8, 2014
AIM: To investigate whether P162 increases the radiosensitivity of esophageal cancer cell line Eca109 by inhibiting the expression of Chk1/2, and to observe its influence on cell cycle progression.
METHODS: Eca109 cells were exposed to small doses of repeated X-rays to develop a radio-resistant cell line Eca109R. Cells were divided into four groups: a group without exposure to either P162 or X-rays, a group exposed only to X-rays, a group exposed only to P162, and a group exposed to both P162 and X-rays. Both Eca109 and Eca109R cell lines were used in each group. The optimal radiation dose was determined by MTT assay. The CCK-8 method was used to determine the optimal drug concentration needed for subsequent experiments. Western blot was used to detect the dynamic changes in Chk1 and Chk2 proteins. The change in cell cycle progression was measured by flow cytometry.
RESULTS: The radio-resistant Eca109R cell line was successfully developed. A radiation dose of 6 Gy was used as the optimal radiation dose for subsequent experiments, and 20 mg/L was used as the optimal concentration of P162. Western blot showed that both Eca109 and Eca109R cell lines expressed a small amount of Chk1 and Chk2. After irradiation, Chk1 and Chk2 expression was up-regulated in both cell lines. After treatment with 20 mg/L P162 for 48 h, the expression levels of Chk1 and Chk2 in Eca109 cells were 0.244 ± 0.013 and 0.148 ± 0.011, respectively, and the corresponding values in Eca109R cells were 0.139 ± 0.010 and 0.134 ± 0.008. At 24 h after 6 Gy irradiation, the expression levels of Chk1 and Chk2 in Eca109 cells were 0.154 ± 0.013 and 0.124 ± 0.011, respectively, and the corresponding values in Eca109R cells were 0.083 ± 0.010 and 0.059 ± 0.009. P162 treatment significantly reduced Chk1 and Chk2 expression (P < 0.05 for all). Cell cycle analysis revealed that exposure to P162 alone only slightly reduced the percentage of cells in G2 phase, but exposure to both P162 and X-rays significantly decreased the percentage of cells in G2 phase.
CONCLUSION: Eca109R cells are more radio-resistant than Eca109 cells. P162 relieves G2/M phase arrest by inhibiting the expression of Chk1 and Chk2 to increase radiosensitivity of esophageal cancer cell line Eca109.
- Citation: Zhang H, Wu QM, Long H, Chen J, Chen JH. P162 increases radiosensitivity of esophageal cancer cell line Eca109 by inhibiting Chk1/2 expression. Shijie Huaren Xiaohua Zazhi 2014; 22(4): 461-468
- URL: https://www.wjgnet.com/1009-3079/full/v22/i4/461.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i4.461
食管癌是发生于食管上皮组织的恶性肿瘤, 他是我国常见的恶性肿瘤[1], 放射治疗是其主要的手段之一[2]. 近30年来, 食管癌常规放疗效果无明显提高, 患者5年生存率仅在20%左右[3,4], 影响放疗效果的因素很多, 而放射抗拒被公认为是肿瘤局部复发、放疗失败的重要原因[5]. 如何提高放射治疗的敏感性成为当前治疗食管癌的一个亟待解决的问题. 细胞周期检测点激酶(checkpoint kinase, Chk)1和Chk2是DNA损伤修复信号转导通路中非常重要的蛋白激酶[6]. P162是利用计算机辅助筛选的一条具有抗癌机制的全新多肽(中国专利2010101400323, PCT WO2011/124063 A1), 学者研究证实, P162对结肠癌[7]、食管癌[8]细胞株都有明显的抗癌作用, 他是否能通过抑制细胞周期检测点信号转导通路增加肿瘤的放射敏感性呢? 检测他对Chk1和Chk2是否有抑制作用, 可以了解放射增敏的机制, 为开辟食管癌治疗新道路提供有力的理论依据.
人食管癌细胞株Eca109(由太和医院馈赠); P162(武汉凯泰新生物技术有限公司提供); RPMI 1640培养粉(Gibco公司); 胎牛血清(杭州四季青有限公司); 胰蛋白酶粉(美国Amresco公司); Chk1及Chk2抗体(美国Santa Cruz公司); 四甲基偶氮唑蓝(MTT)(美国Sigma公司); CCK-8试剂盒(碧云天生物科技有限公司); BCA蛋白定量试剂盒(碧云天生物科技有限公司); PVDF膜(Millipore公司). CO2恒温细胞培养箱(Heal Force公司); 倒置显微镜(Olympus公司); 超净工作台(苏州净化); 酶联免疫检测仪(BioTek公司); 流式细胞仪(美国贝克曼库尔特公司).
1.2.1 细胞培养: Eca109细胞用含有10%胎牛血清、青-链霉素的RPMI 1640培养基, 于37 ℃、5%CO2饱和湿度的恒温培养箱中培养, 根据细胞生长的速度及培养基的颜色更换培养基, 一般为1 d/次, 用0.25%的胰蛋白酶消化传代继续培养或冻存.
1.2.2 不同放射剂量下细胞增殖抑制率测定: 采用四甲基唑蓝(MTT)法, 将对数生长的细胞, 分别以2、4、6、8 Gy照射后立即制成单细胞悬液常规接种96孔板, 设6个复孔; 以未照射为对照组, 2、4、6、8 Gy为放射组, 同时设空白组(无细胞培养液); 分别培养24、48、72 h, 每孔加入5 mg/mL的MTT 20 μL培养4 h后加二甲基亚砜150 μL/孔, 振荡10 min, 上机检测各孔A值(波长490 nm), 计算细胞增殖抑制率(%) = (1-放射组平均A值/对照组平均A值)×100%. 实验重复3次.
1.2.3 不同浓度P162的细胞增殖抑制率: 将对数生长的细胞, 制成单细胞悬液常规接种96孔板, 设6个复孔; 以未加药的为对照组, 5、10、20、40、60 mg/L为实验组, 同时设空白组(无细胞培养液); 培养至细胞单层铺满后分别加入5、10、20、40、60 mg/L浓度梯度的P162, 继续培养24、48、72 h后, 每孔加入10 μL的CCK-8溶液培养1 h后上机检测各孔A值(波长450 nm), 增殖抑制率(%) = (1-实验组A值/对照组A值)×100%. 实验重复3次.
1.2.4 细胞照射: (1)诱导Eca109R细胞株形成: 采用Varian2300直线加速器6MV-X, 表面加1.5 cm标准等效填充物, 源至标本距离100 cm, 照射野10 cm×10 cm, 吸收剂量率为1.5 Gy/min. 取对数生长期的Eca109细胞株, X线照射8 Gy后, 继续培养至细胞长满瓶底, 胰酶消化传代接种, 待细胞长至对数期, 再次X线照射8 Gy, 如此重复以上过程, 待总放射剂量达到60 Gy后, Eca109R细胞株形成; (2)细胞放射线处理: 采用Varian2300直线加速器6MV-X, 表面加1.5 cm标准等效填充物, 源至标本距离100 cm, 照射野10 cm×10 cm, 吸收剂量率为1.5 Gy/min. 将待测细胞X线照射6 Gy, 放回培养箱中继续培养, 在照射后1、2、4、24、48 h胰酶消化后实验.
1.2.5 Western blot测定: 将待测细胞胰酶消化后提取核蛋白, 各样品取50 μg总蛋白上样电泳, 转膜(湿转法), 转膜条件: Chk1-200 mA, 120 min; Chk2-200 mA, 120 min后, 300 mA, 25 min; 用含5%脱脂奶粉的TBST(封闭液)浸泡PVDF膜, 室温摇床封闭2 h. Chk1、Chk2各1:200稀释后, 使PVDF膜浸泡于其孵育液中, 4 ℃孵育过夜, 充分洗涤, 再浸泡于二抗孵育液中, 室温孵育2 h后充分洗涤, 每张膜滴加适量的ECL底物液, 孵育数分钟, 最后显影、定影. LaminB为内参. 实验重复3次.
1.2.6 细胞周期测定: 将对数生长期的细胞胰酶消化, 1000 r/min离心5 min后收集; 再用PBS离心洗涤2遍; 用PBS制成单细胞悬液, 取1×106个细胞加入流式试管中; 加入100 μL DNA Prep LPR, 轻轻混匀, 室温下避光反应1 min; 再加入1 mL DNA Prep Stain, 轻轻混匀, 室温避光反应15-20 min; 用300目的尼龙过滤网过滤细胞, 上机检测. 实验重复3次.
1.2.7 实验分组: 实验分为4组: (1)不加P162不照射组; (2)加P162不照射组; (3)不加P162照射组; (4)加P162照射4大组. 4大组各含Eca109、Eca109R两种细胞株.
统计学处理 采用SPSS17.0统计软件进行分析, 计量资料用mean±SD表示, 多样本均数间比较采用单因素方差分析, 组间比较采用配对t检验, P<0.05为差异有统计学意义.
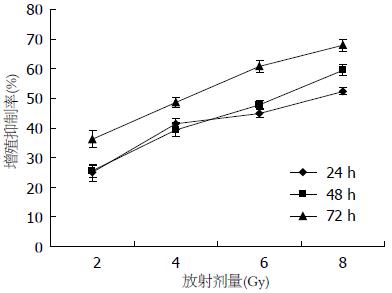
由表1及图1可知: (1)随着放射剂量的增加, 细胞增殖抑制率逐渐增大; (2)随着培养时间的增加, 细胞增殖抑制率也逐渐加大; (3)细胞照射6 Gy的放射剂量时, 其增殖抑制率在24、48、72 h均接近50%; (4)所以6 Gy为最佳放射剂量, 后续实验选取6 Gy为放射剂量.
| 时间(h) | 放射剂量(Gy) | |||
| 2 | 4 | 6 | 8 | |
| 24 | 24.90±2.87 | 41.42±2.01 | 45.04±1.43 | 52.46±1.22 |
| 48 | 25.48±1.99 | 39.40±2.28 | 47.87±1.69 | 59.62±1.87 |
| 72 | 36.27±2.86 | 48.63±1.97 | 60.76±2.14 | 67.92±2.02 |
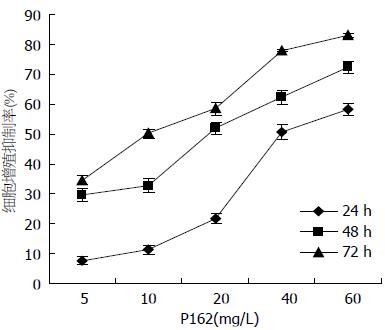
由图2及表2可知: (1)随着P162浓度的增加, 细胞增殖抑制率逐渐增大, P162对细胞抑制作用与浓度呈正相关; (2)随着培养时间的增加, 细胞增殖抑制率也逐渐加大; (3)当P162浓度在20 mg/L时, 细胞增殖抑制率在48、72 h均达到50%左右, 故后续试验P162的最佳浓度选取20 mg/L.
| 时间(h) | P162浓度(mg/L) | ||||
| 5 | 10 | 20 | 40 | 60 | |
| 24 | 7.57±1.23 | 11.30±1.59 | 21.73±1.83 | 50.77±2.36 | 58.22±2.17 |
| 48 | 29.71±2.07 | 32.77±2.43 | 51.92±1.91 | 62.26±2.21 | 72.31±1.89 |
| 72 | 34.52±1.57 | 50.23±1.62 | 58.47±2.11 | 77.87±0.36 | 83.25±0.71 |
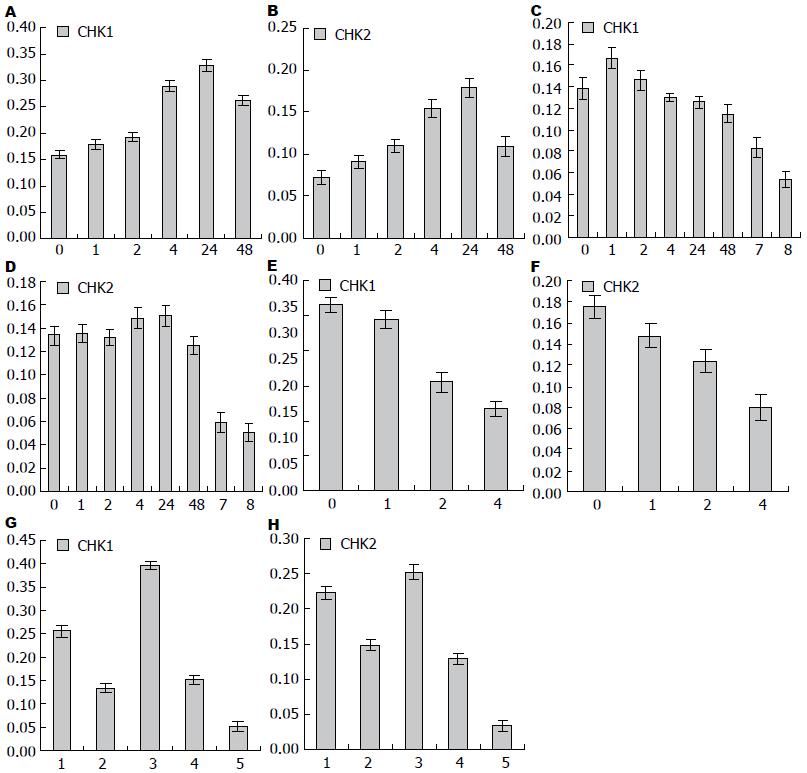
Western blot结果显示: (1)由图3A, B可知食管癌细胞株Eca109中未照射时存在一定量的Chk1与Chk2表达, 经过6 Gy照射后, 随着时间变化, Chk1与Chk2呈峰样变化, 先逐渐增加再逐渐下降; (2)由图3C, D可知食管癌细胞株Eca109R中未照射时也存在一定量的Chk1与Chk2表达, 经过6 Gy照射后, 随着时间变化, Chk1逐渐下降, Chk2略呈峰样变化; (3)由图3C, D可知食管癌细胞株Eca109R加用20 mg/L的P162, 6 Gy照射后24 h, Chk1及Chk2均较未加药照射24 h后明显下降(P值分别为: 0.0015, 0.0000, P<0.05), 加用40 mg/L P162 6 Gy照射后24 h, Chk1与Chk2表达下降更加明显(P值分别为0.0002、0.0018, P<0.05); 这说明在细胞株Eca109R中加用P162后能明显抑制Chk1、Chk2表达, 逆转放射抗拒, 且这种作用与其浓度正相关; (4)由图3E, F可知食管癌细胞株Eca109加用P162后未经照射时, Chk1与Chk2蛋白表达下降(P值分别为0.0018、0.0003, P<0.05), 加P162经照射后与未加药照射者相比Chk1与Chk2蛋白降低更加明显, P值分别为0.0015、0.0000(照射后24 h); 0.0000、0.0000(照射后48 h)(P<0.05), 提示在细胞株Eca109中加用P162后能抑制Chk1、Chk2表达; (5)如图3G, H所示, Eca109R细胞株中Chk1与Chk2的表达高于Eca109细胞株(P值分别为0.0002、0.0013, P<0.05), 提示Chk1与Chk2参与了细胞放射抵抗; Eca109R与Eca109比较, 加用P162后, Eca109R与Eca109中Chk1、Chk2表达均下降(P值分别为0.0000、0.0004, P<0.05), Eca109R对Chk1、Chk2抑制作用比Eca109更加明显, 这提示P162对Eca109R及Eca109细胞株均有增敏作用, 是通过抑制Chk1、Chk2达到增敏效果的; (6)由上述图可知: Eca109及Eca109R两组细胞株中Chk1的表达高于Chk2, 提示Chk1在食管癌Eca109的放射抗拒形成中可能起主要作用; 两组细胞株加药经过6 Gy照射后, Chk1与Chk2表达均发生变化, 但Chk1蛋白的变化更明显, 提示P162可能主要是通过抑制Chk1蛋白的表达来增加细胞株的放射敏感性.
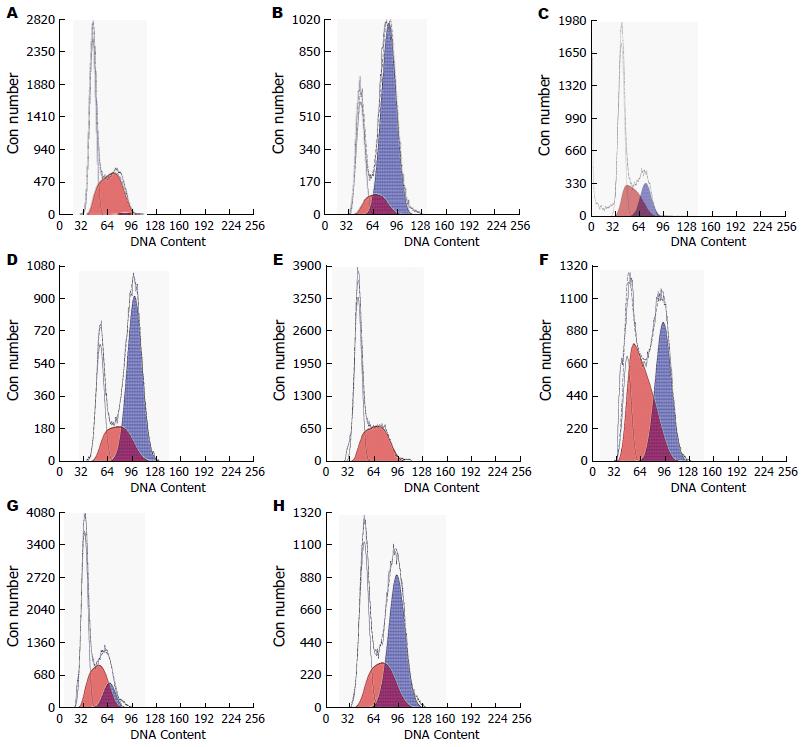
由图4A, B可知Eca109照射前后比较, G2期由1.61%明显增加到66.7%, 提示照射后出现G2/M期阻滞; 由图4C, D可知Eca109R照射前后比较, G2期增加, 说明Eca109R照射后也发生细胞周期改变, 出现G2期阻滞; 与Eca109比较, Eca109R未照射时G2期比例高于Eca109 细胞株(P = 0.0011), 提示G2/M期阻滞程度高于Eca109细胞株, 即表明Eca109R细胞株放射抗拒性高于Eca109细胞株; Eca109加用P162照射前G2期比例比未加药未照射组下降(P = 0.0086), 照射后加药组比不加药组亦下降(P = 0.0066); Eca109R加用P162未照射组G2期比例较未加药未照射组G2期比例降低(P = 0.0019), 照射后加药组比不加药组下降更明显(P = 0.0008); 综合以上结果可知, P162能改变Eca109与Eca109R细胞株的细胞周期, 降低G2期比例, 解除G2期阻滞, 从而达到放射增敏.
Chkl、Chk2是DNA损伤修复信号转导通路中非常重要的蛋白激酶[9]. 一般情况下, 当放射线引起肿瘤细胞DNA损伤后, 细胞将快速启动细胞周期检测点信号转导通路[10-13], 通过调节细胞周期相关蛋白的表达变化, 促使受损伤的细胞停滞于G1/S期、G2/M期的检测点[14]. 而G2期阻滞与DNA损伤修复有关, 他为照射后受损伤肿瘤细胞修复创造条件, 降低了放射线对肿瘤细胞的杀灭效应, 从而使放射抗拒性增加[15].
在肝癌[16]、胰腺癌[17]、前列腺癌[18]、肺癌[19]等多种恶性肿瘤中干扰Chk1和Chk2的表达可以促使肿瘤的凋亡. 建立质粒连接的Chk1和Chk2 shRNA, 经脂质体转染Eca109食管癌细胞后, Chk1和Chk2表达在mRNA及其蛋白水平均明显下降[20]. 抑制Chk1和Chk2蛋白表达, 可以消除肿瘤细胞照射后G2期阻滞, 有效地提高放射线对肿瘤细胞的杀灭效应.
本研究发现, 食管癌细胞株Eca109及Eca109R的细胞中存在少量的Chk1及Chk2表达, 在经过6 Gy射线照射后, 二者表达呈先上升后下降趋势, 提示在经过射线照射后, 细胞中自身有一定的修复功能, 出现Chk、Chk2短期的变化, 加用P162不照射时, 二个细胞株中Chk1及Chk2表达均减少, 加用P162并进行照射后, Chk1及Chk2表达明显降低, 且Chk1的降低幅度更大, 即P162对Chk1及Chk2抑制明显增加, 提示P162通过抑制Chk1及Chk2的表达即减少自身损伤修复来增加放射敏感性. 细胞周期显示, 食管癌细胞株Eca109及Eca109R经过6 Gy射线照射后, G2期明显增加, 提示细胞经过照射后, 发生G2期的阻滞, 自身进行损伤修复, 加用P162未经照射时的G2期略下降, 然而加用P162经过6 Gy照射后24 h, 细胞周期发生明显变化, G2期比例明显下降, 甚至逆转, 并且随着P162浓度加大, 逆转更加明显. 这些结果充分地表明P162能降低Chk1及Chk2的表达, 通过抑制Chk1及Chk2的表达来解除照射后细胞G2/M期阻滞, 减少自身修复, 进而提高细胞的放射敏感性, 起到放射增敏作用.
P162是利用计算机辅助筛选的一条具有抗癌机制的全新多肽, 其结构与G3BP(Ras-GTPase-activating protein SH3 domain binding protein)的NTF2蛋白域发生特异性结合, 干预G3BP蛋白功能磷酸化[21]. Kennedy等[22]与Vognsen等[23]研究证实G3BP通过N端的NTF2样结构域与GAP的SH3结构域相联系, 参与到许多生长因子的信息传递通路, 如Ras通路、PI3K通路、NF-κB的调节和HER通路等, Ming等[24]与Li等[25]发现G3BP参与了p53的负性调节, 在肿瘤的发生中起重要的作用. p53的激活与ATM密切相关[26], Chk1、Chk2是ATM下游的关键酶, 从而推断G3BP与ATM有关联, 而P162能干预G3BP的活性[8], 所以我们考虑P162是通过这条途径来抑制Chk1及Chk2的表达, 抑制细胞DNA修复, 消除照射后G2期的阻滞, 使G2期未修复的细胞进入M期, 从而增加食管癌的放射敏感性.
我们经过射线反复照射, 成功诱导了食管癌细胞株Eca109R, 实验发现其Chk1、Chk2的表达较Eca109中Chk1、Chk2表达高, 而且细胞周期发生改变, 说明Eca109R比Eca109细胞株具有更高的放射抗拒性, 这与Fukuda等[27]研究一致, 而学者研究[28]认为反复分级放射诱导食管癌细胞株, 可以使细胞具有干细胞特性. 而干细胞比普通癌细胞具有更强的放射抗拒性[29]. 有学者认为P75NTR具有食管癌干细胞的特性[30], 前期课题组研究证明[8]: 食管癌Eca109细胞株中存在P75NTR的表达, 由此我们是否可以推测Eca109R具有一定的干细胞特性? 这有待进一步实验证实.
Pajonk等[31]提出临床放射治疗失败是由于肿瘤细胞中的一小部分具有放射抗拒性的细胞(干细胞)造成的, 主要是4R机制介导的[5]: DNA的损伤修复、细胞周期重分布、细胞增殖机制及肿瘤细胞再氧合机制. 本实验从DNA损伤修复及细胞周期重分布为靶点研究, 为食管癌的治疗开辟了广阔的前景. 另外, 我们还可以从细胞增殖机制及细胞再氧合机制入手, 找到增加肿瘤治疗敏感性的靶点, 为其他恶性肿瘤的治疗提供思路.
志谢: 感谢吴清明教授、龙辉副教授、陈洁研究生协助设计完成此课题, 感谢武汉凯泰新生物技术有限公司陈建华博士提供多肽P162.
我国是食管癌高发区, 食管癌进展快, 预后差. 食管癌的治疗方式主要包括手术、放疗、化疗、内镜下治疗以及新辅助疗法等多种手段, 大多数患者就诊时已属中晚期, 放射治疗成为主要的手段之一.
程英升, 教授, 上海交通大学附属第六人民医院放射科
放射抗拒被公认为是食管癌局部复发、放疗失败的重要原因, 学者提出放射抗拒的4R机制: DNA的损伤修复、细胞周期重分布、细胞增殖机制及肿瘤细胞再氧合机制. 如何提高放疗的敏感性成为目前放疗研究的重点之一.
癌细胞在射线照射引起DNA损伤后, 将快速启动细胞周期检测点信号转导通路, 使受损伤的细胞停滞于G2/M期进行自身修复, 解除G2期阻滞可以增加放射敏感性. P162可以增加食管癌的放射敏感性, 但具体机制待进一步研究.
P162是利用计算机辅助筛选的一条具有抗癌机制的全新多肽, 其结构与G3BP的NTF2蛋白域特异性结合, 干预G3BP蛋白功能磷酸化. 研究其增敏机制为恶性肿瘤的治疗开辟新的道路.
本实验从DNA损伤修复及细胞周期重分布进行研究, 我们还可以从细胞增殖机制及细胞再氧合机制入手, 找到其他增加肿瘤放疗敏感性的方法, 为食管癌的治疗, 也为其他恶性肿瘤的治疗提供思路.
本文有一定的新意, 实验设计合理, 结果有说服力, 具有一定指导意义.
编辑: 田滢 电编:闫晋利
| 1. | Muijs CT, Pruim J, Beukema JC, Berveling MJ, Plukker JT, Langendijk JA. Oesophageal tumour progression between the diagnostic 18F-FDG-PET and the 18F-FDG-PET for radiotherapy treatment planning. Radiother Oncol. 2013;106:283-287. [PubMed] [DOI] |
| 3. | Smit JK, Faber H, Niemantsverdriet M, Baanstra M, Bussink J, Hollema H, van Os RP, Plukker JT, Coppes RP. Prediction of response to radiotherapy in the treatment of esophageal cancer using stem cell markers. Radiother Oncol. 2013;107:434-441. [PubMed] [DOI] |
| 4. | Nguyen GH, Murph MM, Chang JY. Cancer stem cell radioresistance and enrichment: where frontline radiation therapy may fail in lung and esophageal cancers. Cancers (Basel). 2011;3:1232-1252. [PubMed] [DOI] |
| 5. | Caputo F, Vegliante R, Ghibelli L. Redox modulation of the DNA damage response. Biochem Pharmacol. 2012;84:1292-1306. [PubMed] [DOI] |
| 6. | Zhang H, Zhang S, He H, Zhao W, Ren K, Chen J, Shao RG. RasGAP-derived peptide 38GAP potentiates the cytotoxicity of cisplatin through inhibitions of Akt, ERK and NF-κB in colon carcinoma HCT116 cells. Cancer Lett. 2011;308:62-70. [PubMed] [DOI] |
| 8. | Bensimon A, Aebersold R, Shiloh Y. Beyond ATM: the protein kinase landscape of the DNA damage response. FEBS Lett. 2011;585:1625-1639. [PubMed] [DOI] |
| 9. | Fokas E, Prevo R, Hammond EM, Brunner TB, McKenna WG, Muschel RJ. Targeting ATR in DNA damage response and cancer therapeutics. Cancer Treat Rev. 2014;40:109-117. [PubMed] [DOI] |
| 10. | Toledo LI, Murga M, Fernandez-Capetillo O. Targeting ATR and Chk1 kinases for cancer treatment: a new model for new (and old) drugs. Mol Oncol. 2011;5:368-373. [PubMed] [DOI] |
| 11. | Maugeri-Sacc拉 M, Bartucci M, De Maria R. Checkpoint kinase 1 inhibitors for potentiating systemic anticancer therapy. Cancer Treat Rev. 2013;39:525-533. [PubMed] [DOI] |
| 12. | Hyun SY, Rosen EM, Jang YJ. Novel DNA damage checkpoint in mitosis: Mitotic DNA damage induces re-replication without cell division in various cancer cells. Biochem Biophys Res Commun. 2012;423:593-599. [PubMed] [DOI] |
| 13. | Chen T, Stephens PA, Middleton FK, Curtin NJ. Targeting the S and G2 checkpoint to treat cancer. Drug Discov Today. 2012;17:194-202. [PubMed] [DOI] |
| 14. | Stracker TH, Usui T, Petrini JH. Taking the time to make important decisions: the checkpoint effector kinases Chk1 and Chk2 and the DNA damage response. DNA Repair (Amst). 2009;8:1047-1054. [PubMed] [DOI] |
| 15. | Moon DO, Kim MO, Choi YH, Hyun JW, Chang WY, Kim GY. Butein induces G(2)/M phase arrest and apoptosis in human hepatoma cancer cells through ROS generation. Cancer Lett. 2010;288:204-213. [PubMed] [DOI] |
| 16. | Boreddy SR, Srivastava SK. Pancreatic cancer chemoprevention by phytochemicals. Cancer Lett. 2013;334:86-94. [PubMed] [DOI] |
| 17. | Chen HM, Chang FR, Hsieh YC, Cheng YJ, Hsieh KC, Tsai LM, Lin AS, Wu YC, Yuan SS. A novel synthetic protoapigenone analogue, WYC02-9, induces DNA damage and apoptosis in DU145 prostate cancer cells through generation of reactive oxygen species. Free Radic Biol Med. 2011;50:1151-1162. [PubMed] [DOI] |
| 18. | Grabauskiene S, Bergeron EJ, Chen G, Chang AC, Lin J, Thomas DG, Giordano TJ, Beer DG, Morgan MA, Reddy RM. CHK1 levels correlate with sensitization to pemetrexed by CHK1 inhibitors in non-small cell lung cancer cells. Lung Cancer. 2013;82:477-484. [PubMed] [DOI] |
| 20. | Pamonsinlapatham P, Hadj-Slimane R, Lepelletier Y, Allain B, Toccafondi M, Garbay C, Raynaud F. p120-Ras GTPase activating protein (RasGAP): a multi-interacting protein in downstream signaling. Biochimie. 2009;91:320-328. [PubMed] [DOI] |
| 21. | Kennedy D, French J, Guitard E, Ru K, Tocque B, Mattick J. Characterization of G3BPs: tissue specific expression, chromosomal localisation and rasGAP(120) binding studies. J Cell Biochem. 2001;84:173-187. [PubMed] |
| 22. | Vognsen T, Kristensen O. Crystal structure of the Rasputin NTF2-like domain from Drosophila melanogaster. Biochem Biophys Res Commun. 2012;420:188-192. [PubMed] [DOI] |
| 23. | Ming M, He YY. PTEN in DNA damage repair. Cancer Lett. 2012;319:125-129. [PubMed] [DOI] |
| 24. | Li Y, Qu X, Qu J, Zhang Y, Liu J, Teng Y, Hu X, Hou K, Liu Y. Arsenic trioxide induces apoptosis and G2/M phase arrest by inducing Cbl to inhibit PI3K/Akt signaling and thereby regulate p53 activation. Cancer Lett. 2009;284:208-215. [PubMed] [DOI] |
| 25. | Yuan J, Luo K, Zhang L, Cheville JC, Lou Z. USP10 regulates p53 localization and stability by deubiquitinating p53. Cell. 2010;140:384-396. [PubMed] [DOI] |
| 26. | Fukuda K, Sakakura C, Miyagawa K, Kuriu Y, Kin S, Nakase Y, Hagiwara A, Mitsufuji S, Okazaki Y, Hayashizaki Y. Differential gene expression profiles of radioresistant oesophageal cancer cell lines established by continuous fractionated irradiation. Br J Cancer. 2004;91:1543-1550. [PubMed] |
| 27. | Zhang X, Komaki R, Wang L, Fang B, Chang JY. Treatment of radioresistant stem-like esophageal cancer cells by an apoptotic gene-armed, telomerase-specific oncolytic adenovirus. Clin Cancer Res. 2008;14:2813-2823. [PubMed] [DOI] |
| 28. | Peitzsch C, Kurth I, Kunz-Schughart L, Baumann M, Dubrovska A. Discovery of the cancer stem cell related determinants of radioresistance. Radiother Oncol. 2013;108:378-387. [PubMed] [DOI] |
| 30. | Pajonk F, Vlashi E, McBride WH. Radiation resistance of cancer stem cells: the 4 R's of radiobiology revisited. Stem Cells. 2010;28:639-648. [PubMed] [DOI] |