修回日期: 2014-11-04
接受日期: 2014-11-12
在线出版日期: 2014-12-28
目的: 探讨白藜芦醇在酒精诱导的SH-SY5Y细胞损伤中的抗氧化及抗凋亡作用, 揭示白藜芦醇抗酒精神经性损伤的作用机制.
方法: SH-SY5Y细胞经维甲酸诱导成正常神经细胞后以白藜芦醇预处理SH-SY5Y细胞24 h, 用酒精诱导氧化应激及凋亡的产生. MTT方法检测白藜芦醇处理组与对照组SH-SY5Y细胞活力; 用ELISA试剂盒检测不同实验组的超氧化物歧化酶(superoxide dismutase, SOD)及细胞内总活性氧(reactive oxygen species, ROS)含量、流式细胞术检测不同实验组细胞凋亡水平; 采用RT-PCR方法检测抗氧化应激凋亡通路中关键基因SOD1、SOD2、过氧化氢酶及Caspase3和PRAP的mRNA表达水平.
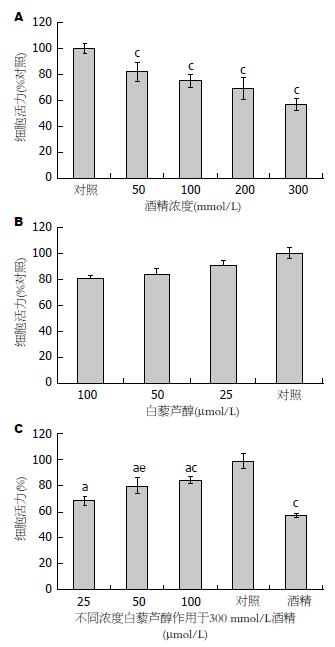
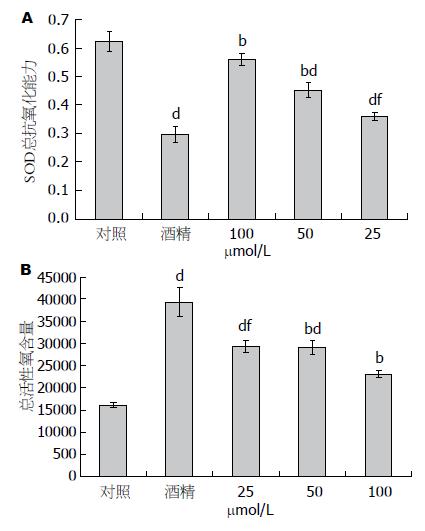
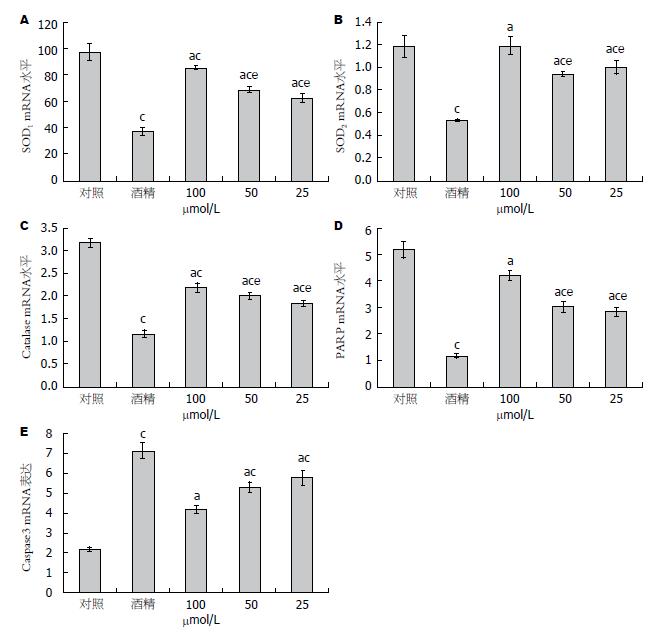
结果: MTT结果显示, 与对照组比较, 白藜芦醇(25、50、100 μmol/L)对SH-SY5Y细胞的细胞毒性均在20%以下, 300 mmol/L酒精可致近50% SH-SY5Y细胞死亡; 25-100 μmol/L白藜芦醇可有效对抗300 mmol/L酒精对SH-SY5Y引起的细胞毒性作用; SOD活性显示100 μmol/L白藜芦醇预处理组SOD含量(0.391±0.011)明显高于非处理组(0.286±0.019), 而ROS结果显示酒精诱导组(29234.79±2288)明显高于白藜芦醇25、50、100 μmol/L预处理组(18023.26±1359.66; 13528.44±1078.99; 8219.87±635.99); RT-PCR结果显示, 与300 mmol/L酒精比较, 25、50和100 μmol/L白藜芦醇可上调SOD1(0.623±0.032; 0.686±0.0213; 0.854±0.014)、SOD2(1.001±0.058; 0.938±0.021; 1.190±0.078)、过氧化氢酶(1.828±0.067, 2.018±0.079; 2.196±0.100) 及PARP(2.828±0.161; 3.018±0.208; 4.196±0.190)mRNA表达量; 不同剂量白藜芦均可下调Caspase3 mRNA表达量(5.828±0.367; 5.318±0.279; 4.196±0.200).
结论: 本实验结果揭示了300 mmol/L的酒精可以引起SH-SY5Y细胞氧化应激与凋亡的发生. 表明白藜芦醇通过介导氧化应激及氧化应激引起的抗凋亡途径发挥了神经保护作用
核心提示: 本研究发现白藜芦醇通过介导氧化应激及氧化应激引起的抗凋亡途径发挥了神经保护作用. 实验数据表明白藜芦醇可降低酒精诱导引起的细胞内总活性氧(reactive oxygen species, ROS)增高, 提高超氧化物歧化酶(superoxide dismutase, SOD)含量及减少酒精引起的细胞凋亡, mRNA表达水平的检测证明白藜芦醇可以通过增加抗氧化酶的表达提高抗氧化酶活性, 加快活性氧自由基代谢, 抑制酒精引起的凋亡, 从而起到神经保护作用.
引文著录: 王明娟, 耿永芝, 刘景华, 侯志平, 何培元. 白藜芦醇对抗酒精诱导的SH-SY5Y细胞损伤作用: 氧化应激与凋亡. 世界华人消化杂志 2014; 22(36): 5594-5601
Revised: November 4, 2014
Accepted: November 12, 2014
Published online: December 28, 2014
AIM: To assess the effects of resveratrol as an antioxidant against alcohol-induced oxidative stress and apoptosis in SH-SY5Y cells and explore the underlying mechanisms.
METHODS: SH-SY5Y cells were pretreated with resveratrol for 24 h before treatment with alcohol to induce oxidative stress and apoptosis. MTT assay was then performed to detect the viability of SH-SY5Y cells in both resveratrol-treated and control groups. ELISA was performed to detect the presence of superoxide dismutase (SOD) and the level of total intracellular reactive oxygen species (ROS). Flow cytometry was used to detect cell apoptosis. RT-PCR was performed to detect the expression levels of SOD1, SOD2, catalase, PARP and Caspase 3, which are key genes involved in anti-oxidation and apoptosis pathways.
RESULTS: MTT assay showed that in comparison with control cells (non-treated with resveratrol), toxicity of resveratrol (25, 50, 100 μmol/L) towards SH-SY5Y cells was below 20%. Treatment with 300 mmol/L alcohol without pre-treatment with resveratrol resulted in death of around 57% cells. Resveratrol at concentrations from 25-100 μmol/L played an antagonistic role against cytotoxicity of 300 mmol/L alcohol to SH-SY5Ycells. ELISA results showed that SOD activity was significantly higher in cells treated with 100 μmol/L resveratrol (0.559 ± 0.021) than in non-treated cells (0.296 ± 0.023). After alcohol induction, non-resveratrol-treated cells showed a higher ROS level (16163.89 ± 624.67) compared to cells treated with 25, 50, and 100 μmol/L resveratrol (29302.79.26 ± 1208.38; 25528.34 ± 1126.63; 20219.78 ± 1622.35). Flow cytometry showed that the percentage of apoptotic cells in alcohol treated cells were higher than those in other groups. RT-PCR results showed that compared to cells treated with 300 mmol/L alcohol, resveratrol increased the expression of SOD1 (0.623 ± 0.033; 0.686 ± 0.022; 0.853 ± 0.014), SOD2 (1.19 ± 0.123; 0,928 ± 0.0121; 1.09 ± 0.0101), catalase (1.828 ± 0.067; 2.018 ± 0.079; 2.196 ± 0.081), PARP (2.828 ± 0.161; 3.018 ± 0.208; 4.196 ± 0.190) and Caspase3 (5.828 ± 0.367; 5.318 ± 0.279; 4.196 ± 0.200).
CONCLUSION: Our findings show the neuroprotective of resveratrol against alcohol-induced oxidative stress and apoptosis in SH-SY5Y cells.
- Citation: Wang MJ, Geng YZ, Liu JH, Hou ZP, He PY. Protective effects of resveratrol against alcohol-induced oxidative stress and apoptosis in human SH-SY5Y cells. Shijie Huaren Xiaohua Zazhi 2014; 22(36): 5594-5601
- URL: https://www.wjgnet.com/1009-3079/full/v22/i36/5594.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i36.5594
长期过度饮酒可以导致酒精性肝病(alcoholic liver disease, ALD). ALD致死率占全球死亡率近4%[1]. 在美国, ALD引起的肝脏相关疾病死亡率比丙型肝炎病毒引起的死亡率还要高[2,3]. 使用计算机断层扫描技术发现在ALD早期患者即可发现脑部出现"萎缩"[4]. 核磁共振(magnetic resonance imaging, MRI)和死后尸检发现酒精成瘾者脑部在包括海马区在内的皮层区域灰质和白质均有减少[5].
白藜芦醇是一种主要存在于各种红葡萄果实和红葡萄酒中非黄酮类多酚化合物[6], 研究[7-10]证据表明白藜芦醇具有抗衰老、抗氧化、抗肿瘤、抗炎和免疫调节作用. 目前其在肝脏疾病的治疗方面有一些研究[11,12], 其作用机制主要为消除自由基、抗氧化和抗凋亡. 文献报道[13,14]了很多天然产物(绿茶、黑茶、葡萄等)通过抗氧化活力在神经保护方面的作用, 其中既有体内实验也有体外实验. 因此, 抗氧化与神经保护具有密切的相关性.
虽然有很多关于嗜酒性痴呆和神经退行性改变的相关性研究报道, 但是对于酒精和神经毒性机制目前并不清楚. 但是目前还没有关于白藜芦醇对抗酒精诱导的神经细胞毒性作用及其机制的研究. 本实验旨在研究白藜芦醇对酒精性中枢神经系统损伤的保护作用及作用机制.
人SH-SY5Y细胞株购自美国ATCC公司; 酒精、二甲基亚砜(DMSO)购自天津化工厂; DMEM/F-12培养基、NEM、胎牛血清、链霉素、胰蛋白酶、MTT购自Sigma公司; 总RNA提取试剂盒、RT-PCR扩增试剂盒购自上海生工公司; 细胞培养箱(美国Thermo)、倒置显微镜为日本Olympus公司产品, 由承德医学院基础研究所提供.
1.2.1 细胞培养SH-SY5Y细胞: 于DMEM/F-12(Dulbecco's modified Eagle's medium)培 养液, 包含10%(V/V)小牛血清和100 μg/mL链霉素, 37℃、50 mL/L CO2培养箱中培养. 细胞密度达到80%以上后种在96孔细胞培养板上, 密度为每孔2×105个, 维甲酸预处理7 d, SH-SY5Y细胞分化为正常神经细胞.
1.2.2 毒性检测: 通过MTT(3-[4,5-di-methylthiazol-2-yl]-2,5-diphenyl tetrazolium bromide)方法检测细胞活性从而代表化学试剂的细胞毒性, 方法同参考文献[11]. 分化的SH-SY5Y细胞(2×105)种于96孔细胞培养板中, 培养24 h后以不同浓度的白藜芦醇(0-100 μmol/L)处理24 h后测细胞活性以观察白藜芦醇的细胞毒性; 同样以不同浓度的酒精[12](0-400 mmol/L)处理细胞24 h后检测细胞活性以观察酒精的细胞毒性.
1.2.3 白藜芦醇减弱酒精诱导的神经毒性: 以不同浓度的白藜芦醇(0-100 μmol/L)预处理分化后的SH-SY5Y细胞24 h后, 用300 mmol/L浓度的酒精诱导24 h, 之后在每孔中加入20 μL MTT, 孵育4 h, 弃去培养液, 加入100 μL DMSO, 摇床震荡15 min, 待紫色结晶完全溶解后, 酶标仪570 nm处读取吸光度(A)值.
1.2.4 超氧化物歧化酶(superoxide dismutase, SOD)与细胞内总活性氧(reactive oxygen species, ROS)检测: 使用武汉华美生物工程有限公司的ELISA试剂盒检测SOD、ROS表达, 按照说明书进行严格操作, 用荧光酶标仪在490 nm处读取SOD A值; 以激发波长480 nm, 发射波长530 nm读取ROS A值; 酶标仪450 nm处读取ROS读数.
1.2.5 细胞凋亡检测: 白藜芦醇与酒精处理过的SH-SY5Y细胞用预冷的PBS冲洗后, 0.1%胰蛋白酶收取细胞, 离心后用试剂盒自带缓冲液预冷后重悬细胞, FITC Annexin V和碘化丙啶(PI)荧光标志物孵育15 min, 流式细胞仪检测细胞凋亡
1.2.6 RT-PCR检测细胞内SOD1、SOD2、过氧化氢酶、多聚ADP核糖聚合酶[poly(ADP-ribose) polymerase, PARP]和Caspase3 mRNA的表达: 使用上海生工总RNA提取试剂盒严格按照说明书提取SH-SY5Y细胞总RNA; 使用紫外分光光度计检测A260/230和A260/280以检测RNA纯度及计算RNA浓度. 引物设计参考文献[13,14]并在GenBank中比对, 由上海生工合成, 表1为相关基因上下游引物基本信息. 根据上海生工一步法反转录试剂盒说明书配制RT-PCR混合物. 反转录体系为: RNA样本(50 ng/μL)1 μL, 5×RT Buffer 4 μL, 反转录引物2 μL, 反转录酶1 μL, 双蒸水12 μL, 总共20 μL. 使用PCR仪48 ℃ 1 min, 42 ℃ 60 min, 95 ℃ 5 min进行反转录. PCR复合扩增体系为: 各基因cDNA 9.3 μL, 10.7 μL PCR反应混合物, 包含5×PCR Buffer、25 μmol/L MgCl2和上下游引物. 扩增条件: 95 ℃ 10 min, 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃延长1 min, 34个循环, 4 ℃保存. 内参基因为ACTB. 应用GeXP基因分析仪分析抗氧化酶基因(SOD1、SOD2和过氧化氢酶)和凋亡基因(PARP、Caspase3)mRNA水平的变化.
| 基因名称 | GeneBank 号 | 引物序列(5'-3') | |
| 上游引物 | 下游引物 | ||
| ACTBa | NM_001101 | GATCATTGCTCCTCCTGAGC | AAAGCCATGCCAATCTCATC |
| SOD1 | NM_000454 | TCATCAATTTCGAGCAGAAGG | TGCTTTTTCATGGACCACC |
| SOD2 | NM_000636 | CATCAAACGTGACTTTGGTTC | CTCAGCATAACGATCGTGGTT |
| Catalase | NM_001752 | GAAGTGCGGAGATTCAACACT | ACACGGATGAACGCTAAGCT |
| PARP | NM_001618 | TATCGAGTCGAGTACGCCAA | GTGTGGGACTTTTCCATCAAA |
| Caspase3 | NM_032991.2 | TTGAGACAGACAGTGGTGTT | GTTAACCGAAAGGTGGCAA |
统计学处理 采用SPSS20.1软件进行分析, 统计结果以mean±SD表示, 计量资料采用方差分析. P<0.05为差异有统计学意义.
白藜芦醇与酒精的细胞毒性结果如图1. 图1A为不同浓度酒精(0-300 mmol/L)作用于SH-SY5Y细胞24 h后的细胞活力. 各不同酒精浓度组细胞活性较对照组均有所下降, 差异均有统计学意义(P<0.05). 图1B为不同浓度的白藜芦醇(0-100 μmol/L)作用于SH-SY5Y细胞24 h后的细胞毒性, 各组与对照组相比均无明显变化(P>0.05).
白藜芦醇对抗酒精毒性的细胞活力检测显示了不同浓度的白藜芦醇均可削弱300 mmol/L酒精诱导的细胞毒性作用(P<0.05)(图1C); 与对照组比较, 25 μmol/L白藜芦醇组差异无统计学意义(P>0.05)(图1C), 50和100 μmol/L的白藜芦醇比较, 差异有统计学意义(P<0.05).
细胞内SOD、ROS含量改变如图2所示. 图2A为SOD活性改变: 与对照组比较, 酒精组细胞内SOD活性明显下降, 差异有统计学意义(P<0.01); 与酒精组比较100和50 μmol/L白藜芦醇组细胞内SOD活性明显升高, 差异有统计学意义(P<0.01), 而其25 μmol/L白藜芦醇预处理组SOD活性略有升高与酒精组比较差异无统计学意义(P>0.05). 图2B所示为ROS水平: 与对照组比较, 酒精组细胞内ROS水平明显升高. 与酒精组比较, 各组白藜芦醇组细胞内ROS水平明显下降, 差异有统计学意义(P<0.01), 而最低浓度的25 μmol/L组ROS水平与对照组比较差异也有统计学意义(P<0.01).
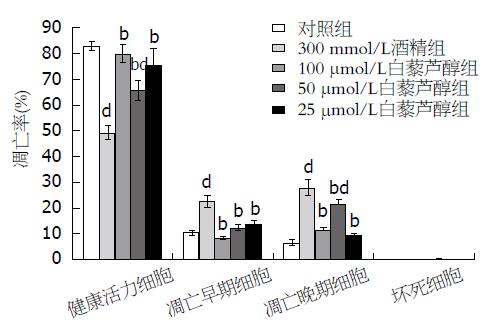
细胞凋亡是指细胞在生理或病理条件下, 遵循自身的程序, 结束自己生命的过程, 其与坏死是完全不一样的死亡过程. 在细胞凋亡早期, 细胞膜内部的磷脂酰丝氨酸(PS)迁移到细胞外层表面, Annexin V对PS有高度亲和力的磷脂结合蛋白, 可作为探针识别细胞膜表面是否有PS而识别早期凋亡细胞. 与对照组早期凋亡细胞(R6)10.46%±0.93%和晚期凋亡细胞(R4)6.48%±1.02%相比, 300 mmol/L酒精诱导后SH-SY5Y早晚期凋亡细胞明显增加22.61%±2.28%和27.81%±3.14%(P<0.01); 同样, 两组间健康活力细胞比较也具有统计学意义(P<0.01), 对照组活力细胞(R5)为82.85%±1.75%, 酒精组为49.1%±2.43%. 不同浓度白藜芦醇均可抑制酒精诱导的凋亡发生, 并且呈剂量依赖关系, 白藜芦醇浓度越高, 健康有活力细胞越多, 反之则减少, 如图3所示.
图4显示经不同浓度白藜芦醇预处理再以300 mmol/L酒精诱导后SH-SY5Y细胞内SOD1、SOD2、过氧化氢酶、PARP和Caspase3五种基因mRNA水平与未施加任何处理因素的对照组比较, 酒精组SOD1、SOD2、过氧化氢酶、PARP mRNA水平均明显下降, Caspase3 mRNA明显升高, 差异有统计学意义(P<0.05); 不同浓度的白藜芦醇预处理组SOD1、SOD2、过氧化氢酶和PARP mRNA水平与酒精组比较均有所升高, 而Caspase3 mRNA明显下降, 并且差异有统计学意义(P<0.05). 组间比较显示, SOD1、SOD2、过氧化氢酶、PARP mRNA表达中100 μmol/L白藜芦醇组中SOD1明显高于50和25 μmol/L组; 而Caspase3组mRNA表达中100 μmol/L白藜芦醇组明显低于其他剂量组. 充分说明白藜芦醇作用与剂量呈正比.
白藜芦醇是众所周知的抗氧化与抗炎化合物, 其在红酒中含量较大, 可以发挥很多药理学作用, 包括肝脏保护作用和心血管保护作用[1,15,16]. 研究[17]表明中等量的红酒对肝脏酶的活性并不发挥作用. 因此, 由于白藜芦醇在白酒中的低溶解性和低吸附性科研数据并不支持通过饮用红酒来预防治疗酒精相关性疾病[18]. 氧化应激引起的酒精性肝病致病机制已成为公认的致病机制, 在氧化应激损伤过程中, 又引起了凋亡的发生, 凋亡与氧化应激相互作用, 共同促进酒精性疾病的发展[19-21]. 长期大量饮酒可以引起脑细胞受损和大脑损伤, 最终发展为酒精性痴呆[22-24]. 酒精性痴呆患者可引起记忆力障碍, 语言受损, 不能胜任诸如包装等复杂手部动作[19,25,26]. 然而酒精引起的神经细胞受损及相关的神经退行性改变潜在机制并不十分清楚.
因此, 本研究的主要目的是检测白藜芦醇在分化的SH-SY5Y神经元样细胞中的抗氧化活性, 抑制了凋亡通路, 进而发挥了抗酒精性损伤作用. 本研究发现暴露于300 mmol/L酒精的细胞24 h后其细胞活力下降了近一半, 并引起了细胞内自由基明显增高, 而与此同时, 抗氧化酶活性却大大下降. 流式细胞仪检测细胞凋亡发现, 酒精在引起氧化应激反应的同时, 激活了凋亡的产生. 通过复合扩增方式检测细胞的mRNA水平发现, 酒精诱导的细胞在氧化应激和凋亡相关基因中均有所变化. 这些研究结果与之前的相关研究结果相一致. 实际上, 有些研究结果表明了酒精可以干扰正常发育的大脑, 尤其是新皮质和海马区的神经细胞[27]. 酒精发挥作用的机制可能是通过DNA修复不足或点突变, 这样即可引起DNA损伤和细胞死亡.
一些天然化合物, 比如黄酮类化合物, 由于潜在的预防效果已经被用于预防神经保护和抗炎作用[28-31]. 近期研究[32]表明, 白藜芦醇除了经典的抗氧化功能, 还通过诱导抗凋亡信号通路和线粒体损伤清除来发挥神经细胞保护作用. 本研究证明白藜芦醇是通过削弱酒精引起的自由基增多, 同时激活氧化还原酶提高抗氧化活性, 继而减少酒精损伤性细胞的凋亡而发挥的神经保护作用. 在本实验中, 我们使用了三种不同浓度的白藜芦醇: 25、50和100 μmol/L, 实验数据表明白藜芦醇的神经保护作用具有剂量依赖性, 高剂量的白藜芦醇神经保护作用强, 低剂量组神经保护作用弱, 尤其是100 μmol/L组可以明显降低酒精引起的神经细胞损伤作用.
凋亡是在基因调控下发生的一种程序性细胞死亡, 凋亡既可以在生理条件下产生, 也可以在病理刺激下发生[33], 对胚胎发育、正常细胞群的稳定、肿瘤等其他疾病的发生进展起着重要作用[34-36]. 流式细胞结果显示酒精可以引起细胞凋亡的发生, 而白藜芦醇通过减弱凋亡发挥了保护作用. 实验数据表明抗凋亡通路中的PARP和 Caspase3均发生了相关变化. PARP是细胞凋亡核心成员Caspase的切割底物. 因此, 他在DNA损伤修复与细胞凋亡中发挥着重要作用. PARP对于细胞的稳定和存活非常重要, PARP失去酶活力会加速细胞的不稳定. 已有体内体外实验表明半胱氨酸介导的PARP-1可以有效地引起DNA损伤依赖的催化剂活性的失活[37].
总之, 本实验结果揭示了300 mmol/L的酒精可以引起SH-SY5Y细胞氧化应激与凋亡的发生. 表明白藜芦醇通过介导氧化应激及氧化应激引起的抗凋亡途径发挥了神经保护作用. 由于本文只是初步研究, 比如实验数据表明的白藜芦醇可降低酒精诱导引起的ROS增高, 在实验中只探讨了抗氧化酶SOD的作用, 并没有探讨非抗氧化酶, 比如谷胱甘肽, 在氧化应激中的作用. 因此, 在未来的实验中, 应该继续探讨白藜芦醇在酒精诱导的神经细胞损伤保护作用中的确切靶点, 从而为临床治疗打下坚实基础.
我国酒精消费量逐年升高, 不久的将来酒精将成为致残致死的主要病因. 早期患者即可发现脑部出现"萎缩", 酒精成瘾者脑部灰质白质均有减少, 而临床上缺乏特效的治疗方案及药物.
迟宝荣, 教授, 吉林大学第一医院消化内科
氧化应激与凋亡是酒精性神经退行性变中导致神经细胞损伤的重要发病机制. 多种自由基、抗氧化酶及凋亡参与其中构成了一个较为复杂的网络式反应体系. 各种不同的组分在整个体系中的地位及其相互关系成为研究的热点. 如何应用天然化合物及中草药对抗氧化应激及凋亡保护酒精性神经细胞损伤是研究的重点.
长期大量饮酒可以引起脑细胞受损和大脑损伤, 最终发展为酒精性痴呆, 引起记忆力障碍, 语言受损, 不能胜任诸如包装等复杂手部动作. 然而酒精引起的神经细胞受损及相关的神经退行性改变潜在机制并不十分清楚.
本文测定了神经细胞内SOD活性, ROS含量及凋亡细胞数量, 并应用PCR技术检测了凋亡与氧化应激相关基因的mRNA水平, 从而对酒精性肝病中氧化应激发生的机制有了新的认识. 并通过毒性检测获得了用酒精和白藜芦醇处理神经细胞的浓度, 为后续的科研工作提供了有价值的参数.
本研究检测了经白藜芦醇处理前后细胞内ROS含量、SOD活性以及细胞凋亡水平的检测, 并且应用PCR技术检测了相关基因mRNA水平, 证实白藜芦醇对酒精诱导的氧化应激所致神经细胞损伤有保护作用, 提供了一种有潜在研发价值的酒精性脑病治疗药物, 并为其可能的临床应用提供理论基础.
氧化应激: 氧化应激的概念包含氧化和抗氧化两个大方面内容. 人体在新陈代谢过程中及遭受各种有害刺激时会产生多种有氧化作用的高活性分子称作自由基(Free radical), 包括超氧阴离子(•O2-)、羟自由基(•OH)和过氧化氢(H2O2)等多种分子. 这些分子可氧化脂质等多种重要机体组分而造成细胞损伤. 人体内也同时存在抗氧化系统包括以SOD和过氧化氢酶为代表的抗氧化酶和以还原型谷胱甘肽为代表的非酶抗氧化物. 氧化应激即指因体内氧化作用强于抗氧化作用而出现的失衡现象.
本研究具有一定的新意. 实验结果较明确, 实验证据基本充足. 讨论条理分明, 有系统的理论分析和有价值的科学结论. 文章具有一定的创新性, 可读性和科学性.
编辑: 郭鹏 电编:闫晋利
| 1. | Liu LQ, Fan ZQ, Tang YF, Ke ZJ. The resveratrol attenuates ethanol-induced hepatocyte apoptosis via inhibiting ER-related caspase-12 activation and PDE activity in vitro. Alcohol Clin Exp Res. 2014;38:683-693. [PubMed] [DOI] |
| 2. | Barnes MA, McMullen MR, Roychowdhury S, Pisano SG, Liu X, Stavitsky AB, Bucala R, Nagy LE. Macrophage migration inhibitory factor contributes to ethanol-induced liver injury by mediating cell injury, steatohepatitis, and steatosis. Hepatology. 2013;57:1980-1991. [PubMed] [DOI] |
| 3. | Tome S, Lucey MR. Review article: current management of alcoholic liver disease. Aliment Pharmacol Ther. 2004;19:707-714. [PubMed] |
| 4. | Cala LA, Thickbroom GW, Black JL, Collins DW, Mastaglia FL. Brain density and cerebrospinal fluid space size: CT of normal volunteers. AJNR Am J Neuroradiol. 1981;2:41-47. [PubMed] |
| 5. | Crews F, Nixon K, Kim D, Joseph J, Shukitt-Hale B, Qin L, Zou J. BHT blocks NF-kappaB activation and ethanol-induced brain damage. Alcohol Clin Exp Res. 2006;30:1938-1949. [PubMed] |
| 6. | Renaud S, de Lorgeril M. Wine, alcohol, platelets, and the French paradox for coronary heart disease. Lancet. 1992;339:1523-1526. [PubMed] [DOI] |
| 7. | Singh CK, Kumar A, Lavoie HA, Dipette DJ, Singh US. Diabetic complications in pregnancy: is resveratrol a solution? Exp Biol Med (Maywood). 2013;238:482-490. [PubMed] [DOI] |
| 8. | Sinha K, Chaudhary G, Gupta YK. Protective effect of resveratrol against oxidative stress in middle cerebral artery occlusion model of stroke in rats. Life Sci. 2002;71:655-665. [PubMed] [DOI] |
| 9. | Polycarpou E, Meira LB, Carrington S, Tyrrell E, Modjtahedi H, Carew MA. Resveratrol 3-O-D-glucuronide and resveratrol 4'-O-D-glucuronide inhibit colon cancer cell growth: evidence for a role of A3 adenosine receptors, cyclin D1 depletion, and G1 cell cycle arrest. Mol Nutr Food Res. 2013;57:1708-1717. [PubMed] [DOI] |
| 10. | Puca AA, Carrizzo A, Ferrario A, Villa F, Vecchione C. Endothelial nitric oxide synthase, vascular integrity and human exceptional longevity. Immun Ageing. 2012;9:26. [PubMed] [DOI] |
| 11. | 何 培元, 高 淑梅, 侯 志平, 马 立新, 李 炳庆. 白藜芦醇对酒精诱导的HepG2细胞氧化损伤的保护作用及相关基因表达的变化. 世界华人消化杂志. 2014;22:1928-1935. [DOI] |
| 12. | 何 培元, 高 淑梅, 张 聪, 侯 志平, 马 立新, 李 炳庆. 白藜芦醇通过MEK/ERK-SIRT1通路的激活调节酒精诱导的HepG2细胞凋亡损伤. 世界华人消化杂志. 2014;22:3011-3018. [DOI] |
| 13. | Zhao B. Natural antioxidants protect neurons in Alzheimer's disease and Parkinson's disease. Neurochem Res. 2009;34:630-638. [PubMed] [DOI] |
| 14. | Mancuso C, Siciliano R, Barone E, Preziosi P. Natural substances and Alzheimer's disease: from preclinical studies to evidence based medicine. Biochim Biophys Acta. 2012;1822:616-624. [PubMed] [DOI] |
| 15. | Kasdallah-Grissa A, Mornagui B, Aouani E, Hammami M, El May M, Gharbi N, Kamoun A, El-Fazaâ S. Resveratrol, a red wine polyphenol, attenuates ethanol-induced oxidative stress in rat liver. Life Sci. 2007;80:1033-1039. [PubMed] |
| 16. | Rivera H, Shibayama M, Tsutsumi V, Perez-Alvarez V, Muriel P. Resveratrol and trimethylated resveratrol protect from acute liver damage induced by CCl4 in the rat. J Appl Toxicol. 2008;28:147-155. [PubMed] |
| 17. | Pinzani P, Petruzzi E, Orlando C, Malentacchi F, Petruzzi I, Pazzagli M, Masotti G. Healthy centenarian subjects: the effect of red wine consumption on liver function tests. J Endocrinol Invest. 2005;28:120-122. [PubMed] |
| 18. | Rodrigo R, Miranda A, Vergara L. Modulation of endogenous antioxidant system by wine polyphenols in human disease. Clin Chim Acta. 2011;412:410-424. [PubMed] [DOI] |
| 19. | Iliev A, Traykov V, Prodanov D, Mantchev G, Yakimova K, Krushkov I, Boyadjieva N. Effect of the acetylcholinesterase inhibitor galanthamine on learning and memory in prolonged alcohol intake rat model of acetylcholine deficit. Methods Find Exp Clin Pharmacol. 1999;21:297-301. [PubMed] |
| 20. | Liang S, Su WW, Wang YG, Peng W, Nie YC, Li PB. Effect of quercetin 7-rhamnoside on glycochenodeoxycholic acid-induced L-02 human normal liver cell apoptosis. Int J Mol Med. 2013;32:323-330. [PubMed] [DOI] |
| 21. | Goldin RD, Hunt NC, Clark J, Wickramasinghe SN. Apoptotic bodies in a murine model of alcoholic liver disease: reversibility of ethanol-induced changes. J Pathol. 1993;171:73-76. [PubMed] |
| 22. | Tiwari V, Chopra K. Resveratrol abrogates alcohol-induced cognitive deficits by attenuating oxidative-nitrosative stress and inflammatory cascade in the adult rat brain. Neurochem Int. 2013;62:861-869. [PubMed] [DOI] |
| 23. | Peters R, Peters J, Warner J, Beckett N, Bulpitt C. Alcohol, dementia and cognitive decline in the elderly: a systematic review. Age Ageing. 2008;37:505-512. [PubMed] [DOI] |
| 24. | Schuckit MA. Alcoholism and other psychiatric disorders. Hosp Community Psychiatry. 1983;34:1022-1027. [PubMed] |
| 25. | Jung ME, Gatch MB, Simpkins JW. Estrogen neuroprotection against the neurotoxic effects of ethanol withdrawal: potential mechanisms. Exp Biol Med (Maywood). 2005;230:8-22. [PubMed] |
| 26. | Khalil R, King MA, Soliman MR. Testosterone reverses ethanol-induced deficit in spatial reference memory in castrated rats. Pharmacology. 2005;75:87-92. [PubMed] |
| 27. | Tiwari V, Chopra K. Resveratrol prevents alcohol-induced cognitive deficits and brain damage by blocking inflammatory signaling and cell death cascade in neonatal rat brain. J Neurochem. 2011;117:678-690. [PubMed] [DOI] |
| 28. | Mancuso C, Bates TE, Butterfield DA, Calafato S, Cornelius C, De Lorenzo A, Dinkova Kostova AT, Calabrese V. Natural antioxidants in Alzheimer's disease. Expert Opin Investig Drugs. 2007;16:1921-1931. [PubMed] |
| 29. | Essa MM, Vijayan RK, Castellano-Gonzalez G, Memon MA, Braidy N, Guillemin GJ. Neuroprotective effect of natural products against Alzheimer's disease. Neurochem Res. 2012;37:1829-1842. [PubMed] [DOI] |
| 30. | Newman DJ, Cragg GM. Natural products as sources of new drugs over the 30 years from 1981 to 2010. J Nat Prod. 2012;75:311-335. [PubMed] [DOI] |
| 31. | Chou TC, Dong H, Zhang X, Lei X, Hartung J, Zhang Y, Lee JH, Wilson RM, Danishefsky SJ. Multifaceted cytoprotection by synthetic polyacetylenes inspired by the ginseng-derived natural product, panaxytriol. Proc Natl Acad Sci U S A. 2011;108:14336-14341. [PubMed] [DOI] |
| 32. | Wu Y, Li X, Zhu JX, Xie W, Le W, Fan Z, Jankovic J, Pan T. Resveratrol-activated AMPK/SIRT1/autophagy in cellular models of Parkinson's disease. Neurosignals. 2011;19:163-174. [PubMed] [DOI] |
| 34. | von Pawel J, Harvey JH, Spigel DR, Dediu M, Reck M, Cebotaru CL, Humphreys RC, Gribbin MJ, Fox NL, Camidge DR. Phase II trial of mapatumumab, a fully human agonist monoclonal antibody to tumor necrosis factor-related apoptosis-inducing ligand receptor 1 (TRAIL-R1), in combination with paclitaxel and carboplatin in patients with advanced non-small-cell lung cancer. Clin Lung Cancer. 2014;15:188-196. e2. [PubMed] [DOI] |
| 35. | Garimella SV, Gehlhaus K, Dine JL, Pitt JJ, Grandin M, Chakka S, Nau MM, Caplen NJ, Lipkowitz S. Identification of novel molecular regulators of tumor necrosis factor-related apoptosis-inducing ligand (TRAIL)-induced apoptosis in breast cancer cells by RNAi screening. Breast Cancer Res. 2014;16:R41. [PubMed] [DOI] |
| 36. | Thompson CB. Apoptosis in the pathogenesis and treatment of disease. Science. 1995;267:1456-1462. [PubMed] |
| 37. | D'Amours D, Sallmann FR, Dixit VM, Poirier GG. Gain-of-function of poly(ADP-ribose) polymerase-1 upon cleavage by apoptotic proteases: implications for apoptosis. J Cell Sci. 2001;114:3771-3778. [PubMed] |